多角度解析化学平衡
2017-11-22北京市十一学校博士
■北京市十一学校 李 军(博士)
多角度解析化学平衡
■北京市十一学校 李 军(博士)
编者注:“创新题追根溯源”栏目里的例题都非常新颖,有的是原创题,有的是改编题,每一道题都非常注重多解多变。同学们要把握核心考点,扩大知识视野,用扎实的基本功应对试题的万千变化。
化学平衡属于高中化学的基本概念和重要理论,也是每年高考考查的重点和热点内容。为了能够让大家更好地理解化学平衡,我们设计了基于化学平衡的实验探究、工艺流程及图像三种类型的题,通过与实际生活相结合,让大家能够更深入地理解平衡,做到举一反三,融会贯通,事半功倍。
例题为探究Na2SO3溶液和铬(Ⅵ)盐溶液的反应规律,某同学进行实验如下:
(1)进行实验Ⅰ和Ⅱ(见表1)。
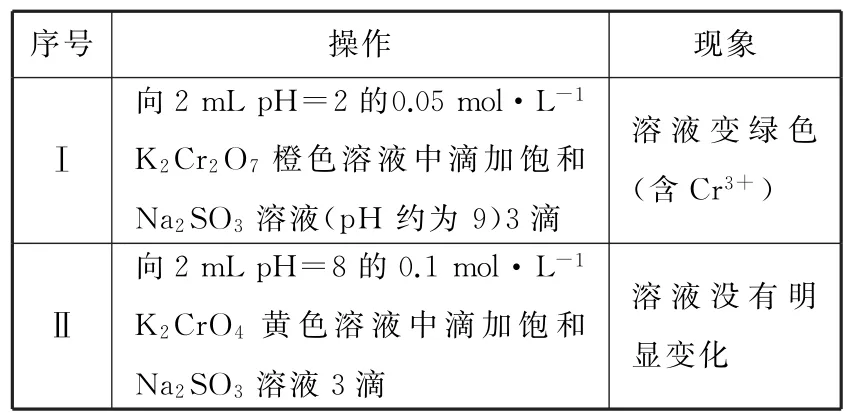
表1
(2)继续进行实验Ⅲ(见表2)。

表2
为了说明产生上述现象的原因,补充实验:
向2mL蒸馏水中滴加pH=2的0.05mol·L-1K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①用离子方程式解释Ⅰ中现象:___。
②对比Ⅰ和Ⅱ可知____。
③用化学平衡移动原理解释Ⅲ中现象:____。
答案:①
②K2Cr2O7酸性溶液氧化性强
练习1 工业废水中常含有一定量的,它们会对人类及生态系统产生很大损害,必须进行处理。常用还原沉淀法处理,该法的工艺流程为:

(1)若平衡体系的pH=2,该溶液显____色。
(2)能说明第①步反应达平衡状态的是____。
b.2v
c.溶液的颜色不变
用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀,该沉淀干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程的实际损耗,消耗硫酸亚铁铵的物质的量为____mol。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
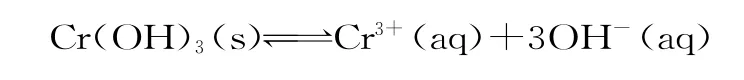
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至____。
解析:(1)pH=2时,反应正向进行的速率较大,溶液呈橙色。(2)达到平衡状态时,正、逆反应速率相等,混合物中各组分浓度保持不变,但不一定相等,溶液的颜色不再发生改变,即只有c项正确。(3)根据反应前后Cr和Fe元素的化合价变化,可确定还原1mol需6molFeSO4·7H2O,根据元素守恒,铁的物质的量为n(1+y)mol,因此消耗的硫酸亚铁铵也为n(1+y)mol。(4)当c(Cr3+)=10-5mol·L-1时,根据Ksp的表达式可求出c(OH-)=10-9mol·L-1,则此时溶液pH=5。
答案:(1)橙 (2)c (3)6n(1+y)(4)5
练习2元素铬(Cr)在溶液中主要以Cr3+等形式存在。Cr(OH)3为难溶于水的固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____。

图1
①用离子方程式表示Na2CrO4溶液中的转化反应:____。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与生成砖红色沉淀,指示剂达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5mol·L-1)时,溶液中c(Ag+)为____mol·L-1,此时溶液中)等 于____mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的还原成Cr3+,该反应的离子方程式为____。
解析:(1)通过类比考查知识迁移能力及信息的使用能力。(2)考查图像分析能力,由反应及图像可知A点时溶液中)=1.0mol·L-1,根据Cr元素守恒,可知A点溶液中=0.5mol·L-1;此时该反应的平衡常数K=1.0×10-14。温度升高溶液中的平衡转化率减小,说明平衡逆向移动,根据平衡移动原理分析正反应是放热反应。(3)考查Ksp的计算能力。
答案:(1)生成沉淀,继续滴加NaOH溶液,沉淀溶解
(3)2.0×10-55.0×10-3
综上所述,对化学平衡理论的学习,只有吃透概念,挖掘教材,打好基础,才能以不变应万变。若基础不牢,概念不清,好似空中楼阁——没有依靠,耗时于茫茫题海,任你做题再多,也事倍功半。在学习过程中一定要夯实“双基”,一是要重视基础知识的理解和记忆,二是重视基本知识的应用,不能用“题海”来代替对“双基”的学习。借助于几个典型的例题,梳理基本知识、基本原理做到事半功倍。
(责任编辑 谢启刚)
李军,中科院博士,中学化学高级教师,全国基础教育化学新课程实施优秀个人,曾发表论文30余篇,获奖论文20余篇。
