电化学题目中所承载的“微粒观”
2017-11-22北京市十一学校刘子宏
■北京市十一学校 刘子宏
电化学题目中所承载的“微粒观”
■北京市十一学校 刘子宏
高考是选拔性考试,因此高考化学试卷担负着选拔出具有化学核心素养的优秀人才的责任。而电化学在这个过程中起到的作用是什么?我认为,是考查考生的“微粒观”,更准确地说应该是“微粒运动观”。通过电化学题目考查考生是否认识到微观粒子的客观存在,以及微观粒子是在一定作用驱动下,按照一定规律运动的。
一、微观粒子的存在
在对电化学装置进行分析时,首先要明确体系中所存在的微观粒子,即认识到微观粒子是客观存在的。
例1某同学按图1所示的装置进行电解实验。下列说法正确的是( )。

图1
A.电解过程中,铜电极上有H2产生
C.电解过程中,溶液的颜色变化为“无色→蓝色→无色”
D.整个电解过程中,溶液中H+的浓度不断增大
解析:阳极是铜电极,故电解过程中阳极反应为Cu-2e-══Cu2+,不产生H2,A项错误。虽然Cu2+放电顺序应该在H+之前,但电解的初始阶段,溶液中大量存在的阳离子是H+,而Cu2+浓度较低,故H+在阴极放电,B项正确。此过程中,阴极一直在消耗H+,故H+浓度不断减小,D项错误。随着阳极Cu-2e-══Cu2+反应的进行,Cu2+浓度不断增大,溶液由无色逐渐变为蓝色,阴极的主要反应由2H++2e-══H2↑向Cu2++2e-══Cu过渡,阳极每产生一个Cu2+,阴极消耗一个Cu2+,此阶段中Cu2+浓度不变,即溶液蓝色不变。当铜电极完全消耗掉时,该装置断路,溶液维持在蓝色,不会变无色,C项错误。
答案:B
二、微观粒子的“运动”
不知大家是否想过一个问题:仍用例1的装置图,将电解质溶液换为氯化钠溶液,电解一段时间以后,石墨电极上是否能镀上铜呢?
咱们在电化学的题目中,演示电镀原理时,一般都选用硫酸铜溶液,铜电极为阳极。电镀开始时,阳极反应为Cu-2e-══Cu2+,阴极反应为Cu2++2e-══Cu,很快,同学们就能看到阴极上附着一层铜。如果换为例1中的稀硫酸,经之前的分析我们不难想到,虽然电解初期阴极没有铜附着,但是电解一段时间后,随着阳极Cu-2e-══Cu2+反应的进行,Cu2+浓度不断增大,阴极就会附着铜。那么换为氯化钠溶液呢?我们来一起想象一下这个过程。
电解初期,阳极反应为Cu-2e-══Cu2+,阴极反应为2H2O+2e-══H2↑+2OH-,有的同学可能会想,开始的时候溶液中Cu2+浓度低,但是电解一段时间以后,阳极附近Cu2+浓度增大,Cu2+会从阳极向阴极移动,那阴极的电极反应就会变为Cu2++2e-══Cu。请注意,此电化学装置中,在电极电性的驱动下,阳离子会向阴极移动,而同时阴离子也会向阳极移动,阴极产生的OH-不是静止在阴极的,它们一旦产生,就会向着阳极不断移动,请想象一下,会出现什么结果?是的,向阴极移动的Cu2+和向阳极移动的OH-会在溶液中某处相遇,生成Cu(OH)2沉淀,Cu2+几乎难以到达阴极生成铜单质。
在原电池中也是同样的情况,阴离子会不断向负极移动,阳离子会不断向正极移动,离子一直处于不断的运动中,不是静止不动的。
例2电解硫酸铝和硫酸铁的混合溶液(溶液A)得到液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。装置如图2所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)。
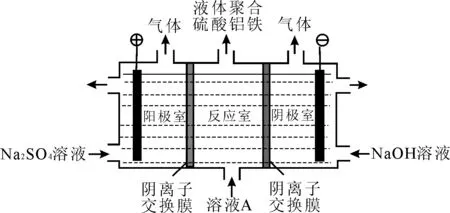
图2
(1)电解过程阳极室溶液pH的变化是____(填“增大”“减小”或“不变”)。
(2)简述在反应室中生成液体聚合硫酸铝铁的原理:____。
解析:阳极电极反应式为2H2O-4e-══O2↑+4H+,H+浓度增大,故pH减小;对比进入反应室的溶液A和液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]不难发现,一进一出的两种物质其差异在于阴离子的种类和数目。由Al2(SO4)3和Fe2(SO4)3的混合液A相当于[AlaFeb(SO4)(1.5a+1.5b)],对比它与液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]化学式不难发现,是OH-替代了部分,因此在解释时要描述出OH-移入反应室,而移出反应室的“动态”过程。
答案:(1)减小 (2)电解过程中反应室中的SO42-通过阴离子交换膜进入阳极室,阴极室中的OH-通过阴离子交换膜进入反应室,生成聚合硫酸铝铁。
三、微观粒子的“定量运动”
说了上述两个问题之后,我们再来看看微观粒子的定量运动。在电化学装置中,电解质溶液中离子的重要作用之一就是平衡电荷,形成闭合回路。我们先来看一个简单的模型(图3):
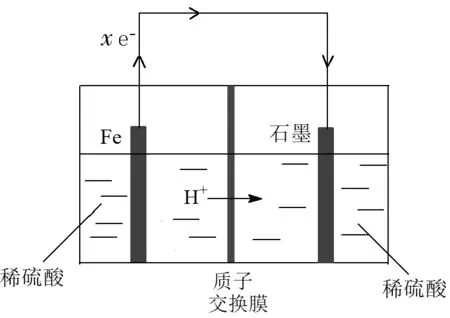
图3
此装置中,铁电极为负极,负极每失去x个电子(xe-),正极便得到x个电子(xe-),此时如果离子不移动,负极便带x个正电,而正极带x个负电,电荷不再平衡。为了平衡电荷,溶液中的离子就要进行移动。因为是质子交换膜,仅允许H+通过,因此负极室的H+透过质子交换膜,移入正极室,共移动x个H+时,两个电极室的电荷达到平衡。
若将上述装置中的质子交换膜改为阳离子交换膜(如图4),此时负极室的阳离子(H+和Fe2+)透过阳离子交换膜,移入正极室,H+和Fe2+共移动x个单位正电荷时,两个电极室的电荷到达平衡,与图3装置相比,此时移动的H+个数少于x个。
我们再回头看一下例2的(1),试想一下,若将例2装置中的阴离子交换膜改为只允许OH-通过的交换膜,电解过程阳极室溶液的pH仍然是减小吗?当然不是。每当电路中通过x个电子时,阳极就会产生x个H+,为了平衡电荷,同时会有x个OH-通过交换膜进入阳极室,等量的H+与OH-中和,溶液仍为中性(原阳极室液体中为Na2SO4溶液)。
我们再来看一道题。

图4
例3电化学降解NO-3的原理如图5所示。
若电解过程中转移了2mole-,则膜两侧电解液的质量变化差(Δm左-Δm右)为____g。
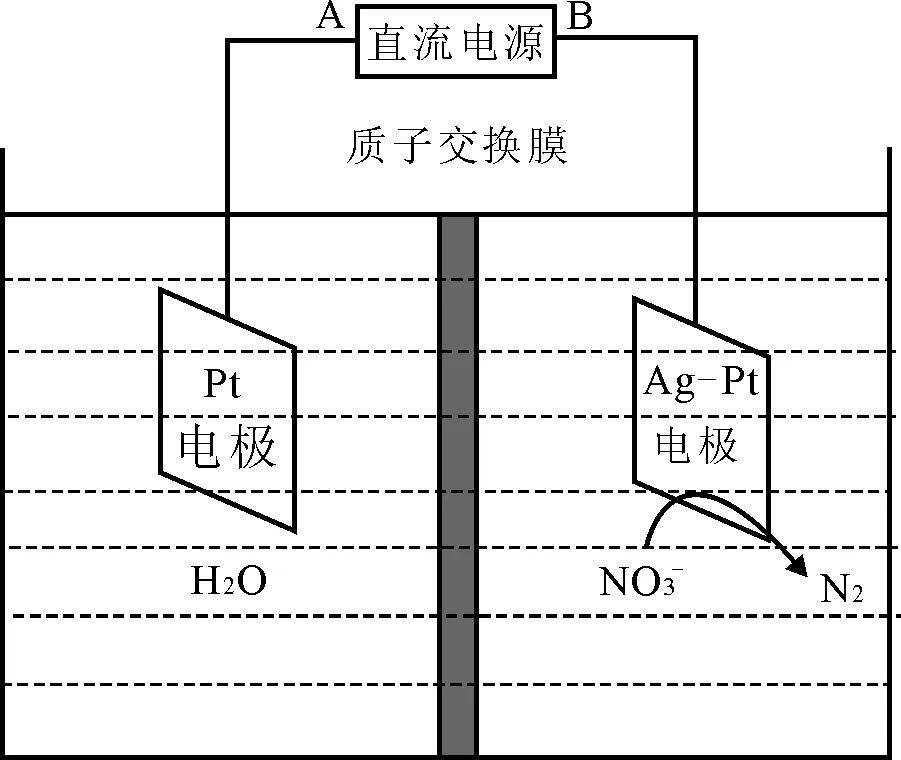
图5
解析:B电极上NO-3转变为N2,N化合价降低,得电子,为阴极。
阳极(A):2H2O-4e-══O2↑+4H+
阴极(B):2NO-3+6H2O+10e-══N2↑+12OH-
因为电解过程中转移了2mole-,故阳极生成O20.5 mol,即减重16g,阴极生成0.2molN2,即减重5.6g,所以膜两侧电解液的质量变化差(Δm左-Δm右)为10.4g,是这样吗?注意,这样想的同学,是“看到”了微粒,但是还没有“看到”微粒的运动。当转移2mole-时,为了平衡电荷,左侧电极室必然有2molH+移入右侧电极室,因此,左侧减少2molH+,减重变为18g,右侧增加2molH+,减重从5.6g变为3.6g,故膜两侧电解液的质量变化差(Δm左-Δm右)为(18-3.6)g,即14.4g。
答案:14.4
点评:从上述几例我们可以看出,电化学习题所承载的是对考生“微粒观”的考查,电化学题目中的“难点”,就是对考生化学核心素养的考查点。在日常的练习中,我们要有意识地去强化“微粒观”,认识到微观粒子是在运动的,这样,这些所谓的“难点”也就迎刃而解了。
(责任编辑 谢启刚)
刘子宏,毕业于北京大学,硕士,海淀区骨干教师。从教10年,有较为丰富的高中化学教学经验,曾公开发表《理科思维融合对提高化学教学实效性的研究》《大陆与台湾化学必修教材中“电解质”概念群编写的比较》等文章。
