弥散张量成像纵向分析轻度认知障碍高危个体的脑白质微结构改变
2017-11-22周智美陈德基王延平罗永良
周智美,陈德基*,王延平,罗永良
(1.广州医科大学附属第二医院放射科,2.神经内科,广东 广州 510260)
弥散张量成像纵向分析轻度认知障碍高危个体的脑白质微结构改变
周智美1,陈德基1*,王延平2,罗永良1
(1.广州医科大学附属第二医院放射科,2.神经内科,广东 广州 510260)
目的采用DTI纵向分析轻度认知障碍(MCI)高危个体的脑白质微结构改变。方法采用结构MRI、DTI及神经量表对102名受试者进行1年的随访观察,其中91名受试者认知保持正常(CN-stable组),11名受试者发展为MCI(CN-MCI组)。分析两组FA值和MD值的差异,并对其与MCI、认知能力的关系进行多因素Logistic回归分析。结果与CN-stable组比较,基线期CN-MCI组穹隆、左海马旁回白质的MD值增高(P<0.05),随访期CN-MCI组穹隆、左海马旁回白质、左扣带回中部、胼胝体压部的MD值增高(P<0.05),穹隆、左海马旁回白质的FA值减低(P<0.05)。多因素Logistic回归分析显示,穹隆的MD值是CN-MCI向MCI发展的危险因素,左海马旁回白质的MD值是CDR评分增高的危险因素。结论在MCI临床确诊前,MCI高危个体的白质微结构发生变化,可作为AD早期相关脑改变的潜在影像学生物标志。
阿尔茨海默病;认知障碍;脑白质;扩散磁共振成像
轻度认知障碍(mild cognitive impairment, MCI)被认为是正常老龄化向阿尔茨海默病(Alzheimer disease, AD)的过渡阶段。在AD临床症状出现前,神经病理改变可能已持续多年,确诊MCI时脑结构已发生不可逆的损伤[1]。尽管内侧颞叶灰质萎缩已作为早期AD的影像学生物标志,但研究[2-3]显示在MCI及其更早期,白质微结构的变化较灰质更明显,提示白质改变可能是AD进展的一个独立因素。但目前鲜见MCI前的脑白质研究报道。本研究采用DTI观察白质纤维微结构,前瞻性识别MCI高危个体,探讨MCI临床确诊前的白质变化,以及白质改变与MCI进展、认知能力减退的关系。
1 资料与方法
1.1 一般资料 2014年1月—2015年12月于社区招募65岁以上常住、非独居认知能力正常(cognitively normal, CN)的102名老人作为受试者。纳入标准:无痴呆家族史、无神经系统疾病;受教育程度在小学以上,简易精神状态检查(mini-mental state examination, MMSE)量表评分为27~30分;临床痴呆程度(clinical dementia rating, CDR)量表评分0分;Hachinski缺血指数表评分≤4分;无MR检查禁忌,常规颅脑MR(T1WI、T2WI)检查除脑萎缩和深部白质少量T2WI高信号(最大径<5 mm、部位≤4处)[4]外,未见其他异常改变。排除随访期Hachinski评分>4分的受试者。本研究经本院伦理委员会批准(2014058),所有受试者均签署知情同意书。
所有受试者于入组基线期和1年随访期接受常规MRI、DTI及MMSE、CDR、Hachinski缺血指数量表检查。随访期,MMSE评分较基线下降2分以上者[5]进行MCI筛查,诊断为MCI者纳入CN-MCI组;余认知能力稳定的受试者纳入对照(CN-stable)组。MMSE、CDR、Hachinski量表及MCI诊断均由神经内科医师完成。MCI诊断符合Petersen标准[6]。
1.2 仪器与方法 采用GE Signa HDXT 1.5T MR扫描仪,8通道头部线圈。常规MR序列包括T1WI、T2WI、DWI、T2WI-FLAIR及T2WI-GRE的标准轴位扫描。DTI采用单次激发EPI序列,21个弥散方向,行标准轴位全脑扫描。DWI和DTI的b值均为0、1 000 s/mm2。具体扫描参数见表1。
1.3 DTI数据处理 采用GE AW 4.4工作站的Functool软件对DTI原始数据进行后处理。参考Wakana等[7]的白质纤维模型,结合部分各向异性分数(fractional anisotropy, FA)和平均扩散率(mean diffusivity, MD)图,在b=0 s/mm2的DTI参考图上设置ROI,测量FA值和MD值。于半卵圆中心层面设置双侧半卵圆中心、扣带回中部、顶叶白质的ROI(图1A);于穹隆体、基底核层面设置双侧额枕叶白质、内囊前后肢及胼胝体膝压部、穹隆体的ROI(图1B~1D);于四叠体池、海马旁回层面设置双侧海马旁回白质ROI(图1E)。ROI的范围设于解剖结构内,注意避开灰质和脑脊液。随访期ROI的设置层面和位置尽量与基线期一致。MD、FA值的测定分别由2名放射科医师独立完成,结果取平均值。
1.4 统计学分析 采用SPSS 17.0统计分析软件。两组间计量资料比较采用独立样本t检验,计数资料比较采用χ2检验。以基线期各ROI的MD值、FA值作为变量,与MCI、认知能力的关系进行多因素Logistic回归分析。P<0.05为差异有统计学意义。不同观察者测量数据的一致性采用Kappa检验,Kappa>0.75为一致性好,0.40≤Kappa≤0.75为一致性一般,Kappa<0.40为一致性差。
2 结果
两组的年龄、性别及教育年限、基线期MMSE评分差异均无统计学意义(P均>0.05),随访期MMSE、CDR评分差异有统计学意义(P<0.01;表2)。两名观察者测量MD值、FA值一致性好 (Kappa=0.81)。
基线期,CN-MCI组穹隆和左海马旁回白质的MD值分别为14.21±3.08、8.53±0.82,较CN-stable组(11.24±1.79、7.66±0.42)增高(t=-2.26、-2.55,P=0.04、0.02),FA值差异无统计学意义(P>0.05)。
随访期,CN-MCI组的穹隆、左海马旁回白质、左扣带回中部、胼胝体压部的MD值增高,穹隆、左海马旁回白质的FA值减低,与CN-stable组相应区域比较差异有统计学意义(P均<0.05;表3)。
Logistic回归分析结果显示穹隆MD值增高是MCI高危个体向MCI进展的危险因素,左侧海马旁回白质MD值增高是CDR评分增高的危险因素(表4)。
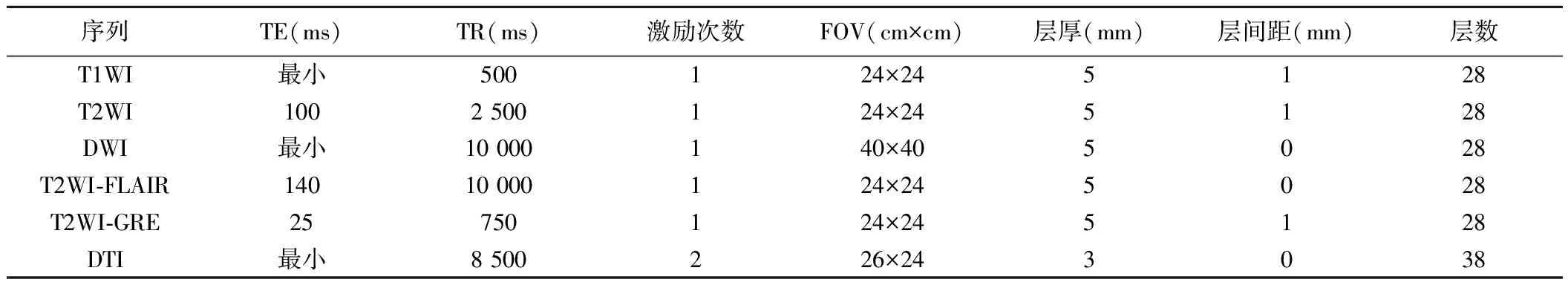
表1 MRI序列主要扫描参数
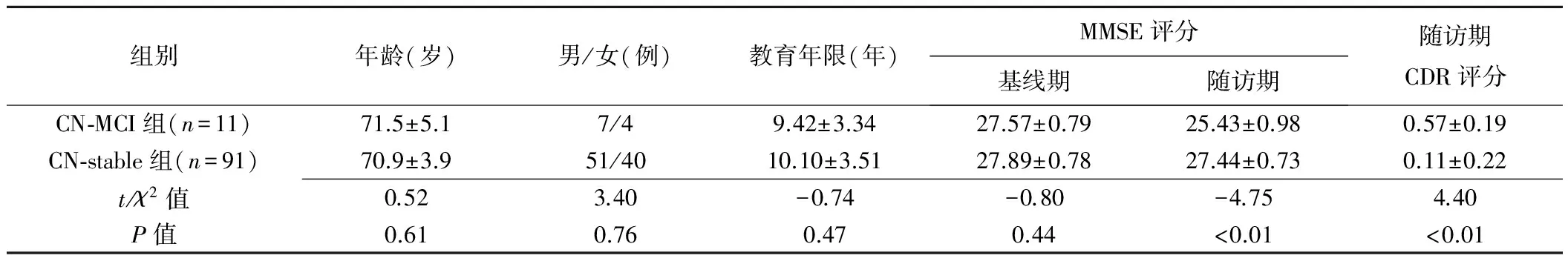
表2 受试者临床资料比较
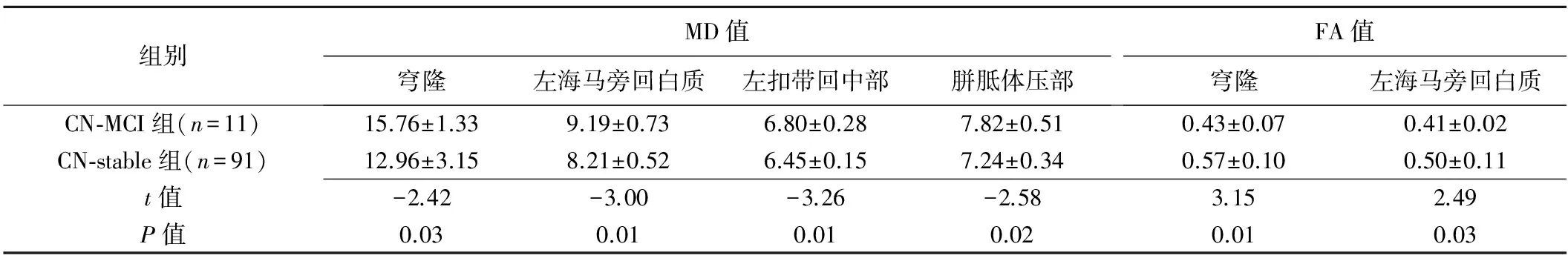
表3 随访期两组MD值和FA值差异有统计学意义的白质部位

表4 Logistic回归分析结果
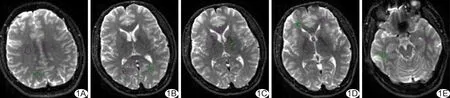
图1 ROI放置示意图 A.右侧半卵圆中心、左侧扣带回中部、右侧顶叶白质; B.胼胝体压部、双侧枕叶白质; C.胼胝体膝部、右侧内囊前肢、左侧内囊后肢; D.穹窿、双侧额叶白质; E.双侧海马旁回白质
3 讨论
本研究结果显示,CN-MCI组基线期、随访期均出现穹隆、左侧海马旁回白质的DTI改变,随访期新现左侧扣带回中部、胼胝体压部的DTI改变。研究[8-9]表明,随着MCI高危个体向MCI的发展,受损的白质部位逐渐增多,由内侧颞叶向各皮层相关的脑区扩展。
本研究提示,基线期穹隆MD值的增高可预测MCI高危个体向MCI的进展。穹隆是胆碱能系统海马环路的主要联合纤维,不仅可将类胆碱输入海马,同时也可将类胆碱输送到其他脑区[10]。Jeltsch等[11]通过切断海马通路(扣带束、背穹隆海马伞),破坏胆碱能纤维,发现动物空间定向和记忆障碍,AD模型被稳定建立。因此,穹隆受损与AD认知功能的改变直接关联;穹隆DTI的改变可能是MCI病程进展的早期标志。
本研究显示,左侧海马旁回白质MD值的增高可预测CDR评分上升。CDR量表是临床评定痴呆严重程度的主要方法,随着评分的增高(0~3),提示AD的进展。海马旁回白质是多个重要纤维系统的组成部分,是楔前叶、扣带后部皮层向内嗅皮层的输入通路。静息态功能磁共振已证实楔前叶和扣带后部是情景记忆默认网络的关键组成部分[12]。因此,海马旁回白质在情景记忆中有至关重要的作用。情景记忆的减退是AD最早、最显著的临床症状。海马旁回白质的受损将引发、加重AD症状。研究[13]发现在AD早期,左侧半球相关脑区的受损更明显,与本研究结果中左侧海马旁回白质的DTI改变可提示AD的进展相符。
本研究发现CN-MCI组的白质改变表现为MD值的增高、或伴FA值的减低,与前期AD相关的DTI研究[14]结果一致,提示白质纤维的完整性受损。本研究结果进一步显示,基线期CN-MCI组穹隆及左侧海马旁回白质仅出现MD值的改变;随访期,该组的穹隆及左侧海新马旁回白质后续出现FA值的改变,而该期新现的白质异常部位(左侧扣带回中部、胼胝体压部)仅发现MD值改变;此外,回归分析亦显示穹隆、左侧海马旁回白质的MD值是CN-MCI进展的危险因素。提示MCI前期,MD值可更敏感地反映白质变化。Douaud等[15]研究也认为MD值在MCI的临床随访中更具敏感性,与本研究的观点一致。
本研究的不足:以ROI为研究方法,可能存在偏倚,未能反映全脑的改变,今后应联合应用基于纤维束示踪的空间统计分析(tract-based spatial statistics, TBSS)等分析方法,以客观地观察全脑组织的变化;随访期较短,受试中的高危个体发展为MCI的时间可能存在差,将继续更长时间的随访。
总之,本研究以前瞻性设计、通过随访识别MCI高危个体,探讨MCI临床诊断前的DTI改变,为AD早期相关的脑改变提供了潜在的影像生物学资料。
[1] Kantarci K, Murray ME, Schwarz CG, et al. White-matter integrity on DTI and the pathologic staging of Alzheimer's disease. Neurobiol Aging, 2017,4(17):30152-30155.
[2] Genc S, Steward CE, Malpas CB, et al. Short-term white matter alterations in Alzheimer's disease characterized by diffusion tensor imaging. Magn Reson Imaging, 2016,43(3):627-634.
[3] Madhavan A, Schwarz CG, Duffy JR, et al. Characterizing white matter tract degeneration in syndromic variants of Alzheimer's Disease: A diffusion tensor imaging study. Alzheimers Dis, 2016,49(3):633-643.
[4] Bozzuli M, Falini A, Cercignani M, et al. White matter damage in Alzheimer's disease assessed in vivo using diffusion tensor magnetic resonance imaging. Neurol Neurosurg Psychiatry, 2002,2(4):742-746.
[5] 孟琛.社区老年人认知功能的研究.国外医学(老年医学分册),2000,2(1):73-76.
[6] Petersen RC, Smith GE, Waring SC, et al. Mild cognitive impairment: Clinical characterization and outcome. Arch Neurol, 1999,56(2):303-308.
[7] Wakana S, Jiang H, Nagae-Poetscher LM, et al. Fiber tract-based atlas of human white matter anatomy. Radiology, 2004,230(1):77-87.
[8] Lancaster MA, Seidenberg M, Smith JC, et al. Diffusion tensor imaging predictors of episodic memory decline in healthy elders at genetic risk for Alzheimer's disease. Int Neuropsychol Soc, 2016,22(10):1005-1015.
[9] Nishioka C, Poh C, Sun SW. Diffusion tensor imaging reveals visual pathway damage in patients with mild cognitive impairment and Alzheimer's disease. Alzheimers Dis, 2015,45(1):97-107.
[10] Oishi K, Mielke MM, Albert M, et al. The fornix sign: A potential sign for Alzheimer's disease based on diffusion tensor imaging. Neuroimaging, 2012,22(4):365-374.
[11] Jeltsch H, Cassel JC, Neufang B, et al. The effects of intrahippocampal raphe and/or septal grafts in rats with fimbria-fornix lesions depend on the origin of the grafted tissue and the behavioural task used. Neuroscience, 1994,63(1):19-29.
[12] Greicius MD, Supekar K, Menon V, et al. Resting-state functional connectivity reflects structural connectivity in the default mode network. Cereb Cortex, 2009,19(1):72-78.
[13] 周智美,陈德基,王延平,等.阿尔茨海默病早期脑白质改变的DTI研究.国际医药卫生导报,2015,21(10):1337-1340.
[14] 金蓉,范国光,李松柏,等.弥散峰度成像评估阿尔茨海默病脑部白质纤维束损害.中国医学影像技术,2015,31(8):1159-1162.
[15] Douaud G, Menke RA, Gass A, et al. Brain microstructure reveals early abnormalities more than two years prior to clinical progression from mild cognitive impairment to Alzheimer's disease. Neurosci, 2013,33(5):2147-2155.
Microstructuralwhitematterchangesinhigh-riskindividualsofmildcognitiveimpairment:Alongitudinalanalysisofdiffusiontensorimaging
ZHOUZhimei1,CHENDeji1*,WANGYanping2,LUOYongliang1
(1.DepartmentofRadiology, 2.DepartmentofNeurology,theSecondAffiliatedHospitalofGuangzhouMedicalUniversity,Guangzhou510260,China)
ObjectiveTo longitudinally analyze microstructural white matter changes in high risk mild cognitive impairment (MCI) patients with DTI.MethodsStructural MRI, DTI and psychometric analyses were performed in 102 individuals with 1 year follow-up. At the end of the follow-up, 11 participants were diagnosed with MCI (CN-MCI group), while 91 participants were classified as cognitively stable (CN-stable group). The differences of fractional anisotropy (FA) and mean diffusivity (MD) between the two groups were analyzed, and the relationship with MCIs and cognitive ability was observed with multivariate logistic regression analysis.ResultsAt the baseline assessment, MD of CN-MCI group increased in fornix and left parahippocampal gyrus white matter compared with those of CN-stable group (P<0.05). For 1-year follow-up reassessment, the MD of CN-MCI group increased in the fornix, left parahippocampal gyrus white matter, left cingulum and splenium, while FA of CN-MCI group reduced in fornix and left parahippocampal gyrus white matter compared with those of CN-stable group (P<0.05). MultivariateLogisticregression analysis showed that MD of the fornix could be a predictor of conversion from a high-risk MCI to MCI, and MD of left parahippocampus gyrus white matter was a risk factor for increased CDR scores.ConclusionFor high-risk MCI individuals, microstructural white matter changes may be used as potential imaging biomarkers in the early phase of AD.
Alzheimer disease; Cognitive dysfunction; White matter; Diffusion magnetic resonance imaging
广东省医学科研基金(A2014312)。
周智美(1978—),女,广东广州人,硕士,副教授。研究方向:神经影像学。E-mail: zzmei2010@qq.com
陈德基,广州医科大学附属第二医院放射科,510260。E-mail: master0012006@126.com
2017-03-31
2017-10-05
R742; R445.2
A
1672-8475(2017)11-0686-04
10.13929/j.1672-8475.201703051
