头痛宁对偏头痛大鼠硬脑膜及三叉神经节IL-1β表达影响
2017-11-22金善泉王成云陈柯言
金善泉 王成云 董 欣 陈柯言 张 雪 万 琪
(南京医科大学第一附属医院神经内科,南京210029)
•论 著•
头痛宁对偏头痛大鼠硬脑膜及三叉神经节IL-1β表达影响
金善泉 王成云 董 欣 陈柯言 张 雪 万 琪△
(南京医科大学第一附属医院神经内科,南京210029)
目的:研究头痛宁对反复发作性偏头痛大鼠硬脑膜及三叉神经节IL-1β(interleukin-1beta)表达的影响。方法:选择健康成年雄性SD大鼠60只,初始质量180~220 g。先取20只随机分为4组,每组5只,分别为生理盐水7天组 (sham)、致炎剂 (in fl ammatory soup, IS) 1天组(IS1)、致炎剂3天组(IS3)和致炎剂7天组(IS7),建立反复发作性偏头痛大鼠模型;再取25只随机分为5组,每组5只,分别为致炎剂7天对照组(IS7)、0.375 g/kg头痛宁干预组(T1)、0.75 g/kg头痛宁干预组(T2)、1.5 g/kg头痛宁干预组(T3)和3.0 g/kg头痛宁干预组(T4),取硬脑膜及三叉神经节进行IL-1β蛋白免疫印迹分析(western blot)及IL-1β mRNA实时荧光定量PCR检测。最后取15只,随机分为3组,每组5只,分别为生理盐水7天组(sham)、致炎剂7天组(IS7)和3.0 g/kg头痛宁干预组(T4),灌流固定后各组分别取大鼠硬脑膜及三叉神经节进行IL-1β蛋白免疫荧光检测。结果:(1)与生理盐水7天组比较,致炎剂7天组IL-1β的表达在硬脑膜(P< 0.01)及三叉神经节(P< 0.01)均明显升高;(2)与致炎剂7天组相较,在大鼠硬脑膜/三叉神经节,0.75 g/kg头痛宁干预组(P< 0.01/P< 0.01)、1.5 g/kg 头痛宁干预组 (P< 0.01/P< 0.05)和 3.0 g/kg 头痛宁干预组 (P< 0.01/P< 0.01) IL-1β 表达均明显降低,0.375 g/kg头痛宁干预组IL-1β表达下降不明显;(3)与致炎剂7天组相较,3.0 g/kg头痛宁干预组三叉神经节神经元细胞胞质内免疫荧光斑点数明显减少,大鼠硬脑膜未能成功染色;(4)与致炎剂7天组相较,3.0 g/kg头痛宁干预组在硬脑膜(P< 0.01)及三叉神经节 (P< 0.05) IL-1β mRNA表达均减少。结论:头痛宁抑制硬脑膜及三叉神经节IL-1β基因转录,下调IL-1β的表达可能是其治疗偏头痛的机制之一。
偏头痛;头痛宁;硬脑膜;三叉神经节;IL-1β
偏头痛是一种常见的神经系统原发性头痛,典型表现为单侧、搏动性、中到重度疼痛,常持续4到72小时[1]。其中,超过一半的人(50.3%)报告为严重头痛,21.8%的人报告为极严重头痛[2],严重影响患者生活质量。因此,研究偏头痛发生机制及其相应的治疗手段具有重要意义。目前偏头痛的发病机制涉及两个主要理论:皮层扩散性抑制及三叉神经血管学说[3]。其中,三叉神经血管学说的分子学机制涉及到硬脑膜、三叉神经节、三叉神经核等多个层面,以及 IL-1β[4]、CGRP[5]、TRPV1受体[6]、5-HT1B/1D受体[7]等多个分子。在众多分子中,IL-1β的角色最近越来越受到重视,成为偏头痛发生机制研究的热点。偏头痛发生机制的不完全明晰导致偏头痛的治疗陷入困境——传统途径药物治疗有其较大的局限性[8]。因此,探索偏头痛产生发展的新机制及其相对应的治疗方法成为当务之急。幸运的是,我们临床研究表明,头痛宁(Toutongning) 胶囊(咸阳步长制药有限公司,国药准字Z20026851)作为中成药制剂,在治疗偏头痛方面具有确切疗效[9,10],这为我们进一步探索偏头痛机制、寻找新的治疗方法开辟了新思路。IL-1β作为目前偏头痛机制研究中的热点,进一步明确其在偏头痛产生维持过程中的角色,探索其在头痛宁治疗偏头痛机制中的变化成为本实验研究目的。
本实验首次观察到IL-1β不仅在偏头痛大鼠三叉神经节也在其硬脑膜有了显著表达增加,并首次观察到头痛宁可以减少偏头痛大鼠硬脑膜及三叉神经节IL-1β表达,其可能为头痛宁治疗偏头痛的重要机制之一。
方 法
1.主要试剂及仪器
IL-1β兔抗大鼠一抗 (ab9787, Abcam);GAPDH兔抗大鼠一抗(AB2302, Millipore);荧光二抗Alexa Fluor 594(红色)山羊抗兔IgG (A-11012, Thermo);逆 转录 试 剂 盒 (R222-01, Vazyme),SYBR Green Master Mix (Q141 - 02, Vazyme);引物合成(上海,Introgen);Western blot 电泳仪,转膜仪(Thermo);石蜡包埋机(EG1150H, Leica);石蜡切片机(RM2235,Leica);荧光显微镜(DP70, Olympus);实时定量PCR 仪 (Step one plus, Applied Biosystems)。
2.方法
(1)实验动物及分组
选择健康成年雄性SD大鼠共60只,初始质量180~220 g, 购于上海杰思捷实验动物有限公司。22℃恒温环境中单笼饲养,自由饮水进食。先随机(电脑选取)取20只分为4组,每组5只,分别为生理盐水7天组(sham)、致炎剂 (in fl ammatory soup, IS) 1天组 (IS1)、致炎剂3天组 (IS3)、致炎剂7天组 (IS7);再取25只随机分为5组,每组5只,分别为致炎剂7天对照组 (IS7)、0.375 g/kg头痛宁干预组(T1)、0.75 g/kg头痛宁干预组(T2)、1.5g/kg头痛宁干预组 (T3) 和3.0g/kg头痛宁干预组 (T4)。取硬脑膜及三叉神经节行IL-1β蛋白免疫印迹分析(western blot)、IL-1β mRNA实时荧光定量PCR检测。最后取15只,随机分为3组,每组5只,为生理盐水7天组,致炎剂7天组,3.0 g/kg头痛宁干预组,灌流固定后各组分别取大鼠硬脑膜及三叉神经节行IL-1β蛋白免疫荧光检测。
(2)手术方法
根据Agustin等的反复发作性偏头痛模型[11],参考Chen等[12]手术方法,腹腔注射10%水合氯醛(0.4 ml/100 g),麻醉大鼠,将大鼠固定于立体定位仪。碘伏消毒,逐层剪开皮肤肌肉,暴露人字缝。于左侧横窦上,上矢状窦旁左侧,牙科钻小心于硬脑膜外钻出方形骨窗(约3 mm×3 mm)。取出方形骨瓣,并在骨窗右侧钻一保留底边的纵行骨瓣。棉线固定消毒过的PE10管于纵行骨瓣上,使之开口于硬脑膜与颅骨之间(不接触硬脑膜),将方形骨瓣复位并缝合切口。所有操作过程切勿触及硬脑膜。
(3)建立模型
药物干预:术后恢复3天,于第4天开始每天固定时间经PE10管缓慢(10 min)向硬脑膜外注射致炎剂(含2 mmol/L组胺、5-羟色胺、缓激肽1.032 mg及 0.2 mmol/L 前列腺素 E2)1次 10 µl。①致炎剂1天、3天、7天组分别经PE10管予致炎剂注射1次、3次、7次。生理盐水7天对照组,每天经PE10管给予等量生理盐水1次,共7次。建立反复发作性偏头痛大鼠模型。②头痛宁干预组在术后第2天开始,每天予头痛宁0.375 g/kg、0.75 g/kg、1.5 g/kg和3.0 g/kg灌胃,术后第4天开始每组除头痛宁灌胃外,每天经PE10管予致炎剂1次,直至术后第7天。致炎剂7天对照组从术后第2天开始予等量生理盐水灌胃,第4天开始经PE10管予致炎剂,直至术后7天。
(4)免疫印迹分析
在最后一次药物干预后3 h,10%水合氯醛深麻醉处死实验大鼠。迅速于冰上从矢状缝剪开大鼠颅骨,取出大鼠左侧刺激侧硬脑膜及三叉神经节,在4℃预冷PBS溶液中充分洗净血液,滤纸吸干,置于1.5 ml EP管中,液氮速冻,-80℃冰柜保存留用。于-80℃冰柜取出硬脑膜及三叉神经节,剪碎组织,加入含有蛋白酶抑制剂等裂解混合液,置于冰上,超声匀浆,静置40 min后4℃离心,12 000 r/min,15 min(离心半径5 cm),取上清,BCA法测蛋白浓度。蛋白原液加入上样缓冲液100℃变性5 min。取等量蛋白上样液行免疫印迹检测,SDS-PAGE凝胶电泳,转于PVDF膜上,5%脱脂奶粉室温封闭1 h,加入IL-1β一抗稀释液(1:1 000,ab9787, Abcam) 、GAPDH一抗稀释液(1:4 000,AB2302, Millipore) 4℃过夜。洗膜缓冲液洗膜3次,加入山羊抗兔二抗稀释液室温孵育2 h,洗膜,显色,使用ImageJ2x进行灰度分析,以GAPDH作为内参照。
(5)免疫荧光
在最后一次药物干预后3 h,10%水合氯醛(0.4 ml/100 g)腹腔注射麻醉大鼠,开胸经左心室插管至升主动脉,先用0.01 mol/L 预冷PBS冲洗血液,再用4%多聚甲醛灌流固定,取出硬脑膜及左侧三叉神经节置于4%多聚甲醛固定12 h。于梯度酒精中逐步脱水,二甲苯透明,浸蜡,石蜡包埋。切片机上石蜡切片,厚度5 µm,4℃冰箱保存待用。取出切片,二甲苯,梯度酒精,脱蜡到水。PBS冲洗(5 min×3次)后,PBST中浸泡20 min破膜。滴加含5%小牛血清白蛋白和0.3%Triton X-100的封闭液室温孵育1 h。滴加IL-1β一抗(1:400,ab9787,Abcam),4℃过夜。次日,PBS冲洗(5 min×3次),加入荧光二抗Alexa Fluor 594(红色)山羊抗兔IgG (1:800,A-11012, Thermo)避光室温孵育2 h,PBS冲洗(5 min×3次),封固,在荧光显微镜下观察拍照。
(6)实时荧光定量PCR
取材方法同免疫印迹分析。于-80℃冰柜取出脑膜及三叉神经,迅速放入-80℃预冷消毒的研钵内,不断倒入适量液氮,进行研磨。当组织成粉末时,根据试剂盒操作指南提取总RNA,分光光度计测RNA浓度。取总RNA0.5 µg,构建10 µl逆转录体系:5*prime script RT master mix for realtime (vazyme,R222-01) 2 µl,无菌ddH2O补至10 µl放入逆转录仪,37℃ 15 min,85℃ 5 s,4℃ forever,得全基因组cDNA。构建10ulqRT-PCR反应体系:SYBR Green Master Mix (vazyme, Q141-02) 5 µl,前后端引物各0.2 µl (GAPDH:F:GTGGAGTCTACTGGCGTCTT,R:TGCTGACAATCTTGAGGGA; IL-1β:F:CAAATCT-CACAGCAGCAT,R:GGTCGTCATCATC CCAC),无菌ddH2O补至10 µl。实时定量PCR仪(Applied Biosystems)进行两步法反应:95℃预变性5 min, 扩增95℃变性10 s,60℃退火/延伸30 s,扩增40个循环,得出CT值。并通过2-△ct计算相对mRNA表达水平。
3.统计学方法
采用SPSS STATISTICS 19.0统计软件进行分析,数据用均数±标准差(±SD)及直方图表示,两组比较用t检验,秩和检验。多组间比较运用单因素方差分析(ANOVA),Turkey's多重比较法,Tamhane's T2检验法。P< 0.05表示差异有统计学意义。
结 果
1.随致炎剂注射次数增加,大鼠硬脑膜及三叉神经节IL-1β表达逐渐增加:取致炎剂7天组,建立反复发作性偏头痛大鼠模型(见图1,表1)。
2.经头痛宁干预,与致炎剂7天组相较,IL-1β在大鼠硬脑膜及三叉神经节表达下降(见图2,表2)。
3.经头痛宁干预,与致炎剂7天组相较,大鼠三叉神经节IL-1β免疫荧光明显减少与生理盐水7天对照组相较,致炎剂7天组IL-1β主要表达于神经元细胞,点状免疫荧光明显增多。3.0 g/kg头痛宁干预组与致炎剂7天组相较,神经元细胞内点状免疫荧光明显减少。大鼠硬脑膜由于组织特殊性,未能成功染色(见图3)。
4.经头痛宁干预,与致炎剂7天组相较,头痛宁干预组大鼠硬脑膜及三叉神经节IL-1βmRNA表达下降大鼠硬脑膜,致炎剂7天组与生理盐水7天组相较,IL-1β mRNA表达明显增高。1.5 g/kg头痛宁干预组、3.0 g/kg头痛宁干预组较致炎剂7天组mRNA表达明显降低。在大鼠三叉神经节,致炎剂7天组与生理盐水7天组相较,IL-1β mRNA表达增高。3.0 g/kg头痛宁干预组较致炎剂7天组mRNA表达降低(见图4,表3)。
讨 论
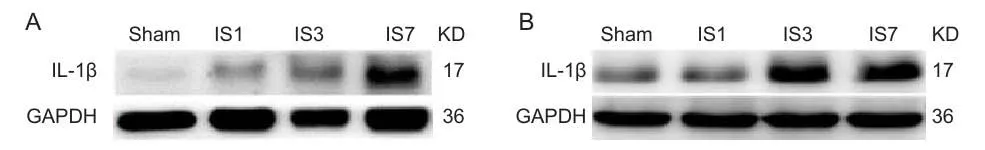
图1 A:大鼠硬脑膜,与Sham相较,IS1、IS3、IS7组IL-1β表达均显著增加(*P < 0.01);B:大鼠三叉神经节,与Sham相较,IS1、IS3,IS7组IL-1β表达均显著增加(*P < 0.01,见表1)。Sham:生理盐水7天组; IS1:致炎剂1天组; IS3:致炎剂3天组; IS7:致炎剂7天组Fig.1 A: IL-1β level of IS1, IS3, and IS7 group was signi fi cantly higher than saline control group in dura (*P < 0.01); B:IL-1β level of IS1, IS3, and IS7 group was signi fi cantly higher than saline control group in trigeminal ganglion (*P < 0.01, Table 1). Sham:7-day saline control group, IS1: 1-day in fl ammatory soup group; IS3:3-day in fl ammatory soup group; IS7:7-day in fl ammatory soup group.
表1 生理盐水7 天对照组及致炎剂注射各组IL-1β在硬脑膜及三叉神经节表达比较( ±SD,n = 5)Table 1 The expression of IL-1β in dura and trigeminal ganglion of different inflammatory soup groups (±SD,n = 5)

表1 生理盐水7 天对照组及致炎剂注射各组IL-1β在硬脑膜及三叉神经节表达比较( ±SD,n = 5)Table 1 The expression of IL-1β in dura and trigeminal ganglion of different inflammatory soup groups (±SD,n = 5)
致炎剂7天组IS7硬脑膜Dura 0.125±0.023 0.405±0.010* 0.634±0.028* 1.183±0.035*三叉神经节Trigeminal ganglion 0.665±0.006 0.731±0.001* 1.114±0.016* 1.173±0.023*组织Tissue生理盐水7天对照组Sham致炎剂1天组IS1致炎剂3天组IS3

图2 A:大鼠硬脑膜,与IS7组相较, IL-1β在T1组表达无明显变化,T2,T3,T4组表达明显下降(*P < 0.01)。B:大鼠三叉神经节,与IS7组相较, IL-1β在T1组表达无明显变化,T2,T3,T4组表达明显下降(#P < 0.01,见表2)。 IS7:致炎剂7天对照组, T1:0.375 g/kg头痛宁干预组; T2:0.75 g/kg头痛宁干预组; T3:1.5 g/kg头痛宁干预组; T4:3.0 g/kg头痛宁干预组Fig.2 A: In dura, compared with IS7, IL-1β level in T2, T3, T4 group was signi fi cantly lower (*P < 0.01); B: In trigeminal ganglion,compared with IS7, IL-1β level in T2, T3, T4 group was signi fi cantly lower (*P < 0.01, #P < 0.05, Table 2). IS7:7-day in fl ammatory soup group; T1:0.375 g/kg Toutongning group; T2:0.75 g/kg Toutongning group; T3:1.5 g/kg Toutongning group; T4:3.0 g/kg Toutongning group.
表2 头痛宁干预组及致炎剂7天对照组IL-1β在硬脑膜及三叉神经节表达比较(±SD,n = 5)Table 2 The exp ression of IL-1β in dura and trigeminal ganglion of different Toutongning groups and 7-day inflammatorysoup group(±SD,n = 5)

表2 头痛宁干预组及致炎剂7天对照组IL-1β在硬脑膜及三叉神经节表达比较(±SD,n = 5)Table 2 The exp ression of IL-1β in dura and trigeminal ganglion of different Toutongning groups and 7-day inflammatorysoup group(±SD,n = 5)
*P < 0.01, #P < 0.05,与致炎剂 7 天组比较,compared with IS7. IS7: 7-day in fl ammatory soup group.
头痛宁干预组 Toutongning group 0.375 g/kg (T1) 0.75g/kg (T2) 1.5 g/kg (T3) 3.0 g/kg (T4)硬脑膜Dura 0.998±0.023 1.115±0.078 0.362±0.029* 0.108±0.013* 0.207±0.033*三叉神经节Trigeminal ganglion 1.291±0.047 0.951±0.128 0.267±0.162* 0.530±0.154# 0.290±0.148*组织Tissue致炎剂7 天对照组IS7
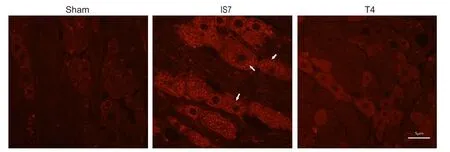
图3 各组三叉神经节内IL-1β免疫荧光的比较(×400)Sham:生理盐水7天对照组;IS7:致炎剂7天组;T4: 3.0 g/kg头痛宁干预组Fig.3 The expression of IL-1β in trigeminal ganglion by immuno fl uorescence in 3 di ff erent groups(×400)Sham: 7-day saline control group; IS7: 7-day in fl ammatory soup group; T4: 3.0 g/kg Toutongning group.
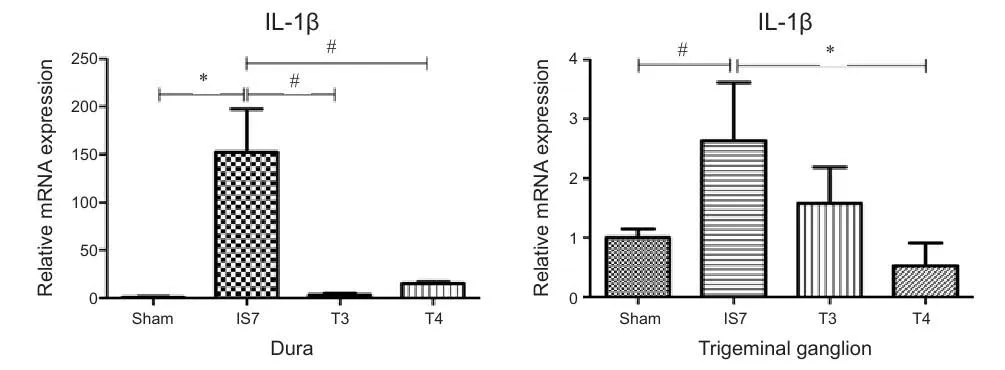
图4 各组大鼠硬脑膜及三叉神经节IL-1βmRNA表达情况。*P <0.01,#P < 0.05。Sham: 生理盐水7 天对照组;IS7:致炎剂7天组;T3:1.5 g/kg头痛宁干预组;T4:3.0 g/kg头痛宁干预组 (见表3)。Fig.4 The mRNA expression of di ff erent groups in dura and trigeminal ganglion. *P < 0.01, #P < 0.05. Sham: 7-day saline control group; IS7:7-day in fl ammatory soup group; T3:1.5 g/kg Toutongning group; T4:3.0 g/kg Toutongning group (Table 3).
偏头痛是一种原发性反复发作性的单侧,剧烈搏动性头痛,严重影响患者生活质量。其致病机制复杂,研究最深入的是“三叉神经血管学说”。该学说认为,三叉神经支配区的三叉神经周围末梢受刺激激活,激活后启动疼痛伤害感受通路,同时信号逆向传递至三叉神经末梢,引发末梢促炎神经肽物质的释放(CGRP, P物质等)[13],造成神经源性炎症。这些促炎神经肽类物质具有扩张局部血管,增加渗透性和激活召集炎性细胞作用,使炎症反应放大,释放大量炎性产物(PGE2,缓激肽,5-HT和细胞因子),反复持续的刺激三叉神经周围感觉神经疼痛伤害感受器,引起周围敏化[14]。由该经典理论可知,神经源性炎症在偏头痛产生的机制中具有重要作用。而IL-1β作为白介素家族细胞因子一员,已经被证实在多种炎症性疾病及炎症性疼痛中表达显著增加[15]。而Alessandro 等研究表明:IL-1β 可激活三叉神经节内卫星细胞 SGC,使其三叉神经元 CGRP 释放增加,神经节内 CGRP 浓度的升高又再次促进了 SGC 内 IL-1β 在内的细胞因子表达增加,形成了一个正反馈回路[4]。CGRP 则被认为是三叉神经传导头痛信号通路中主要的神经介质。而我实验室研究随后证实,IL-1β 在急性炎症性头痛大鼠三叉神经节表达显著增加[12]。因此,IL-1β很可能在偏头痛产生机制中也扮演重要角色。另一方面,临床调查显示:偏头痛患者和对照组中 IL-1β+3953 C/T 基因型分布的多态性存在显著的差异(P= 0.004),IL-1β +3953 T 等位基因在无先兆性偏头痛患者中出现频率显著高于健康对照组(P= 0.004)[16]。综上,种种证据提示,IL-1β 在以神经源性炎症为基础的偏头痛的发展和维持中可能起着重要作用。本实验采用的偏头痛大鼠模型基于 augustin 等的偏头痛模型[11]。该模型基于偏头痛的三叉血管系统激活与敏化理论,即利用致炎剂(In fl ammation soup, IS)连续 7 天反复刺激硬脑膜痛觉受体,使三叉神经血管系统反复激活。该模型表现出了与慢性偏头痛患者近似的症状:日常活动减少,静息活动增加,出现头面部痛觉过敏现象,曲普坦类药物可以减少以上变化,且结果稳定可重复。因此该模型是目前较好的可模拟反复发作慢性偏头痛的重要模型。
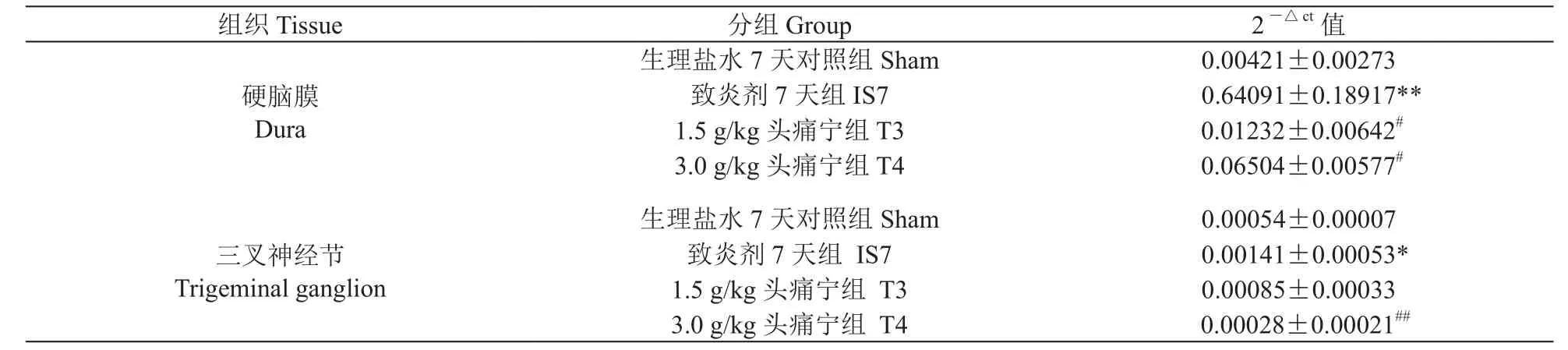
表3 各组大鼠硬脑膜及三叉神经节IL-1β mRNA表达比较(n=5)Table 3 The relative IL-1β mRNA expression of different groups in dura and trigeminal ganglion (n=5)
在偏头痛大鼠模型的三叉神经节,IL-1β转录翻译后主要以无活性的前体形式(proIL-1β)存在于三叉神经眼支无髓鞘C纤维细胞质中[12,17]。当受到促炎刺激时,细胞质内NALP3被激活,形成具有casepase-1活性的细胞内蛋白复合体,其水解proIL-1β,引发IL-1β的成熟和分泌[17~19]。并继而通过与周围胶质细胞的自分泌和旁分泌通路,强化维持局部炎症[20]。本实验显示:头痛宁可减少三叉神经节神经元内IL-1β表达,并呈一定的剂量依赖性:0.375 g/kg头痛宁干预组IL-1β表达未见明显变化,而0.75 g/kg及以上剂量头痛宁干预组IL-1β表达则呈现明显降低。3.0 g/kg头痛宁干预组与致炎剂7天组相较,神经元细胞内点状免疫荧光明显减少。本实验还发现,3.0 g/kg头痛宁干预组IL-1β基因的转录较致炎剂7天对照组下降,说明头痛宁可能也可以通过抑制三叉神经节神经元细胞内IL-1β基因的转录,减少proIL-1β的存量来下调活性IL-1β的生成和分泌。
硬脑膜主要分布有无髓C纤维痛觉传导末梢[21],与其周围分布的大量免疫细胞群(包括纤维细胞,巨噬细胞,树突状细胞,和肥大细胞)具有密切联系。这些免疫细胞群可释放炎症前细胞因子(包括IL-1β)及神经兴奋介质,在神经源性炎症产生阶段具有重要作用[22]。本实验发现,头痛宁可显著下调硬脑膜IL-1β蛋白表达,且呈剂量依赖性。同时,头痛宁也可显著抑制由硬脑膜反复炎症刺激引起的IL-1βmRNA表达。由于大鼠硬脑膜极薄,很难进行切片获得完整的硬脑膜组织荧光染色。国外文献中有报道用“整体标本准备”(Whole-mount preparation)技术行免疫荧光染色[23],本实验室由于相应技术、经验储备不足,未能成功,因而遗憾未能观察到硬脑膜IL-1β的组织学定位。尽管如此,我们认为,对于感觉神经元,由于其硬脑膜上分布的感觉末梢缺乏游离核糖体和mRNA,不合成蛋白质。因此,本实验中致炎剂7天组硬脑膜大量表达的成熟IL-1β很可能就是来自于硬脑膜大量免疫细胞群。三叉神经节中神经元细胞只占很小比例,而proIL-1β又主要分布于C纤维神经元内[12],所占比例更小。硬脑膜却分布有大量免疫细胞群。本实验同组之间硬脑膜与三叉神经节表现出的IL-1β mRNA巨大数量级差异(见表3)也与我们以上的猜测一致。所以,尽管没有足够的组织学支持,我们的研究表明,头痛宁可能通过抑制硬脑膜免疫细胞群IL-1β基因转录而显著下调了硬脑膜IL-1β的表达。
综上所述,我们认为头痛宁抑制硬脑膜及三叉神经节IL-1β基因转录从而下调IL-1β表达可能是其治疗偏头痛的机制之一。
[1]Headache Classi fi cation Committee of the International Headache S. The International Classification of Headache Disorders, 3rd edition (beta version), Cephalalgia, 2013, 33: 629~808.
[2]Lipton RB, Diamond S, Reed M,et al. Migraine diagnosis and treatment: Results from the American Migraine Study II. Headache, 2001, 41: 638 ~ 645.
[3]赵维民, 张波. 偏头痛发病机制的研究进展. 中医药临床杂志, 2015, 1:125 ~ 127.
[4]Thalakoti S, Patil VV, Damodaram S. Neuron-glia signaling in trigeminal ganglion: implications for migraine pathology. Headache, 2007, 47(7):1008 ~1023.
[5]Cumberbatch MJ,Williamson DJ, Mason GS. Dural vasodilation causes a sensitization of rat caudal trigeminal neurones in vivo that is blocked by a 5-HT1B/1D agonist.Br J Pharmacol,1999,126(6):1478 ~ 1486.
[6]刘欣, 刘沙, 燕南云. 偏头痛大鼠硬脑膜及三叉神经节上TRPV1的表达变化. 中国疼痛医学杂志, 2012,18(7):422 ~ 426.
[7] Donaldson C, Boers PM, Hoskin KL. The role of 5-HT1B and 5-HT1D receptors in the selective inhibitory effect of naratriptan on trigeminovascular neurons.Neuropharmacology, 2002, 42(3):374 ~ 385.
[8]Mitsikostas DD, Rapoport AM. New players in the preventive treatment ofmigraine. BMC Med, 2015,10, 13:279.
[9]杨海霞,张玉芹, 刘斌. 头痛宁胶囊治疗偏头痛的疗效评价及其对血小板和血液流变学的影响. 中国实验方剂学杂志, 2012, 5:230 ~ 232.
[10]刘新英. 步长头痛宁胶囊治疗偏头痛120例临床观察 山东医药,2007,35:79~80.
[11]Melo-Carrillo A, Lopez-Avila A. A chronic animal model of migraine, induced by repeated meninge-al nociception,characterized by a behavioral and pharmacological approach. Cephalalgia, 2013, 33(13):1096 ~ 1105.
[12]Chen L, Li X, Huang L,et al. Chemical stimulation of the intracranial dura activates NALP3 inflammasome in trigeminal ganglia neurons. Brain Res, 2014, 1566:1 ~ 11.
[13]Moskowitz MA. The neurobiology of vascular head pain. Ann Neurol, 1984, 16:157 ~ 168.
[14]Strassman AM, Raymond SA, Burstein R. Sensitization of meningeal sensory neurons and the origin of headaches.Nature, 1996, 384: 560 ~ 564.
[15]Ren K, Torres R. Role of interleukin-1beta during pain and in fl ammation. Brain Res Rev, 2009, 60:57 ~ 64.
[16]Yilmaz IA, Ozge A, Erdal ME. Cytokine polymorphism in patients with migraine: some suggestive clues of migraine and in fl ammation. Pain Med, 2010, 11(4): 492 ~ 497.
[17]Messlinger, K, Ellrich, J. Meningeal nociception:electrophysiologicalstudies related to headache and referred pain. Microsc. Res Tech, 2001, 53(2):129 ~ 137.
[18]Burns K, Martinon F, Tschopp J. New insights into the mechanism of IL-1beta maturation. Curr Opin Immunol, 2003, 15:26 ~ 30.
[19]Martinon F, Tschopp J. Inflammatory caspases:linking an intracellular innate immune system to autoin fl ammatory diseases. Cell, 2004, 117:561 ~ 574.
[20]Capuano A, De Corato A, Lisi L,et al. Proin fl ammatoryactivated trigeminal satellite cells promote neuronal sensitization: relevance for migraine pathology. Mol Pain, 2009, 5:43.
[21]Eftekhari S, Warfvinge K, Blixt FW,et al. Di ff erentiation of Nerve Fibers Storing CGRP and CGRP Receptors in the Peripheral Trigeminovascular System. Pain, 2013,14:1289 ~ 1303.
[22]Wieseler J, Ellis A, Sprunger D,et al. A novel method for modeling facial allodynia associated with migraine in awake and freely moving rats. J Neurosci Methods,2010, 185:236 ~ 245.
[23]Shimizu T, Toriumi H, Sato H,et al. Distribution and origin of TRPV1 receptor-containing nerve fi bers in the dura mater of rat. Brain Res, 2007, 1173:84 ~ 91.
EFFECTS OF TOUTONGNING ON THE EXPRESSION OF IL-1β BOTH IN DURA AND TRIGEMINAL GANGLION IN A MIGRAINE RAT MODEL
JIN Shan-Quan, WANG Cheng-Yun, DONG Xin, CHEN Ke-Yan, ZHANG Xue, WAN Qi△
(Department of Neurology, First Affiliated Hospital of Nanjing Medical University, Nanjing 210029, China)
Objective:To investigate the e ff ect of Toutongning on the expression of IL-1β (interleukin-1beta)both in dura and trigeminal ganglion of the recurrent migraine rat model.Methods:Totally 60 healthy adult male SD rats were selected. Twenty SD rats were randomly divided into 7-day saline control group and 1, 3, 7-day in fl ammatory soup (IS) groups (5 in each group). The recurrent migraine rat model was created. Twenty- fi ve adult male SD rats were randomized into 7-day IS control group and 0.375 g/kg, 0.75 g/kg, 1.5 g/kg, 3.0 g/kg Toutongning groups (5 in each group). Expression of IL-1β in dura matter and trigeminal ganglion of above was detected by Western blot and quanti fi ed realtime-PCR. At last, fi fteen adult male SD rats were randomized into 7-day saline control group, 7-day IS control group and 3.0 g/kg Toutongning group. Expression of IL-1β in dura matter and trigeminal ganglion of this 3 groups was detected by immuno fl uorescence after being perfused with paraformaldehyde.Results:(1)IL-1β levels of 7-day IS group was significantly higher than that of saline control group both in dura (P< 0.01) and trigeminal ganglion (P< 0.01). (2) Compared with 7-day IS control group, the expression of IL-1β in dura/trigeminal ganglion sharply decreased in 0.75 g/kg (P< 0.01/P< 0.01), 1.5 g/kg (P< 0.01/P< 0.05) and 3.0 g/kg Toutongning group (P< 0.01/P< 0.01). However, there was no di ff erence in 0.375 g/kg Toutongning group. (3) The number of fl uorescence spots in the neuron plasma of 3.0 g/kg Toutongning group was greatly reduced compared with 7-day IS control group. The immuno fl uorescence of dura was unsuccessful. (4) The IL-1β mRNA levels of 3.0 g/kg Toutongning group was signi fi cantly lower than 7-day IS control group both in dura (P< 0.01) and trigeminal ganglion (P< 0.05).Conclusion:Toutongning may down-regulate the expression of IL-1β by repressing transcription which may be one of the underlying mechanisms for the treatment of migraine.
Migraine; Toutongning; Dura matter; Trigeminal ganglion; IL-1β
10.3969/j.issn.1006-9852.2017.03.003
△通讯作者
