深圳地区四家医院感染性腹泻来源沙门菌耐药性及分子分型研究
2017-11-21龙冬玲韦洁宏吴劲松郝红雨蒋淑萍黎剑华
龙冬玲,韦洁宏,吴劲松,郝红雨,蒋淑萍,黎剑华,卓 菲
深圳地区四家医院感染性腹泻来源沙门菌耐药性及分子分型研究
龙冬玲1,韦洁宏2,吴劲松3,郝红雨4,蒋淑萍5,黎剑华1,卓 菲1
目的分析2012-2016年深圳地区感染性腹泻沙门菌耐药状况及分子型别特征,为沙门菌感染防控提供科学依据。方法收集深圳地区四家医院的137株沙门菌,传统血清学方法鉴定沙门菌血清型,微量肉汤稀释法测定菌株药物敏感性,脉冲场凝胶电泳(PFGE)对鼠伤寒沙门菌和肠炎沙门菌作分子同源性分析。结果137株沙门菌可分为30种菌型,鼠伤寒沙门菌和肠炎沙门菌是本地优势菌型。菌株对链霉素、氨苄西林、阿莫西林/克拉维酸钾耐药最为严重,对青霉素类、头孢类、氨基糖苷类、大环内酯类抗生素的耐药呈逐年增高的趋势。49株鼠伤寒沙门菌经脉冲场凝胶电泳可获得38种带型,相似度65.5%~100%,TY18为优势带型;27株肠炎沙门菌经脉冲场凝胶电泳可获得9种带型,相似度61.8%~100%,EN7为优势带型。结论感染性腹泻来源沙门菌耐药状况比较严重,菌株PFGE带型多样化,呈高度散发,部分带型与其耐药谱之间具有一定的聚集与关联性。
沙门菌;耐药特征;脉冲场凝胶电泳
沙门菌是一种在公共卫生学上具有重要意义的人兽共患病病原菌,是引起人类感染性腹泻和食物中毒最为常见的肠道致病菌之一,至今已有2 523种血清型被发现[1]。据统计,在全球范围内每年约有1 600万人受沙门菌感染,其中60万人死亡[2]。近年来,因抗生素在农业、畜牧业和临床治疗中的广泛使用导致病原菌的耐药性逐步增强,沙门菌的多重耐药率从20世纪90年代的20%增加到本世纪的70%[3]。虽然沙门菌肠道感染多是自限性疾病,但鉴于沙门菌在感染性腹泻中的重要性及在多重耐药方面的严峻性,本研究对分离自深圳地区四家医院腹泻人群的沙门菌进行药敏实验,并结合PFGE对菌株进行分子同源性分析,为指导沙门菌病的防控和食物中毒暴发溯源提供科学依据。
1 材料与方法
1.1菌株 标本分离自深圳市四家肠道门诊医院,分别为深圳市人民医院、深圳市第五人民医院、远东妇幼保健院、深圳罗湖区妇幼保健院。其中深圳市人民医院和深圳市第五人民医院是市级肠道哨点监测医院,其余为辖区医院。其中2012年分离23株、2013年29株、2014年29株、2015年33株、2016年23株。
1.2试剂和仪器 TTB、SC增菌液、三糖铁、XLD培养基,Swarm Agar琼脂(北京陆桥生物制品有限公司)、沙门菌显色培养基(法国科玛嘉)、沙门菌诊断血清(丹麦SSI公司),MicroScan WalkAway-40全自动细菌鉴定分析仪及配套试剂(美国贝克曼公司),微量肉汤稀释法药敏检测板(上海星佰生物技术公司),Seakem Gold 琼脂糖(美国Rockland),蛋白酶K(德国Merck),限制性内切酶XbalI(美国NEB),脉冲场凝胶电泳仪(美国BIO-RAD CHEF Mapper);凝胶成像系统(美国SYNGENE,G.BOX);DENSIMAT浊度计(法国BioMerirux);BioNumercs图像分析软件(比利时)。所有试剂均验收合格并在有效期内使用。
1.3菌株鉴定 参照国家标准GB 4789.4-2010《食品微生物学检验 沙门氏菌检验》[4]及WS271—2007《感染性腹泻诊断标准》[5]执行,医院上送的可疑菌株经SC、TTB增菌,采用沙门显色平板、XLD平板分离,挑选可疑菌落转种TSI,全自动生化鉴定系统鉴定为沙门菌属后采用沙门诊断血清作O抗原凝集,采用Swarm agar琼脂作H抗原诱导和血清凝集试验,生理盐水作盐水对照。菌型判定根据Kauffman-White血清分型表确定。
1.4药敏实验 依据美国临床和实验室标准协会(CLSI)推荐的抗菌药物敏感性实验执行标准M100-S20,采用微量肉汤稀释法对环丙沙星(CIP)、链霉素(STR)、氨苄西林(AMP)、氯霉素(CHL)、磺胺异噁唑(SUL)、复方新诺明(SXT)、奈啶酸(NAL)、阿莫西林/克拉维酸钾(AMC)、头孢曲松(CRO)、庆大霉素(GEN)、四环素(TCY)、头孢西丁(FOX)、头孢吡肟(FEP)、强力霉素(DOX)、阿奇霉素(AZI)、亚胺培南(IMP)16种不同类别的抗生素进行试验。质控菌株大肠埃希菌ATCC25922购自广东环凯微生物科技有限公司。
1.5PFGE分型 参照美国CDC Pulse Net实验室使用的沙门菌标准分型方法,对137株沙门菌进行分子分型,电泳条件:电压6.0V/cm,脉冲参数2.2-63.8 s,电泳18.5 h。用BioNumerics 6.0软件对电泳图谱作数据分析,绘制聚类分析树状图,聚类算法为非加权配对平均法(UPGMA),电泳条带位置优化度设为1.5%,相似度为100%认定为同一PFGE带型。PFGE分子标准布伦登卢普沙门菌H9812由深圳市疾病预防控制中心馈赠。
2 结 果
2.1流行特征 收集到的137株沙门菌中,男女比例为1.3∶1(78/59),男性患者比例稍高于女性患者;其中0~5岁儿童共分离84株,占总体的61.3%(84/137),在季节分布上以每年的5-10月为主,其中2-4月份共分离得24株,5-7月份44株,8-10月份48株,剩下月份21株,具有较典型的夏秋季特征。
2.2菌型分布 137株沙门菌共可分为30种菌型。鼠伤寒沙门菌单相变种(抗原式O4+;O5+;O12+;Hi+;H2-)在统计分析时统称为鼠伤寒沙门菌,有7株菌无法分型。血清型分布排名前三名的分别为鼠伤寒沙门菌(49株)、肠炎沙门菌(27株)、斯坦利沙门菌(9株)。鼠伤寒沙门菌肠炎沙门菌是本地区的优势血清型,共分离得76株,占总体的55.5%(76/137)。
2.3药敏试验 137株沙门菌中,除2株菌对16种测试药物完全敏感,其他菌株均对1种以上测试药物耐药,其中耐3种以上测试药物的菌株有78株(60%),耐10种以上测试药物的菌株有29株(22.3%)。菌株对链霉素、氨苄西林、阿莫西林/克拉维酸钾的耐药最为严重,耐药率依次为86.1%、62.8%、62.8%。目前临床治疗严重肠道感染沙门菌以喹诺酮类抗生素和头孢类抗生素为主。本次试验中,菌株对一代喹诺酮类药物奈啶酸和三代氟喹诺酮类药物环丙沙星的耐药率分别为43.8%和13.9%,对三代头孢类抗生素头孢曲松、头孢吡肟的耐药率依次为22.6%和13.1%。2012-2016年间,沙门菌对氨苄西林、氯霉素、阿莫西林/克拉维酸钾、庆大霉素、阿奇霉素及头孢吡肟的耐药率呈逐年增高的趋势,见图1。
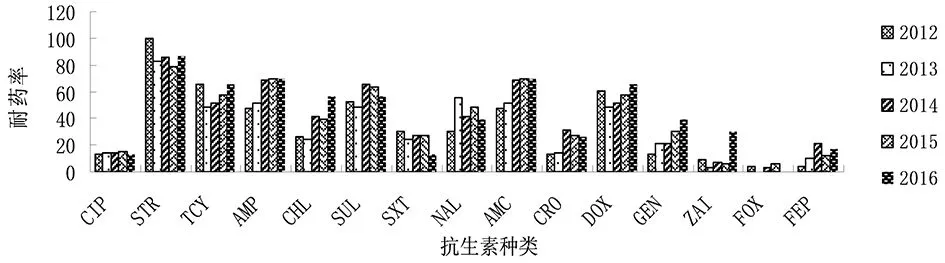
图1 2012-2016年137株沙门菌对测试药物的耐药变化Fig.1 Antibiotic resistance changes of 137 Salmonella strains to antibiotics from 2012 to 2016
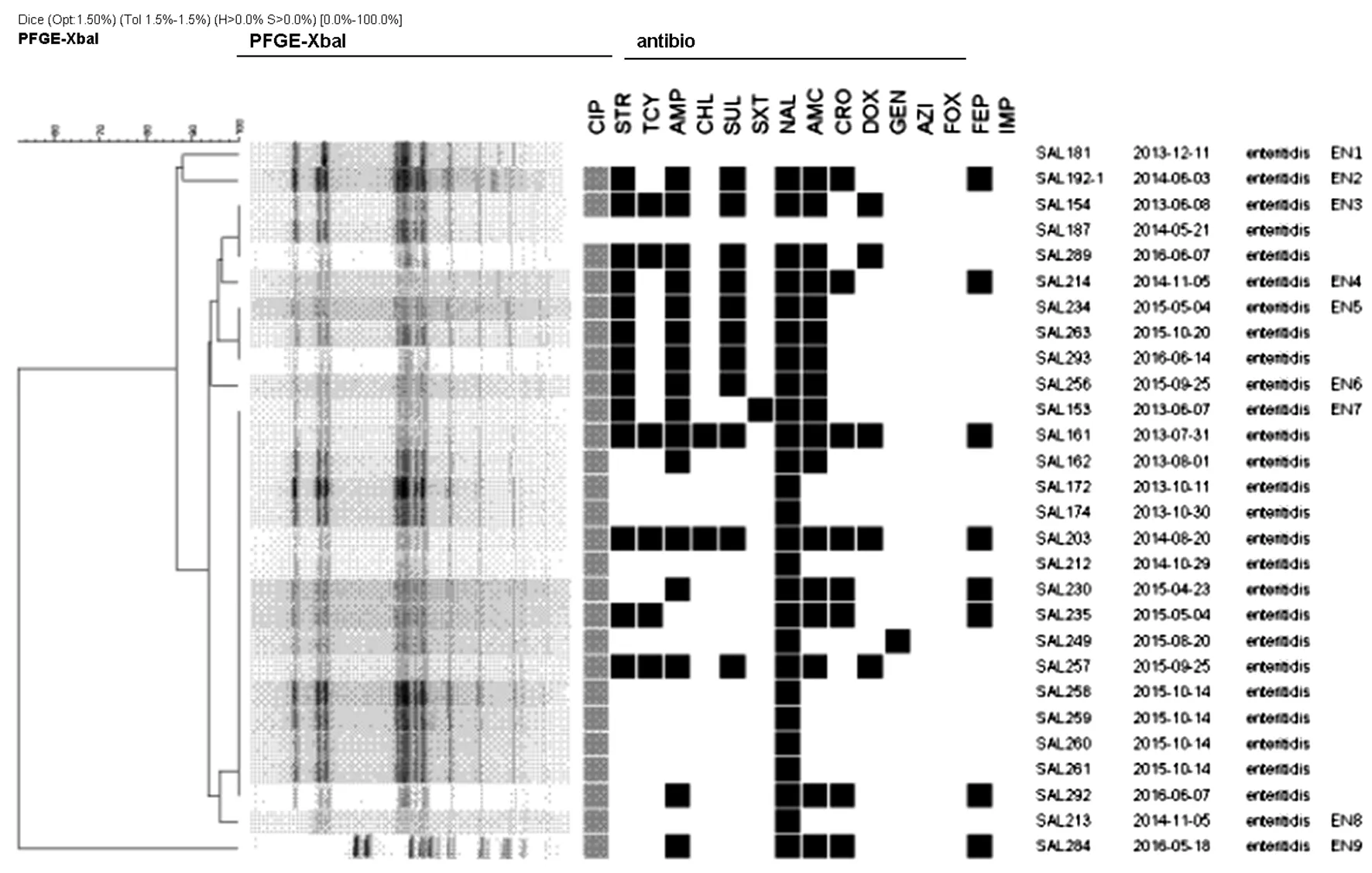
注:药敏结果中黑色框代表耐药,灰色框代表中介,白色框代表敏感。Emteritidis为肠炎沙门菌。图3 27株肠炎沙门菌聚类分析及耐药谱Fig.3 PFGE clustering analysis and drug resistance spectrum of 27 S. enteritidis strains
2.4PFGE分型:对优势菌型鼠伤寒沙门菌及肠炎沙门菌进行脉冲场凝胶电泳分型分析。49株鼠伤寒沙门菌经XbalI酶切可分为38种PFGE带型,每种带型包含菌株数1~6株不等,相似度63.5%~100%,其中带型TY18包含6株菌,为此血清型的优势带型。27株肠炎沙门菌经XalI酶切可获得9种PFGE带型,每种带型包含菌株数1~16株不等,相似度61.8%~100%,其中EN7带型有16株菌,为肠炎沙门菌的优势带型,PFGE聚类分析见图2、图3。此外,PFGE带型与其耐药谱之间关系复杂,具有一致性,也有特殊性。带型相同的菌株中往往存在相同的耐药谱,如鼠伤寒沙门菌TY18带型中的SAL142、148、156、189 耐药谱相同;肠炎沙门菌优势带型EN7带型中有7株菌(SAL172、174、212、258、259、260、261)耐药谱相同。从型间分析,不同带型之间也存在耐药谱相同的情况,如鼠伤寒沙门菌中的SAL228、129、111、142和肠炎沙门菌中的SAL284、292、230。单株带型的菌株也可出现相同的耐药谱。

注:药敏结果中黑色框代表耐药,灰色框代表中介,白色框代表敏感。Typhimurium为鼠伤寒沙门菌。图2 49株鼠伤寒沙门菌聚类分析及抗生素耐药谱Fig.2 PFGE clustering analysis and drug resistance spectrum of 49 S. typhimurium strains
3 讨 论
经2012-2016年对深圳地区四家肠道门诊医院感染性腹泻来源沙门菌的流行特征分析发现,沙门菌的分离具有典型的夏秋季特征,深圳地区属于亚热带气候,5-10月气温均处于较高水平,天气炎热,有利于肠道致病菌的增殖,故夏秋季分离率明显高于其他季节。从菌株来源的人群分布可知,婴幼儿感染沙门菌的比例最高,一方面与婴幼儿自身免疫系统未发育完善,病情重,家长不会擅自给孩子服用抗生素,而是快速寻医有关,另一方面源于本次研究涉及的四家医院有两家为妇幼保健院,婴幼儿患者的例数较多有关。鼠伤寒沙门菌和肠炎沙门菌是沙门菌肠道感染的优势菌型,此监测结果与中国其他地区[6]、亚洲[7]、欧洲[8]的研究结果相一致。除去优势菌型,深圳地区分离的其他沙门菌血清型分布广泛,种类繁多,有研究报道德比沙门菌、阿贡纳沙门菌、山夫登堡沙门菌在河南[9]、武汉[10]、上海[11]等地有明显的流行趋势,这些血清型在深圳地区均不常见,提示沙门菌型别的分布具有很强的地域特征,人群感染沙门菌的菌型分布具有广泛性,但在具体区域具有特殊性。
目前临床治疗沙门菌肠道感染首选喹诺酮类和三代头孢菌素类抗生素。本次研究中,菌株对头孢曲松的耐药率高达23.3%,对头孢吡肟的耐药率为13.1%,此结果均高于国内以往的研究结果[12-13]。此外,菌株对喹诺酮抗生素奈啶酸及环丙沙星的敏感率已降至56.2%和45.9%,这与喹诺酮类药物在国内畜牧业和养殖业不合理使用,过度滥用等因素密切相关。由本次药敏试验结果可看出,深圳地区沙门菌的耐药问题十分严峻,菌株对8类16种抗生素存在不同程度的耐药,比较严重的有青霉素类、四环素类和磺胺类药物。结合抗生素耐药趋势结果发现,菌株对青霉素类、头孢类、氨基糖苷类、大环内酯类抗生素的耐药呈逐年增高的趋势,耐药数据结果表明深圳地区沙门菌的耐药形势非常严峻,临床上喹诺酮类和头孢类耐药菌株的出现,不仅为病人治疗、疾病预防控制带来困难,甚至易导致耐药菌株引起的食源性疾病的暴发。因此,持续性开展沙门菌血清型分布及耐药监测,及时分析分享数据,有益于指导农业、畜牧业和医疗部门合理使用抗生素,减缓耐药菌株出现的速度,减轻社会和患者的经济负担。
脉冲场凝胶电泳(PFGE)是近年来快速发展起来的一种病原菌分子分型技术,依托此项技术可快速鉴别细菌间的同源性,对于细菌性传染病监测、传染源追踪、传播途径调查及在暴发事件调查中有着非常重要的意义。本研究利用该技术对优势菌型鼠伤寒沙门菌和肠炎沙门菌进行分子同源性分析,积累了本地区沙门菌分子流行病学的基线数据,成功建立起沙门菌PFGE指纹图谱,为往后与其他地区开展分子流行病学比对调查和暴发溯源提供科学依据。采用XbaI酶切,49株鼠伤寒沙门菌分成38种带型,表现出菌株的遗传多态性;分析优势带型TY18的菌株,菌株的分离时间分散,没有聚集性病例的出现,提示鼠伤寒沙门菌的感染高度散发。通过对PFGE图谱和耐药谱之间的比对,相同耐药表型的菌株存在相同的PFGE带型,两者呈现聚类一致性,提示基于共同暴露源的菌株可能具有相同的基因和耐药表型特征[14];然而也存在不同耐药表型的菌株却有相同的PFGE带型,说明分子带型与耐药谱之间的联系也存在差异性与不确定性,两者之间的流行病学关系、基因遗传关系尚待进一步的研究。
(致谢:感谢深圳市感染性腹泻哨点监测项目及深圳市疾病预防控制中心扈庆华、李迎慧、石晓路老师的支持与帮助。)
[1] Lin MR, Zhou X, Li MY, et al. Characterization of antimicrobial resistances and molecular characteristics of 84 strains ofSalmonella[J]. Chin J Zoonoses, 32(6): 553-557. DOI: 10.3969/j.issn.1002-2694.2016.06.009 (in Chinese)
林茂锐, 周旋, 李明友, 等. 84株沙门菌耐药特征及分子分型结果分析[J]. 中国人兽共患病学报, 2016, 32(6): 553-557.
[2] Long DL, Zhuo F, Li JH, et al. Serotype distribution and antibiotic resistance ofSalmonellain Luohu district of Shenzhen in 2012[J]. Chin J Health Lab Tec,2014,24(2): 285-287. (in Chinese)
龙冬玲, 卓菲, 黎建华, 等. 2012年深圳市罗湖区沙门菌菌型分布及耐药情况分析[J]. 中国卫生检验, 2014, 24(2): 285-287.
[3] Su LH, Chiu CH, Chu C, et al. Antimicrobial resistance in nontyphoidSalmonellaserotypes: A global challenge[J]. Clin Infect Dis, 2004, 39(4): 546-551. DOI: 10.1086/422726
[4] Ministry of Health of the PRC. National food safety standard of GB 4789.4-2010. Food microbiological examination: Salmonella[S]. Beijing: Standards Press of China, 2010. (in Chinese)
中华人民共和国卫生部. GB4789.4-2010 食品微生物学检验沙门氏菌检验[S]. 北京: 中国标准出版社, 2010.
[5] Ministry of Health of the PRC. WS271-2007. Diagnostic criteria for infectious diarrhea[S]. Beijing: Standards Press of China, 2007. (in Chinese)
中华人民共和国卫生部. WS271-2007 感染性腹泻诊断标准[S]. 北京: 中国标准出版社, 2007.
[6] Ran L, Wu S, Gao Y, et al. Laboratory-based surveillance of nontyphodialSalmonellainfections in China[J]. Foodborne Pathog Dis, 2011, 8(8): 921-927. DOI: 10.1089/fpd.2010.0827
[7] Bangtrakulnonth A, Pornreongwong S, Pulsrikan C, et al. Salmonella serovars from humans and other sources in Thailand,1993-2002[J]. Emerg Infect Dis, 2004, 10(1): 131-136. DOI: 10.320/eid1001.020781
[8] Galanis E, Lo Fo Wong DM, Patrik ME, et al. Web-based surveillance and globalSalmonelladistribution, 2000-2002[J]. Emerg Infect Dis, 2006, 12(3): 381-388. DOI: 10.320/eid1205.050854
[9] Xia S, Hendriksen RS, Xie Z, et al. Molecular characterization and antimicrobial susceptibility ofSalmonellaisolatesfrom infections in humans in Henan Province, China[J]. J Clin Microbiol 2009, 47(2): 401-409.DOI:10.1128/JCM.01099-08
[10] Deng X, Ran L, Wu S, et al. Labotatory-based surveillance of non-typhoidalSalmonellainfections in Guangdong Province, China[J]. Foodborne Pathog Dis, 2012, 9(4): 305-312.DOI:10.1089/FPD.2011.1008
[11] Gu BK, Yuan ZA, Jin HM, et al.Epidemiological surveillance of Samonellosis in Shanghai[J]. J Environ Occup Med, 2008, 25(3): 245-247. (in Chinese)
顾宝柯, 袁政安, 金汇明, 等. 上海市沙门菌病流行特征分析[J]. 环境与职业医学, 2008, 25(3): 245-247.
[12] Liang DW, Lu JH, Jiang LX, et al. Pattern of antimicrobial resistance and molecular typing forSalmonellaisolated from diarrhea cases in Guangzhou[J]. Mod Prevent Med, 2016, 43(4): 696-699. (in Chinese)
梁达炜, 卢解红, 江凌晓, 等.广州市136株沙门菌耐药表型与分子分型研究[J]. 现代预防医学, 2016, 43(4): 696-699.
[13] Hopkins KL, Kirvhner M, Guerra B, et al. MultiresistantSalmonellaentericaserover 4, [5], 12; i:- in Europe: a new pandemic strain?[J]. Euro Surveill, 2010, 15(22): 19580.
[14] Zhao JY, Huang LL, Mu YJ, et al. Characteristics of drug resistance and molecular typing research forSalmonellatyphimuriumisolated in Henan Province, 2011-2013[J]. Chin J Zoonoses,2016,32(1): 56-60. DOI: 10.3969/j.issn.1002-2694.2016.01.012 (in Chinese)
赵嘉咏, 黄丽莉, 穆育姣, 等. 2011-2013年河南省鼠伤寒沙门菌耐药与分子分型研究[J]. 中国人兽共患病学报, 2016, 32(1): 56-60.
CharacteristicsofdrugresistanceandmoleculartypingforSalmonellaindiarrheapatientsfromfourhospitalsinShenzhen
LONG Dong-ling1, WEI Jie-hong2, WU Jing-song3, HAO Hao-yu4, JIANG Shu-ping5, LI Jian-hua1, ZHUO Fei1
(1.LuohuDistrictCenterforDiseaseControlandPrevention,Shenzhen518020,China;2.DepartmentofLaboratoryMedicine,theFifthPeople’sHospitalofShenzhen,Shenzhen518020,China;3.DepartmentofLaboratoryMedicine,ShenzhenPeople’sHospital,Shenzhen518020,China;4.DepartmentofLaboratoryMedicine,ShenzhenYuandongMaternityandChildHealthcareHospital,Shenzhen518020,China;5.DepartmentofLaboratoryMedicine,ShenzhenLuohuMaternityandChildHealthcareHospital,Shenzhen518020,China)
We analyzed the antimicrobial resistance and pulsed field gel electrophoresis(PFGE) patterns ofSalmonellastrains of infectious diarrhea isolated four hospitals in Shenzhen during 2012-2016. A total of 137Salmonellastrains collected in 4 hospitals in Shenzhen were identified by serotyping, micro-dilution method was used to detect the antimicrobial susceptibility of the isolates. Pulsed field gel-electrophoresis(PFGE) was used for molecular typing and cluster analysis ofS.typhimuriumandS.entericastrains. Results showed that 137 strains ofSalmonellawere divided into 30 kinds of serotype.S.typhimuriumwas the predominant serotype. The drug susceptibility test indicated that the antibiotic resistance of the strains to chloromycetin, ampicillin and amoxicillin were more serious than other drugs, the resistance to penicillins, cephalosporins, aminolycosides and macrolides showed increase trends year by year. Of 49 strains ofS.typhimuriumwere divided 38 molecular patterns by PFGE, with similarity ranged from 65.5%-100%, TY18 was the main PFGE pattern. The 27 strains ofS.entericawere divided into 7 molecular patterns by PFGE, with similarity ranged from 61.8%-100%, EN7 was the main PFGE pattern. The status of drug resistance of infectious diarrhea isolates was rather severe, PFGE patterns showed diversity, suggesting the diarrhea cases were distributed sporadically. Partial PFGE patterns and its corresponding antidrug spectrum have certain aggregation relationship.
Salmonella; antimicrobial resistance character; pulsed field gel-electrophoresis
Zhuo Fei, Email: diedrelong@126.com
10.3969/j.issn.1002-2694.2017.10.009
深圳罗湖区软科学研究计划项目(No.2015035)资助
卓菲,Email:diedrelong@126.com
1.深圳市罗湖区疾病预防控制中心,深圳 518020;
2.深圳市第五人民医院检验科,深圳 518020;
3.深圳市人民医院检验科,深圳 518020;
4.深圳市远东妇幼保健院检验科,深圳 518020;
5.深圳市罗湖区妇幼保健院检验科,深圳 518020
378
A
1002-2694(2017)10-0897-06
Supported by the Shenzhen Luohu District Research Project of Soft Science (No. 2015035)
2017-06-26编辑李友松
