福建省登革热监测点白纹伊蚊mtDNA-COI基因遗传多态性研究
2017-11-21游丽斌何文祥翁育伟王金章阚乃鹏张拥军
游丽斌,朱 颖,何文祥,翁育伟,2,王金章,阚乃鹏,张拥军,2
福建省登革热监测点白纹伊蚊mtDNA-COI基因遗传多态性研究
游丽斌1,朱 颖1,何文祥1,翁育伟1,2,王金章1,阚乃鹏1,张拥军1,2
目的探讨福建省登革热监测点白纹伊蚊线粒体细胞色素C氧化酶亚基I(mtDNA-COI)基因序列特征和遗传多态性。方法选择福建省登革热监测点2015—2016年送检部分批次白纹伊蚊雌性成蚊,提取基因组DNA,扩增全长mtDNA-COI基因片段并测序,分析基因特征并构建系统发育树。结果PCR扩增mtDNA-CO I基因共12个片段,测序得到的片段长度在1 476 bp—1 494 bp之间。与白纹伊蚊参比序列相比,同源性为99%,包含9个位点的碱基差异。根据不同单倍体型序列构建种系发育树,发现6个登革热监测点的白纹伊蚊分属3个单倍体型,即H02、H03、H08。结论确定福建省登革热监测点白纹伊蚊mtDNA-COI基因存在9个单核苷酸差异位点,包括H02、H03、H08共3种单倍体型,为福建省虫媒病毒病监测及其防控提供技术支撑。
白纹伊蚊;线粒体细胞色素C氧化酶亚基I;遗传多态性;种系发生分析
白纹伊蚊(Aedesalbopictus)属双翅目,蚊科,伊蚊属(Aedes),是登革热、黄热病、西尼罗热、基孔肯雅热等病毒性疾病传播的主要媒介[1]。白纹伊蚊原广泛分布于亚洲的热带、亚热带地区和部分温带地区,过去数十年间其孳生地不断扩大,北美、南美、欧洲和非洲大陆的一些国家均有分布[2]。在中国,白纹伊蚊孳生地遍及辽宁、陕西、江苏、福建、云南等20个省份[3]。福建省自1873年厦门首次报道登革热的暴发流行[4],至今已发生过多起登革热的局部暴发流行,引起严重的公共卫生问题[5]。蚊媒控制不仅是处置这类暴发疫情的关键,也是预防其它输入性虫媒病毒病导致本地病例的核心。近年来国内外部分研究表明,生态环境变化、区域间交通运输和人员交流,甚至蚊虫防治措施的实施都会影响白纹伊蚊的种群遗传结构[6-7]。不同地理种群白纹伊蚊在生态习性、媒介效能方面的差异影响其流行病学特征[8]。因此,研究白纹伊蚊不同环境下遗传结构的差异和种群动态特征对于这些虫媒病毒病的防控工作具有重要参考价值。
研究白纹伊蚊种群结构和系统发育分析的常用遗传标记包括:同工酶、线粒体DNA(mtDNA)、核糖体DNA(rDNA)、微卫星等[9]。其中,最常见的靶基因是线粒体基因组细胞色素C氧化酶亚基I(mitochondrial cytochrome C oxidase subunit I,mtDNA-COI),该基因具有序列保守、进化速率恰当、无重组等特点,广泛应用于白纹伊蚊蚊种鉴定和进化遗传研究[10]。本研究首次尝试扩增白纹伊蚊mtDNA-COI基因全长,分析2015—2016年福建省白纹伊蚊mtDNA-COI基因序列的多态性,为福建省蚊媒监测提供分子依据。
1 材料与方法
1.1样本来源 选取福建省各登革热监测点2015-2016年送检的白纹伊蚊雌性成蚊,共计12批,分别来自6个监测点:福州台江区(1)、连江县(5)、厦门集美区(2)、宁德霞浦县(1)、莆田涵江区(1)、建瓯市(2),其中连江县样品采集时间为2015年6月、7月、8月、10月及2016年(表1)。
1.2基因组DNA的提取 采用高盐抽提法提取基因组DNA,简述如下:取数只白纹伊蚊腿于1.5 mL离心管中,加400 μL消化液(10 mmol/L NaCl,10 mmol/L Tris(pH8.0),10 mmol/L EDTA(pH8.0),0.5% SDS);加蛋白酶K(20 mg/mL)40 μL,55 ℃过夜;12 000 r/min离心2 min,转移上清液到新的1.5 mL离心管;加400 μL醋酸钠溶液(3 mol/L,pH5.2),-20 ℃放置15 min;12 000 r/min离心20 min,取上清液到新的1.5 mL离心管;加800 μL无水乙醇,-20 ℃放置15 min;12 000 r/min离心20 min,弃上清;加500 μL无水乙醇洗涤1次,12 000 r/min离心5 min,弃上清;加70%无水乙醇500 μL洗涤2次,12 000 r/min离心5 min,弃上清,自然干燥后加50 μL双蒸灭菌水重悬,-20 ℃保存。
1.3PCR扩增和测序 根据白纹伊蚊线粒体基因组参比序列(GenBank:NC_006817)中mtDNA-COI基因编码区(nt1436-2972)设计扩增全长编码区的引物。上游引物(COX1FL-1424F):5′-CCAGCCATTTAATCGCGACA-3′和下游引物(COX1FL-2999R):5′-TTCATTGCACTAACTCGCCA-3′由生工生物工程(上海)股份有限公司合成。以提取的白纹伊蚊基因组DNA为模版,进行目的基因扩增。扩增试剂盒Premix TaqTM(Ex TaqTMVersion 2.0 plus dye)为大连TAKARA公司,反应体系为50 μL:Premix Taq 25 μL,上下游引物(10 μmol/L)各2 μL,模版2 μL,ddH2O 19 μL。PCR反应条件为:94 ℃预变性4 min;94 ℃变性30 s;50 ℃退火90 s;72 ℃延伸30 s;共30个循环;72 ℃后延伸10 min。扩增产物用1%琼脂糖凝胶电泳鉴定,4 ℃保存,阳性产物送至铂尚生物技术(上海)有限公司测序。
1.4mtDNA-CO I基因序列分析 应用Bioedit软件查看双向测序峰图,核对序列,与参比序列进行多序列比对。从GenBank下载白纹伊蚊mtDNA-COI基因的72种单倍体型序列(GenBank:KC690896-KC690961,AB907796-AB907801)[11-12],埃及伊蚊mtDNA-COI基因序列(GenBank:AY056597)作为外群,应用Mega 6.0[13]构建系统发育树。采用基于Kimura双参数校正模型的最大似然法(maximum likelihood,ML),并用Bootstraping法对系统发育树进行评估,Bootstrap步数设置为1 000。
2 结 果
2.1白纹伊蚊mtDNA-COI基因片段的PCR扩增 提取福建省6个登革热监测点2015—2016年送检的12批白纹伊蚊雌性成蚊腿的基因组DNA,扩增全长mtDNA-COI基因。PCR产物经1%琼脂糖凝胶电泳,约在1 500 bp处可见单一条带,与预期片段大小吻合(图1)。

M:DL2000 marker;1-12号泳道样品编号依次为:JO-2015, TJ-2015, JM-2015, HJ-2015, JO-2016, XP-2016, JM-2016, LJ-2016, LJ-2015-Jun, LJ-2015-Jul, LJ-2015-Aug, LJ-2015-OctM: DL2000 marker; Lane 1-12: A. albopictus samples from JO-2015, TJ-2015, JM-2015, HJ-2015, JO-2016, XP-2016, JM-2016, LJ-2016, LJ-2015-Jun, LJ-2015-Jul, LJ-2015-Aug, LJ-2015-Oct图1 白纹伊蚊全长mtDNA-COI基因扩增Fig.1 PCR amplification of full-length mtDNA-COI genes from A. albopictus
2.2白纹伊蚊mtDNA-COI基因变异分析 分别采用扩增引物对PCR产物进行测序,经过拼接,片段长度在1 476 bp—1 494 bp之间(GenBank)。与白纹伊蚊参比序列(GenBank:NC_006817)进行多序列比对,结果显示序列相似性均达99%,共确认9个变异位点(1505C/T、1580C/G、1678C/A、1706G/A、1804G/A、1966C/T、2104G/A、2296T/C、2805T/C)(表1)。来自福建省6个登革热监测点的12个白纹伊蚊样本之间,mtDNA-COI基因遗传距离在0.00-0.002,观察到仅在4个位点(1804G、2104G、2296T、2805T)存在一个或多个变异,其余5处位点均一致。
2.3系统发育分析 从GenBank下载已知白纹伊蚊mtDNA-COI基因的72种单倍体型序列(这些单倍体型分别来自中国、日本、新加坡、意大利、美国、哥斯达尼加、巴拿马等),并以埃及伊蚊相应序列(GenBank:AY056597)作为外群,以共有片段1 388 bp的序列构建出系统发育树(图2)。从图2中看出,来自福建省登革热监测点的这12条序列分属3个单倍体型。HJ-2015、JO-2015、JO-2016属于H03单倍体型,LJ-2015-Aug属于H02单倍体型,邻近的单倍体型有H25、H62。其余8条序列JM-2015、JM-2016、LJ-2016、TJ-2015、XP-2016、LJ-2015-Jun、LJ-2015-Jul、LJ-2015-Oct属于H08单倍体型,在进化树的上下游为H12、H13等单倍体型。值得注意的是,连江县的5个批次样品,分属H02和H08单倍体型,除了2015年8月样品LJ-2015-Aug为H02单倍体型,其余样品均为H08单倍体型。
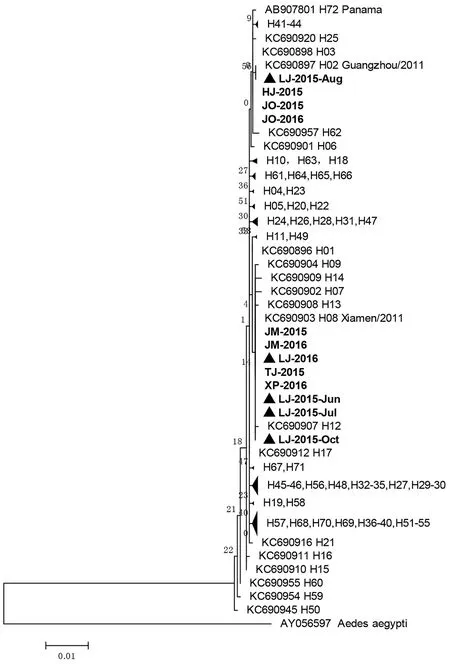
图2 福建省登革热监测点白纹伊蚊COI基因的系统发育树Fig.2 Phylogenetic analysis on COI genes of A. albopictus from dengue surveillance sites in Fujian
3 讨 论
国内外不同团队先后开展了关于白纹伊蚊mtDNA-COI基因特征的研究,但分析的片段大都在400—700 bp之间[14-17],由于该基因本身相对保守,且蚊媒样品来源受到地域限制,能够提供的信息有限。近几年,Zhong等[11]将研究对象的地理范围扩大,首次对来自中国、日本、新加坡、意大利、美国等地白纹伊蚊样品扩增了1 433 bp的片段,确定66种单倍体型(H01—H66),其中包括来自福建厦门的样品。随后日本学者Futami等[12]对哥斯达尼加、巴拿马采集的白纹伊蚊进行了类似研究,扩增了1 390 bp的片段,确定了另外6种单倍体型(H67—H72)。因此,鉴于福建省开展登革热蚊媒监测10余年,尚未明确我省存在哪些单倍体型的白纹伊蚊,本研究的首要目标,即是确定各登革热监测点明确存在的白纹伊蚊单倍体型别。
首先,我们设计引物并扩增了白纹伊蚊的全长mtDNA-COI基因,选择2015—2016年各登革热监测点送检的部分批次成蚊,扩增得到12条片段,测序后片段长度在1 476—1 494 bp之间。初步同源性分析显示,所得12条mtDNA-COI片段与白纹伊蚊参考序列(GenBank:NC_006817)的同源性达99%。在发现的9个碱基差异位点中,核苷酸序列1505C、1580C、1678C、1706A、1966C位点上,6个登革热监测点的12个白纹伊蚊样本序列表现出一致性突变,而核苷酸序列1804G、2104G、2296T、2805T位点上,12个白纹伊蚊样本序列表现出多态性(表1)。福建省6个监测点白纹伊蚊样本间多序列比对结果显示,白纹伊蚊样本mtDNA-COI基因遗传距离在0.00-0.002之间,遗传距离极小,说明监测期间各监测点白纹伊蚊同源性较高。与Zhong等在厦门29只样品中发现11个可变位点的结果接近,但低于深圳40只样品发现24个可变位点的结果[11,18]。
表1 福建省登革热监测点白纹伊蚊样品信息及COI基因变异位点
Tab.1 List of A. albopictus samples collected from dengue surveillance sites in Fujian Province and variation sites of mtDNA-COI gene

样品编号Sample采集地点Collectionsites采集时间ColletiontimeGenBank登录号GenBankNo.COI单倍体型Haplotype变异位点Variationsites150515801678170618041966210422962805参比序列台湾台北NC_006817CCCAGCGTTTJ⁃2015福州台江区2015年5月KY971597H08TGAG—T—C—LJ⁃2015⁃Jun福州连江县2015年6月KY971599H08TGAG—T—C—LJ⁃2015⁃Jul福州连江县2015年7月KY971600H08TGAG—T—C—LJ⁃2015⁃Aug福州连江县2015年8月KY971601H02TGAGAT——CLJ⁃2015⁃Oct福州连江县2015年10月KY971602H08TGAGAT——CLJ⁃2016福州连江县2016年KY971596H08TGAGAT——CJM⁃2015厦门集美区2015年7月KY971594H08TGAGAT——CJM⁃2016厦门集美区2016年KY971595H08TGAGAT——CXP⁃2016宁德霞浦县2016年KY971598H08TGAGAT——CHJ⁃2015莆田涵江区2015年6月KY971591H03TGAGAT——CJO⁃2015南平建瓯市2015年6月KY971592H03TGAG—TAC—JO⁃2016南平建瓯市2016年KY971593H03TGAGAT——C
注:所有位点均参照GenBank登录号NC_006817
Note: The variation sites are listed according to the sequence of NC_006817 in GenBank.
然后,通过与目前已知的72种白纹伊蚊mtDNA-COI单倍体型参比序列进行种系发生分析,本研究首次确定了2015-2016年福建省登革热监测点的白纹伊蚊mtDNA-COI基因单倍体型(图2)。共发现3种单倍体型,即H02、H03、H08。其多样性低于文献报道中广州6种、厦门11种单倍体型,而与江苏2种单倍体型接近[11]。对照Zhong等观察到的结果,其中H08单倍体型为厦门独有(29只厦门样品中有9只属于H08型),本研究中12批次样品也有8份为H08型。因此,H08单倍体型是否为福建省特有,需要今后更多序列数据证明。同时,本研究中有3份样品属于H03单倍体型。该型别在Zhong等观察到的结果属于优势型,总共346份样品中有113份属于H03,并且在广州、厦门、江苏样品中占优势(20/32、9/29、23/30)。从以上数据看来,H03单倍体型极有可能是国内的优势基因型。另外,本研究还发现唯一一份样品LJ-2015-Aug属于H02型,而该单倍体型根据文献仅出现于来自广州的样品,如果能够得到其它证据的支持,表明福建省可能发生过不同遗传背景的白纹伊蚊入侵事件。从这个角度来看,鉴于目前白纹伊蚊孳生地在全球不断扩张的事实,国内外研究人员按照统一的标准和单倍体型分型方案,将有助于精确定位白纹伊蚊的来源、迁徙路线及种群进化,科学评估新的种群入侵可能带来的危害。
综上所述,本研究首次扩增比较来自福建省各登革热监测点白纹伊蚊mtDNA-COI全长片段序列,观察到各监测点之间样品同源性较高,并且参照国内外现有的72种mtDNA-COI单倍体型确定了各监测点的基因型,为今后在分子水平持续进行蚊媒监测、推动虫媒病毒病防控奠定了坚实的基础。
[1] Haddad N, Mousson L, Vazeille M, et al.Aedesalbopictusin Lebanon, a potential risk of arboviruses outbreak[J]. BMC Infect Dis, 2012, 12:300. DOI: 10.1186/1471-2334-12-300
[2] Qian QQ, Fang YL, Zhang JQ, et al. Research on the different geographic strains ofAedesalbopictus[J]. Chin Frontier Health Quarant, 2016, 39(1): 66-68. DOI: 10.16408/j.1004-9770.2016.01.018 (in Chinese)
钱茜茜, 方义亮, 张建庆,等. 不同地理株白纹伊蚊研究现状[J]. 中国国境卫生检疫杂志, 2016, 39(1):66-68.
[3] Lu BL. Fauna Sinica, Diptera: Culicidae (1, 2)[M]. Beijing: Science Press. 1997: 244. (in Chinese)
陆宝麟. 中国动物志.Ⅷ.双翅目: 蚊科(上、下)[M].北京: 科学出版社,1997: 244
[4] Chen YD. Epidemics of dengue fever in global prevalence area[J]. Chin J Epidemiol, 1990, 11(1): 51-54. (in Chinese)
陈韵冬. 登革热在全球主要流行区的流行近况[J]. 中华流行病学杂志, 1990, 11(1):51-54.
[5] Hu TS, Zhang HL, Liu YH, et al. Molecular characteristics of the full-length genome of dengue serotype 1 virus strains isolated from dengue fever cases in Sino-Myanmar border region in Yunnan Province, China[J]. Chin J Zoonoses, 2017, 33(6):473-480. DOI:10.3969/j.issn.1002-2694.2017.06.001(in Chinese)
胡挺松, 张海林, 刘永华等. 云南中缅边境登革1型病毒全基因组序列特征研究[J]. 中国人兽共患病学报, 2017, 33(6):473-480.
[6] Lin Y, Zhang SY, Lin YY, et al. Genetic polymorphism analysis on rDNA ITS2 from different geographical strains ofAedesalbopictusin Fujian Province[J]. Chin J Zoonoses, 2010,(8): 735-738. (in Chinese)
林岩, 张山鹰, 林耀莹,等. 福建省不同地理株白纹伊蚊rDNA ITS2基因多态性分析[J]. 中国人兽共患病学报, 2010,(8):735-738.
[7] Huber K, Loan LL, Hoang TH, et al. Temporal genetic variation inAedesaegyptipopulations in Ho Chi Minh City(Vietnam)[J]. Heredity(Edinb), 2002, 89(1): 7-14.
[8] Tien TK, Vazeille-Falcoz M, Mousson L, et al.Aedesaegyptiin Ho Chi Minh City (Viet Nam): susceptibility to dengue 2 virus and genetic differentiation[J]. Trans Roy Soy Trop Med Hyg, 1999, 93(6): 581-586.
[9] Goubert C, Minard G, Vieira C, et al. Population genetics of the Asian tiger mosquitoAedesalbopictus, an invasive vector of human diseases[J]. Heredity, 2016, 117(3): 125-134. DOI: 10.1038/hdy.2016.35
[10] Folmer O, Black M, Hoeh W, et al. DNA primers for amplification of mitochondrial cytochrome C oxidase subunitIfrom diverse metazoan invertebrates[J]. Mol Mar Biol Biotechnol, 1994, 3(5): 294-299.
[11] Zhong D, Lo E, Hu R, et al. Genetic analysis of invasiveAedesalbopictuspopulations in Los Angeles County, California and its potential public health impact[J]. PLoS One, 2013, 8(7): e68586. DOI:10.1371/journal.pone.0068586
[12] Futami K, Valderrama A, Baldi M, et al. New and common haplotypes shape genetic diversity in Asian tiger mosquito populations from Costa Rica and Panama[J]. J Econ Entomol, 2015, 108(2):761-768. DOI: 10.1093/jee/tou028
[13] Tamura K, Stecher G, Peterson D, et al. MEGA6: Molecular Evolutionary Genetics Analysis Version 6.0[J]. Mol Biol Evol, 2013, 30(12): 2725-2729. DOI: 10.1093/molbev/mst197
[14] Fang YL, Zhang SY, Xie HG, et al. Study on mtDNA-COI genetic characteristics ofAedesalbopictusin different geographic strains[J].Strait J Prev Med, 2011, 17(4): 1-4. (in Chinese)
方义亮, 张山鹰, 谢汉国,等. 不同地理株白纹伊蚊mtDNA-COI基因特征研究[J]. 海峡预防医学杂志, 2011, 17(4): 1-4.
[15] Ismail NA, Dom NC, Ismail R, et al. Mitochondrial cytochrome oxidase I gene sequence analysis ofAedesalbopictusin Malaysia[J]. J Am Mosq Control Assoc, 2015, 31: 305-312. DOI: 10.2987/moco-31-04-305-312.1
[16] Zhang RL, Yao GQ, Pan XQ, et al. Genetic diversities of different geographical populations ofAedesalbopictusbased on mitochondrial gene COI[J]. Chin J Zoonoses, 2017, 33(4):316-320.DOI:10.3969/j.issn.1002-2694.2017.04.005 (in Chinese)
张瑞玲, 姚广琴, 潘晓倩,等. 不同地理种群白纹伊蚊线粒体基因COI的遗传多样性分析[J]. 中国人兽共患病学报, 2017, 33(4):316-320.
[17] Guo S, Ling F, Wang JN, et al. Genetic polymorphism analysis of cytochrome C oxidase subunit I gene inAedesalbopictusfrom Zhejiang Province, China[J]. Chin J Zoonoses, 2016, 32(2):133-136. DOI:10.3969/j.issn.1002-2694.2016.02.007(in Chinese)
郭颂, 凌锋, 王金娜,等. 浙江省不同地理株白纹伊蚊mtDNA-COI基因多态性研究[J]. 中国人兽共患病学报, 2016, 32(2):133-136.
[18] Yang F, Zhang RL, Liu Y, et al. Genetic polymorphism analysis on mtDNA COⅠ ofAedesalbopictusin Shenzhen, China[J]. Chin J Vector Biol Control, 2015, 26(4): 337-340. DOI: 10.11853/j.issn.1003.4692.2015.04.002 (in Chinese)
阳帆, 张仁利, 刘阳,等. 深圳市白纹伊蚊细胞色素C氧化酶亚基Ⅰ基因多态性分析[J]. 中国媒介生物学及控制杂志, 2015, 26(4): 337-340.
GeneticdiversityofcytochromeCoxidasesubunitIgenesinAedesalbopictusfromdenguesurveillancesitesinFujianProvince,China
YOU Li-bin1, ZHU Ying1, HE Wen-xiang1, WENG Yu-wei1,2, WANG Jin-zhang1, KAN Nai-peng1, ZHANG Yong-jun1,2
(1.FujianCenterforDiseaseControlandPrevention,Fuzhou350001,China;2.FujianProvincialKeyLaboratoryofZoonosisDiseaseResearch,Fuzhou350001,China)
The mosquitoAedesalbopictusis the primary vector for dengue virus transmission in Fujian Province. Despite that active dengue surveillance has been launched in several sites since 2005, the genetic diversity ofA.albopictusfrom these sites remains exclusive. In this study, mosquito pools collected from dengue surveillance sites during 2015-2016 were randomly selected, the full-length mitochondrial cytochrome C oxidase subunit I (mtDNA-COI) were amplified and sequenced. Preliminary sequence alignment of 12 amplicons with the reference sequence indicated 99% homology at nucleotide level, due to variations at 9 nucleotide sites. Three haplotypes, namely H02, H03 and H08, were determined based on phylogenetic analysis with 72 reference sequences of known haplotypes. These observations facilitate surveillance and control of arboviral diseases in Fujian.
Aedesalbopitus; mitochondrial cytochrome C oxidase subunit I; genetic diversity; phylogenetic analysis
Zhang Yong-jun,Emial:zhangyj@fjcdc.com.cn
10.3969/j.issn.1002-2694.2017.10.004
福建省科技厅引导性项目(No. 2016Y0011)和福建省医学创新课题(No. 2015-CXB-13)联合资助
张拥军,Email:zhangyj@fjcdc.com.cn
1.福建省疾病预防控制中心,福州 350001;
2.福建省人兽共患病重点实验室,福州 350001
373
A
1002-2694(2017)10-0872-05
Supported by the Department of Science and Technology, Fujian Province (No. 2016Y0011) and the Innovative Project of Medical Science of Fujian Province (No. 2015-CXB-13)
2017-01-12编辑李友松
