谷氨酸和肽聚糖在促进细菌间纳米管形成中作用的研究
2017-11-21钟桥石杭亚平刘衍伶陈艳慧胡龙华
钟桥石,杭亚平,刘衍伶,丁 慧,俞 凤,陈艳慧,胡龙华
谷氨酸和肽聚糖在促进细菌间纳米管形成中作用的研究
钟桥石1,杭亚平1,刘衍伶2,丁 慧1,俞 凤1,陈艳慧1,胡龙华1
目的对细菌间纳米管形成机制及组成成分进行探索,为预防细菌耐药提供潜在靶标。方法利用扫描电子显微镜观察细菌间纳米管的形成,用表面解吸常压化学电离质谱(SDAPCI-MS)技术和酶联免疫吸附实验(ELISA)分别检测细菌间纳米管形成前后谷氨酸(glutamic,Glu)和肽聚糖(peptidoglycan,PGN)的浓度。结果相同菌量的金黄色葡萄球菌和大肠埃希菌在纳米管形成后PGN含量明显增多,且它们在纳米管形成后消耗了更多的Glu。结论PGN是纳米管组成成分,Glu是促进细菌间纳米管形成的主要能量来源。
纳米管;谷氨酸;肽聚糖
由于抗菌药物在临床的广泛使用,临床常见细菌在抗菌药物的选择压力下产生耐药性,过往对细菌耐药机制关注最多的是水解酶[1-2]的产生、药物作用靶位点及细菌药物外排泵的改变[3]等;尤其是细菌还可以通过获得耐药基因的方式,形成多重耐药甚至泛耐药菌,极大的增加了临床用药选择压力。然而,最新研究发现细菌间可以形成纳米管(Nanotubes)来传递耐药基因[4]。而纳米管的物质组成成分及形成机制尚不完全清楚。本文将对细菌间纳米管形成机制及组成成分进行探索,旨在为预防细菌耐药提供潜在靶标。
1 材料与方法
1.1菌株 金黄色葡萄球菌ATCC25923和大肠埃希菌ATTCC25922。
1.2主要试剂与仪器 VITEK 2-Compact全自动细菌分析仪(法国)及配套鉴定卡,Bio-merieux公司产品;扫描电子显微镜(SEM Quanta200),美国FEI公司生产;LTQ-XL线性离子阱质谱仪,美国菲尼根公司产品;表面解吸常压化学电离源(SDAPCI),为陈焕文教授[5]自主研发;哥伦比亚血琼脂培养基,法国生物梅里埃公司产品。
1.3细菌培养及鉴定 将菌株转种至血琼脂平板分离细菌,依据血琼脂平板上的生长情况,获得纯培养后,经革兰染色、凝固酶、触酶、氧化酶试验等初筛,再用GPI或GNI卡在VITEK 2-Compact分析仪上进行菌株鉴定,严格按仪器操作规程进行操作。
1.4电镜观察扫描电子显微镜样品制备 将含有OD600=0.05的菌液的金黄色葡萄球菌和大肠埃希菌分别在25 mL LB固体、LB液体培养基上37 ℃孵育3 h后,把碳支持膜贴到菌膜或菌液中,在37 ℃继续孵育3 h;取出碳支持膜用0.1M PBS清洗后,用2%戊二醛固定2 h。用25%、50%、75%和95%浓度的酒精各脱水10 min,最后用无水乙醇脱水20 min;待测标本镀金处理后在扫描电子显微镜观察。
1.5离子浓度测定 SDAPCI-MS检测细菌间纳米管形成前后谷氨酸的相对离子浓度
1.5.1检测条件 用正、负离子2种检测模式,将SDAPCI离子源耦合到LTQ线性离子阱质谱仪中,检测扫描m/z 20-200,LTQ-Tune功能自动优化离子透镜、检测系统及其他参数。以空白平板为对照。
1.5.2检测方法 将经培养后培养基置于密闭管中,空白对照血琼脂平板随机取样。充入氮气的空气样品作为反应气体用SDAPCI-MS检测,手动方式进样,待气流平稳、峰值稳定,每个样品持续进样30~60 s。按照培养时间由短到长的顺序,空白对照与样品交替分析,每个独立样品分别测定3次。
1.6酶联免疫吸附实验(ELISA)检测细菌间纳米管形成前后肽聚糖的浓度
1.6.1菌株筛选 金黄色葡萄球菌ATCC25923和大肠埃希菌ATTCC25922作为研究菌株,选择的标准分别为体外纳米管形成阳性和阴性菌;分别将含有OD600=0.05的菌液金黄色葡萄球菌在25 mL LB固体、液体培养基上37 ℃孵育3 h后,把碳支持膜贴到菌膜中,在37 ℃继续孵育3 h,电镜确认金黄色葡萄球菌间和大肠埃希菌间纳米管形成情况。
1.6.2检测方法 分别将含有OD600=0.05的菌液的纳米管形成前后的金黄色葡萄球菌和大肠埃希菌用PBS(PH7.2~7.4)稀释细胞悬液,通过裂解液试剂,以使细菌破坏并放出细菌内成份。离心20 min(2000~3000 r/min)。收集上清。保存过程中如有沉淀形成,应再次离心;依据肽聚糖ELISA法分析使用说明书检测纳米管形成前后金黄色葡萄球菌和大肠埃希菌肽聚糖的含量。
2 结 果
2.1扫描电子显微镜结果 经扫描电子显微镜分别观察到金黄色葡萄球菌间和大肠埃希菌间形成的纳米管(见图1)。

注:a:大肠埃希菌菌株间形成的纳米管 b:金黄色葡萄球菌菌株间形成的纳米管 c:携带有pLS20质粒的枯草芽孢杆菌(GD127)间的菌毛接合(×70 000 Gyanendra P et al.2011)。Note:a, formation of nanotubes in E.coli;b, formation of nanotubes in staphylococcus aureus;c, pilus conjunction in carry pLS20 plasmid of bacillus subtilis (GD127)图1 扫描电镜下各菌株间形成的纳米管Fig.1 Nanotubes formed in various spaces by scanning electron microscopy
2.2质谱检测 经SDAPCI-MS检测得到其20-200范围内离子流谱图,通过进样时间筛选出需要的进样峰(64,空气中几乎检测不到)。发现148(谷氨酸)高强度地出现在无纳米管形成的菌株中,纳米管形成后强度明显下降,与金黄色葡萄球菌相比较,大肠埃希菌在纳米管形成过程中消耗了更多的谷氨酸(见图2)。金黄色葡萄球菌和大肠埃希菌在纳米管形成后,谷氨酸的相对离子强度明显低于无纳米管形成时的相对离子强度(见图3)。

注:纵轴为相对离子强度,横轴为进样时间;黑线为离子流谱图;红线为进样峰,绿色为148信号峰(为Glu)Y-axis is relative abundance, X-axis for sample injection time.Black line is spectra of ion flow;The red line is sample injection peak, green for 148 signal peak (Glu)图2 sau和eco菌纳米管形成前后Glu质谱图Fig.2 The amass spectrum of glutamate in E. coli and Staphylococcus aureus in the formation of nanotubes before and after

注:sau为金黄色葡萄球菌纳米管形成前后,上层气体中Glu平均离子强度;eco为大肠埃希菌纳米管形成前后,上层气体中Glu平均离子强度sau is average ion strength of glutamate of upper gas in staphylococcus aureus in the formation of nanotubes before and after; eco is average ion strength of glutamate of upper gas in E. coli in the formation of nanotubes before and after图3 sau和eco菌纳米管形成前后Glu平均离子强度Fig.3 The average ion strength of glutamate in E. coli and Staphylococcus aureus in the formation of nanotubes before and after
2.3ELISA检测结果 经ELISA检测待测菌株在纳米管形成前后肽聚糖含量,我们发现相同菌量的金黄色葡萄球菌和大肠埃希菌在纳米管形成后PGN含量明显增多(见图4)。
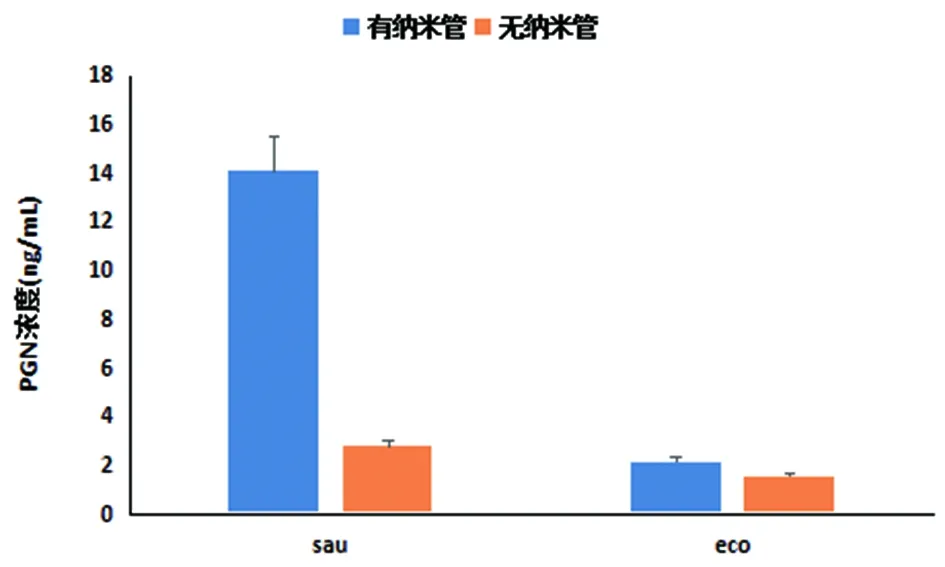
注:sau为金黄色葡萄球菌纳米管形成前后PGN的平均浓度;eco为大肠埃希菌纳米管形成前后PGN的平均浓度sau is average concentration of polysaccharides in staphylococcus aureus in the formation of nanotubes before and after;eco is average concentration of polysaccharides in E.coli in the formation of nanotubes before and after the formation图4 sau与eco菌纳米管形成前后PGN平均浓度Fig.4 The average concentration of polysaccharides in E.coli and Staphylococcus aureus in the formation of nanotubes before and after the formation
3 讨 论
随着广谱抗菌药物在临床的广泛使用,细菌的耐药性呈逐年上升趋势,临床分离的多重耐药或泛耐药的细菌也越来越多,对此类细菌的治疗给临床带来极大的困难。近年来,通过抑制耐药基因的传递来控制耐药菌的产生受到越来越多的关注。
2010年Gyanendra P等研究发现[4],枯草芽孢杆菌和大肠埃希菌在固体培养基上能形成类似管道的结构(纳米管),且进一步证实不同菌属之间也能形成纳米管,而在液体培养基中不能形成,细菌间这种全新的通信方式——相邻细菌间的纳米管形成受到关注。在电镜中,纳米管的结构与细胞膜类似,长可达1 μm,径宽30~130 nm。该研究证实,纳米管能有效、快速地在细菌间进行胞质小分子、耐药基因及质粒的传递,尤其是在进行质粒传递时,其效率远高于质粒接合,且其转移的速度与纳米管内径宽度大小成正相关。由于纳米管能够快速的传递耐药基因,因此针对开发抑制纳米管形成来预防耐药菌的快速增加的研究具有重要意义。
研究显示纳米管内部有多层结构,而具体组成成分及其形成机制尚不完全清楚,但有研究表明,Glu能通过调节生物膜内部与外围细菌能量供给的方式,使生物膜的形成产生类似集体振荡(collective oscillations,生物膜增长间歇性停止)的方式,从而提高生物膜抵御来自外部化学侵蚀的能力[6]。细菌生物膜除了含有水和细菌外,还含有蛋白质、多糖、PGN等物质[7]。PGN是细菌等原核生物细胞壁的特有成分,其对提高细胞壁的机械强度和维持细胞形状起着重要作用[8]。Glu和PGN在生物膜形成中具有重要作用,而纳米管形成的条件与细菌生物膜形成的条件又有众多相似之处,PGN和Glu在纳米管的形成中是否也具有重要作用,国内外还尚无研究报道。我们研究发现相同菌量的金黄色葡萄球菌和大肠埃希菌在纳米管形成后PGN含量明显增多(见图4),提示PGN是纳米管组成成分;通过SDAPCI-MS检测还发现它们在纳米管形成后将消耗更多的Glu(见图2-3);研究证实,通过纳米管进行物质交换并不消耗能量,由此表明Glu是促进细菌间纳米管形成的主要能量来源,Glu和PGN在纳米管形成中是否相互关联有待进一步研究。
随着细菌耐药性的不断上升,越来越多的研究关注细菌间耐药基因的传递机制,从而控制耐药菌的产生。我们研究首次发现Glu和PGN在促进细菌间纳米管的形成中具有重要作用,为有效干预细菌获得耐药基因提供新的思路,为通过抑制纳米管形成防止耐药基因在菌株间传递提供潜在靶标。
[1] Koch G, Yepes A, Forstner KU, et al. Evolution of resistance to a last-resort antibiotic in Staphylococcus aureus via bacterial competition[J]. Cell, 2014,158(5): 1060-1071. DOI: 10.1016/j.cell.2014.06.046.
[2] Nijhuis RH, Oueslati S, Zhou K, et al. OXY-2-15, a novel variant showing increased ceftazidime hydrolytic activity[J]. J Antimicrob Chemother , 2015,70(5): 1429-1433. DOI: 10.1093/jac/dkv002.
[3] Kim CH, Kang HY, Kim BR, et al. ,Mutational inactivation of OprD in carbapenem-resistantPseudomonasaeruginosaisolates from Korean hospitals[J]. J Microbiol ,2016,54(1): 44-49. DOI: 110.1007/s12275-016-5562-5. Epub 2016 Jan 5.
[4] Dubey GP, Ben-Yehuda S. Intercellular nanotubes mediate bacterial communication[J]. Cell, 2011, 144(4): 590-600. DOI: 10.1016/j.cell.2011.01.015
[5] Chen H, Luo M, Xiao S, et al. Extractive electrospray ionization mass spectrometry for uranium chemistry studies [J]. Mass Spectrom (Tokyo),2013, 2(9): S0021.DOI:10.5702/massspectrometry.S0021.
[6] Liu J, Prindle A, Humphries J, et al. Metabolic co-dependence gives rise to collective oscillations within biofilms [J]. Nature, 2015, 523(7562): 550-554. DOI: 10.1038/nature14660.
[7] Denoel T, Zervosen A, Lemaire C, et al. Enantioselective synthesis of alpha-benzylated lanthionines and related tripeptides for biological incorporation intoE.colipeptidoglycan [J]. Org Biomol Chem, 2014, 12(48): 9853-9863. DOI: 10.1039/c4ob01476f.
[8] McGlynn SE, Chadwick GL, Kempes CP, et al. Single cell activity reveals direct electron transfer in methanotrophic consortia [J]. Nature, 2015, 526(7574): 531-535. DOI: 10.1038/nature15512.
Theroleofglutamateandpeptidoglycaninnanotubesformationbetweenadjacentbacteria
ZHONG Qiao-shi1,HANG Ya-ping1,LIU Yan-lin2,DING Hui1,YU Feng1,CHEN Yan-hui1,HU Long-hua1
(1.DepartmentofLaboratoryMedicine,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang330006,China;2.DepartmentofLaboratoryMedicine,theFirstAffiliatedHospitalofNanchangUniversity,Nanchang330006,China)
We investigated the formation mechanism and immediate constituents of nanotubes between adjacent bacteria,preventing rapid increase of drug-resistant bacteria provide potential targets.We used scanning electron microscopy(SEM) to observe formation of nanotubes;glutamic was determined by surface desorption atmospheric pressure chemical ionization mass spectrometry(SDAPCI-MS)and peptidoglycan was determined by enzyme linked immunosorbent assay(ELISA) in the formation of nanotubes before and after.The results showed thatStaphylococcusaureusandEscherichiacoliconsumed more glutamic after formation of nanotubes;at the same time, the concentration of peptidoglycan in nanotubes formation ofS.aureusandE.coliincreased significantly.This study illuminated the glutamic and peptidoglycanin role mechanism of nanotubes form.We found that peptidoglycan is constituents of nanotubes and glutamic is the main energy source for the formation of nanotubes.
nanotubes;glutamic; peptidoglycan
Hu Long-hua,Email:longhuahu@163.com
10.3969/j.issn.1002-2694.2017.10.008
江西省青年自然基金资助项目(No.20171BAB2150798)和江西省自然基金资助项目(No.20133BAB205062)联合资助
胡龙华,Email:longhuahu@163.com
1.南昌大学第二附属医院检验科,南昌 330006;
2.南昌大学第一附属医院检验科,南昌 330006
378
A
1002-2694(2017)10-0893-04
Funded by the Youth Natural Science Foundation of Jiangxi and the Natural Science Foundation of Jiangxi(No.20133BAB205062)
2017-06-11编辑李友松
