雌激素对大鼠内脏痛觉感受及结肠5-羟色胺合成的影响*
2017-11-21臧凯宏秦红岩朱丽娟
臧凯宏 秦红岩 马 骏 任 远 朱丽娟△
(1甘肃中医药大学药学院,兰州730000;2甘肃省中药药理与毒理学重点实验室,兰州730000;3 兰州大学第一医院药剂科,兰州730000)
•论 著•
雌激素对大鼠内脏痛觉感受及结肠5-羟色胺合成的影响*
臧凯宏1,2秦红岩3马 骏1,2任 远1,2朱丽娟1,2△
(1甘肃中医药大学药学院,兰州730000;2甘肃省中药药理与毒理学重点实验室,兰州730000;3兰州大学第一医院药剂科,兰州730000)
目的:研究雌激素对大鼠内脏痛觉感受及结肠5-羟色胺 (5-hydroxytryptamine, 5-HT) 合成的影响。方法Wistar雌性大鼠采用随机数字表分组,分为假手术组,卵巢切除组及卵巢切除+雌激素组。卵巢切除+雌激素组动物皮下注射苯甲酸雌二醇(30 µg·kg-1),连续给药2周。给药结束后次日测定大鼠内脏痛阈值、血清雌激素和孕激素水平;收集结肠组织测定5-HT含量、嗜铬细胞数量及色氨酸羟化酶的表达。结果雌激素替代给药后显著提高卵巢切除大鼠血清雌激素水平、降低内脏痛阈值、明显提高结肠嗜铬细胞数量、5-HT含量及色氨酸羟化酶的表达。结论雌激素对结肠5-HT合成具有正性调控作用,该机制可能参与雌激素介导的内脏痛觉感受增强。
雌激素;内脏痛;5-羟色胺;卵巢切除;嗜铬细胞
临床研究表明,痛觉存在显著的性别差异,即女性的痛阈值明显低于男性[1]。流行病学资料显示,女性比男性更易患肠易激综合征和间质性膀胱炎等疾病,其发生可能与雌激素对内脏痛觉转导的正向调制作用有关[2]。雌激素通过激活雌激素受体参与痛觉调节,雌激素受体广泛分布于肠神经丛及肠上皮细胞,其激活可精密调控肠道感觉和分泌功能[3]。
5-羟色胺 (5-hydroxytryptamine, 5-HT) 是参与调控胃肠功能的重要神经递质,肠黏膜中嗜铬细胞是其主要来源,色氨酸羟化酶 (tryptophan hydroxylase,TPH) 是其合成限速酶[4]。研究显示,5-HT增多在内脏痛觉形成中起关键作用,5-HT增多既可以通过激活传入神经上的5-HT受体介导痛觉反应,又可以通过敏化外周痛觉感受器诱发痛觉超敏[5]。雌激素和5-HT均为内脏痛觉的重要调控分子,二者之间是否存在相互作用?其相互作用是否对内脏痛觉存在影响?目前尚缺少相关研究证据。研究雌激素与5-HT在内脏痛觉调制中的相互作用可深入了解内脏痛觉超敏的分子机制,对阐明肠易激综合征和间质性膀胱炎的发病机制具有重要意义。本研究拟应用卵巢切除 (ovariectomy, OVX) 大鼠模型,考察OVX及雌激素替代对内脏痛觉感受及肠道5-HT生成的影响。
方 法
1. 材料
(1)药品与试剂
大鼠雌激素检测ELISA试剂盒及大鼠5-HT检测ELISA试剂盒购自北京百奥莱博科技有限公司(ARB12673,ARB11940);大鼠孕激素测定ELISA试剂盒购自上海酶联生物科技有限公司(ML-E-00899)。Anti-TPH抗 体 购 自Santa Cruz公司 (sc30079);anit-serotonin抗体购自Sigma公司(S5545)。即用型SABC (兔IgG) 免疫组化试剂盒购于武汉博士德生物工程有限公司 (SA1022);ECL发光试剂购于赛默飞世尔科技公司(32209);苯甲酸雌二醇注射液(兽药,规格2 mg/ml,批号:20151201)购于四川金科药业有限公司。
(2)仪器
电热恒温培养箱(重庆永恒实验仪器厂);3K15型低温离心机(Sigma公司);酶标仪(Bio-Rad公司);XB51-32H01型病理图像分析系统(奥林巴斯);DY89-1型电动匀浆机(宁波新芝生物科技有限公司);1658001型蛋白印迹电泳仪(Bio-Rad);LT-224S 型电子天平(北京赛多利斯)。
(3)动物
成年雌性Wistar大鼠,SPF级,体重200~240 g,购于甘肃中医大学实验动物中心,合格证号:SCXK(甘)2001-0001-0001335。
2. 实验方法
(1)卵巢切除大鼠模型
雌性大鼠随机分为OVX手术组和假手术组。大鼠用7﹪水合氯醛(350 mg·kg-1, ip.)麻醉,于肋弓下侧腹部做一约1 cm的切口,进入腹腔。沿子宫找到卵巢并用4号线结扎卵巢系膜血管,切除双侧卵巢,子宫复位后细线缝合切口,关腹。假手术组动物打开腹腔后摘取卵巢旁少许脂肪组织后关腹。
(2) 动物分组、给药及样品收集
动物共分为3组:假手术组(Sham),OVX组及OVX+雌激素替代给药组(OVX+E)。雌激素替代给药方法:于卵巢切除后次日,动物给予苯甲酸雌二醇注射液(30 µg·kg-1, s.c.)[6],Sham组及OVX组动物皮下注射灭菌纯芝麻油作为对照。动物连续给药2周,于末次给药后次日进行腹壁收缩实验测定内脏痛阈值;然后水合氯醛麻醉,腹主动脉取血并分离血清进行雌孕激素测定;同时收集近端结肠组织,一部分多聚甲醛固定并制备石蜡切片,另一部分组织测定肠道5-HT含量及TPH蛋白表达。
(3)腹壁收缩实验
具体实验方法如文献所示[7]:动物禁食,乙醚麻醉,将润滑的球囊导管(6 cm)插入动物肛门并固定于动物尾部。动物放于透明笼内适应30 min,用血压计以5 mmHg递增的方式向球囊加压并观察动物变化,直至动物出现明显的腹壁肌肉收缩伴腹壁抬高。记录引起动物腹壁收缩反射所对应的压力值。每只大鼠共测定5次,每次间隔5 min,取其平均值作为该动物的内脏痛阈值。
(4)免疫组织化学实验
石蜡组织切片脱蜡至水,放于pH = 6.0的柠檬酸钠缓冲溶液中采用微波法进行抗原修复。切片阻断内源性过氧化物酶,再用5%牛血清室温封闭30 min。切片加入一抗(1:4 000稀释)4℃孵育过夜,按照免疫组化试剂盒说明书进行操作,DAB显色,苏木素复染,脱水、透明、树胶封片。嗜铬细胞阳性染色为棕黄色,显微镜下拍片并进行统计:200×镜下每张切片随机选取5个视野,用Image J软件计数每个视野中阳性染色的细胞数量并计算黏膜面积,用每平方米黏膜面积中的阳性染色细胞数作指标进行定量分析[8]。
(5)免疫印迹实验
应用免疫印迹实验测定肠道组织中TPH的蛋白表达,具体方法如下:取近端结肠组织提取并制备组织蛋白样品,12%SDS-PAGE凝胶电泳并转到PVDF膜上,5%脱脂牛奶室温封闭1 h。将PVDF膜与一抗(1:1 000稀释)4℃摇床孵育过夜。洗去一抗,加入对应的二抗,室温孵育1 h。加入ECL发光试剂,暗室压片,曝光。扫描显影条带,应用Image J软件计算灰度值,定量分析蛋白表达量。
(6)ELISA测定
肠组织加入含有EDTA的Tris盐酸裂解液(含0.5% Triton X-100及蛋白酶抑制剂)进行组织匀浆。匀浆液经10 000 G低温离心10 min,分离上清,应用大鼠5-HT检测ELISA试剂盒进行5-HT含量测定。血清雌激素及孕激素测定根据ELISA试剂盒所提供的操作说明进行实验。每个样品设定2个复孔,结果取平均值进行统计分析。
3.统计分析
结 果
1.卵巢切除及雌激素替代对大鼠血清雌激素和孕激素水平的影响
与假手术组大鼠相比,卵巢切除手术组大鼠血清雌激素及孕激素水平明显降低(P< 0.05),说明卵巢切除动物模型制备成功。与卵巢切除组大鼠相比,雌激素替代给药显著提高卵巢切除大鼠血清雌激素水平(P< 0.05,见表1),且该血清雌激素水平接近假手术组大鼠血清雌激素水平,说明雌激素替代治疗比较成功。此外,表1结果显示,雌激素替代对血清孕激素水平无明显影响(P> 0.05,见表1)。
2.卵巢切除及雌激素替代对大鼠内脏痛阈值的影响
与假手术组大鼠相比,卵巢切除手术组大鼠的内脏痛阈值明显升高(P< 0.05),提示卵巢切除可降低大鼠内脏痛觉阈值。与卵巢切除组大鼠相比,雌激素替代可以明显减低卵巢切除大鼠的内脏痛阈值(P< 0.05,见表2),说明雌激素可以提升内脏痛觉感受器的敏感性。
3. 卵巢切除及雌激素替代对大鼠肠道嗜铬细胞数量及5-HT含量的影响
肠道嗜铬细胞免疫组化染色结果见图1,同假手术组大鼠相比,卵巢切除组大鼠肠道嗜铬细胞数量明显减少,而雌激素替代可逆转卵巢切除大鼠肠道嗜铬细胞数量的减少。如表3所示,卵巢切除组大鼠肠道嗜铬细胞数量及5-HT含量均明显低于假手术组大鼠(P< 0.05),提示卵巢切除可降低肠道嗜铬细胞数量及5-HT含量。与卵巢切除组大鼠相比,雌激素替代给药显著提高卵巢切除大鼠结肠组织中嗜铬细胞的数量及肠组织中5-HT的含量(P< 0.05),提示补充雌激素可增加大鼠肠道嗜铬细胞数目及5-HT含量。
表1 卵巢切除及雌激素替代对大鼠血清雌激素和孕激素水平的影响(±SD,n=7)Table 1 Effects of ovariectomy (OVX) and estrogen supplementation on serum estrogen and progestogen level in rats(±SD,n=7)

表1 卵巢切除及雌激素替代对大鼠血清雌激素和孕激素水平的影响(±SD,n=7)Table 1 Effects of ovariectomy (OVX) and estrogen supplementation on serum estrogen and progestogen level in rats(±SD,n=7)
*P < 0.05, 与假手术组比较,compared with sham group, #P < 0.05, 与OVX组比较,compared with OVX group.
孕激素Progestogen (ng·ml-1)Sham18.94±4.8732.63±6.48 OVX 5.01±1.96 * 7.38±1.71*OVX+E 17.83±1.91 # 7.13±1.23组别Groups雌激素Estrogen (pg·ml-1)
表2 卵巢切除及雌激素替代对大鼠内脏痛阈值的影响(±SD,n=7)Table 2 Effects of ovariectomy (OVX) and estrogen supplementation on visceral pain threshold pressure in rats(±SD,n=7)
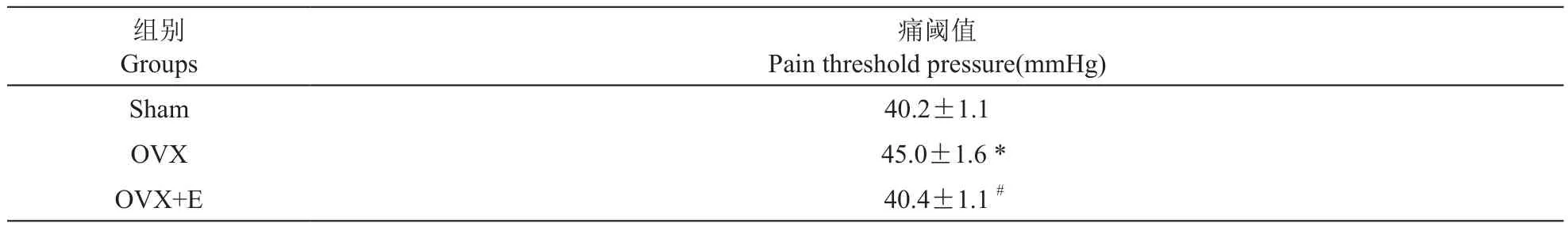
表2 卵巢切除及雌激素替代对大鼠内脏痛阈值的影响(±SD,n=7)Table 2 Effects of ovariectomy (OVX) and estrogen supplementation on visceral pain threshold pressure in rats(±SD,n=7)
*P < 0.05, 与假手术组比较, compared with sham group, #P < 0.05, 与OVX组比较,compared with OVX group.
痛阈值Pain threshold pressure(mmHg)Sham40.2±1.1 OVX 45.0±1.6 *OVX+E 40.4±1.1 #组别Groups
4. 卵巢切除及雌激素替代对大鼠结肠TPH表达的影响
与假手术组动物相比,卵巢切除手术组大鼠结肠组织中TPH的表达明显降低(P< 0.05),该结果与结肠中嗜铬细胞数量减少及5-HT含量降低一致。与卵巢切除组大鼠相比,雌激素替代给药显著提高结肠组织中TPH的表达(P< 0.05,见图2、表4),提示雌激素可上调大鼠肠道TPH的表达。
讨 论
我们的研究结果显示,OVX大鼠内脏痛阈值明显提高,而雌激素替代可使OVX大鼠内脏痛阈值恢复并接近正常水平,说明雌激素对内脏痛觉感受具有增敏作用。该结果与文献报道一致,研究发现,雌激素可使慢性神经病理性疼痛大鼠对热刺激变得更加敏感[9];雌激素通过上调大鼠背根神经节中痛觉感受调制受体P2Y1的表达提高痛觉感受[10];雌激素可提高初级感觉神经元对疼痛介质P物质的感受性并参与痛觉敏感的发生[11]。目前认为,女性高发肠易激综合征内脏痛敏与雌激素对内脏痛觉感受的增敏作用密切相关[2]。
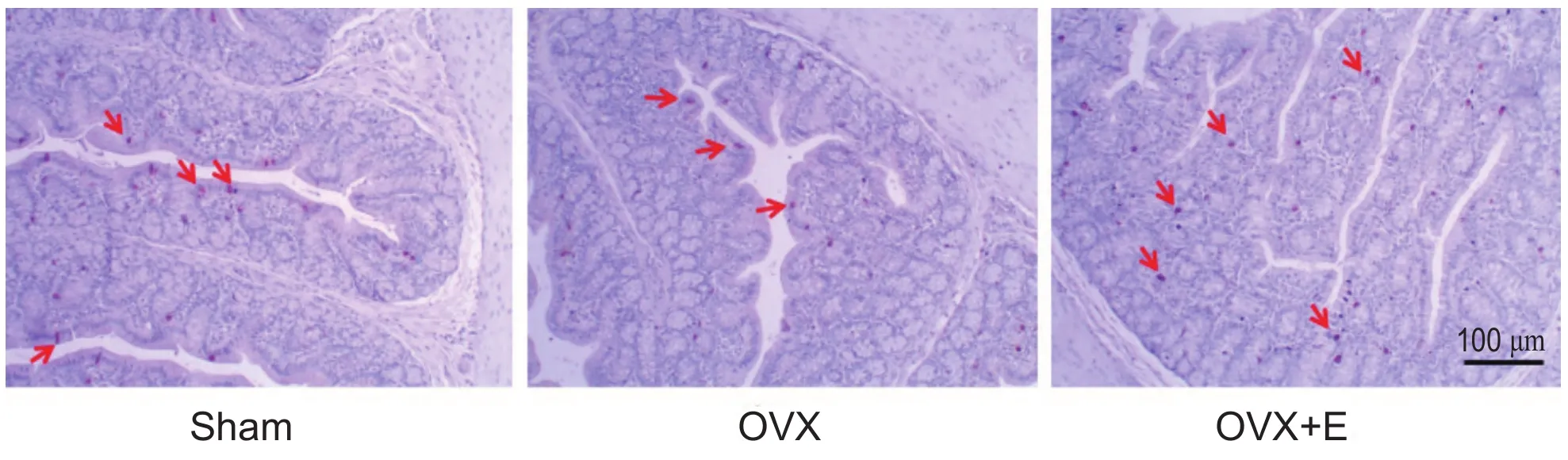
图1 免疫组化结果显示卵巢切除及雌激素替代对大鼠结肠嗜铬细胞数量的影响(箭头所示为嗜铬细胞,DAB,标尺= 100 μm)Fig. 1 Immunohistochemistry shows the effects of ovariectomy (OVX) and estrogen supplementation on colonic enterochromaf fi n cell number in rats (arrowheads indicate enterochromaf fi n cells, DAB, Scale bar = 100 μm).
表3 卵巢切除及雌激素替代对大鼠肠道嗜铬细胞数量及5-HT含量的影响(±SD,n=7)Table 3 Effects of ovariectomy (OVX) and estrogen supplementation on colonic EC cell density and 5-HT content in rats(±SD,n=7)

表3 卵巢切除及雌激素替代对大鼠肠道嗜铬细胞数量及5-HT含量的影响(±SD,n=7)Table 3 Effects of ovariectomy (OVX) and estrogen supplementation on colonic EC cell density and 5-HT content in rats(±SD,n=7)
*P < 0.05, 与假手术组比较, compared with sham group, #P < 0.05, 与OVX组比较,compared with OVX group.
5-HT含量5-HT content(ng·mg-1)Sham89.21±10.3811.87±2.47 OVX 69.99±14.75 * 7.18±2.44 *OVX+E84.18±6.50 # 9.98±1.83 #组别Groups嗜铬细胞数量EC cell density(mm2)
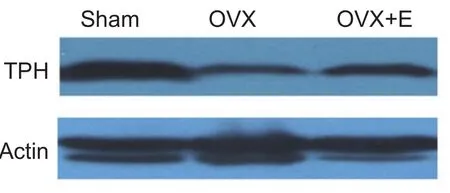
图2 卵巢切除及雌激素替代对大鼠结肠色氨酸羟化酶(TPH)蛋白表达的影响Fig.2 Effects of ovariectomy (OVX) and estrogen supplementation on protein expression of tryptophan hydroxylase (TPH) in the colon tissue of rats.
表4 卵巢切除及雌激素替代对大鼠肠道色氨酸羟化酶(TPH)蛋白表达的影响(±SD,n=7)Table 4 Effect of ovariectomy (OVX) and estrogen supplementation on protein expression of tryptophan hydroxylase (TPH) in the colon tissue of rats(±SD,n=7)

表4 卵巢切除及雌激素替代对大鼠肠道色氨酸羟化酶(TPH)蛋白表达的影响(±SD,n=7)Table 4 Effect of ovariectomy (OVX) and estrogen supplementation on protein expression of tryptophan hydroxylase (TPH) in the colon tissue of rats(±SD,n=7)
*P < 0.05, 与假手术组比较, compared with sham group, #P < 0.05,与OVX组比较,compared with OVX group(n=7).
色氨酸羟化酶表达(光密度比值)TPH expression (ratio of optical density)Sham1.19±0.14 OVX 0.42±0.03 *OVX+E 0.64±0.04 #组别Groups
5-HT是调节肠道功能的重要神经递质,可通过与肠神经元上的多种5-HT受体结合,调节胃肠道的感觉、运动和分泌功能。大量研究表明,肠道嗜铬细胞数量的增加及5-HT含量增多是内脏痛觉超敏发生的主要原因[12],TPH抑制剂LX1031可减少肠道5-HT合成,临床研究证实TPH抑制剂可明显缓解肠易激综合症患者的内脏痛敏[13],说明肠道5-HT在内脏痛觉超敏中发挥重要作用。
现代研究发现,雌激素受体和5-HT受体共同表达于肠道神经丛,雌激素水平升高可上调5-HT受体的表达[14],说明雌激素对5-HT信号系统具有增强作用。我们的研究显示,OVX可下调肠道TPH的蛋白表达,而雌激素替代治疗可上调TPH表达并使其接近正常水平,该结果与肠道嗜铬细胞数量及5-HT含量变化比较一致。雌激素通过何种途径调节TPH表达,该调节是转录前调控还是转录后修饰是我们后期研究中需要重点关注的问题,值得深入研究。
总之,雌激素可上调肠道5-HT合成酶表达,促进5-HT合成并提高5-HT含量,从而提高内脏痛觉敏感性。本研究可为雌激素与5-HT相互作用研究提供依据,了解雌激素与5-HT在内脏痛觉调制中的相互作用有望为肠易激综合征内脏痛觉超敏的分子机制研究提供线索。
[1] Dodds KN, Beckett EA, Evans SF,et al. Glial contributions to visceral pain: implications for disease etiology and the female predominance of persistent pain. Transl Psychiatry, 2016, 6(9):1~13.
[2] Mulak A, Taché Y. Sex difference in irritable bowel syndrome: do gonadal hormones play a role? Gastroenterol Pol, 2010, 17(2):89~97.
[3] Meleine M, Matricon J. Gender-related differences in irritable bowel syndrome: potential mechanisms of sex hormones.World J Gastroenterol, 2014, 20(22):6725~6743.
[4] Deiteren A, de Wit A, van der Linden L,et al. Irritable bowel syndrome and visceral hypersensitivity: risk factors and pathophysiological mechanisms. Acta Gastroenterol Belg, 2016, 79(1):29~38.
[5] Farzaei MH, Bahramsoltani R, Abdollahi M,et al.The Role of Visceral Hypersensitivity in Irritable Bowel Syndrome: Pharmacological Targets and Novel Treatments. J Neurogastroenterol Motil, 2016,22(4):558~574.
[6] Fukuda K, Yao H, Ibayashi S,et al. Ovariectomy exacerbates and estrogen replacement attenuates photothrombotic focal ischemic brain injury in rats.Stroke, 2000, 31(1):155~160.
[7] Al-Chaer ED, Kawasaki M, Pasricha PJ. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development.Gastroenterology, 2000, 119(5):1276~1285.
[8] Qin HY, Luo JL, Qi SD,et al. Visceral hypersensitivity induced by activation of transient receptor potential vanilloid type 1 is mediated through the serotonin pathway in rat colon. Eur J Pharmacol, 2010, 647(1-3):75~83.
[9] 赵欣,刘健,徐建国. 雌激素对慢性神经病理性疼痛大鼠热痛觉过敏的影响. 中华麻醉学杂志, 2004,24(4):279~281.
[10] 杜狄,王立鹏,马蓓. 去卵巢大鼠雌激素替代后背根神经节P2Y1受体表达增加. 第二军医大学学报,2011, 32(3):254~257.
[11] Ouyang A, Wrzos HF. Contribution of gender to pathophpiology and clinical presentation of IBS:should management be different in women? Am J Gastroenterol, 2006, 101(12):602~609.
[12] Farzaei MH, Bahramsoltani R, Abdollahi M,et al.The Role of Visceral Hypersensitivity in Irritable Bowel Syndrome: Pharmacological Targets and Novel Treatments. J Neurogastroenterol Motil, 2016, 22(4):558~574.
[13] Brown PM, Drossman DA, Wood AJ,et al. The tryptophan hydroxylase inhibitor LX1031 shows clinical bene fi t in patients with nonconstipating irritable bowel syndrome. Gastroenterology, 2011, 141(2):507~516.
[14] Rybaczyk LA, Bashaw MJ, Pathak DR,et al. An overlooked connection: serotonergic mediation of estrogen-related physiology and pathology. BMC Womens Health, 2005, 5:12.
EFFECTS OF ESTROGEN ON THE VISCERAL PAIN SENSITIVITY AND COLONIC 5-HT SYNTHESIS IN RATS*
ZANG Kai-Hong1,2, QIN Hong-Yan3,MA Jun1,2, REN Yuan1,2, ZHU Li-Juan1,2△
(1College of pharmacy, Gansu University of Traditional Chinese Medicine; Lanzhou, 730000, China;2Gansu Key Laboratory of Phamacology and Toxicology of Traditional Chinese Medicine; Lanzhou, 730000, China;3Department of pharmacy, First Hospital of Lanzhou University, Lanzhou 730000, China)
Objective: To investigate the effects of estrogen on visceral pain sensitivity and colonic 5-hydroxytryptamine (5-HT) synthesis in rats.MethodsFemale Wistar rats were randomly divided and
ovariectomy (OVX) or sham operation. Three groups were set for this study, they are sham group, OVX group and OVX plus estrogen supplementation group. Rats in OVX group and sham group were treated with pure sesame oil subcutaneously as controls, and rats in OVX plus estrogen group were subcutaneously treated with estradiol benzoate(30 ug·kg-1), drugs were given to rats for consecutive 2 weeks. After drugs treatment, pain threshold pressure was measured by abdominal withdrawal re fl ex test; blood was collected for determination of the serum level of estrogen and progesterone by ELISA; and proximal colon tissue was also collected for 5-HT content assay, enterochromaf fi n cells counting, and tryptophan hydroxylase (TPH) expression detection by ELISA, immunohistochemistry and Western-blot, respectively.ResultsCompared with the rats in OVX group, the pain threshold in estrogen-treated rats was marked decreased, while colonic enterochromaf fi n cells density, 5-HT content as well as TPH expression were all signi fi cantly increased.ConclusionEstrogen can positively regulate colonic 5-HT synthesis, and this effect may have correlation with estrogen-mediated increase of visceral sensitivity.
Estrogen; Visceral pain; 5-Hydroxytryptamine; Ovariectomy; Enterochromaf fi n cells
10.3969/j.issn.1006-9852.2017.09.000
国家自然科学基金资助项目(81341145;81400596)
△通讯作者 39921706@qq.com
