miR-200a对肺癌A549细胞增殖、迁移及凋亡的影响
2017-11-20刘曙光章思思邵牧民马红梅
刘曙光,章思思,邵牧民,马红梅,申 洪
miR-200a对肺癌A549细胞增殖、迁移及凋亡的影响
刘曙光1,章思思2,邵牧民3,马红梅1,申 洪2
目的探讨miR-200a在肺癌细胞中的表达及其对A549细胞增殖、迁移及凋亡等生物学功能的影响。方法采用RT-PCR检测肺癌细胞株A549、H23、H460和永生化人支气管上皮细胞株16HBE的表达水平。采用脂质体转染法将miR-200a mimics和阴性对照序列(miR-negtive control, miR-NC)分别转染A549细胞,运用CCK-8实验和平板克隆形成实验检测细胞增殖能力的改变情况;Transwell实验检测细胞迁移能力;流式细胞术检测细胞凋亡情况。利用生物信息学方法预测miR-200a的靶基因。结果miR-200a在肺癌细胞株A549、H23和H460相对表达水平均低于16HBE组,差异有统计学意义(P<0.05)。miR-200a mimics和miR-NC组分别转染A549细胞,CCK-8实验显示miR-200a mimics组在第4、5天时的OD值明显低于miR-NC组,差异有统计学意义(P<0.05);平板克隆形成实验显示miR-200a mimics组细胞克隆形成率为(33.13±0.74)%,明显少于miR-NC组(45.57±1.27)%,差异有统计学意义(P<0.05)。Transwell实验显示,miR-200a mimics穿膜细胞数为(71.60±17.90)个,少于miR-NC组[(140.20±17.88)个],差异有统计学意义(P<0.05)。流式细胞术检测显示,miR-200a mimics凋亡率为(17.80±1.90)%,明显高于miR-NC组[(11.33±1.96)%],差异有统计学意义(P<0.05)。生物信息学方法预测Tiam1等可能是miR-200a的靶基因。结论miR-200a能够抑制肺癌细胞A549的增殖、迁移并促进其凋亡,为肺癌的治疗提供潜在靶点。miR-200a可能通过靶基因Tiam1发挥其对肿瘤的调控作用。
肺肿瘤;miR-200a;A549细胞;增殖;迁移;凋亡
肺癌是最常见的恶性肿瘤,其发生率和病死率均占全球首位,其中非小细胞肺癌(non-small cell lung cancer, NSCLC)约占所有肺癌的80%。NSCLC发生、发展是一个多步骤、多因素的过程,涉及众多基因和蛋白。miRNA是一类非编码微小RNA,广泛存在于真核生物体内,在转录后水平调控基因的表达。近年研究发现,miR-200a与多种恶性肿瘤的发生、发展有关,通过其靶基因和多种信号转导途径发挥抑癌或促癌作用。目前,有关miR-200a在NSCLC中功能的研究鲜有报道。因此本实验通过分析miR-200a对肺癌A549细胞生物学行为的影响,旨在为NSCLC的发病机制和治疗策略提供新的理论依据。
1 材料与方法
1.1主要材料人NSCLC细胞株A549、H23、H460和永生化人支气管上皮细胞株16HBE均来自南方医科大学病理系重点实验室。PRIM 1640、胎牛血清FBS及胰蛋白酶(HyClone公司);逆转录试剂盒(Thermo公司);转染试剂盒(Invitrogen公司);miR-200a mimics、随机阴性对照RNA(上海吉玛生物公司);RT-PCR检测试剂盒(全式金公司);TRIzol(Takara公司);CCK-8试剂盒(Dojindo公司);Transwell小室(Corning公司)。
1.2方法
1.2.1细胞培养与转染 细胞选用PRIM 1640培养液进行培养,培养条件:置于37 ℃、CO2体积分数为5%的培养箱中培养。根据细胞生长情况每2~3天换液培养1次,当细胞覆盖瓶底壁大部分表面时,进行细胞传代或收集细胞。将生长状态稳定的A549细胞[细胞数(4~5)×105个]接种于6孔细胞培养板,培养24 h后进行细胞转染,转染过程严格按照Lipofectamine RNAiMax说明书进行。转染miR-200a mimics为实验组,转染miRNA negative control(miR-NC)作为阴性对照组,转染后6 h更换新鲜培养液进行后续实验。miR-200a mimics序列:5′-UAACACUGUCUGGUAACGAUGU-3′;3′-AUCGUU ACCAGACAGUGUUAUU-5′;miR-NC序列:5′-CAG UACUUUUGUGUAGUACAA-3′。
1.2.2RT-PCR检测不同细胞株中miR-200a表达 采用RNA 抽提试剂盒抽提各细胞株中总RNA,逆转录引物序列:5′-GTCGTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGACACATCGTT-3′。逆转录合成cDNA保存于-80 ℃冰箱中备用。定量PCR上游引物:5′-CATGACACTGTCTGGTAAC-3′;下游引物:5′-GTGCAGGGTCCGAGGT-3′。PCR扩增反应体系为20 μL,其中包括miR-PCR primers 2 μL、2×SYBR Mix 10 μL、miRNA RTproduct 2.0 μL、Rox 0.1 μL、蒸馏水5.9 μL。以U6为内参,所测定的miR-200a的相对表达量采用2-ΔΔCt表示。
1.2.3CCK-8检测A549细胞的增殖能力 具体操作参照CCK-8 试剂盒说明书进行。将转染24 h的A549细胞以每孔(1~2)×103个细胞接种于96孔培养板中,每孔体积100 μL,设空白对照(仅加培养基);分别培养1、2、3、4、5天。每孔加入10 μL CCK-8,37 ℃继续培养2 h后终止培养,以空白对照孔调零,酶标仪上450 nm 测定各孔吸光度值(OD值),以相对应OD值表示细胞增殖能力的大小。各组取3 孔平均值,绘制增殖曲线,实验重复3 次。
1.2.4平板克隆实验 将转染后的实验组和阴性对照组细胞接种在6 孔细胞培养板中,每孔接种细胞200个(每孔加培养液2 mL),将培养板置于37 ℃、CO2体积分数为5% 的培养箱中培养约2周。密切观察细胞的生长情况,2 周时出现肉眼可见的集落形成,即可终止培养。移除培养液,加入1 mL PBS洗涤细胞3次,再用4%的多聚甲醛固定10 min,然后用吉姆萨染色法染色20 min,置于空气中干燥。计数细胞克隆。
1.2.5Transwell小室迁移实验 采用24孔板,每孔加入600 μL RPMI 1640+10 %FBS培养基后放入Transwell小室。转染24 h后将miR-200a mimics组、miR-NC组细胞以0.25%胰蛋白酶常规消化,吹打成单细胞悬液,并以每孔200 μL 有1×104个细胞接种于Transwell小室上层,每组设置3个复孔,48 h后,用PBS洗涤细胞3次。4%多聚甲醛固定细胞30 min,用PBS洗涤细胞3次,苏木精染色,30 min后,流水清洗培养板。计数,拍照,本实验重复3次。
1.2.6流式细胞术检测细胞的凋亡率 转染48 h后消化收集细胞,制成单细胞悬液,经1 200 r/min 离心5 min,弃上清。预冷PBS洗涤细胞2次,用500 μL 1×Binding Buffer重悬细胞,加入5 μL FITC标记的Annexin V,加入10 μL的PI。混匀后室温避光孵育5 min,立即上流式细胞仪检测。
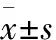
1.4hsa-miR-200a靶基因预测miR-200a潜在靶基因应用miRWalk综合数据库(http://www.umm.uni-heidelberg.de/apps/zmf/mirwalk/)进行预测,并取其中Targetscan、miRanda、RNAhybrid、miRWalk和Microt4共5种工具计算基因交集。
2 结果
2.1miR-200a在肺癌细胞株和正常支气管上皮细胞株中的表达RT-PCR检测肺癌细胞株及永生化人支气管上皮细胞株16HBE中miR-200a的表达,结果发现miR-200a在3种肺癌细胞株中的表达均明显低于16HBE(P均<0.05)。其中以A549细胞中miR-200a的表达水平最低,因此选取A549细胞株作为进一步分析对象(图1)。
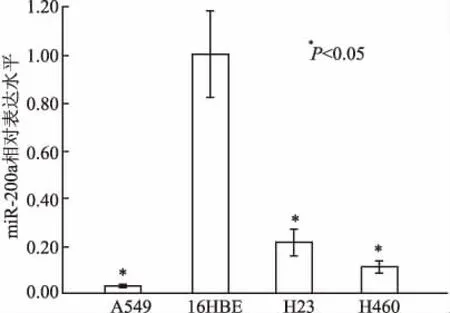
图1 miR-200a在不同细胞株中的相对表达水平
2.2miR-200a对A549细胞增殖的影响以吸光度为纵坐标、时间点为横坐标,绘制细胞生长曲线。肉眼观察并记录克隆斑数目,计算克隆形成率,克隆形成率=(克隆形成数/接种细胞数)×100%。CCK-8法检测A549细胞转染miR-200a mimics、miR-NC后1~5天的OD值,并绘制生长曲线。结果显示:与miR-NC组细胞相比,转染miR-200a mimics细胞的OD值在4、5天时均降低(图2),差异具有统计学意义(P均<0.05)。平板克隆形成实验显示miR-200a mimics转染组细胞克隆形成率为(33.13±0.74)%,明显少于miR-NC组[(45.57±1.27)%],差异具有统计学意义(P<0.05,图3)。
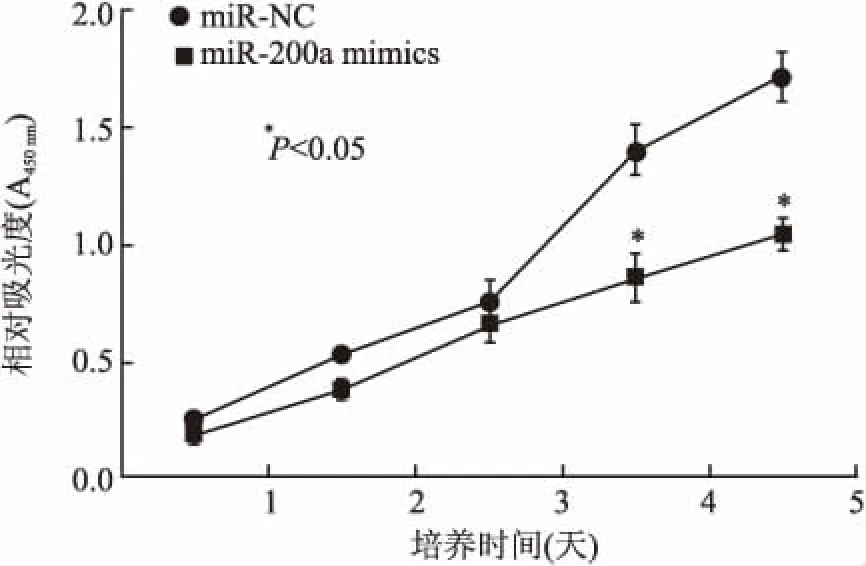
图2 转染miR-200a mimics后A549细胞生长曲线
图3 平板克隆形成实验结果
A.miR-NC组;B.miR-200a mimics组;C.克隆形成率
2.3miR-200amimics对A549细胞迁移能力的影响Transwell细胞体外迁移能力检测结果显示,转染miR-200a mimics穿膜细胞数为(71.60±17.90)个/孔,少于miR-NC组[(140.20±17.88)个/孔],差异有统计学意义(P<0.05,图4)。
2.4miR-200amimics对A549细胞凋亡率的影响流式细胞术检测转染48 h后两组细胞的凋亡率,结果显示,miR-200a mimics和miR-NC组的细胞凋亡率分别为(17.80±1.90)%和(11.33±1.96)%,miR-200a mimics组的细胞凋亡率明显高于miR-NC组,差异有统计学意义(P<0.05,图5)。
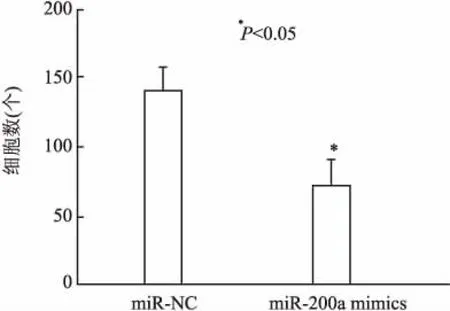
图4 Transwell迁移实验结果
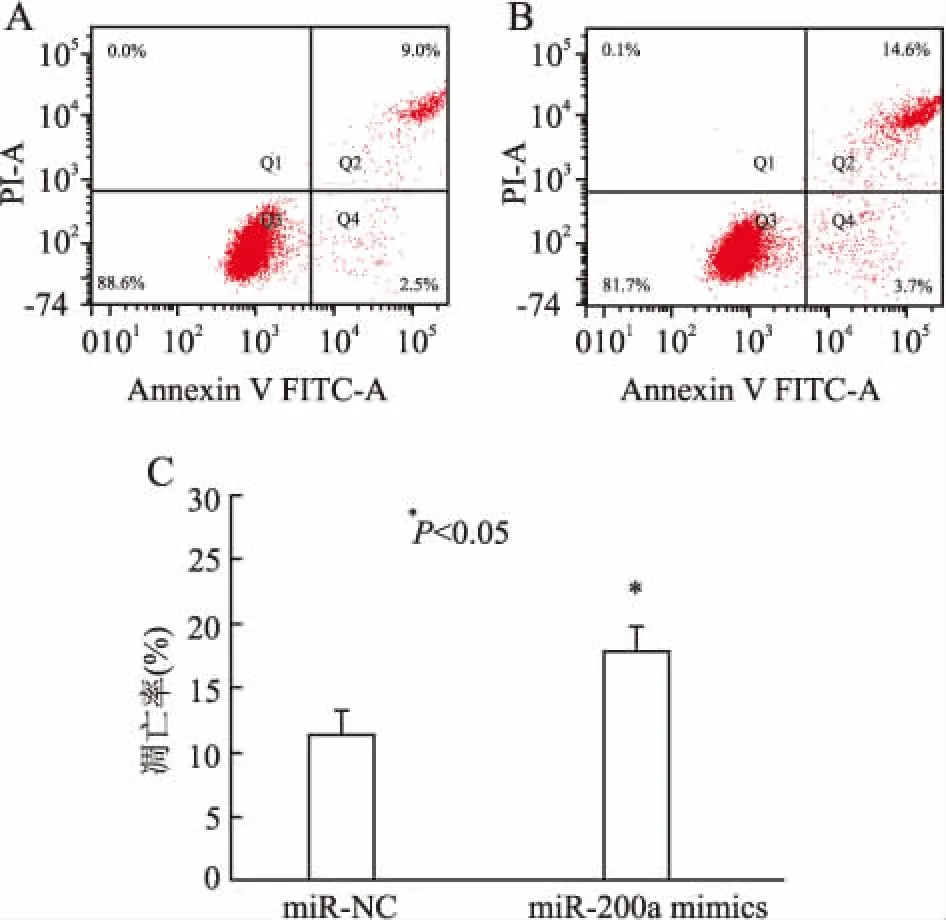
图5 流式细胞术检测检测细胞凋亡结果
A.miR-NC组;B.miR-200a mimics组;C.细胞凋亡率
2.5miR-200a靶基因的预测利用miRWalk综合数据库,并取其中Targetscan、miRanda、RNAhybrid、miRWalk和Microt4共5种数据库的计算结果取其交集,所得部分靶基因详见表1。选择其中1个潜在靶基因Tiam1利用TargetScan、DIANA-microT和miRanda常用数据库反向预测Tiaml相互作用的miRNAs,结果显示miR-200a可做为候选miRNA。TargetScan 数据库显示miR-200a与Tiaml的3’UTR区以不完全互补的方式结合。因此,我们推测Tiaml可作为miR-200a的靶基因进行下一步分析。
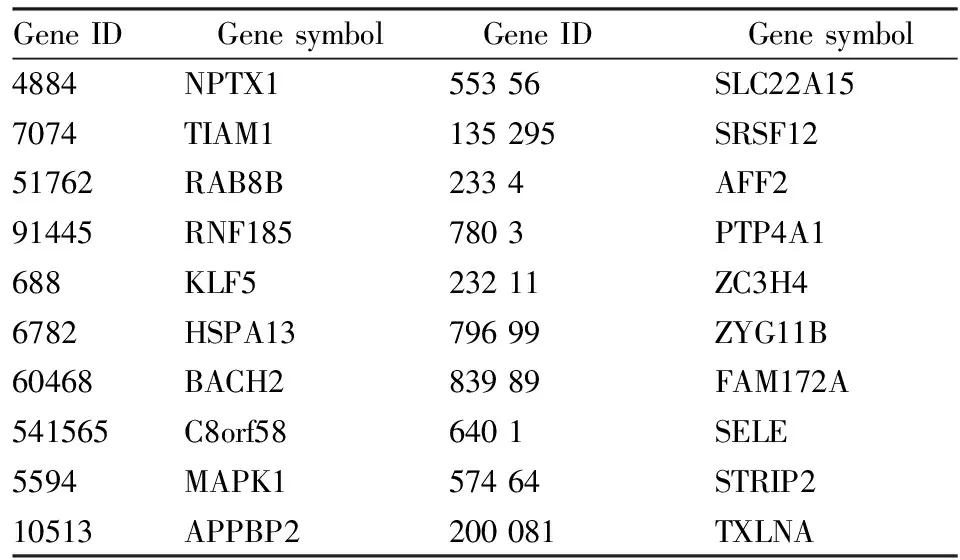
表1 利用miRWalk预测所得miR-200a的部分靶基因
3 讨论
miRNA是大小为17~25个碱基的单链非编码小分子RNA,广泛存在于真核生物体内,通过与靶mRNA3’UTR的序列特异性结合,导致靶mRNA降解或翻译抑制,出现转录后负调控靶基因的表达。预测分析约30%的人类蛋白编码基因包括多种癌基因和抑癌基因受miRNA的调控。越来越多的证据表明,miRNAs在肿瘤的发生发展、侵袭与转移及治疗等方面具有重要作用[1]。由于miRNA在外周血、尿中稳定性强,重复性好,且在石蜡标本也可提取,提示miRNA可作为肿瘤标志物以及肿瘤治疗靶点的潜能。miRNA与NSCLC的增殖、侵袭和转移也有密切关系,如miR-182[2]、miR-200[3]、miR-145[4]等可抑制NSCLC细胞增殖、侵袭和转移。因此,积极探寻抑癌miRNA在NSCLC侵袭、转移中的作用及其机制是当前肺癌研究热点。
miR-200a作为miR-200家族(包括miR-200a、miR-200b、miR-200c、miR-114、miR-429)中的一员,定位于人1号染色体1p36.33。miR-200家族中的5个成员具有高度相似的种子序列,根据5’末端种子序列的相似性,将miR-200家族分为miR-200a/141和miR-200b/c/429两个亚族。近年miR-200家族被认为能调控上皮-间质细胞转化(epithelial-mesenchymal transition, EMT),并且在某些肿瘤中表达下调促进肿瘤侵袭和转移。Wang等[5]在对肝癌的研究中发现,miR-200a 在肝癌中表达下调,通过靶基因GAB1抑制癌细胞迁移和侵袭;miR-200a可靶向TFAM抑制乳腺癌细胞的增殖[6]。此外,在胃癌[7]、胰腺导管腺癌[8]、肾细胞癌[9]等肿瘤中也有类似作用。但在少数肿瘤中miR-200a也会表达上调,如miR-200a在结直肠中表达上调,通过靶基因PTEN促进细胞增殖、迁移和侵袭[10];miR-200a在子宫内膜癌细胞中高表达,在细胞株HEC-1B中下调miR-200a可抑制细胞增殖并促进凋亡[11]。可见,miR-200a在不同肿瘤组织中的表达及作用部分有类似。目前,miR-200a在肺癌中的研究较少。Zhen等[12]发现miR-200a在肺癌细胞株表达低于正常肺上皮细胞株,过表达miR-200a可通过下调EGFR和c-MET抑制肺癌细胞迁移和侵袭。miR-200a在肺腺癌H1299细胞中的表达水平明显低于人肺小气道上皮细胞SAEC细胞,在转移性肺癌细胞株中,miR-200a对多个癌基因具有抑制作用[13]。另有研究显示,miR-200家族中miR-200a和miR-200c在肺腺癌细胞中的表达水平明显低于永生化上皮细胞HBE[14],本组结果支持上述部分结论。然而,miR-200a在肺癌细胞中的功能及作用机制仍不明确,本组通过转染成熟体miR-200a mimics序列,上调miR-200a的表达,并对A549细胞生物学行为进行检测。结果显示,A549细胞生长受到抑制,细胞克隆率明显减少,细胞的穿膜细胞数减少,表明miR-200a可以抑制肺癌细胞的增殖和迁移。流式细胞术检测发现,上调miR-200a表达后,A549细胞的凋亡率显著提高,以上结果表明miR-200a在肺癌中发挥抑癌基因作用,可抑制肺癌细胞增殖、迁移,并促进凋亡,提示hsa-miR-200a有可能作为肺癌治疗的新靶点。为进一步探讨miR-200a影响A549细胞增殖和迁移作用机制,本课题组从生物信息网站(TargetScan等)预测并筛选出Tiam1基因。Tiam1属于鸟苷酸转换因子家族成员,可调节Rho家族的小G蛋白。目前研究认为Tiaml主要通过选择性激活Rac下游信号通路,从而实现调节连接细胞外信号与细胞骨架的通讯,参与肿瘤的发生、侵袭及转移等。我们前期研究[15]证实Tiaml在肺腺癌组织中高表达,其表达不仅与患者TNM分期和淋巴结转移密切相关,其还是影响肺腺癌患者生存的独立预后因素。文献已证实,miR-200家族另一成员miR-141在肝癌中与Tiam1存在特异性结合[16],miR-200a在肺癌中的直接作用靶基因是否是Tiam1,还需进一步实验验证。
miR-200a不仅调控靶基因的表达,还受到上游基因、转录因子及表观遗传等的调控。需要强调的是,miR-200a与其调控的靶点mRNA并非一对一的关系,两者之间形成一个复杂和相互关联的调控网络。miR-200a的改变能引起一连串级联反应和反馈通路,涉及多个mRNA和影响多个信号通路的靶基因。文献报道miR-200a作用于SIP1、ZEB1、ZEB2、SIRT1、TFAM等靶基因mRNA的3’UTR,参与EMT过程的调节,从而增加肿瘤侵袭和转移的能力。另一方面miR-200a还可通过Wnt/β-catenin[17]、NF-κB[18]等信号通路参与肿瘤的进展。由于miR-200a可以靶向多种基因,除少数靶基因已得到鉴定外,miR-200a还存在其他未被认知的靶基因和作用机制。本课题组拟进一步验证miR-200a的靶基因,并探讨其表达的机制与肿瘤预后的关系,为肺癌的治疗提供新的思路和治疗靶点。
[1] Zhao A, Zeng Q, Xie X,etal. MicroRNA-125b induces cancer cell apoptosis through suppression of Bcl-2 expression[J]. J Genet Genomics, 2012,39(1):29-35.
[2] Zhang L, Liu T, Huang Y, Liu J. microRNA-182 inhibits the proliferation and invasion of human lung adenocarcinoma cells through its effect on human cortical actin-associated protein[J]. Int J Mol Med, 2011,28(3):381-388.
[3] Roybal J D, Zang Y, Ahn Y H,etal. miR-200 inhibits lung adenocarcinoma cell invasion and metastasis by targeting Flt1/VEGFR1[J]. Mol Cancer Res, 2011,9(1):25-35.
[4] Sachdeva M, Mo Y Y. MicroRNA-145 suppresses cell invasion and metastasis by directly targeting mucin 1[J]. Cancer Res, 2010,70(1):378-387.
[5] Wang J, Song W, Shen W,etal. MicroRNA-200a suppresses cell invasion and migration by directly targeting GAB1 in hepatocellular carcinoma[J]. Oncol Res, 2017,25(1):1-10.
[6] Yao J, Zhou E, Wang Y,etal. microRNA-200a inhibits cell proliferation by targeting mitochondrial transcription factor A in breast cancer[J]. DNA Cell Biol, 2014,33(5):291-300.
[7] Shinozaki A, Sakatani T, Ushiku T,etal. Downregulation of microRNA-200 in EBV-associated gastric carcinoma[J]. Cancer Res, 2010,70(11): 4719-4727.
[8] Wu X, Wu G, Wu Z,etal. miR-200a suppresses the proliferation and metastasis in pancreatic ductal adenocarcinoma through downregulation of DEK gene[J]. Transl Oncol, 2016,9(1):25-31.
[9] Liu H, Brannon A R, Reddy A R,etal. Identifying mRNA targets of microRNA dysregulated in cancer: with application to clear cell renal cell carcinoma[J]. BMC Syst Biol, 2010,4:51.
[10] Li Y, Sun J, Cai Y,etal. miR-200a acts as an oncogene in colorectal carcinoma by targeting PTEN[J]. Exp Mol Pathol, 2016,101(3):308-313.
[11] Li R, He J L, Chen X M,etal. miR-200a is involved in proliferation and apoptosis in the human endometrial adenocarcinoma cell line HEC-1B by targeting the tumor suppressor PTEN[J]. Mol Biol Rep, 2014,41(4):1977-1984.
[12] Zhen Q, Liu J, Gao L,etal. MicroRNA-200a targets EGFR and c-Met to inhibit migration, invasion, and gefitinib resistance in non-small cell lung cancer[J]. Cytogenet Genome Res, 2015,146(1):1-8
[13] Pacurari M, Addison J B, Bondalapati N,etal. The microRNA-200 family targets multiple non-small cell lung cancer prognostic markers in H1299 cells and BEAS-2B cells[J]. Int J Oncol, 2013,43(2):548-560.
[14] 王 勇,李宇男,于晓松. 肺癌细胞及组织中miR-181a、miR-200a、miR-200c表达变化及意义[J]. 山东医药, 2014,54(48):16-18.
[15] Liu S, Li Y, Qi W,etal. Expression of Tiam1 predicts lymph node metastasis and poor survival of lung adenocarcinoma patients[J]. Diagn Pathol, 2014,9:69.
[16] Liu Y, Ding Y, Huang J,etal. miR-141 suppresses the migration and invasion of HCC cells by targeting Tiam1[J]. PLoS One, 2014,9(2):e88393.
[17] Cong N, Du P, Zhang A,etal. Downregulated microRNA-200a promotes EMT and tumor growth through the wnt/β-catenin pathway by targeting the E-cadherin repressors ZEB1/ZEB2 in gastric adenocarcinoma[J]. Oncol Rep, 2013,29(4):1579-1587.
[18] Shi Z, Hu Z, Chen D,etal. MicroRNA-200a mediates nasopharyngeal carcinoma cell proliferation through the activation of nuclear factor-κB[J]. Mol Med Rep, 2016,13(2):1732-1738.
EffectofmiR-200aontheproliferation,migrationandapoptosisoflungcancercelllineA549
LIU Shu-guang1, ZHANG Si-si2, SHAO Mu-min3, MA Hong-mei1, SHEN Hong2
(1DepartmentsofPathology,theEighthAffiliatedHospital,SunYat-senUniversity,Shenzhen518033,China;2DepartmentofPathology,SouthernMedicalUniversity,Guangzhou510515,China;3DepartmentsofPathology,ShenzhenHospitalAffiliatedtoGuangzhouUniversityofChineseMedicine,Shenzhen518033,China)
PurposeTo investigate the expression of miR-200a in different lung cancer cell lines and its effect on proliferation, migration, and apoptosis in A549 cells.MethodsThe expressions of miR-200a in different lung cancer cell lines were detected by RT-PCR. miR-200a mimics was transfected into A549 cells by Lipofectamine RNAiMax. The change of proliferation ablility of A549 cells was detected by CCK-8 method and plate clone formation assay. Cell migration was examined by Transwell chamber assay. The flow cytometry was used to examine the changes of apoptosis. The possible target genes of miR-200a were forecasted by bioinformatics tools.ResultsThe results of RT-PCR showed that the expression of miR-200a was significantly down-regulated in A549, H23 and H460 cell lines than 16HBE cell line. CCK-8 assay showed that the OD values of the mimics group at 4, and 5 days were significantly lower than those in the negative control (NC) group (P<0.05). Plate clone formation assay showed rate of colony formation in the mimics group was significantly lower than that in the NC group [(33.13±0.74)%vs(45.57±1.27)%,P<0.05]. Transwell migration assay showed that the cell number of mimics group that passed the Transwell membrane was significantly lower than that of the NC group [(71.60±17.90)vs(140.20±17.88),P<0.05]. Flow cytometry showed that the apoptosis rate of the mimics group was significantly higher than that of the NC group [(17.80±1.90)%vs(11.33±1.96)%,P<0.05]. Tiam1 may be one of the target gene of miR-200a.ConclusionmiR-200a can inhibit the proliferation and migration, and promote apoptosis of lung cancer A549 cells, suggesting a potential new therapeutic agent for lung cancer cell. MiR-200a may play a function of regulation of tumor development through target gene Tiam1.
lung neoplasm; miR-200a; A549 cells; proliferation; migration; apoptosis
时间:2017-9-18 6:23 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170918.0623.011.html
R 734.2
A
1001-7399(2017)09-0992-06
10.13315/j.cnki.cjcep.2017.09.011
接受日期:2017-06-30
广东省医学科研基金资助(A2015429、A2016114)、深圳市福田区卫生公益性科研项目(FTWS2015017)
1中山大学附属第八医院病理科,深圳 518033
2南方医科大学病理学系,广州 510515
3广州中医药大学深圳附属医院病理科,深圳 518033
刘曙光,男,博士,副主任医师。E-mail: SGL3016@163.com
申 洪,男,教授,博士生导师,通讯作者。E-mail: shenhong2010168@163.com
