M2型巨噬细胞浸润与前列腺癌恶性程度的相关性分析
2017-11-20王国庆王雪晴陈恕求张丽华
王国庆,陶 陶 ,苏 欢,王雪晴 ,陈恕求,陈 明,张丽华
M2型巨噬细胞浸润与前列腺癌恶性程度的相关性分析
王国庆1,陶 陶2,苏 欢3,王雪晴1,陈恕求3,陈 明3,张丽华1
目的探讨前列腺癌组织M2型巨噬细胞浸润与前列腺癌病理分级和分期的相关性。方法选取58例行根治性前列腺癌切除患者,对病理标本行HE和免疫组化SP法染色,确定肿瘤分期、病理分级及有无M2型巨噬细胞浸润,采用χ2检验分析M2型巨噬细胞浸润与肿瘤分级和分期的相关性。结果M2型巨噬细胞浸润的前列腺癌组≥T2c为71.4%,发生淋巴结转移为60.0%,明显高于无M2型巨噬细胞浸润组(χ2=5.97,P=0.015;χ2=10.28,P=0.001);M2型巨噬细胞浸润与无M2型巨噬细胞浸润的前列腺癌组的病理分级差异无统计学意义(P>0.05)。结论M2型巨噬细胞浸润可能参与前列腺癌细胞的生长和转移;其相关病理、生理机制有待进一步分析。
前列腺肿瘤;巨噬细胞;病理分级;临床分期
前列腺癌是男性泌尿生殖系统常见的恶性肿瘤,有数据显示2009年我国前列腺癌的发病率为9.92/10万,2015年我国前列腺癌发病率增至60.3/10万,病死率达26.6/10万[1]。前列腺癌已成为威胁中国男性健康的主要疾病之一,其发生和进展机制亟待深入分析。
既往研究表明,炎症反应的主要作用是促进伤口愈合、组织修复以及对抗各类感染。近年研究发现,炎症反应尤其是慢性非可控炎症反应中的炎性细胞浸润于肿瘤组织中可显著促进肿瘤的恶性进展。在肝癌、胃癌、食管癌、结肠癌和膀胱癌等多种实体肿瘤中,人们发现炎症细胞可以促进肿瘤滋养血管生成、DNA损伤、改变微环境以促进肿瘤转移和逃避免疫应答[2]。这些炎症细胞包括巨噬细胞、肥大细胞、中性粒细胞、T淋巴细胞、B淋巴细胞等[3-6]。文献报道[7-8]循环血液中的炎症细胞比值(中性粒细胞/淋巴细胞)可以作为预测前列腺癌临床分期、病理分级和预后的重要指标。本实验检测58例前列腺癌,分析肿瘤组织有无炎症细胞浸润与临床病理特征的关系,探讨前列腺癌炎症微环境与前列腺癌的恶性表型之间的相关性。
1 材料与方法
1.1临床资料选取2014~2015年东南大学附属中大医院泌尿外科58例前列腺癌标本(均行腹腔镜前列腺癌根治+淋巴清扫),平均年龄(72.3±7.2)岁;Gleason评分≤7分者35例,8~10分者23例。临床分期 1.2方法肿瘤组织行HE染色和免疫组化SP法染色,200倍显微镜下观察肿瘤组织周围有无M2型巨噬细胞浸润。 2.1临床特征HE染色示部分前列腺癌组织间质内存在M2型巨噬细胞浸润,巨噬细胞体积较大,形态不规则,胞质嗜酸性染色,核稍偏位,核卵圆形,染色质深染(图1);部分前列腺癌组织间质内无M2型巨噬细胞浸润(图2)。免疫组化SP法染色示M2型巨噬细胞标志物CD163蛋白呈阳性(图3);M2型巨噬细胞标志物CD163蛋白呈阴性(图4)。 ①②③④ 图1有M2型巨噬细胞浸润的前列腺癌病理组织HE染色,可见典型的M2型巨噬细胞,细胞体积较大,形态不规则,核稍偏位,染色质深染图2无M2型巨噬细胞浸润的前列腺癌病理组织HE染色图3巨噬细胞标志物CD163蛋白呈阳性,SP法图4巨噬细胞标志物CD163蛋白呈阴性,SP法 2.2M2型巨噬细胞浸润与前列腺癌局部进展的相关性M2型巨噬细胞浸润的前列腺癌组≥T2c为71.4%,镜下未见M2型巨噬细胞浸润的前列腺癌组≥T2c为39.1%(χ2=5.97,P=0.015,表1)。 2.3M2型巨噬细胞浸润与前列腺癌淋巴结转移的相关性M2型巨噬细胞浸润的前列腺癌组发生淋巴结转移为60.0%;镜下无M2型巨噬细胞浸润的前列腺癌组发生淋巴结转移为17.4%(χ2=10.28,P=0.001,表1)。 表1 M2型巨噬细胞浸润与前列腺癌局部进展和淋巴结转移的相关性 *P<0.05 2.4M2型巨噬细胞浸润与前列腺癌病理分级的相关性M2型巨噬细胞浸润与无M2型巨噬细胞浸润的前列腺癌组的病理分级,差异无统计学意义(P>0.05) 目前,根治性切除和放疗是治愈局限性前列腺癌的主要方法。但是,对于已有远处转移、不适宜手术或治疗后复发(转移)等情况,通常选择内分泌治疗。研究表明,80%以上的患者可通过雄激素剥夺治疗获得疾病的缓解,但经过14~30个月的中位时间后,大部分患者的病变均逐渐发展为去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)。患者一旦发生去势抵抗和远处转移,预后较差[9]。虽然多种药物包括多西紫杉醇、阿比特龙、恩杂鲁胺等可用于CRPC的治疗,但其疗效仍然有限。目前,CRPC已成为晚期前列腺癌患者主要死因[10]。因此,探讨前列腺癌的进展机制,寻找新的分子靶点,对延缓疾病进程和降低晚期肿瘤的病死率具有重大作用。 近年越来越多的研究证实肿瘤相关炎症反应与肿瘤的发生、发展密切相关,很多肿瘤起源于感染、慢性炎性刺激和炎症反应:肿瘤相关炎症反应的主要特点是炎性细胞的渗透、细胞因子产生、组织重建以及血管生成。其中,中性粒细胞可以分泌大量血管内皮生长因子(vascular endothelial growth factor, VEGF),而内皮细胞分泌的趋化因子又可以诱导中性粒细胞向肿瘤趋化,为肿瘤生长和增殖提供适宜的环境,促使肿瘤血管形成,进而加快肿瘤的生长[2]。Nonomura等[11]发现在接受内分泌治疗的前列腺癌患者病理切片中,肿瘤相关巨噬细胞(tumour-associated macrophage,TAM)计数较低组的预后明显优于计数较高组。Lanciotti等[12]通过对93例前列腺癌根治术后的病理切片与生化复发进行关联分析发现,高密度的TAM浸润是前列腺癌复发的独立危险因子。 巨噬细胞有两种已经明确的分化表型,即M1型和M2型。M1型巨噬细胞常分泌引起辅助性T细胞(Th)1型免疫反应的细胞因子,M2型巨噬细胞则常分泌引起Th2型免疫反应的细胞因子。研究表明,TAM具有M2型巨噬细胞特性,高表达CD163、CD206、Arg-1等M2型巨噬细胞的标记分子,同时主要组织相容性复合体低表达,并且介导VEGF、MMP-9、壳多糖酶样蛋白等细胞因子的分泌,促进肿瘤的血管生成、浸润、转移等[13]。本组回顾性分析58例前列腺癌患者术后病理切片中炎性细胞浸润与肿瘤临床分期、病理分级的相关性,发现M2型巨噬细胞的浸润与肿瘤的局部生长和淋巴转移呈显著的正相关,与肿瘤的病理分级未见明显相关性。本组由于样本量较少,且可能存在地域差异;M2型巨噬细胞浸润是否影响前列腺癌患者的生化复发,以及M2型巨噬细胞浸润促进前列腺癌细胞生长和转移的相关分子机制尚有待于进一步深入探讨。 [1] Chen W, Zheng R, Baade P D,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132. [2] Khan S, Jain M, Mathur V,etal. Chronic inflammation and cancer: paradigm on tumor progression, metastasis and therapeutic intervention[J]. Gulf J Oncol, 2016,1(20):86-93. [3] Coffelt S B, Lewis C E, Naldini L,etal. Elusive identities and overlapping phenotypes of proangiogenic myeloid cells in tumors[J]. Am J Pathol, 2010,176(4):1564-1576. [4] Denardo D G, Andreu P, Coussens L M. Interactions between lymphocytes and myeloid cells regulate pro-versus anti-tumor immunity[J]. Cancer Metastasis Rev, 2010,29(2):309-316. [5] Egeblad M, Nakasone E S, Werb Z. Tumors as organs: complex tissues that interface with the entire organism[J]. Dev Cell, 2010,18(6):884-901. [6] Johansson M, Denardo D G, Coussens L M. Polarized immune responses differentially regulate cancer development[J]. Immunol Rev, 2008,222:145-154. [7] 晋学飞,李宏岩,刘恒昌,等. 根治性前列腺癌切除术患者外周血中性粒细胞-淋巴细胞比值与预后的关系[J]. 中华实验外科杂志, 2015,32(12):2967-2969. [8] 付 凯,陈楚杰,林藩雄,等. 术前中性粒细胞与淋巴细胞比值与前列腺癌恶性度的关系探讨[J]. 中华腔镜泌尿外科杂志(电子版), 2015,9(5):13-16. [9] Tao T, Liu D, Liu C,etal. Autoregulatory feedback loop of EZH2/miR-200c/E2F3 as a driving force for prostate cancer development[J]. Biochim Biophys Acta, 2014,1839(9):858-865. [10] Tyson M D, Bryce A. The effect of enzalutamide and bicalutamide on patient-reported quality of life outcomes: results from the TERRAIN study[J]. Eur Urol, 2016,71(4):543-544. [11] Nonomura N, Takayama H, Nakayama M,etal. Infiltration of tumour-associated macrophages in prostate biopsy specimens is predictive of disease progression after hormonal therapy for prostate cancer[J]. BJU Int, 2011,107(12):1918-1922. [12] Lanciotti M, Masieri L, Raspollini M R,etal. The role of M1 and M2 macrophages in prostate cancer in relation to extracapsular tumor extension and biochemical recurrence after radical prostatectomy[J]. Biomed Res Int, 2014,2014:486798. [13] Chen Y, Zhang S, Wang Q,etal. Tumor-recruited M2 macrophages promote gastric and breast cancer metastasis via M2 macrophage-secreted CHI3L1 protein[J]. J Hematol Onco, 2017,10(1):36. RelationshipbetweenM2microphageinfiltrationandthemalignantdegreeofprostatecancer WANG Guo-qing1, TAO Tao2, SU Huan3, WANG Xue-qing1, CHEN Shu-qiu3, CHEN Ming3, ZHANG Li-hua1 (1DepartmentofPathology,3DepartmentofUrology,ZhongdaHospital,MedicalSchool,SoutheastUniversity,Nanjing210009,China;2DepartmentofUrology,AnhuiProvincialHospital,AnhuiMedicalUniversity,Hefei230001,China) PurposeTo investigate the relationship between M2 microphage infiltration and the pathological grading and staging of prostate cancer.Methods58 patients who accepted the radical resection of prostate cancer were selected. After operation, pathologic specimens were hematoxylin eosin stained and immunohistochemical of SP stained to identify the pathological grading, staging, and M2 microphage infiltration. Then, Chi-squared test was used to analyze the relationship between M2 microphage infiltration and the pathological grading and staging of prostate cancer.ResultsThere were 71.4% high stage (≥T2c) cases and 60% lymph node metastasis cases in M2 microphage infiltration group, which was significantly higher than those in non M2 microphage infiltration group. However, there was no relationship between M2 microphage infiltration and pathological grading.ConclusionM2 macrophage infiltration may participate in the prostate cancer cell growth and metastasis, whose pathophysiological mechanism needs further exploration. prostate neoplasm;macrophage;pathological grading; clinical stage 时间:2017-9-18 6:23 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170918.0623.006.html R 737.25 A 1001-7399(2017)09-0969-03 10.13315/j.cnki.cjcep.2017.09.006 接受日期:2017-07-24 江苏省自然科学基金(BK20160705) 1东南大学附属中大医院病理科、3泌尿外科,南京 210009 2安徽医科大学附属安徽省立医院泌尿外科,合肥 230001 王国庆,男,医师。Tel:(025)83272037,E-mail: wanggq130@sina.com 张丽华,女,博士,主任医师,通讯作者。E-mail:15905179393@126.com 网络出版时间:2017-9-18 6:23 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170918.0623.007.html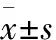
2 结果


3 讨论
