肝细胞癌中TLR3介导的间质微环境细胞改变
2017-11-20张崇辉
张崇辉,陈 莉
肝细胞癌中TLR3介导的间质微环境细胞改变
张崇辉1,2,陈 莉2
目的探讨肝细胞癌(hepatocellular carcinoma, HCC)中Toll样受体3(Toll-like receptor 3, TLR3)的表达及其与临床病理特征、间质微环境的相关性。方法采用专利技术(CN101319971B)制备人体HCC组织芯片,应用免疫组化SP法染色检测HCC细胞中TLR3的表达,同时检测间质中各项指标。采用多因素相关分析HCC中TLR3表达与其临床病理特征及间质微环境的关系。结果HCC中TLR3的阳性率为71.57%,与癌脉管侵犯(P=0.001)、肝硬化背景(P=0.007)、Edmondson分级(P=0.001)、TNM分期(P=0.000)呈负相关;与癌乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阳性呈正相关(P=0.000);与间质浸润的T细胞(P=0.002)和自然杀伤(natural killer, NK)细胞(P=0.000)呈正相关;与癌相关肌纤维母细胞(carcinoma-associated fibroblasts, CAFs)(P=0.000)和微血管密度(microvessel density, MVD)(P=0.000)呈负相关。结论TLR3对HCC间质微环境具有十分重要的影响。
肝肿瘤;肝细胞癌;TLR3;临床病理特征;微环境;相关性
原发性肝细胞癌(hepatocellular carcinoma, HCC)是世界上最常见的恶性肿瘤之一,其全球发病率和病死率分别为第5位和第3位[1],中国是HCC的高危地区,其发病率和病死率均占第3位[2]。Toll样受体(Toll-like receptors, TLR)是果蝇Toll蛋白的同源体,Toll样受体3(Toll-like receptor 3, TLR3)为TLR家族的重要成员。目前,HCC中TLR3信号活化对癌间质微环境中细胞的影响尚不十分清楚。本实验采用免疫组化SP法检测102例HCC细胞中TLR3表达,以及CD3表达的T细胞与CD56表达的自然杀伤(natural killer, NK)细胞、间质中α-SMA表达的癌相关肌纤维母细胞(carcinoma-associated fibroblasts, CAFs)和血管生成相关指标CD34表达的微血管密度(microvessel density, MVD),分析HCC中TLR3表达与HCC临床病理特征、癌间质微环境的相关性,为临床治疗提供新靶点。
1 材料与方法
1.1材料收集南通市肿瘤医院、南通大学附属医院和南通市第三人民医院2003年1月~2004年12月手术切除的102例HCC石蜡标本。所有病例术前均未行放、化疗处理。102例HCC患者年龄<50岁52例、≥50岁50例;男性84例、女性18例;乙型肝炎表面抗原(hepatitis B surface antigen, HBsAg)阴性71例、阳性31例;生存时间<5年65例、≥5年37例。
1.2组织芯片制作及免疫组化染色利用鄂群、陈莉、金国华等发明的专利技术(CN101319971B,2010年)制备人体HCC组织芯片,免疫组化采用SP法染色。
1.3判断标准免疫组化SP法染色呈棕黄色颗粒者为阳性,阳性细胞需结构清晰,着色明显高于背景。TLR3、CD3、CD56和α-SMA免疫组化结果的判定标准参照文献,根据着色强度进行评分:无阳性着色为0分、淡黄色1分、棕黄色2分、深棕色为3分;根据阳性细胞百分比进行评分:阳性细胞<5%为1分、5%~25%为2分、26%~50%为3分、>50%为4分。两项得分相加作为最终判定标准:1分为阴性(-)、2分为弱阳性(+)、3分为中等阳性()、≥4分为强阳性()。血管内皮细胞CD34呈阳性,于100倍镜下选取微血管最密集的3个视野计数微血管数目,即为MVD值。MVD分级为:<120为低、120~240为重、>240为高。
1.3统计学方法运用统计学软件SPSS 19.0进行统计学分析。采用χ2检验分析HCC中各指标免疫组化检测结果,运用Spearman等级相关分析HCC中有关指标间的相互关系。P<0.05为差异有统计学意义。
2 结果
2.1TLR3表达与HCC临床病理特征的关系102例HCC中TLR3主要表达于肿瘤细胞的胞膜或胞质(图1),检测的阳性率为71.57%(73/102)。TLR3表达在脉管侵犯阳性组与阴性组、伴与不伴肝硬化组、Edmondson不同分级组、TNM不同分期组间差异有统计学意义(P<0.05),且呈显著负相关(P<0.05);在HBsAg阴性组和阳性组间差异有统计学意义(P<0.05),且呈显著正相关。HCC中TLR3表达在患者性别、年龄、肿瘤直径、瘤结数目及血清甲胎蛋白(α-fetoprotein, AFP)值组中的差异无统计学意义(P>0.05,表1)。
2.2HCC中TLR3表达与癌间质微环境的相关性
2.2.1HCC中TLR3表达与癌间质免疫活性细胞反应的相关性 HCC间质中免疫活性细胞均定位于细胞胞质(图2)。在HCC中TLR3表达与CD3阳性的T细胞、CD56阳性的NK细胞呈正相关(表2)。
2.2.2HCC中TLR3表达与癌间质中CAFs反应的相关性 HCC间质中CAFs显示α-SMA阳性,定位于胞质(图3)。在HCC中TLR3表达与α-SMA阳性的CAFs呈负相关(表3)。
2.2.3HCC中TLR3表达与间质MVD的相关性 HCC间质CD34表达于血管内皮细胞质或胞膜(图4)。HCC中TLR3在不同MVD的癌中表达差异有显著统计学意义,且HCC中TLR3表达与MVD呈显著负相关(表4)。
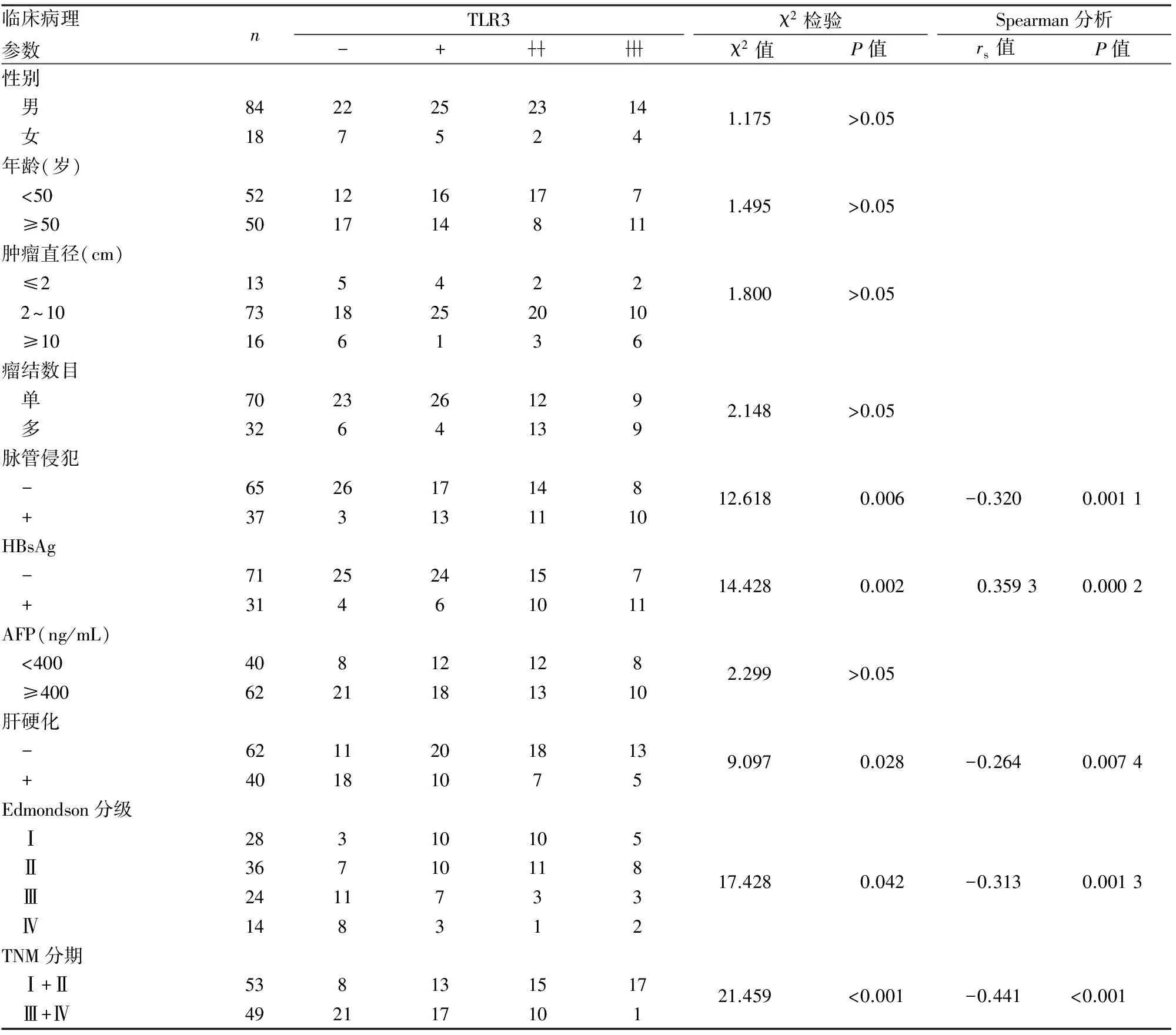
表1 TLR3表达与HCC临床病理特征的关系
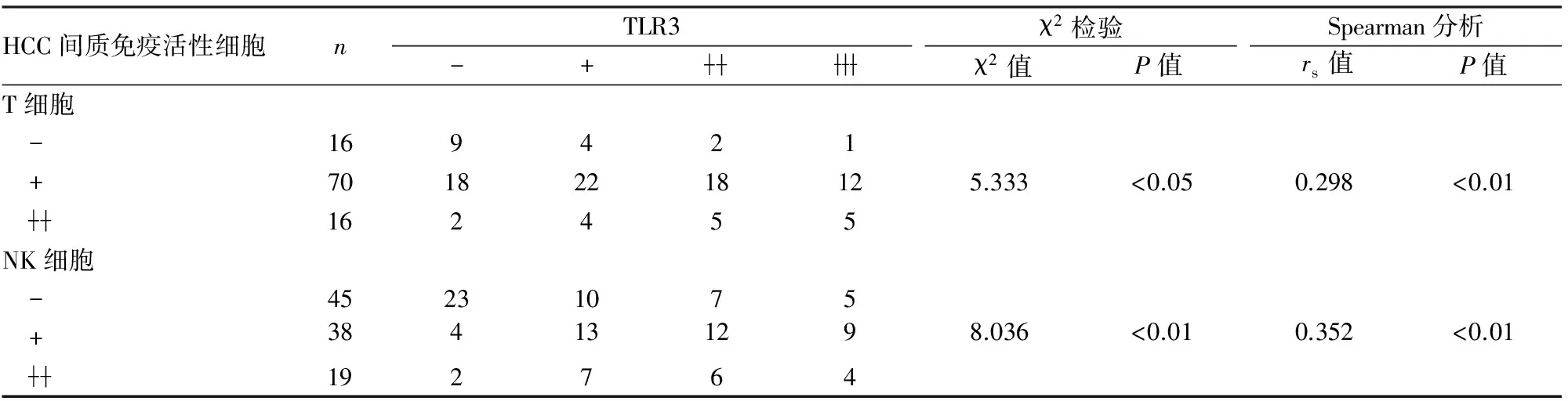
表2 HCC中TLR3表达与癌间质免疫活性细胞反应的相关性

表3 HCC中TLR3表达与癌间质CAFs反应的相关性
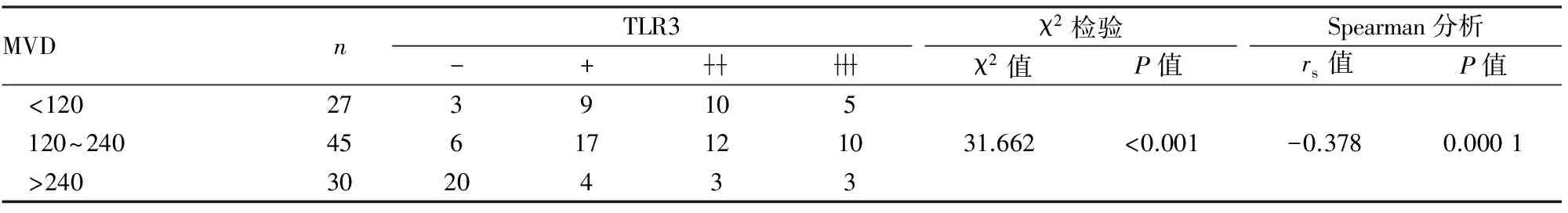
表4 HCC中TLR3表达与间质MVD的相关性

①②A②B③④图1 HCC中TLR3表达定位于胞质,呈棕黄色颗粒,SP法 图2 HCC中免疫活性细胞的表达,SP法:A.CD3阳性的T细胞;B.CD56阳性的NK细胞 图3 HCC中α⁃SMA表达的CAFs,SP法 图4 HCC中CD34表达于血管内皮细胞质或胞膜,计数MVD,SP法
3 讨论
TLR家族能同时调节天然免疫和获得性免疫[3],已知TLR家族表达于各种免疫细胞,甚至还表达于非免疫细胞中[4]。TLR3是TLR家族的重要成员之一,最近的研究已证实TLR3在HCC癌细胞中有一定的表达,活化的TLR3信号导致NF-κB感应,分泌炎症细胞因子,影响癌微环境中多种细胞活力[5]。本组在102例HCC中检测73例TLR3表达于癌细胞胞膜和胞质中,阳性率为71.57%,略高于Yuan等[5]报道的65%,可能与本组收集的HCC病例临床Ⅰ~Ⅱ级比例较高有关,也可能与本地区HCC常伴有乙肝病毒(hepatitis B virus, HBV)感染,病毒双链激活TLR3引起其表达增加等有关。
已知双链RNA(double stranded RNA, dsRNA)是TLR3的配体,而dsRNA常是病毒基因组的成分,包括HBV在内的多种病毒在其复制期间均会合成dsRNA。此外,癌细胞坏死或调亡后释放出的信使RNA(messenger RNA, mRNA)或其他RNA可形成双链结构,都可成为TLR3的配体并与其结合[6],如本组分析显示TLR3表达与HBsAg呈正相关。虽然肝炎、肝硬化是HCC发生、发展的主要因素,但TLR3可能通过间质微环境中免疫活性细胞抗病毒免疫反应和抑制CAFs减少基质分泌,如胶原、层粘连蛋白和纤维连接蛋白,抑制HCC间质纤维化。因此,TLR3表达与HCC肝硬化背景呈负相关。由于TLR3表达抑制CAFs,使其基质降解酶(如金属蛋白酶[7]等)生成减少,而基质降解酶的主要功能是破坏肿瘤细胞与周围的组织学屏障,因此TLR3表达与HCC脉管侵犯、Edmondson分级和TNM分期呈负相关。由此证明TLR3在抑制恶性肿瘤细胞的生物学行为方面发挥重要作用[4,8-10]。
肿瘤微环境是指肿瘤在其逐渐发展过程中形成的自己独特的组织内环境。HCC细胞及其与微环境之间的动态变化是细胞存活、生长、增殖、上皮-间充质转化(epithelial-mesenchymal transitions, EMT)乃至HCC复发转移所必需的[11-12]。
在肿瘤局部免疫中以杀伤性T细胞和NK细胞为代表的免疫杀伤细胞对肿瘤生长及转移发挥重要作用。T细胞常处于机体免疫系统与肿瘤相互作用的最前沿,其组成和功能在一定程度上反映了机体抗肿瘤反应的性质、强度和总体水平。Faraji等[13]的研究显示CD8+T细胞的功能正向影响cadml对肿瘤细胞肺转移的抑制作用。Bidwell等[14]的研究显示乳腺癌患者去除CD8+T细胞和NK细胞能恢复骨转移,同时能显著恶化无转移患者的预后。Giuliani等[15]在最近的研究中发现,抗肿瘤药物来那度胺发挥抗肿瘤活性的重要途径是通过激活NK细胞。本实验中TLR3表达与T细胞及NK细胞均呈正相关,提示TLR3与T细胞及NK细胞对HCC的生物学影响具有协同作用。
CAFs是肿瘤微环境的中心成分。HCC微环境中表达α-SMA的CAFs,同时具有分泌大量细胞外基质与促进基质沉积形成HCC硬化背景的能力[16]。本文中TLR3表达与CAFs呈负相关,系TLR3可能通过间质微环境中免疫活性细胞抗病毒免疫反应和抑制CAFs以减少基质分泌来抑制HCC间质纤维化。
血管再生是HCC浸润、扩散和转移的基础。异常的肿瘤血管形成,一方面直接给肿瘤细胞提供营养物质,另一方面为肿瘤细胞血道转移提供阻力最小的通道,使肿瘤细胞更易进入血循环形成转移。Guo等[17]的研究表明HCC细胞中发挥抗血管生成作用正是通过激活TLR3的机制。本组HCC中TLR3表达与MVD呈负相关,提示癌细胞TLR3表达能抑制血管生成。
综上所述,TLR3作为一种还有待进一步深入分析的新型抗体,可辅助用于对HCC患者临床病理特征及间质微环境的评估;同时表明TLR3是HCC靶向性治疗中较好的靶点,如能与HCC微环境的特点相结合,有利于获得更多的治疗效果好、毒副作用低的精准靶向性抗HCC药物,开拓出新的HCC治疗思路,对提高HCC治疗的效果并最终彻底掌控HCC具有重要的战略意义。
[1] Torzilli G, Donadon M, Belghiti J,etal. Predicting individual survival after hepatectomy for hepatocellular carcinoma: a novel nomogram from the “HCC east & west study group”[J]. J Gastrointest Surg, 2016,20(6):1154-1162.
[2] Chen W Q, Zheng R S, Baade P D,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[3] Lee S O, Brown R A, Razonable R R. Association between a functional polymorphism in Toll-like receptor 3 and chronic hepatitis C in liver transplant recipients[J]. Transpl Infect Dis, 2013,15(2):111-119.
[4] Chen L, Xu Y Y, Zhou J M,etal. TLR3 dsRNA agonist inhibits growth and invasion of HepG2.2.15 HCC cells[J]. Oncol Rep, 2012,28(1):200-206.
[5] Yuan M M, Xu Y Y, Chen L,etal. TLR3 expression correlates with apoptosis, proliferation and angiogenesis in hepatocellular carcinoma and predicts prognosis[J]. BMC Cancer, 2015,15:245.
[6] Xu Y Y, Chen L, Wang G L,etal. A synthetic dsRNA, as a TLR3 pathwaysynergist, combined with sorafenib suppresses HCCinvitroandinvivo[J]. BMC Cancer, 2013,13:527.
[7] Qiao A X, Gu F, Guo X J,etal. Breast cancer-associated fibroblasts: their roles in tumor initiation, progression and clinical applications[J]. Front Med, 2016,10(1):33-40.
[8] Xu Y Y, Chen L, Zhou J M,etal. Inhibitory effect of dsRNA TLR3 agonist in a rat hepatocellular carcinoma model[J]. Mol Med Rep, 2013,8(4):1037-1042.
[9] Tao S S, Zhu L X, Lee P,etal. Negative control of TLR3 signaling by TICAM1 down-regulation[J]. Am J Respir Cell Mol Biol, 2012,46(5):660-667.
[10] Patel A K, Hackam A S. A novel protective role for the innate immunity Toll-like receptor 3 (TLR3) in the retina via Stat3[J]. Mol Cell Neurosci, 2014,63:38-48.
[11] Leonardi G C, Candido S, Cervello M,etal. The tumor microenvironment in hepatocellular carcinoma[J]. Int J Oncol, 2012,40(6):1733-1747.
[12] 吴文涌,孟翔凌,齐 勇,等. 人肝细胞癌中LC3B和p62的表达及意义[J]. 临床与实验病理学杂志, 2016,32(4):366-369.
[13] Faraji F, Pang Y, Walker R C,etal. Cadm1 Is a metastasis susceptibility gene that suppresses metastasis by modifying tumor interaction with the cell-mediated immunity[J]. PLoS Genet, 2012,8(9):e1002926.
[14] Bidwell B N, Slaney C Y, Withana N P,etal. Silencing of Irf7 pathways in breast cancer cells promotes bone metastasis through immune escape[J]. Nat Med, 2012,18(8):1224-1231.
[15] Giuliani M, Janji B, Berchem G. Activation of NK cells and disruption of PD-L1/PD-1 axis: two different ways for lenalidomide to block myeloma progression[J]. Oncotarget, 2017,8(14):24031-24044.
[16] Ostman A. Cancer-associated fibroblasts: recent developments and emerging challenges[J]. Semin Cancer Biol, 2014,25:1-2.
[17] Guo Z Y, Chen L, Zhu Y Y,etal. Double-stranded RNA-induced TLR3 activation inhibits angiogenesis and triggers apoptosis of human hepatocellular carcinoma cells[J]. Oncol Rep, 2012,27(2):396-402.
CorrelationofTLR3withthealterationofstromalcellsintumormicroenvironmentofhepatocellularcarcinoma
ZHANG Chong-hui1,2, CHEN Li2
(1DepartmentofPathology,ChangzhouChildren’sHospital,Changzhou213003,China;2DepartmentofPathologicalAnatomy,MedicalSchoolofNantongUniversity,Nantong226001,China)
PurposeTo analyse the correlation between the Toll-like receptor 3 (TLR3) expression and clinic pathologic factors, stromal microenvironment in hepatocellular carcinoma (HCC).MethodsThe tissue microarrays of human HCC were prepared with self-owned patent technology. The expression of TLR3 in HCC cells as well as various indexes in HCC stroma was examined with immunohistochemistry of SP. The correlation between TLR3 expression with the clinic pathologic factors of HCC, and the correlation between TLR3 expression with the reaction of stromal cells in HCC microenvironment were analyzed by multi-factor correlation analysis. Results The positive expression rate of TLR3 in HCC was 71.57%. The expression of TLR3 in HCC had negative correlation with vascular invasion (P=0.001), cirrhosis (P=0.007), Edmondson′s grades (P=0.001) and staging of TNM (P=0.000). It had positive correlation with hepatitis B surface antigen (HBsAg) (P=0.000). It had positive correlation with T cells (P=0.002) and natural killer (NK) cells (P=0.000). It had negative correlation with carcinoma-associated fibroblasts (CAFs) (P=0.000) and microvessel density (MVD) (P=0.000).ConclusionTLR3 has an important influence on the interstitial microenvironment of HCC.
hepatocellular neoplasm; hepatocellular carcinoma; Toll-like receptor 3; clinicopathologic factors; microenvironment; correlation
时间:2017-9-18 6:23 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170918.0623.010.html
R 735.7
A
1001-7399(2017)09-0987-05
10.13315/j.cnki.cjcep.2017.09.010
接受日期:2017-06-27
1常州市儿童医院病理科,常州 213003
2南通大学医学院病理解剖学系,南通 226001
张崇辉,男,硕士,副主任医师。E-mail: zch101@163.com
陈 莉,女,博士,教授,通讯作者。Tel:(0513)85051729,E-mail: bl1@ntu.edu.cn
