伴有转移的胃肠道间质瘤临床病理特征
2017-11-20王源,孟刚
王 源,孟 刚
伴有转移的胃肠道间质瘤临床病理特征
王 源,孟 刚
目的探讨伴有转移的胃肠道间质瘤(gastrointestinal stromal tumors, GIST)临床病理特征及其淋巴结转移的机制。方法收集45例伴有转移的GIST并选取同期50例原发GIST作对比分析。采用免疫组化EnVision法染色标记Ki-67、CD31、D2-40,计数微血管密度(micro vessel density, MVD)和微淋巴管密度(lymphatic microvessel density, LMVD)。结果GIST总转移率为5.45%,血道转移率为1.33%,淋巴结转移率为1.09%。转移性GIST实质内的MVD为每平方毫米398.39±68.20 个,非转移性GIST实质内的MVD为每平方毫米192.07±56.85个,两者差异有统计学意义。转移性及非转移性GIST实质内均无淋巴管,转移性GIST边缘区LMVD为每平方毫米13.28±2.40个、周围正常组织LMVD为每平方毫米25.36±6.71个;非转移性GIST边缘区LMVD为每平方毫米12.21±1.83 个、周围正常组织LMVD为每平方毫米24.23±8.64个;两组GIST边缘区及周围正常组织内LMVD差异无统计学意义。GIST形态学观察可见淋巴结转移组9例均呈浸润性生长,而非淋巴结转移组仅12例(12/86)呈浸润性生长。结论转移性GIST的MVD高于非转移性GIST,GIST肿瘤实质内无淋巴管,肿瘤呈浸润性生长可能是淋巴结转移的原因。
胃肠道肿瘤;胃肠道间质瘤;淋巴结转移;病理
胃肠道间质瘤(gastrointestinal stromal tumors, GIST)是胃肠道最为常见的间叶源性肿瘤,发病率占胃肠道恶性肿瘤的0.1%~3%[1]。肝脏转移和腹腔种植性转移是GIST最常见的转移途径,淋巴结转移少见[2],外科手术治疗亦不考虑淋巴结清扫。美国国立综合癌症网络(NCCN)软组织肉瘤临床实践指南(2016)中,新增“对于SDH缺乏的GIST患者,需考虑切除病理性肿大的淋巴结”[3]。目前文献报道GIST淋巴结转移病例多为个案,大宗病例的系统分析罕见,对其临床病理特征尚缺乏充分认识。本组收集825例GIST并结合检索GIST淋巴结转移的报道,对伴有转移尤其是淋巴结转移的GIST进行分析,探讨其独特的临床病理特征及与淋巴结转移的相关性分析[4]。
1 材料与方法
1.1材料收集安徽医科大学第一附属医院病理科2011年11月~2016年10月确诊为GIST的825例组织标本,选取45例伴有转移的手术标本作为分析对象,并选取50例同期非转移性GIST作为对照。
1.2方法所有病例重新切片,行HE及免疫组化EnVision法染色。抗体CD34、Ki-67、CD31、D2-40及免疫组化试剂,均购自福州迈新公司。
1.3结果判断免疫组化切片中细胞阳性信号呈棕黄色细颗粒状。计数微血管密度(micro vessel density, MVD)和微淋巴管密度(lymphatic microvessel density, LMVD):观察用CD31(CD34)/D2-40标记的免疫组化切片,在100倍镜下寻找血管/淋巴管密集的热点区域,分别计数3个热点区域200倍镜下的微血管/微淋巴管计数,根据高倍镜视野直径计算每平方毫米的微血管/微淋巴管数量计为 MVD/LMVD[5-6]。
1.4统计学方法MVD和LMVD结果运用SPSS 13.0软件进行统计学方差分析,P<0.05为差异有统计学意义。
2 结果
2.1转移性GIST临床病理特征825例GIST患者中,45例(5.45%)发生转移,其中发生淋巴结转移者9例(1.09%)、发生肝脏转移者11例(1.33%)、发生腹腔转移者25例(2.91%)。转移性患者发病年龄最小为23岁,最大为82岁,多发于50~60岁。最常见的原发部位是胃(24例,53%),其次为小肠(15例,30%),结肠(4例,8.8%),胃肠道外(2例,4.4%)。HE镜下细胞形态特点:35例为梭形细胞型,5例为上皮细胞型,5例为混合细胞型。淋巴结转移组GIST中9例均呈浸润性生长,而非淋巴结转移组仅12例(12/86)呈浸润性生长。GIST浸润性生长的形态学特点:当肿瘤边缘位于胃肠道肌层时,肿瘤组织呈舌状伸入肌层并包饶肌层细胞逐渐浸润;当肿瘤边缘位于胃肠道黏膜层、肝脏组织、淋巴结时,肿瘤组织呈侵袭性浸润生长;肿瘤呈浸润性生长局部MVD明显高于肿瘤实质中的MVD。
淋巴结转移灶肿瘤边缘界限不清(图1),CD117免疫组化染色阳性(图2)。淋巴结转移性GIST中男性6例,女性3例;6例原发于胃,3例原发于小肠;2例原发于胃者肿瘤直径<5 cm,7例肿瘤直径≥5 cm。组织学类型:7例呈梭形细胞型,1例为上皮样细胞型,1例为混合细胞型。危险度分级:8例为高度危险,1例呈中度危险。淋巴结转移性GIST的Ki-67增殖指数、核分裂象、MVD均一致偏高,且明显高于非淋巴结转移性GIST(P<0.05);9例淋巴结转移性GIST显微镜下均呈浸润性生长(表1)。
2.2转移性GIST与风险度评价根据2008年美国国立卫生研究院(NIH)关于GIST风险度评价,本组转移性GIST患者中,32例为高度风险,9例为中度风险,3例为低度风险,1例为极低风险。8例(8/9)淋巴结转移、7例(7/11)肝脏转移病例和17例(17/25)腹腔转移病例属于高度风险。转移性GIST中,1例淋巴结转移和1例肝脏转移肿块最大径为1 cm(<2 cm),其余44例转移性间质瘤肿瘤最大径均>2 cm,其中有39例(87%)患者的肿瘤最大径≥5 cm。
2.3转移性GIST的MVD转移性GIST的MVD明显高于非转移性GIST(图3、4),两者差异有统计学意义(P<0.05)。其中发生于淋巴结转移性GIST的MVD(实质)为每平方毫米511.11±72.20 个,发生于肝脏的转移性GIST的MVD(实质)为每平方毫米(345.00±52.50 个,淋巴结转移性GIST的MVD高于肝脏转移性GIST的MVD,差异有统计学意义(P=0.041)。在肿瘤边缘发生浸润性生长区域观察微血管分布发现:这些区域的MVD很高,平均每平方毫米633.78±125.64个,且血管排列紊乱扭曲(图5、6)。
2.4转移性GIST的LMVD所有转移性GIST及非转移性GIST的肿瘤实质中均无淋巴管分布。转移性GIST的边缘区LMVD为每平方毫米13.28±2.40个,非转移性GIST边缘区的LMVD为每平方毫米12.21±1.83个;转移性GIST肿瘤周围正常组织的LMVD为每平方毫米25.36±6.71个,非转移性GIST肿瘤周围正常组织LMVD为每平方毫米24.23±8.64个。经统计学分析,差异均无统计学意义(P<0.05)。

①②③④⑤⑥
图1淋巴结转移灶,肿瘤边界不清图2CD117呈阳性,EnVision法图3转移性GIST的微血管分布,EnVision法图4非转移性GIST的微血管分布,EnVision法图5转移性GIST浸润性生长区域图6CD31标记的MVD,EnVision法
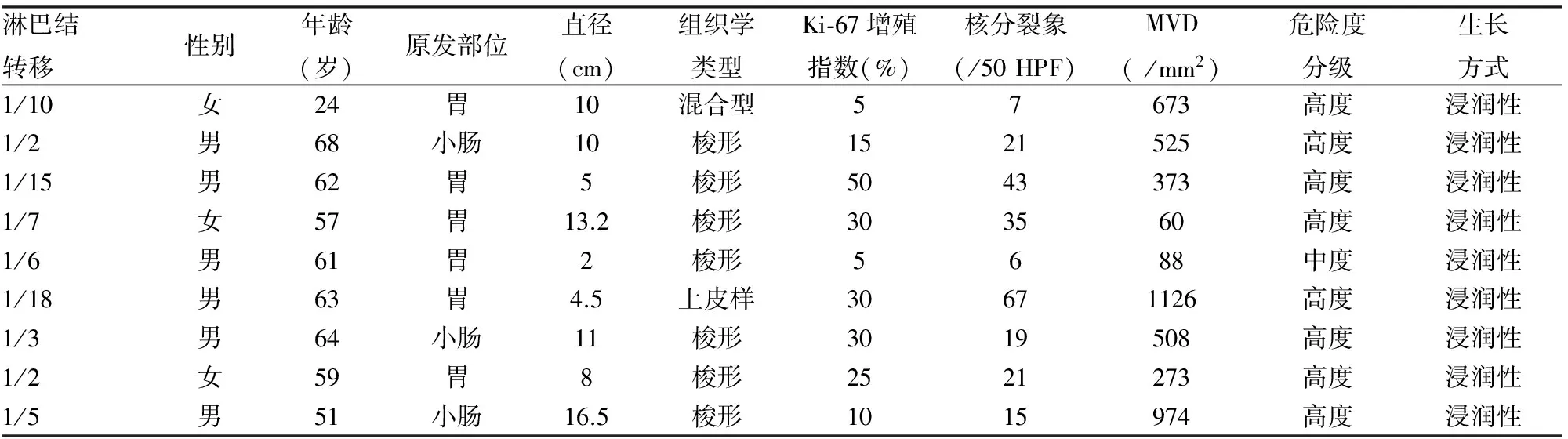
表1 淋巴结转移性GIST临床病理特征(n=9)

表2 文献报道淋巴结转移性GIST的临床病理特征
NG:结果未知;LN:淋巴结
3 讨论
本文在基于现有实验结果的基础上结合目前对于GIST淋巴结转移的个案报道(表2)探讨伴淋巴结转移GIST的临床特点。GIST属于最常见且最具恶性潜能的胃肠道间叶源性肿瘤,占胃肿瘤的1%~3%[20],文献报道20%~25%胃原发GIST、40%~50%肠原发GIST为恶性,表现为局部复发、腹腔转移及肝脏转移,淋巴结转移较罕见[21]。目前,文献报道20例GIST有淋巴结转移,均为个案报道。2006~2016年NCCN指南中关于GIST淋巴结转移的处理意见:由于GIST发生淋巴结转移者少见,所以外科手术不要求做淋巴结清扫。2016年NCCN(2版)指南中关于GIST淋巴结转移处理更改为“对于SDH缺乏的GIST患者,需考虑切除病理性肿大的淋巴结”,随着文献报道GIST淋巴结转移病例的增多,人们对GIST淋巴结转移问题重新给予较多的关注,GIST手术后是否行淋巴结清扫再次成为大家关注的焦点。
本组825例GIST患者中,45例发生转移,淋巴结转移者9例(1%),且发生淋巴结转移者几乎均为肿瘤体积大、风险度高、核分裂象及Ki-67增殖指数高的患者,提示上述指标对GIST生物学行为预测的有效性。但有1例直径为2 cm的胃原发GIST也发生周围淋巴结的转移,这提示在临床工作中肿瘤大小仅具有参考价值,如活检提示组织有限时或形态学难以定论时或冷冻需要确定手术范围时,肿瘤大者可能偏向恶性,肿瘤小者可能偏向良性[22]。目前,对于淋巴结转移的GIST术前尚无可预测的临床指标,但本组伴有淋巴结转移的病例均表现为浸润性生长。因此,对于显微镜下呈浸润性生长的病例,应建议临床密切随诊,同时浸润性生长是否可以作为评价GIST生物学行为的新指标有待于进一步大宗病例分析。
肿瘤的转移是多步骤、多环节过程,包括肿瘤细胞自发性脱落、浸润周围组织进入循环系统,在远隔部位突破毛细血管形成转移灶,其中新生血管的生成是肿瘤侵袭转移的重要环节[23]。癌主要经淋巴道转移,肉瘤常常血道转移,文献对此现象缺少系统研究。本实验发现GIST肿瘤实质内无淋巴管,且呈膨胀性生长的肿瘤边缘区淋巴管也由于受压而萎缩、塌陷呈闭塞状,有研究认为此类淋巴管属于无功能状态的淋巴管[5],这可能是GIST罕见淋巴结转移的原因。对于伴有淋巴结转移的GIST,肿瘤边缘常常界限不清呈浸润性生长且局部MVD高于肿瘤实质及非浸润性生长区域,肿瘤边缘可见扩张的淋巴管,这可能是其发生淋巴结转移的原因。
[1] Kang K Y, Lee W. Gastrointestinal stro mal tumor with extensive lymphatic metastasis: a case report[J]. J Gastric Cancer, 2013,13(3):192-195.
[2] Zhang Q, Yu J W, Yang W L,etal. Gastrointestinal stromal tumor of stomach with inguinal lymph nodes metastasis: a case report[J]. World J Gastroenterol, 2010,16(14):1808-1810.
[3] 汪 明,曹 晖. NCCN《软组织肉瘤临床实践指南》胃肠间质瘤部分更新介绍与解读[J]. 中国实用外科杂志, 2016,36(9):958-960.
[4] Yamada E, Oyaizu T, Miyashita T. A case of gastrointestinal stromal tumor of the stomach with lymph node metastasis followed up for 7 years without evidence of recurrence after surgery[J]. Nihon Shokakibyo Gakkai Zasshi. 2010,107(5):743-749.
[5] 曹 方,王 阔,朱 荣,等. 胃癌中D2-40和CD34的表达及临床意义[J]. 临床肿瘤学杂志, 2013,18(1):20-24.
[6] Norhisham N F, Chong C Y, Safuan S. Peritumoral lymphatic vessel density and invasion detected with immunohistochemical marker D240 is strongly associated with distant metastasis in breast carcinoma[J]. BMC Clin Pathol, 2017,17(1):2.
[7] Sato T, Kanda T, Nishikura K,etal. Two cases of gastrointestinal stromal tumor of the stomach with lymph node metastasis[J]. Hepatogastroenterology, 2007,54(76):1057-1060.
[8] El Demellawy D, Shokry P, Ing A, Khalifa M. Polypoid gastrointestinal stromal tumor of small bowel metastasizing to mesenteric lymph nodes: a case report[J]. Pathol Res Pract, 2008,204(3):197-201.
[9] Hu X, Forster J, Damjanov I. Primary malignant gastrointestinal stromal tumor of the liver[J]. Arch Pathol Lab Med, 2003,127(12):1606-1608.
[10] Canda A E, Ozsoy Y, Nalbant O A, Sagol O. Gastrointestinal stromal tumor of the stomach with lymph node metastasis[J]. World J Surg Oncol, 2008,6(5):1-5.
[11] 王艳丽,许林杰,孔 梅,滕晓东. 小肠的恶性胃肠道间质瘤伴淋巴结转移病理分析[J]. 中华病理学杂志, 2009,38(9):617-620.
[12] Catani M, De Milito R, Simi M. New orientations in the management of advanced, metastatic gastrointestinal stromal tumors (GIST): combination of surgery and systemic therapy with imatinib in a case of primary gastric location[J]. Chir Ital, 2005,57(1):127-133.
[13] Shafizad A, Mohammadianpanah M, Nasrolahi H,etal. Lymph node metastasis in gastrointestinal stromal tumor (GIST): to report a case[J]. Iran J Cancer Prev, 2014,7(3):171-174.
[14] Vassos N, Agaimy A, Hohenberger W, CronerR S. Extraabdominal lymph node metastasis in gastrointestinal stromal tumors (GIST) [J]. J Gastrointest Surg, 2011,15(7):1232-1236.
[15] Sakurai N, Yamauchi J, Shibuma H,etal. A case of recurrent GIST of the esophagus which completely responded to imatinib mesilate[J]. Gan To Kagaku Ryoho, 2007,34(2):237-240.
[16] Asakage N, Kobayashi S, Gotou T,etal. Two cases of gastrointestinal stromal tumor (GIST) of the stomach and a consideration of its malignancy potential and treatment strategy-report of two cases[J]. Gan To Kagaku Ryoho, 2007,34(6):919-923.
[17] Tashiro T, Hasegawa T, Omatsu M,etal. Gastrointestinal stromal tumour of the stomach showing lymph node metastases[J]. Histopathology, 2005,47(4):438-439.
[18] Ma C, Hao S L, Liu X C,etal. Supraclavicular lymph node metastases from malignant gastrointestinal stromal tumor of the jejunum: a case report with review of the literature[J]. World J Gastroenterol, 2017,23(10):1920-1924.
[19] Kubo N, Takeuchi N. Gastrointestinal stromal tumor of the stomach with axillary lymph node metastasis: a case report[J]. World J Gastroenterol, 2017,23(9):1720-1724.
[20] 邱 静,杨顺清,梁晓东,戴小丽. 胃间质瘤及神经鞘瘤的临床病理特征及鉴别诊断分析[J]. 临床与实验病理学杂志, 2014,30(8):911-914.
[21] Miettinen M, Lasota J. Gastrointestinal stmmal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis[J]. Arch Pathol Lab Med, 2006,130(10):1466-1478.
[22] 刘亚岚,徐 晨,侯英勇,卢韶华. 交界性胃肠道间质瘤279例临床病理学分析[J]. 临床与实验病理学杂志, 2011,27(6):574-579.
[23] 吴 伙,杨文奇. 胃肠道间质瘤中MMP3、VEGF的表达及临床意义[J]. 临床与实验病理学杂志, 2014,30(1):85-87.
Clinicopathologicfeaturesofmetastaticgastrointestinalstromaltumors
WANG Yuan, MENG Gang
(DepartmentofPathology,theSchoolofBasicMedicalCollege,AnhuiMedicalUniversity,Hefei230032,China)
PurposeTo explore the clinicopathologic features of metastatic gastrointestinal stromal tumors (GIST) and the mechanism of lymph node metastasis.Methods45 cases of surgical specimens with metastasis were selected as the research object and 50 cases of primary tumors in the same period were compared. All materials were stained with immunohistochemical method that marked Ki-67, CD31, D2-40, and then micro vessel density (MVD) and lymphatic microvessel density (LMVD) in each group were calculated.ResultsThe total metastatic rate was 5.45%, the blood metastatic rate was 1.33% and the lymph node metastatic rate was 1.09%. MVD of metastatic GIST was 398.39±68.20/mm2and MVD of non-metastatic GIST was 192.07±56.85/mm2, and the difference between them was statistically significant. There was no lymphatic vessels distribution in the essence of GIST regardless of metastasis. About metastatic GIST, LMVD of the edge area of the essence was 13.28±2.40 /mm2and LMVD of normal tissue around the essence was 25.36±6.71/mm2. In regard to non-metastatic GIST, LMVD of the edge area of the essence was 12.21±1.83/mm2and LMVD of normal tissue around the essence was 24.23±8.64/mm2. No statistically significant existed between LMVD of the edge area of the essence and LMVD of normal tissue around the essence. All of the 9 cases of lymph node metastatic GIST and 12 from 86 cases of non-metastatic GIST showed invasive growth.ConclusionMVD of metastatic GIST is higher than that of non-metastatic GIST. There is no lymphatic vessel within the essence of GIST. The invasive growth way may be the cause of the lymph node metastasis.
gastrointestinal neoplasm; gastrointestinal stromal tumors; lymph node metastasis; pathology
时间:2017-9-18 6:23 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170918.0623.009.html
R 735
A
1001-7399(2017)09-0982-05
10.13315/j.cnki.cjcep.2017.09.009
接受日期:2017-07-11
安徽医科大学基础医学院病理学教研室,合肥 230032
王 源,女,硕士,医师。E-mail: 1151285373@qq.com
孟 刚,男,博士,教授,通讯作者。E-mail: menggangbl@163.com
