食管鳞状细胞癌中Beclin1、LC3和 mTOR的表达及其临床意义
2017-11-20舒向芳温菲菲李扬扬刘梦瑶吴淑华1
舒向芳,温菲菲,李扬扬,何 双,刘梦瑶,吴淑华1,
食管鳞状细胞癌中Beclin1、LC3和 mTOR的表达及其临床意义
舒向芳1,2,温菲菲3,李扬扬3,何 双3,刘梦瑶3,吴淑华1,3
目的探讨Beclin1、LC3和mTOR在食管鳞状细胞癌中的表达,并分析其临床意义。方法采用免疫组化EnVision法检测食管30例正常黏膜、32例低级别上皮内瘤变、34例高级别上皮内瘤变、35例早期癌及126例进展期癌中Beclin1、LC3和mTOR的表达,并分析其相关性及其与临床病理特征的关系。结果Beclin1在进展期癌组中的表达高于其他四组(P<0.005)。LC3在食管进展期癌组的表达高于正常黏膜组、低级别上皮内瘤变及早期癌组(P<0.005)。mTOR在进展期癌组中的表达高于正常黏膜组、低级别上皮内瘤变及高级别上皮内瘤变组(P<0.005)。Beclin1、LC3、mTOR表达与肿瘤TNM分期、淋巴结转移具有显著相关性(P<0.05)。Beclin1与LC3、Beclin1与mTOR在食管进展期癌中的表达均呈正相关(P<0.05),mTOR与LC3在高级别上皮内瘤变组及进展期癌中的表达呈正相关(P<0.05)。结论在食管癌的发生、发展中,Beclin1作为抑癌基因激活自噬,导致肿瘤细胞过度自我消耗死亡;mTOR通过抑制自噬及促进血管生成,促进肿瘤生长。联合检测Beclin1、LC3和mTOR在食管癌中的表达,有助于评估进展程度和预后判断。
食管肿瘤;鳞状细胞癌;Beclin1;LC3;mTOR
食管癌是消化系统常见的恶性肿瘤[1-2],对人类健康危害较大,5年生存率较低[3]。目前专家认为绝大多数食管鳞状细胞癌来自于上皮内瘤变,即正常上皮→低级别上皮内瘤变→高级别上皮内瘤变→早期癌→进展期癌,其中由低级别和高级别上皮内瘤变演变为浸润癌相对危险度分别为9.8和28.3[4]。近年自噬与肿瘤发生的相关性倍受关注,研究显示自噬在多种肿瘤的发生、发展中发挥重要作用[5-8]。目前,有关食管癌与自噬的相关性分析鲜有报道。本实验采用免疫组化EnVision法在食管鳞状细胞癌变过程中同步检测自噬关键因子Beclin1、mTOR及LC3的表达,探讨自噬及其调控因子Beclin1与mTOR在食管癌变过程中的作用,为进一步分析食管癌的发生、发展机制和治疗提供新思路。
1 材料与方法
1.1临床资料收集2009年1月~2011年12月滨州医学院附属医院病理科胃镜、手术切除的低级别上皮内瘤变32例、高级别上皮内瘤变34例、食管早期癌35例、食管进展期鳞状细胞癌126例;另收集正常食管黏膜(距肿瘤旁≥5 cm)30例。根据WHO(2010)消化系统肿瘤分类标准[9]进行,所有切片均由两位资深病理专家重新阅片分类,病例均为首次发现,术前均未行放、化疗。
1.2试剂兔抗人Beclin1(ab55878)、LC3(ab48394)及mTOR(ab2732)抗体,均购自Abcam公司;通用型二抗及DAB显色液,购自北京中杉金桥公司。
1.3方法采用免疫组化EnVision法染色,将切片脱蜡、水化,3%H2O2孵育30 min,高压热修复抗原,一抗Beclin1(1 ∶200)、LC3(1 ∶50)、mTOR(1 ∶200)4 ℃过夜,二抗37 ℃孵育30 min,DAB显色,苏木精复染,1%盐酸乙醇分化,脱水,透明,封固。用绒毛膜癌、正常脑组织和肾组织做阳性对照,PBS代替一抗作阴性对照。
1.4结果判断Beclin1阳性表达主要位于肿瘤细胞的胞膜和胞质,LC3和mTOR阳性表达主要位于肿瘤细胞的胞质中。病理医师采用双盲法在每张切片上随机观察10个高倍视野(400倍)。每个视野计数100个肿瘤细胞,根据细胞染色强度和阳性细胞百分比判断。按细胞染色强度计分:无阳性着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;按阳性细胞百分比计分:≤5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,76%~100%为4分;最后将两者得分相乘,≤4分为阴性,>4分为阳性。
1.5统计学分析采用SPSS 20.0软件进行统计学分析,不同病变组间蛋白的表达差异采用χ2检验,经P值修正,P<0.005为各组间差异有统计学意义。各蛋白表达与临床病理特征的关系及不同病变组各蛋白之间表达的相关性采用χ2检验,并采用Spearman相关性分析,P<0.05为差异有统计学意义。
2 结果
2.1Beclin1、LC3和mTOR在食管癌变过程中的表达在正常食管黏膜、低级别上皮内瘤变组、高级别上皮内瘤变组及癌变组中Beclin1、LC3和mTOR呈不同程度表达(图1~3),经多组二分类资料两两χ2检验比较,自噬相关基因Beclin1在食管进展期癌组中的表达高于正常黏膜组、低级别上皮内瘤变组、高级别上皮内瘤变组及早期癌组,差异有统计学意义(P<0.005);Beclin1在正常黏膜组、低级别内瘤变组、高级别上皮内瘤变组及早期癌组中表达,两两比较其差异无统计学意义(P>0.005)。LC3在食管进展期癌组中的表达高于正常黏膜组、低级别上皮内瘤变组及早期癌组,差异均具有统计学意义(P<0.005);LC3在正常黏膜组、低级别、高级别内瘤变组及早期癌组中表达,差异无统计学意义(P>0.005)。mTOR在进展期癌组中的表达高于正常黏膜组、低级别、高级别上皮内瘤变组,差异有统计学意义(P<0.005);在进展期癌组与早期癌组中的表达,差异无统计学意义(P>0.005);mTOR在正常黏膜组、低级别内瘤变组及高级别上皮内瘤变组,两两比较其表达差异无统计学意义(P>0.005,表1)。
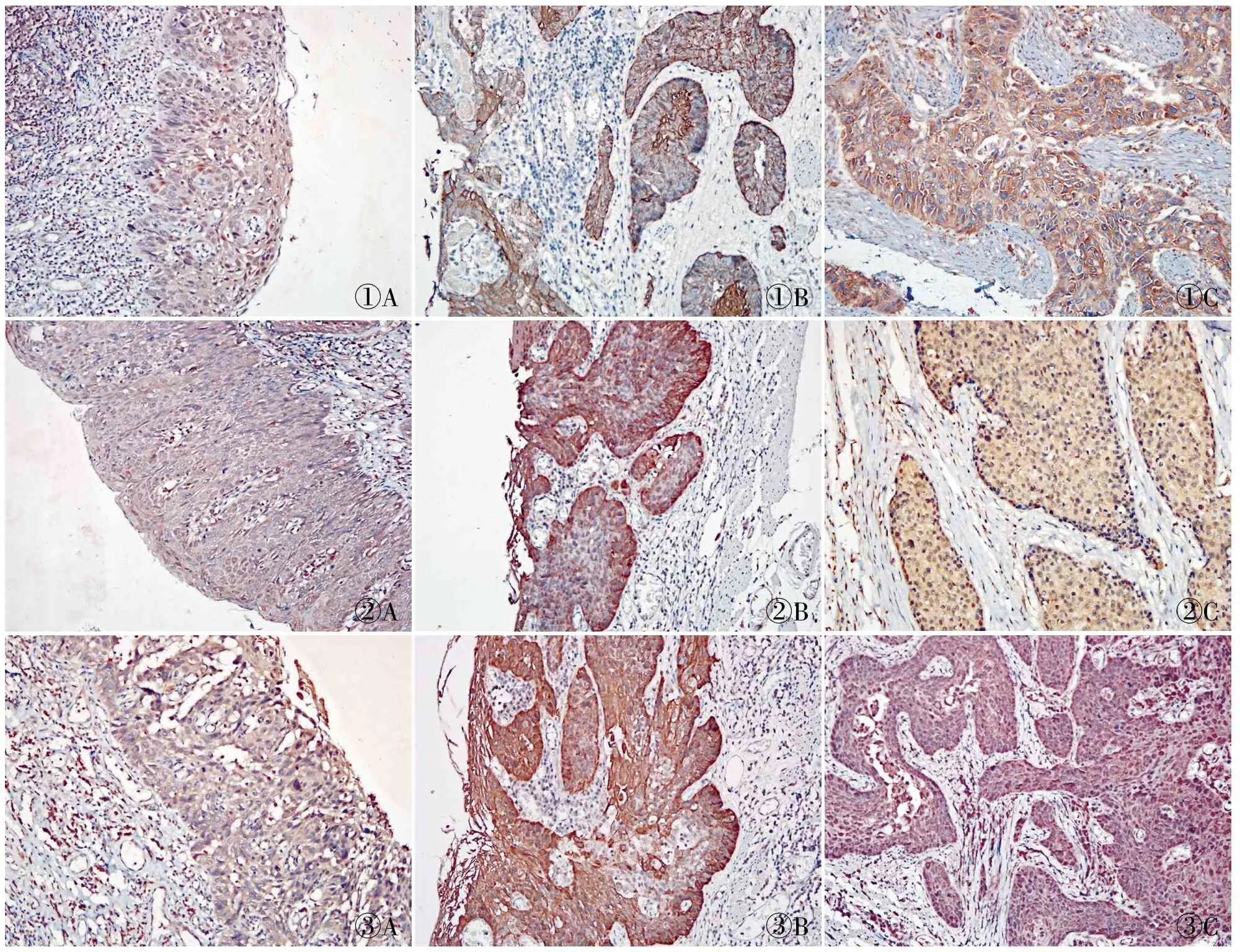
①A①B①C②A②B②C③A③B③C
图1A.Beclin1在高级别上皮内瘤变呈阳性,EnVision法;B.Beclin1在早期癌中呈阳性,EnVision法;C.Beclin1在食管癌细胞质及胞膜中呈强阳性,EnVision法图2A.LC3在高级别上皮内瘤变中呈阳性,EnVision法;B.LC3在早期癌中呈阳性,EnVision法;C.LC3在食管癌细胞质中呈强阳性,EnVision法图3A.mTOR在高级别上皮内瘤变中呈阳性,EnVision法;B.mTOR在早期癌中呈阳性,EnVision法;C.mTOR在食管癌细胞质中呈强阳性,EnVision法
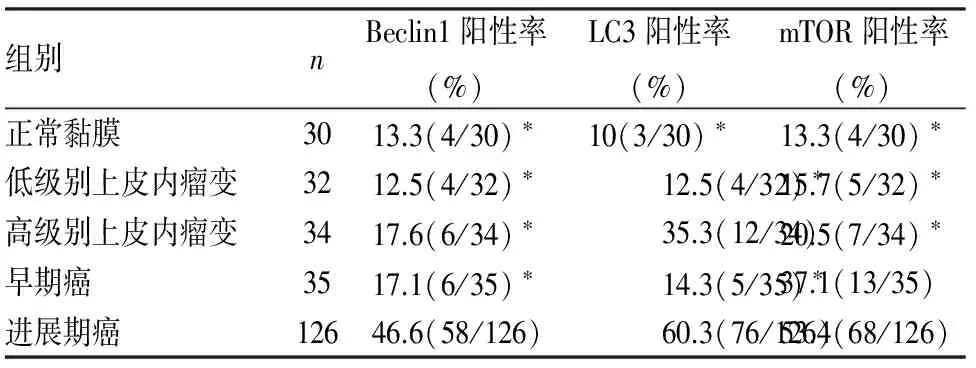
表1 Beclin1、LC3和mTOR在食管不同病变组织中的阳性率
与进展期癌比较,*P<0.005
2.2Beclin1、LC3和mTOR表达与食管癌临床病理特征的关系Beclin1、LC3、mTOR在食管癌中的表达与肿瘤TNM分期具有相关性,其中TNM分期低的肿瘤中,Beclin1、LC3、mTOR呈高表达,差异有统计学意义(P<0.05)。Beclin1、LC3和mTOR与肿瘤是否有淋巴结转移有相关性,在有淋巴结转移的食管癌中,其呈高表达,差异有统计学意义(P<0.05)。Beclin1、LC3和mTOR表达与患者年龄、性别、大小、分化程度等临床病理特征无相关性(P>0.05,表2)。
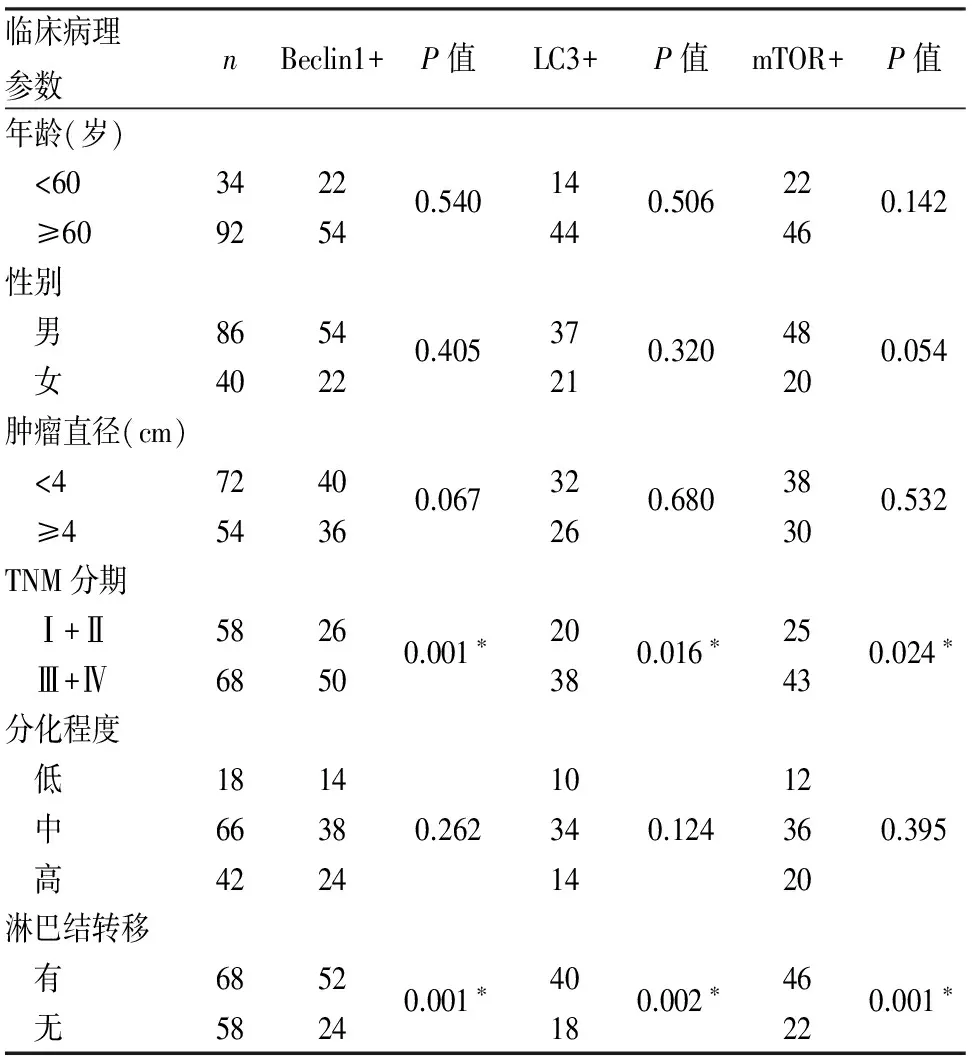
表2 Beclin1、LC3 和mTOR表达与进展期食管癌临床病理特征的关系
*P<0.05
2.3Beclin1、mTOR和LC3在食管癌中表达的相关性Beclin1与LC3在食管进展期癌中的表达呈正相关(r=0.282,P<0.05),在低级别、高级别上皮内瘤变及早期癌组中无明显相关性(P>0.05)。mTOR与LC3在食管高级别上皮内瘤变及进展期癌中的表达呈正相关(r=0.321,P<0.05;r=0.268,P<0.05);在低级别上皮内瘤变及早期癌组中无明显相关性(P>0.05)。Beclin1、mTOR在食管进展期癌中的表达呈正相关(r=0.222,P<0.05),在低级别、高级别上皮内瘤变及早期癌组中无明显相关性(P>0.05,表3)。
表3LC3、Beclin1、mTOR在食管不同病变组织中表达的相关性
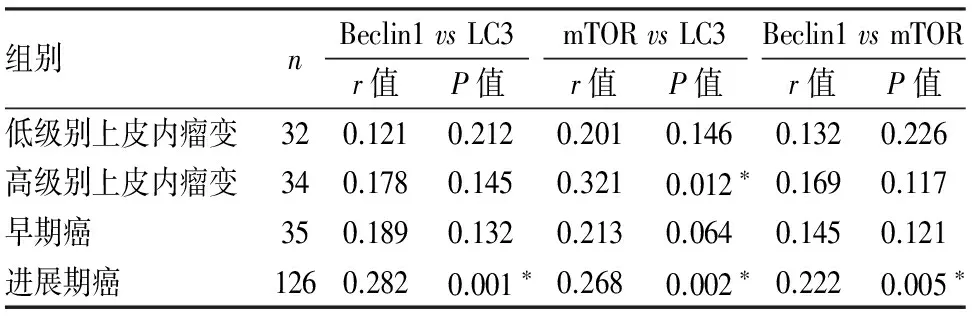
组别nBeclin1vsLC3r值P值mTORvsLC3r值P值Beclin1vsmTORr值P值低级别上皮内瘤变320.1210.2120.2010.1460.1320.226高级别上皮内瘤变340.1780.1450.3210.012∗0.1690.117早期癌350.1890.1320.2130.0640.1450.121进展期癌1260.2820.001∗0.2680.002∗0.2220.005∗
*P<0.05
3 讨论
自噬也被称为Ⅱ型程序性细胞死亡[10],是细胞质中出现双层膜结构包裹变性蛋白和受损细胞器的自噬体,其活性异常与肿瘤的发生、发展密切相关。肿瘤细胞发生自噬后出现两种不同结果:(1)保护性自噬,能稳定细胞内环境使肿瘤细胞耐受缺氧环境,维持细胞存活[11];(2)过度的自噬,能诱导细胞的自噬性细胞死亡,抑制细胞增殖,杀伤肿瘤细胞[12]。目前,自噬已成为探讨肿瘤发生和抑制肿瘤生长、克服肿瘤放、化疗抵抗性研究的热点。LC3是自噬发生过程的关键蛋白,定位于前自噬泡和自噬泡膜表面,被认为是自噬活动的特异性标志[13]。Beclin1与mTOR是调控自噬发生的2个非常重要的因子[14-15]。Beclin1是第一个被鉴定的自噬基因,是自噬过程中的必要调节分子,它参与肿瘤的发生、发展[16]。mTOR是自噬诱导阶段的关键分子,在自噬活性的负向调控中发挥重要作用,是多条信号通路的作用靶点,在调节细胞生长、 自噬等方面具有重要作用,多种因子(如IGF-1、PI3K、AMPK等)可通过激活mTOR抑制细胞自噬[17]。何双等[18]发现自噬及其调控因子LC3、Beclin1、mTOR在结直肠腺瘤恶性转化中发挥重要作用,与腺瘤癌变进展密切相关。目前,自噬在食管癌变过程中的作用尚不清楚。
众所周知,食管黏膜异型增生是食管癌的癌前病变,早在2000年上皮内瘤变的概念就被引入到消化系统肿瘤中,其被定义为上皮浸润前的肿瘤性改变,分为低级别上皮内瘤变和高级别上皮内瘤变,高级别上皮内瘤变继续进展则为早期癌、进展期癌[4]。本实验发现,自噬相关基因LC3在食管进展期癌组中的表达高于正常黏膜组、低级别上皮内瘤变组、早期癌组,进展期癌组的表达明显高于高级别上皮内瘤变组,而进展期癌组中LC3蛋白的表达与高级别内瘤变组无明显差异,提示在食管进展期癌组、高级别上皮内瘤变组自噬水平升高;Beclin1在食管进展期癌组中的表达高于正常黏膜组、低级别上皮内瘤变组、高级别上皮内瘤变组及早期癌组;mTOR在进展期癌组中的表达高于正常黏膜组、低级别上皮内瘤变组、高级别上皮内瘤变组,进展期癌组明显与早期癌组的表达无明显差异。作者认为在食管高级别上皮内瘤变中,食管鳞状上皮内血管较少,不能满足细胞高级别上皮内瘤变所需的营养,自噬水平的升高可以缓解食管上皮内瘤变中的缺血、缺氧,维持细胞的生长。随着病变的发展,一旦突破基膜发展为早期癌,mTOR表达增加,抑制自噬,同时上调VEGF的表达,促进血管的生成;并且在食管黏膜下层,血运丰富,无需自噬为细胞提供营养,自噬水平较低,肿瘤生长迅速。在进展期食管癌中,Beclin1表达显著增加,自噬水平被持续激活,肿瘤细胞因过度自我消耗死亡,肿瘤出现坏死。此时,自噬作为程序性死亡方式之一,杀伤肿瘤细胞,在一定程度上抑制肿瘤发展。同时,mTOR表达持续升高,促进肿瘤的生长。因此,在食管癌的发生、发展中,Beclin1作为抑癌基因激活自噬,导致肿瘤细胞过度自我消耗死亡;而mTOR通过抑制自噬及促进血管生成,促进肿瘤生长。针对Beclin1与mTOR在食管癌变过程中的不同功能,探索新的肿瘤标志物或靶点阻断剂,可为早期预测肿瘤及研发肿瘤个性化治疗提供新思路。
吴淑华等[19]发现多种肿瘤的分化程度、转移等临床病理特征与细胞自噬活性的改变有关。Won等[20]发现Beclin1表达与胃癌组织学分级、肿瘤大小、TNM分期、淋巴结转移等临床病理特征呈负相关,Belin1高表达更有利于胃癌的预后。Wu等[21]也发现LC3蛋白在中+低分化结直肠癌组织中的表达明显高于高分化结直肠癌组,在伴淋巴结转移结直肠癌组织中的表达高于无淋巴结转移组,并且与多药耐药蛋白表达及预后相关。本实验在与食管进展期癌临床病理特征的相关性分析中发现,Beclin1、LC3、mTOR在TNM分期高、淋巴结转移的食管进展期癌组中呈高表达,但与患者年龄、性别、肿瘤分化程度等均无相关。提示Beclin1、LC3、mTOR不仅参与食管癌的发生、发展,还参与肿瘤的转移,且与肿瘤的分期密切相关。
Beclin1与mTOR分别作为细胞自噬正向和负向调节因子,目前多数文献报道局限于针对mTOR或Beclin1中的某一分子,尚缺乏两者在食管癌发生、发展中的相关性报道。作为自噬的重要调控分子,同步分析mTOR、Beclin1两类不同的作用分子,对于进一步揭示食管癌与自噬的相关性及其意义具有重要价值。本实验分析了自噬相关分子LC3、Beclin1、mTOR在食管癌变过程中的表达及相关性,发现Beclin1和mTOR在食管进展期癌中的表达呈正相关,并且均与LC3呈正相关。作者认为在肿瘤的发生、发展中,mTOR、Beclin1可能通过不同的信号通路各自发挥其自噬调控作用。Beclin1基因通过结合Ⅲ型PI3K与VPS15,促进自噬的发生,而mTOR受其上游的Ⅰ型PI3K信号转导通路的调控,抑制自噬活性。在食管进展期癌中,Beclin1过表达促进自噬的发生,mTOR被激活,抑制自噬活性,并且Beclin1过表达产生的自噬促进作用远大于mTOR过表达产生的自噬抑制作用。因此,在食管鳞状细胞癌中,自噬活性标志分子LC3的蛋白表达水平明显增高,即食管鳞状细胞癌的自噬活性增高。
综上所述,自噬相关基因Beclin1、LC3和mTOR在食管癌的发生、发展中起重要作用。自噬是一把双刃剑,既可以是肿瘤的生存性自噬,又能诱发肿瘤的自噬性细胞死亡。本实验结果提示,自噬在食管癌变早期促进肿瘤的发生与恶化,而在肿瘤的进展期持续活化的自噬则可能诱导自噬性细胞死亡,杀伤肿瘤细胞。进一步探讨自噬在食管癌变过程中的分子机制,有助于揭示肿瘤发生、发展的规律,并指导肿瘤的临床诊治。联合检测自噬相关基因Beclin1、LC3与mTOR在食管癌中的表达,有助于评估疾病的进展和预后判断及合理选择个性化治疗方案。
[1] Li Z H, Zheng R, Chen J T,etal. The role of copper transporter ATP7A in platinum-resistance of esophageal squamous cell cancer (ESCC)[J]. J Cancer, 2016,7(14):2085-2092.
[2] Yang C S, Chen X, Tu S. Etiology and prevention of esophageal cancer[J]. Gastrointest Tumors, 2016,3(1):3-16.
[3] Napier K J, Scheerer M, Misra S. Esophageal cancer: a review of epidemiology, pathogenesis, staging workup and treatment modalities[J]. World Gastrointest Oncol, 2014,6:112-120.
[4] Wang G Q, Abnet C C, Shen Q,etal. Histological precursors of oesophageal squamous cell carcinoma: results from a 13 year prospective follow up study in a high risk population[J]. Gut, 2005,54(2):187-192.
[5] Wang S F, Wu M Y, Cai C Z,etal. Autophagy modulators from traditional Chinese medicine: mechanisms and therapeutic potentials for cancer and neurodegenerative diseases[J]. Ethnopharmacol, 2016,194:861-876.
[6] Aveic S, Tonini G P. Resistance to receptor tyrosine kinase inhibitors in solid tumors: can we improve the cancer fighting strategy by blocking autophagy?[J]. Cancer Cell Int, 2016,2(16):62.
[7] Singh P, Ravanan P, Talwar P. Death associated protein kinase 1 (DAPK1): a regulator of apoptosis and autophagy[J]. Front Mol Neurosci, 2016,9:46.
[8] Zambrano J, Yeh E S. Autophagy and apoptotic crosstalk: mechanism of therapeutic resistance in HER2-positive breast cancer[J]. Breast Cancer (Auckl), 2016,10:13-23.
[9] 周晓军,樊祥山. 解读2010年消化系统肿瘤WHO分类(Ⅰ)[J]. 临床与实验病理学杂志, 2011,27(4):341-346.
[10] Notte A, Leclere L, Michiels C. Autophagy as a mediator of chemotherapy-induced cell deam in cancer[J]. Biochem Pharmacol, 2011,82:427-434.
[11] Wu X, Feng X, Zhao X,etal. Role of Beclin1-mediated autophagy in the Survival of pediatric leukemia cells[J]. Cell Physiol Biochem, 2016,39(5):1827-1836.
[12] Fukuda T, Oda K, Wada-Hiraike O,etal. Autophagy inhibition augments resveratrol-induced apoptosis in Ishikawa endometrial cancer cells[J]. Oncol Lett, 2016,12(4):2560-2566.
[13] Hao C L, Li Y, Cheng Y F,etal. High level of microtubule-associated protein light chain 3 predicts poor prognosis in resectable ESCC[J]. Int J Clin Exp Pathol, 2014,7(7):4213-4221.
[14] Al Dhaheri Y, Attoub S, Ramadan G,etal. Carnosol induces ROS-mediated Beclin1-independent autophagy and apoptosis in triple negative breast cancer[J]. PLoS One, 2014,9(10):e109630.
[15] Zhou Z W, Li X X, He Z X,etal. Induction of apoptosis and autophagy via sirtuin1- and PI3K/Akt/mTOR-mediated pathways by plumbagin in human prostate cancer cells[J]. Drug Des Devel Ther, 2015,9:1511-1554.
[16] Yue Z, Jin S, Yang C,etal. Beclin1, an autophagy gene essential for early embryonic development, is a haploinsufficient tumor suppressor[J]. Proc Natl Acad Sci USA, 2003,100(25):15077-15082.
[17] Luo L, Lu A M, Wang Y,etal. Chronic resistance training activates autophagy and reduces apoptosis of muscle cells by modulating IGF-1 and its receptors, Akt/mTOR and Akt/FOXO3a signaling in aged rats[J]. Exp Gerontol, 2013,48(4):427-436.
[18] 何 双,吴淑华,胡金龙,等. 自噬调控因子Beclin1及mTOR在大肠腺瘤癌变过程中的表达及意义[J]. 世界华人消化杂志, 2014,7:920-926.
[19] 吴淑华,胡金龙,何 双,等. 大肠癌中Beclin1、LC3和mTOR的表达及意义[J]. 临床与实验病理学杂志, 2014,30(12):1333-1338.
[20] Won K Y, Kim G Y, Lim S J,etal. Autophagy is related to the hedgehog signaling pathway in human gastric adenocarcinoma: prognostic significance of Beclin1 and Gli2 expression in human gastric adenocarcinoma[J]. Pathol Res Pract, 2015,211(4):308-315.
[21] Wu S, Sun C, Tian D,etal. Expression and clinical significances of Beclin1, LC3 and mTOR in colorectal cancer[J]. Int J Clin Exp Pathol, 2015,8(4):3882-3891.
Beclin1,LC3andmTORexpressioninesophagealsquamouscellcancerationanditsclinicalsignificance
SHU Xiang-fang1,2, WEN Fei-fei3, LI Yang-yang3, HE Shuang3, LIU Meng-yao3, WU Shu-hua1,3
(1DepartmentofPathology,BinzhouMedicalUniversity,Binzhou256603,China;2DepartmentofPathology,BoxingCountyPeople’sHospital,Boxing256500,China;3DepartmentofPathology,AffiliatedHospital,BinzhouMedicalUniversity,Binzhou256603,China)
PurposeTo investigate the difference of expression of autophagy-related gene (Beclin1, LC3, mTOR) in the development of esophageal squamous cell cancer.MethodsImmunohistochemical EnVision method was adopted to detect the expression of autophagy-related gene Beclinl, LC3 and mTOR in 30 cases of normal esophageal mucosa, 32 cases of low-grade intraepithelial neoplasia (LGIN), 34 cases of high-grade intraepithelial neoplasia (HGIN), 35 cases of early carcinoma and 126 cases of advanced esophageal carcinoma, respectively. The correlation between their expression with clinicopathologic factors was also analysed.ResultsThe expression of Beclin1 in advanced esophageal carcinoma was obviously higher than that in another four groups (P<0.005). LC3 expression in advanced esophageal carcinoma was significantly higher than that in normal esophageal mucosa, LGIN and early carcinoma (P<0.005). The expression of mTOR in advanced esophageal carcinoma was significantly higher than that in normal esophageal mucosa, LGIN and HGIN (P<0.005). In advanced esophageal carcinoma group, the expression of Beclin1, LC3 and mTOR was related to tumor TNM stage and lymph node metastasis (P<0.05). Beclin1 expression was positively associated with LC3 and mTOR expression in advanced squamous cell carcinoma (P<0.05). Positive correlation was also observed between the expression of mTOR and LC3 in advanced esophageal carcinoma and HGIN (P<0.05).ConclusionIn the carcinogenesis and development of esophageal cancer, Beclin1, as a tumor suppressor gene, activates autophagy and leads to excessive self consumption and death of tumor cells. mTOR promotes tumor growth by inhibiting autophagy and promoting angiogenesis. The combined detection of Beclinl, LC3 and mTOR may be beneficial to evaluate the progression and prognosis of esophageal squamous cell cancer.
esophageal neoplasm; squamous cell cancer; Beclin1; LC3; mTOR
R 735.1
A
1001-7399(2017)09-0972-06
10.13315/j.cnki.cjcep.2017.09.007
接受日期:2017-06-16
山东省科技发展计划(2010GSF10259)
1滨州医学院病理学教研室,滨州 256603
2山东省博兴县人民医院病理科,博兴 256500
3滨州医学院附属医院病理科,滨州 256603
舒向芳,女,硕士,主治医师。E-mail: 13561596548@163.com
吴淑华,女,教授,硕士生导师,通讯作者。E-mail: wsh6108@126.com
