EGFR-TKI联合放疗对晚期非小细胞肺癌EGFR-TKI治疗后新发骨转移的临床疗效
2017-11-17郭雷鸣郑州大学附属肿瘤医院放疗科河南郑州450008
郭雷鸣(郑州大学附属肿瘤医院放疗科,河南 郑州 450008)
EGFR-TKI联合放疗对晚期非小细胞肺癌EGFR-TKI治疗后新发骨转移的临床疗效
郭雷鸣
(郑州大学附属肿瘤医院放疗科,河南 郑州 450008)
目的探讨表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗有效的晚期非小细胞肺癌患者新发骨转移病灶(≤3个)经局部放疗联合EGFR-TKI治疗后的疗效和安全性。方法22例晚期非小细胞肺癌经EGFR-TKI治疗后新发骨转移(≤3个)患者,给予骨转移病灶局部放疗,并同时继续口服EGFR-TKI类药物,作为EGFR-TKI联合放疗组;23例晚期非小细胞肺癌经EGFR-TKI治疗后新发骨转移患者,给予常规化疗联合放疗为放疗组。所有患者均伴有19或21外显子突变。2组治疗均直至疾病进展或出现不可耐受不良反应。放疗部位包括新发骨转移或较前进展的骨转移病灶。结果EGFR-TKI联合放疗组有效率为72.73%,明显高于放疗组的39.13%(P<0.05)。EGFR-TKI联合放疗组的疾病无进展生存时间、总生存时间、1 a生存率及KPS评分均高于放疗组(P均<0.05)。2组患者的不良反应相似,且均无严重不良反应发生。结论EGFR-TKI类药物治疗有效的晚期非小细胞肺癌患者,新发骨转移或较前进展后继续口服EGFR-TKI类药物联合骨转移病灶放疗可能是安全有效的。
表皮生长因子受体酪氨酸激酶抑制剂;晚期非小细胞肺癌;骨转移;放疗
肺癌是全球最常见的恶性肿瘤之一,其中非小细胞肺癌约占85%[1-2]。Ⅳ期非小细胞肺癌患者骨转移发生率为30%~40%,一旦患者发生骨转移,5 a生存率<5%,中位总生存时间<10个月[3-4]。近年来,表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors, EGFR-TKI)在非小细胞肺癌治疗中取得巨大进展,其具有高选择性和低毒性的优势,已成为晚期非小细胞肺癌中EGFR突变患者的一线治疗方案[5-7]。EGFR-TKI类药物包括吉非替尼、厄洛替尼等。目前基础研究[8-9]证实,EGFR-TKI具有放射增敏性,EGFR-TKI与放疗联合成为晚期非小细胞肺癌极具前景的治疗模式。然而有研究[10]发现对于EGFR-TKI治疗有效的晚期非小胞癌患者,约40%出现孤立骨转移进展。那么对于这些患者是否能从EGFR-TKI治疗获益以及如何为这些患者制定有效的治疗方案,尚未探讨。本文旨在研究EGFR-TKI联合放疗对非小细胞肺癌骨转移患者的临床疗效与安全性。
1 资料与方法
1.1一般资料选取2013年1月至2017年1月于本院进行治疗且经病理确诊的非小细胞肺癌行EGFR-TKI治疗后出现新发骨转移或较前进展(≤3个)患者55例。EGFR-TKI联合放疗组定义为给予新发或进展骨转移病灶放疗同期联合EGFR-TKI,共22例,其中男8例,女14例;年龄(58.24±1.31)岁;病理类型:腺癌19例,其他3例;吸烟5例,未吸烟17例;KPS评分(73.21±4.64)分。放疗组定义为全身化疗联合进展骨转移病灶放疗,共23例,其中男10例,女13例;年龄(54.72±114)岁;病理类型:腺癌20例,其他3例;吸烟6例,未吸烟17例;KPS评分(74.14±5.41)分。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2治疗方法所有患者均给予放疗。放疗是采用医科达直线加速器进行外照射,对新发骨转移或较前进展病灶进行姑息性放疗,根据CT、骨扫描及MRI图像进行放疗靶区设计,GTV勾画基于CT、骨扫描及MRI图像,CTV在GTV基础上椎体部分上下各延长1个椎体,前后左右方向分别外扩1.5 cm;四肢、骨盆、肋骨部位三维方向在GTV基础上外放1.5 cm,放疗方案为30 Gy/10次或40 Gy/20次。放疗计划应用Pinnacle3TM放疗计划系统制定。EGFR-TKI联合放疗组在新发或进展的骨转移病灶放疗过程中以及放疗后让患者继续服用250 mg吉非替尼或150 mg厄洛替尼,每天1次,结束该治疗的时间为患者有不耐受的不良反应发生或疾病进展。放疗组全身化疗联合新发或进展的骨转移病灶局部放疗,化疗方案根据患者病理类型进行选择,化疗4~6周期。
1.3观察指标依据实体瘤疗效评价标准对2组患者的临床疗效及生存时间进行评定,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。以CR+PR计算总有效率。无进展生存时间:自骨转移进展确诊日期至肿瘤进展或死亡时间,此次随访时间为4 a。总生存时间定义为确诊骨转移进展日期至任何原因死亡或末次随访的时间。同时对2组患者的生活质量及不良反应进行观察记录,生活质量评价参考KPS评分。
2 结果
2.12组患者的临床疗效比较EGFR-TKI联合放疗组有效率为72.73%,明显高于放疗组的39.13%,差异有统计学意义(P<0.05)。见表1。
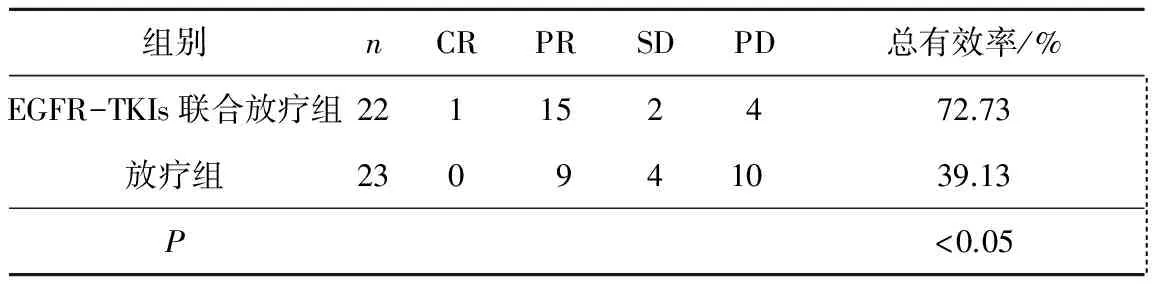
表1 2组患者的临床疗效比较 n(%)
2.22组患者生存情况比较EGFR-TKI联合放疗组的中位疾病无进展生存时间、总生存时间、1 a生存率及KPS评分分别为14.00(95%CI:11.57~16.43)个月、21.50(95%CI:16.46~26.54)个月、81.82%、(83.45±6.57)分,均高于放疗组的8.00(95%CI:5.55~10.45)个月、14(95%CI:9.74~18.26)个月、43.48%、(78.29±7.79)分,差异均有统计学意义(P均<0.05)。
2.32组患者不良反应比较2组患者的不良反应相似,且均无严重不良反应发生。见表2。
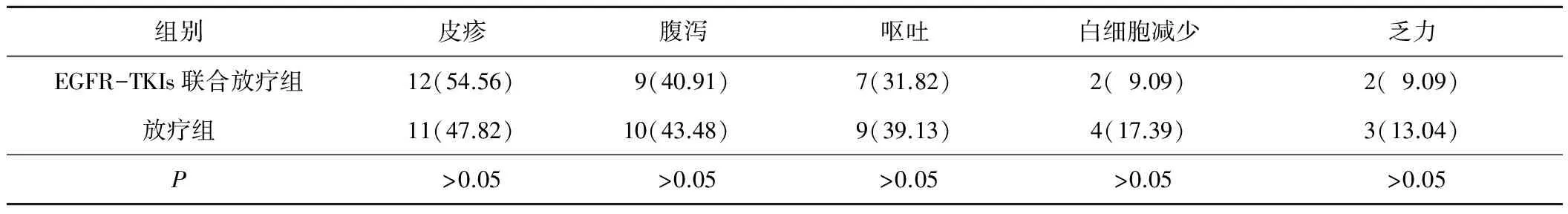
表2 2组患者不良反应比较
3 讨论
WHO统计显示,全球范围内,肺癌是发病率及病死率最高的恶性肿瘤,其中非小细胞肺癌约占全部肺癌的85%。有研究[11-14]指出超过90%的恶性肿瘤患者死于肿瘤转移,远处转移也是肺癌患者死亡的主要原因。骨转移在肺癌患者中十分常见,骨是血行转移的主要部位之一,大约30%~40%的肺癌患者会发生骨转移,这些患者中位总生存时间约为8~10个月[15],经过治疗后1 a生存率也仅为40%~50%[16]。
肺癌骨转移的部位常见于脊柱和躯干骨近端,脊柱骨约占50%,股骨约占20%,肋骨和胸骨约占12%。骨转移提示预后不良,这些患者容易发生骨相关事件,如骨骼疼痛、脊髓压迫、病理性骨折、高巧血症等并发症,肺癌骨转移患者若发生骨相关事件,将明显缩短患者的生存时间。肺癌骨转移通常表现为溶骨性破坏[17],临床上可以出现顽固性骨痛,当骨的强度减弱时会发生病理性骨折,椎体转移时还会造成局部凹陷或膨胀引起脊髓压迫,压迫神经导致功能障,严重影响患者的生活质量,并成为肺癌患者迅速死亡的重要因素。
随着新一代化疗药物及靶向治疗药物的问世,非小细胞肺癌骨转移患者拥有更多的治疗选择,EGFR-TKI通过完全阻断EGFR-TKI细胞内连接三磷酸腺苷的区域,阻止EGFR效应器的自体磷酸化,抑制其激活[18],从而对肿瘤细胞的增殖、生长、存活等多条信号传导通路起到阻断作用[19]。EGFR-TKI治疗有益于19或21外显子突变的非小细胞癌患者,然而研究发现,晚期非小细胞癌患者在EGFR-TKI治疗过程中往往易于发生孤立的骨转移病灶[10],在临床工作中亦常见类似现象。那么对于此类患者应该如何选择治疗方案,以及此类患者是否能从EGFR-TKI联合骨转移病灶放疗中获益,处于尚未研究阶段。
靶向治疗药物具有高效、低毒的特点,且肿瘤细胞的放射敏感性与EGFR的表达水平呈负相关,使放疗联合EGFR-TKI靶向治疗理论上成为可能,因此有可能会提高晚期患者的生存时间。近年来研究[20]证实EGFR-TKI联合放疗不但可以解决放疗后期肿瘤的放射抵抗以及EGFR-TKI继发耐药,还可以增加对肿瘤杀伤能力,同时不良反应较同步放化疗轻。在本研究中发现EGFR-TKI联合新发或进展骨转移病灶放疗能有效提高非小细胞肺癌骨转移患者的治疗有效率,相比化疗联合放疗治疗有效率从39.13%提高至72.73%。2组患者的生存情况比较也发现,EGFR-TKI联合放疗组的中位疾病无进展生存时间、总生存时间、1 a生存率及KPS评分分别为14.00(95%CI:11.57~16.43)个月、21.50(95%CI:16.46~26.54)个月、81.82%、(83.45±6.57)分,均高于放疗组的8.00(95%CI:5.55~10.45)个月、14(95%CI:9.74~18.26)个月、43.48%、(78.29±7.79)分。而2组患者的不良反应相似,且均无严重不良反应发生。以上可证实EGFR-TKI联合放疗治疗对晚期非小细胞肺癌骨转移治疗有益。基础研究[21]也证实EGFR-TKI放射增敏效应可能通过以下机制实现:引起细胞周期阻滞;诱导细胞凋亡;降低放射抗拒;抑制放射损伤的再修复等多种途径。因此,EGFR-TKI联合放疗成为晚期非小细胞肺癌极具前景的治疗模式。
[1] FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al.Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J].Int J Cancer, 2015, 136(5): E359-E386.
[2] Shi Y, Au JS, Thongprasert S, et al.A prospective, molecular epidemiology study of EGFR mutations in Asian patients with advanced non-small-cell lung cancer of adenocarcinoma histology (PIONEER)[J].J Thorac Oncol, 2014, 9(2): 154-162.
[3] CETIN K, CHRISTIANSEN CF, JACOBSEN JB, et al.Bone metastasis, skeletal-related events, and mortality in lung cancer patients: a Danish population-based cohort study[J].Lung Cancer, 2014, 86(2): 247-254.
[4] RECK M, POPAT S, REINMUTH N, et al.Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J].Ann Oncol, 2014,25 Suppl 3:iii27- iii 39.
[5] JIANG T, ZHOU C.Clinical activity of the mutant-selective EGFR inhibitor AZD9291 in patients with EGFR inhibitor-resistant non-small cell lung cancer[J].Transl Lung Cancer Res, 2014,3(6):370-372.
[6] SEQUIST LV, SORIA JC, GOLDMAN JW,et al.Rociletinib in EGFR-mutated non-small-cell lung cancer[J].N Engl J Med,2015,372(18):1700-1709.
[7] Zhou C, Wu YL, Chen G, et al.Final overall survival results from a randomised, phase III study of erlotinib versus chemotherapy as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer (OPTIMAL, CTONG-0802)[J].Ann Oncol,2015,26(9):1877-1883.
[8] MAK KS, GAINOR JF, NIEMIERKO A, et al.Significance of targeted therapy and genetic alterations in EGFR, ALK, or KRAS on survival in patients with non-small cell lung cancer treated with radiotherapy for brain metastases[J].Neuro Oncol, 2015,17(2):296-302.
[9] 罗海涛,梁彩霞.三维适形放疗联合EGFR-TKI治疗老年局部晚期肺腺癌临床观察[J].肿瘤基础与临床, 2015,28(1):30-33.
[10] HWANG JA, LEE JY, KIM WS, et al.Clinical Implications of Isolated Bone Failure Without Systemic Disease Progression During EGFR-TKI Treatment[J].Clin Lung Cancer,2016,17(6):573-580.e1.
[11] CHEN W, ZHENG R, ZHANG S, et al.Report of incidence and mortality in China cancer registries, 2009[J].Chin J Cancer Res,2013 F,25(1):10-21.
[12] SIEGEL RL, MILLER KD, JEMAL A.Cancer statistics, 2015[J].CA Cancer J Clin,2015,65(1):5-29.
[13] MALVEZZI M, BERTUCCIO P, ROSSO T, et al.European cancer mortality predictions for the year 2015: does lung cancer have the highest death rate in EU women[J].Ann Oncol, 2015, 26(4): 779-786.
[14] MOYER VA.Screening for lung cancer: US Preventive Services Task Force recommendation statement[J].Ann Intern Med, 2014, 160(5): 330-338.
[15] 刘桢,张涛, 朱亚杰,等.非小细胞肺癌骨转移的预后因素分析[J].肿瘤基础与临床, 2014,27(5):413-415.
[16] ISLAMI F, TORRE LA, JEMAL A.Global trends of lung cancer mortality and smoking prevalence[J].Transl Lung Cancer Res,2015, 4(4): 327-338.
[17] SATHIAKUMAR N, DELZELL E, MORRISEY MA, et al.Mortality following bone metastasis and skeletal-related events among patients 65 years and above with lung cancer: A population-based analysis of US Medicare beneficiaries, 1999-2006[J].Lung India,2013, 30(1): 20-26.
[18] 李夏南,朱广迎.EGFR-TKI联合放疗治疗晚期非小细胞肺癌的研究进展[J].中国肺癌杂志, 2014, 17(4):357-362.
[19] MARCHETTI A, PALMA JF, FELICIONI L, et al.Early prediction of response to tyrosine kinase inhibitors by quantification of EGFR mutations in plasma of non-small cell lung cancer patients[J].J Thorac Oncol,2015,10(10):1437-1443.
[20] D’ANTONIO C, PASSARO A, GORI B, et al.Bone and brain metastasis in lung cancer: recent advances in therapeutic strategies[J].Ther Adv Med Oncol,2014,6(3):101-114.
[21] ZHANG S, ZHENG X, HUANG H, et al.Afatinib increases sensitivity to radiation in non-small cell lung cancer cells with acquired EGFR T790M mutation[J].Oncotarget, 2015,6(8):5832-5845.
EfficacyofEGFR-TKICombinedwithRadiotherapyintheTreatmentofBoneMetastasesofAdvancedNon-small-cellLungCancerTreatedwithEGFR-TKI
GUO Leiming
(DepartmentofRadiotherapy,theCancerHospitalAffiliatedtoZhengzhouUniversity,Zhengzhou450008,China)
ObjectiveTo explore the safety and efficacy of epidermal growth factor receptor tyrosine kinase inhibitors (EGFR-TKI) combined with radiotherapy in the treatment of bone metastases (≤3) of advanced non-small-cell lung cancer treated with EGFR-TKI.MethodsTwenty-two cases of bone metastases (≤3) of advanced non-small-cell lung cancer treated with EGFR-TKI were treated with EGFR-TKI combined with radiotherapy (the EGFR-TKI combined with radiotherapy group), and 23 cases of bone metastases (≤3) of advanced non-small-cell lung cancer treated with EGFR-TKI were treated with chemotherapy combined with radiotherapy (the control group).All the patients had mutation on exons 19 or 21.ResultsThe response rate was 72.73% in the EGFR-TKI combined with radiotherapy group, and was 39.13% in the control group (P<0.05); the progression-free survival time, the overall survival time, the 1-year survival rate and the KPS score were higher than those in the control group (P<0.05).The toxicities of two groups had no obvious difference (P>0.05).ConclusionEGFR-TKI combined with radiotherapy is safe and effect in the treatment of bone metastases (≤3) of advanced non-small-cell lung cancer treated with EGFR-TKI.
epidermal growth factor receptor tyrosine kinase inhibitors; advanced non-small-cell lung cancer; bone metastasis; radiotherapy
国家自然科学基金资助项目(编号:81372436);郑州市技术研究与开发经费支持项目(编号:121PCXTD524);河南省卫生厅省部共建项目(编号:201201009)
郭雷鸣(1980-),男,硕士,主治医师,主要从事肿瘤放疗工作。E-mail:guoguo19801128@163.com
10.3969/j.issn.1673-5412.2017.05.011
R734.2;R730.58
A
1673-5412(2017)05-0403-04
2017-03-20)
