动物性食品中替米考星酶联免疫检测方法的研究
2017-11-10万宇平韩深吴小胜刘萤孔祥雅桑旭升邬良贤彭鸽
万宇平,韩深,吴小胜,刘萤,孔祥雅,桑旭升,邬良贤,彭鸽
(1.北京勤邦生物技术有限公司,北京102206;2.北京市食品安全免疫快速检测工程技术研究中心,北京102206;3.北京出入境检验检疫局检验检疫技术中心,北京100026;4.福建省龙岩市农产品质量安全检验检测中心,福建龙岩364000)
动物性食品中替米考星酶联免疫检测方法的研究
万宇平1,2,韩深3,吴小胜1,2,刘萤3,孔祥雅1,2,桑旭升1,2,邬良贤4,彭鸽1,2
(1.北京勤邦生物技术有限公司,北京102206;2.北京市食品安全免疫快速检测工程技术研究中心,北京102206;3.北京出入境检验检疫局检验检疫技术中心,北京100026;4.福建省龙岩市农产品质量安全检验检测中心,福建龙岩364000)
通过对替米考星分子结构进行改造,制备替米考星半抗原及人工抗原,通过免疫动物得到替米考星的单克隆抗体。该抗体灵敏度为0.5 μg/L,对泰乐菌素的交叉反应率小于1%。基于该抗体建立了替米考星间接竞争酶联免疫检测方法检测动物组织、肝脏、蜂蜜、鸡蛋、牛奶的检测限分别为0.5、10、1、5、5μg/kg,添加水平回收率为70%~110%,变异系数小于15%。
替米考星;单克隆抗体;酶联免疫检测
替米考星(Tilmicosin)是半合成大环内酯类畜禽专用抗生素,其主要作用机理是干扰菌体蛋白质的合成,主要用于防治家畜肺炎(由胸膜肺炎放线杆菌、巴氏杆菌、支原体等感染引起)、禽支原体病及泌乳动物的乳腺炎,低剂量时亦可作猪的饲料添加剂以促进增重和提高饲料转换率。虽然该药物具有良好的药理作用,但在体内蓄积达到一定浓度,可引起过敏反应、耳蜗神经损害、听力减退,严重者造成肝肾的严重损害,同时导致携带耐药因子的菌株扩散[1]。农业部第235号文件中规定,替米考星在肌肉、脂肪中的最高残留限量为 75 μg/kg~100 μg/kg;在肝脏、肾脏中的最高残留限量为250 μg/kg~1 000 μg/kg;在奶中的最高残留限量为 50 μg/kg。
目前替米考星的检测方法主要是仪器检测方法[2-5]和免疫分析检测方法[6-12]。由于仪器设备昂贵,技术水平要求较高,样品还需要进行纯化处理,不利于现场筛查。文献报道替米考星残留检测的免疫学方法相对较少,大多数对泰乐菌素存在交叉或涉及的检测基质单一。本文应用酶联免疫法,测定动物组织、蜂蜜、鸡蛋和牛奶中替米考星药物的残留量,具有检测限低、特异性强、操作简便、检测速度快、检测成本低,容易推广等优点。
1 材料与方法
1.1 材料与试剂
替米考星、泰乐菌素、牛血清白蛋白(bovine serum albumin,BSA)、卵清蛋白(ovalbumin,OVA)、辣根过氧化物酶(horseradish peroxidase,HRP):美国Sigma公司;包被液(0.05mol/L碳酸盐缓冲液pH 9.6)、洗涤液(含1%吐温-20的0.15mol/L PBS pH 7.4)、封闭液(10%小牛血清溶液)、样本稀释液(含0.5%吐温-20的0.02 mol/L PBS pH 7.4):北京化学试剂公司;8周龄的雌性Balb/C小鼠、无病原体羊:北京勤邦生物技术有限公司;动物组织、肝脏、蜂蜜、鸡蛋、牛奶:北京安为天检测技术有限公司。
1.2 仪器与设备
MK3酶标仪:上海雷勃分析仪器有限公司;Costar酶标板:北京诺博莱德科技有限公司;TDL-40B离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 半抗原及人工抗原
按照如图1所示的技术路线合成替米考星半抗原。取1.0 g替米考星,加DMF溶解,加氢化钠0.138 g,加 2-(4-溴丁基)-1,3-二氧戊环 0.72 g,60℃搅拌 5 h。停止反应,冷却到室温,加水稀释,加适量稀盐酸调节pH值到7,1,2-二氯乙烷萃取,分去水相,水洗,无水硫酸钠干燥,正己烷/乙醚(5/1,体积比)重结晶,得到中间产物缩醛替米考星0.95 g,收率83.33%。取0.95 g中间产物缩醛替米考星加20 mL乙醇溶解,加1 mol/L稀盐酸10 mL,50℃搅拌反应4 h。停止反应,加碳酸氢钠水溶液,调节pH值到7,加乙酸乙酯萃取,水洗,无水硫酸钠干燥,蒸干,上硅胶柱,二氯甲烷/甲醇(5/1,体积比),洗脱分离,得到戊醛替米考星半抗原产物0.8 g,收率 88.9%。
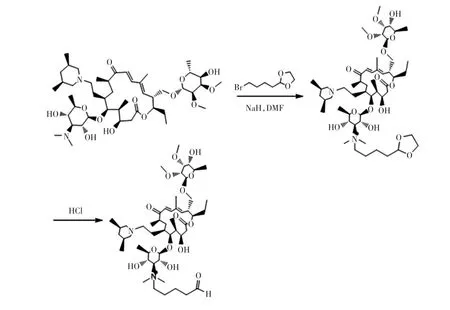
图1 替米考星半抗原的合成Fig.1 Synthesis of tilmicosin hapten
将上述的半抗原与BSA和OVA进行偶联分别得到替米考星免疫原和包被原,具体合成过程如下:取戊醛-替米考星半抗原36 mg用0.4 mL乙醇溶解,缓慢滴加到6 mL含50 mg BSA的0.1 mol/L碳酸盐缓冲液(CB,pH 9.6)中溶解,室温避光搅拌6 h后用0.02 mol/L PBS透析3 d得到免疫原。取戊醛-替米考星半抗原16 mg用0.3 mL乙醇溶解,缓慢滴加到5 mL含50 mg OVA的CB(pH 9.6)中溶解,室温避光搅拌4 h后用0.02 mol/L PBS透析3 d得到包被原。
1.3.2 单克隆抗体的制备及效价验证
将免疫原与等量弗氏完全佐剂充分乳化,免疫8周龄Balb/c小鼠,取免疫后的鼠脾细胞与骨髓瘤细胞融合,筛选获得能稳定分泌单克隆抗体的杂交瘤细胞株。采用体内诱生法得到替米考星单克隆抗体溶液[13],-20℃保存。
1.3.3 制备酶标记抗体
用1.3.2步骤得到的替米考星单克隆抗体免疫无病原体羊,得到羊抗鼠抗体,然后将羊抗鼠抗体与HRP偶联,即得到酶标记抗体[13]。
1.3.4 优选抗原包被浓度、单克隆抗体浓度,制备酶标板
抗原稀释倍数依次为:1∶3000、1 ∶6000、1 ∶12000;单克隆抗体稀释倍数依次为:1∶20 000、1∶40 000、1∶80 000、1∶160 000;酶标记抗体液的稀释倍数为1 ∶1 000;测定波长为 450 nm,分别测定 0、0.5 μg/L 质量浓度的替米考星标准品的吸光度值,并按如下公式计算百分吸光率:

在酶标板包被100 μL/孔抗原包被液,37℃环境中避光孵育2 h或4℃过夜,随后清洗酶标板1次~2次,再加入150 μL/孔封闭液,37℃避光孵育2 h,倾去孔中液体拍干,即制备完成酶标板。
1.3.5 样本的前处理方法
组织(猪肉、鸡肉、牛肉、羊肉、鱼、虾)前处理方法:称取2.0±0.05 g均质后的组织样本加入2 mL 0.1 mol/L CB(PH 10.6)和8 mL乙酸乙酯,涡动仪涡动3 min,3 000 g室温离心5 min,取4 mL上层有机相于50℃~60℃水浴氮气流下吹干,加入1mL正已烷,涡旋仪涡动30 s,加入1 mL样本稀释液,涡旋仪涡动30 s,3 000 g室温离心5 min,取下层50 μL用于分析。
肝脏(鸡肝、猪肝)的前处理方法:称取(1.0±0.05)g均质后的样本加入2 mL 0.5 mol/L CB(pH10.6)和8 mL乙酸乙酯,涡动仪涡动3 min,3 000 g室温离心5 min,取2 mL上层有机相于50℃~60℃(122℉~140℉)水浴氮气流下吹干,加入1 mL正已烷,涡旋仪涡动30 s,加入1 mL样本稀释液,涡旋仪涡动30 s,3 000 g室温离心5 min,取100 μL下层加400 μL样本稀释液,涡旋仪涡动30 s,取50 μL用于分析。
蜂蜜的前处理方法:称取2.0±0.05 g蜂蜜样本加入 2 mL 0.1 mol/L CB(PH=10.6)和 8 mL乙酸乙酯,涡动仪涡动3 min,3 000 g室温离心5 min,取2 mL上层有机相于50℃~60℃水浴氮气流下吹干,加入1 mL样本稀释液,涡旋仪涡动30 s,取50 μL用于分析。
鸡蛋、牛奶的前处理方法:取100 μL均质后的鸡蛋或牛奶样本加900 μL特殊样本稀释液(取样本稀释液与甲醇按19∶1体积比混合),涡旋仪涡动30 s,取50 μL 用于分析。
1.3.6 标准曲线的建立
用0.02 mol/L PBS将替米考星稀释成0、0.5、1.5、4.5、13.5、40.5 μg/L 共 6 个质量浓度,50 μL/孔加入酶标板中,然后加入酶标二抗50 μL/孔,再加入抗体工作液50 μL/孔,25℃避光反应30 min。洗板拍干后加入底物液 100 μL/孔,25℃避光反应 15 min,最后每孔加入50 μL终止液,用酶标仪测定450 nm吸光度值。标准曲线的横坐标为替米考星标准品质量浓度的对数值,纵坐标为百分吸光度值B(其他浓度孔的显色值)/B0(0 μg/L孔的显色值),重复测定2次。
1.3.7 样品中替米考星的检测
根据1.3.6测定所得的标准曲线,将动物组织、肝脏、蜂蜜、鸡蛋或牛奶样本的OD450nm值代入标准曲线,即可得到其相应的质量浓度,用该质量浓度乘以稀释倍数即样本中替米考星残留量。
1.3.8 检测性能
1)计算检出限
测定动物组织、肝脏、蜂蜜、鸡蛋和牛奶空白样本各20份,计算其标准差,以测定平均值加3倍的标准差作为方法的检测限(limit of detection,LOD),即可检测出的最低被测物浓度。
2)精密度及准确度
分别向空白动物组织、肝脏、蜂蜜、鸡蛋和牛奶中添加替米考星至终浓度为 2、20、2、10、10 μg/L,重复5次,分别取3个批次的试剂盒计算变异系数。准确度评价以回收率作为指标;精密度评价以重复测定某一浓度样品的检测结果的变异系数作为指标。
3)测定抗体的特异性
分别测定替米考星、泰乐菌素与抗体的结合反应。交叉反应率为替米考星的IC50与这些物质的IC50的百分比,决定了它们对替米考星检测的干扰程度。
2 结果与分析
2.1 替米考星人工抗原的检测结果
将载体蛋白及偶联物进行SDS-PAGE电泳法检测,结果显示偶联物的电泳条带较载体蛋白滞后,认定免疫原和包被原偶联成功。
2.2 优选抗原包被浓度、单克隆抗体浓度
测定不同单克隆抗体稀释倍数以及抗原稀释倍数条件下,质量浓度为0 μg/L和0.5 μg/L的替米考星标准品的OD450值,并计算百分吸光率,结果见表1。
抗原、单克隆抗体的最佳稀释倍数为百分吸光率为70%~85%时的最大稀释倍数。由表1可知,此次筛选的抗原稀释倍数为6 000,最佳单克隆抗体稀释倍数为80 000。

表1 抗原、抗体的浓度优选结果Table 1 Concentration detection results of antigen and antibody
2.3 标准曲线
以百分吸光度值B/B0为纵坐标,以替米考星标准品质量浓度的对数值为横坐标,绘制标准曲线如图2所示。

图2 替米考星标准曲线Fig.2 The standard curve of tilmicosin
以评定模型Logit(B/B0)为纵坐标,以替米考星标准品质量浓度的对数值为横坐标,将图2转换后可知,在0.5 μg/L~40.5 μg/L质量浓度范围内,Logit(B/B0)与替米考星质量浓度对数呈现良好的线性关系(见图3),建立拟合回归直线方程为Y=-2.182 9X-0.007 4,相关系数R2=0.997 1。

图3 替米考星检测标准曲线Fig.3 The detection standard curve of tilmicosin
2.4 计算检测限
20个动物组织、肝脏、蜂蜜、鸡蛋和牛奶空白样本中替米考星的检测结果见表2。检测限以测定平均值加3倍标准差计算。

表2 火空白样本检测限测定结果Table 2 Detection limit results of blank samples
由表2可知,本文建立的替米考星间接竞争酶联免疫检测方法,检测动物组织、肝脏、蜂蜜、鸡蛋和牛奶的检测限分别为 0.5、10、1、5、5 μg/kg。
2.5 精密度及准确度试验
样本中替米考星的残留量测定,要求有可靠合理的检测方法,并有较高的灵敏度。在动物组织、肝脏、蜂蜜、鸡蛋和牛奶中按照设定的量分别添加替米考星标准品,然后按照1.2.3的方法测定。回收率范围为70%~110%,变异系数小于15%,符合《农业部文件》农医发[2005]17号附件2试剂盒备案参考评判标准中第4点精密度和准确度的规定,说明此检测方法是可靠的,可用于替米考星在动物组织、肝脏、蜂蜜、鸡蛋和牛奶中残留量的分析测定,结果见表3。

表3 精密度及准确度试验结果Table 3 Results of precision and accuracy tests
2.6 抗体的特异性测定
单克隆抗体与替米考星、泰乐菌素的交叉反应率见表4。

表4 抗体与其他物质的交叉反应率Table 4 Cross-reaction rate of tilmicosin and related analytes
替米考星单克隆抗体对泰乐菌素的交叉反应率均较低,对替米考星具有较好的特异性。
3 结论
对替米考星的免疫分析方法中大多数对泰乐菌素存在交叉或涉及的检测基质单一。朱事康等[6]研究的泰乐菌素单克隆抗体与替米考星的交叉反应率为40%,对肌肉、肝脏、蜂蜜中泰乐菌素的检测限为1.5 μg/L ~3.0 μg/L。ZHANG 等[7]制备的单克隆抗体可同时识别泰乐菌素、替米考星、乙酰异戊酰泰乐菌素、脱碳霉糖泰乐菌素,对牛奶中这4种物质残留的检测限为 5.5 μg/L~11.7 μg/L。Burkin 等[8]研究的 ELISA 方法也是同时检测泰乐菌素和替米考星,对牛奶、鸡蛋、蜂蜜和鸡肉中替米考星的检测限为0.14 μg/L。罗晓琴等[9]、Le等[10]建立的胶体金免疫层析法以及王旗等[11]建立的荧光微球免疫层析法均是同时检测泰乐菌素和替米考星。韩青等[12]建立的ELISA方法对泰乐菌素交叉反应率为5%,涉及了牛奶中替米考星的检测,其检测限为2 μg/L。本研究制备的单克隆抗体灵敏度为0.5 μg/L,对泰乐菌素的交叉反应率小于1%。基于该抗体建立了替米考星间接竞争酶联免疫检测方法检测动物组织、肝脏、蜂蜜、鸡蛋和牛奶的检测限分别为0.5、10、1、5、5 μg/kg,添加水平回收率为 70%~110%,变异系数小于15%。
[1] 林秋敏,赖宝色,林伯全,等.复方中草药和替米考星对仔猪免疫功能的影响[J].福建农业学报,2015,30(11):1041-1045
[2] 张敏敏,王建兵,裴琳,等.鸡血浆中替米考星HPLC检测方法的建立[J].中国家禽,2016,38(12):21-24
[3] 王海涛,张睿,段宏安,等.高效液相色谱法同步检测牛奶中替米考星泰乐菌素和螺旋霉素残留量[J].分析试验室,2008,27(7):98-101
[4] 刘永涛,艾晓辉,邹世平,等.水产品中螺旋霉素、替米考星、泰乐菌素与北里霉素残留量的超高效液相色谱-紫外检测法同时测定[J].分析测试学报,2010,29(3):316-320
[5] JUAN C,MOLTOJ C,MANES J,et al.Determination of macrolide and lincosamide antibiotics by pressurized liquid extraction and liquid chromatography-tandem mass spectrometry in meat and milk[J].Food Control,2010,21(12):1703-1709
[6] 朱事康,聂继斌,刘星,等.动物源性食品中泰乐菌素残留ELISA试剂盒的研制[J].中国兽药杂志,2009,43(8):5-8
[7] ZHANG J K,LIU J X,WANG L L,et al.Production of the monoclonal antibody against tylosin for immunoassay of macrolide antibiotics in milk[J].Journal of Environment al Science and Health Part B-Pesticides Food Contaminants and Agricultural Wastes,2012,47(9):876-882
[8] BURKIN M,GALVIDIS I.Simultaneous separate and group determination of tylosin and tilmicosin in food-stuffs using sindle antibody-based immunoassay[J].Food Chemistry,2012,132(2):1080-1086.
[9] 罗晓琴,万宇平,孙震,等.牛奶中泰乐菌素和替米考星的胶体金免疫层析法测定[J].中国乳品工业,2012,40(10):42-48
[10]LE T,HE H Q,NIU X D,et al.Development of an immunochromatographic assay for tylosin and tilmicosin in muscle,liver,fish and eggs[J].Agricultural Sciences,2013,24(4):467-480
[11]王旗,裴星瑶,李向梅,等.基于单一抗体的荧光微球免疫层析法快速定量检测牛奶中泰乐菌素和替米考星残留[C].中国畜牧兽医学会兽医药理毒理学分会第十一届会员代表大会暨第十三次学术讨论会与中国毒理学会兽医毒理专业委员会第五次学术研讨会,2015:184
[12]韩青,王静,徐豪,等.牛奶中替米考星间接竞争酶联免疫吸附检测法的建立[J].中国畜牧兽医,2015,42(10):2625-2630
[13]何方洋,沈建忠,万宇平,等.苏丹红残留酶联免疫检测技术研究[J].食品研究与开发,2009,30(6):139-143
Detecting Tilmicosin in Animal Product Using Enzyme Linked Immunosorbent Assay
WAN Yu-ping1,2,HAN Shen3,WU Xiao-sheng1,2,LIU Ying3,KONG Xiang-ya1,2,SANG Xu-sheng1,2,WU Liang-xian4,PENG Ge1,2
(1.Beijing Kwinbon Biotechnology Company,Beijing 102206,China;2.Beijing Engineering Research Centre of Food Safety Immunodetection,Beijing 102206,China;3.Inspection and Quarantine Technical Center of Beijing Entry-Exit Inspection and Quarantine Bureau,Beijing 102206,China;4.Longyan Quality Inspection of Agriculture Products Monitoring Center,Longyan 364000,Fujian,China)
Artificial hapten and immunogens were synthesized,after which monoclonal antibodies against tilmicosin was raised.The sensitivity of the antibody was 0.5 μg/L,and it cross-reaction rate of tylosin was less than 1%.An indirect competitive enzyme immunoassay based on the antibody for the quantitative analysis of tilmicosin was described.The results showed that the limit of detection was 0.5 μg/kg in animal tissue,10 μg/kg in liver,1 μg/kg in honey and 5 μg/kg in eggs,and milk.The average recovery rate of 70%-110%,and the coefficients of variation of less than 15%.
tilmicosin;monoclonal antibody;enzyme immunoassay
10.3969/j.issn.1005-6521.2017.22.032
北京市科技计划课题(Z151100002115059)
万宇平(1982—),男(汉),研究员,学士,研究方向:食品安全快速检测技术。
2017-04-15
