混合菌种两步发酵法对豆粕肽转化及品质的影响
2017-11-10杨文宇常慧陈昭琪丁之恩
杨文宇,常慧,陈昭琪,丁之恩
(安徽农业大学茶与食品科技学院,安徽合肥230000)
混合菌种两步发酵法对豆粕肽转化及品质的影响
杨文宇,常慧,陈昭琪,丁之恩*
(安徽农业大学茶与食品科技学院,安徽合肥230000)
以枯草芽孢杆菌和黑曲霉好氧发酵作为前发酵,再以酿酒酵母及保加利亚乳酸杆菌厌氧发酵作为后发酵对豆粕进行两步发酵。结果表明:第一步发酵中肽的转化率为52.01%,第二发酵中肽的转化率为65.08%,且两步发酵优于一步发酵。
混合菌种;固态发酵;豆粕;肽的转化率
豆粕,又称“大豆粕”是大豆提取豆油后所得的一种副产品,它的营养成分主要有蛋白质、脂肪、碳水化合物,以及多种矿物质、纤维素和必需氨基酸[1],是一种营养丰富、营养成分种类齐全、营养物质含量均衡的植物性蛋白饲料源。但是豆粕所含蛋白质中的水溶性蛋白质占据很大比重,由于这些水溶性蛋白质分子量较大、结构复杂,如果直接将豆粕用于饲养动物,豆粕中的蛋白质被消化吸收利用率不高,就会造成豆粕资源浪费,从而提高了饲养成本,限制了豆粕的广泛应用。因此,降解豆粕蛋白才能进一步提高豆粕的营养性能和使用价值,扩大豆粕的使用范围。
作为降解蛋白质效果来看,对豆柏进行微生物发酵处理是最理想的方法。微生物发酵的原理是利用微生物在发酵过程中可产生呼吸酶、发酵酶和水解酶[2],可以分解豆粕蛋白产生小肽。因此,国内外学者对发酵豆柏开展了大量研究。杨柳等[3]采用枯草芽孢杆菌、酿酒酵母、植物乳杆菌混合固态发酵豆粕,可获得可溶性蛋白质的含量为165.8 μmol/g,大豆球蛋白的含量为11.4 μmol/g。张良等[4]采用米曲霉、枯草芽孢杆菌、根霉和酵母菌,进行混合菌固态发酵生产大豆肽的含量达17.97%。吴宝昌等[5]对枯草芽饱杆菌与黑曲霉混合发酵制备豆粕饲料的条件进行研究,在最优条件下测得发酵豆粕的肽转化率值为40.8%。Laura等[6]用12株对乳酸菌发酵豆粕研究发现,大部分乳酸菌可降解大豆蛋白并提高了游离氨基酸、主要必需氨基酸和风味氨基酸前体含量。
本试验以大豆肽的转化率为试验标准[7],利用枯草芽孢杆菌、黑曲霉、酿酒酵母和保加利亚乳酸杆菌,进行混合菌固态发酵生产大豆肽,利用种间互惠、偏利共生等关系,进行协同发酵[8]。该方法成本低,是代替酶解蛋白和酸解蛋白较好的方法。
1 材料与方法
1.1 材料
豆粕:益海嘉里(安徽)粮油工业有限公司购买(水分为7.66%、粗蛋白为40.60%、脂肪为3.51%、灰分为5.89%及碳水化合物为42.34%)。
菌种:枯草芽孢杆菌、黑曲霉、啤酒酵母和保加利亚乳酸杆菌均由来自安徽农业大学微生物实验室保藏。
LB培养液:牛肉膏3g/L、蛋白胨10g/L、NaCl 5 g/L、pH7.0~7.2,经121℃蒸汽灭菌30 min备用。察氏培养液:杭州百思生物技术有限公司提供。MRS培养液:杭州百思生物技术有限公司提供。
1.2 主要设备
凯氏定氮仪:济南海能仪器有限公司;GZX-9146 MBE数显鼓风干燥箱:上海博讯实业有限公司医疗设备;DL-5-B飞鸽牌离心机:上海安亭科学仪器厂;SWCJ-1D超净工作台:江苏通净设备公司;PHSJ-4A PH计:合肥原点生物科技有限公司;ML204/02电子天平:梅特勒托利多仪器(上海)有限公司;SHA-C水浴恒温震荡器:金坛市杰瑞尔电器有限公司;UV-180型紫外分光光度机:上海美谱达仪器公司;DHP-9162型电热恒温培养箱:上海一恒科技有限公司;LDZX-30KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;KNT-IV-10超纯水机:北京塞多利斯科仪器厂;DFT-100多功能中药粉粹机:温岭市大德中药机械有限公司。
1.3 方法
1.3.1 生长曲线的测定方法
取装有培养液的250 mL锥形瓶,贴上标签(注明菌名、培养处理)。按无菌操作法用接种环挑取单菌落加入于培养液中。将接种后的培养基置于振荡培养箱中,在适应的温度条件下培养,分别光电比浊测定4种菌种的生长曲线,确定其对数生长期[9-10]。
1.3.2 豆粕第一步发酵单因素试验及正交试验的方法
本试验主要确定混合菌种(枯草芽孢杆菌和黑曲霉)第一步发酵法最优方法,考察发酵时间、发酵温度、接种量、培养基含水量和菌种体积比例对大豆肽转化率的影响。
1.3.2.1 第一步单因素试验设计
1)发酵时间对大豆肽转化率影响
总接种量为8%,菌种体积比例为1∶1,发酵温度为34℃,发酵培养基的含水量为55%设为初始条件,发酵时间分别设定为 48、60、72、84、96 h,考察发酵时间对大豆肽转化率影响。
2)发酵温度对大豆肽转化率影响
总接种量为8%,菌种体积比例为1∶1,发酵时间为72 h,发酵培养基的含水量为55%设为初始条件,发酵温度分别设定为 30、32、34、36、38 ℃,考察发酵温度对大豆肽转化率影响。
3)发酵培养基的含水量对大豆肽的转化率影响
总接种量为8%,菌种体积比例为1∶1,发酵时间为72 h,发酵温度为34℃,设为初始条件,发酵培养基的含水量分别设定为45%、50%、55%、60%、65%,考察发酵培养基的含水量对大豆肽转化率影响。
4)总接种量对大豆肽转化率影响
菌种体积比例为1∶1,发酵时间为72 h,发酵温度为34℃,发酵培养基的含水量为55%设为初始条件,总接种量分别设定为4%、6%、8%、10%、12%,考察总接种量对大豆肽转化率影响。
5)菌种体积比例对大豆肽转化率影响
总接种量为8%,发酵时间为72 h,发酵温度为34℃,发酵培养基的含水量为55%设为初始条件,菌种体积比例(枯草芽孢杆菌∶黑曲霉)分别设定为1∶3、1 ∶2、1 ∶1、2 ∶1、3 ∶1,考察菌种体积比例对大豆肽转化率影响。
1.3.2.2 第一步发酵正交试验设计
根据第一步发酵单因素试验得到的结果和Box-Behnken中心组合试验设计原理,通过Design Expert软件对本试验展开设计以及数据分析处理,并检验其有效性。
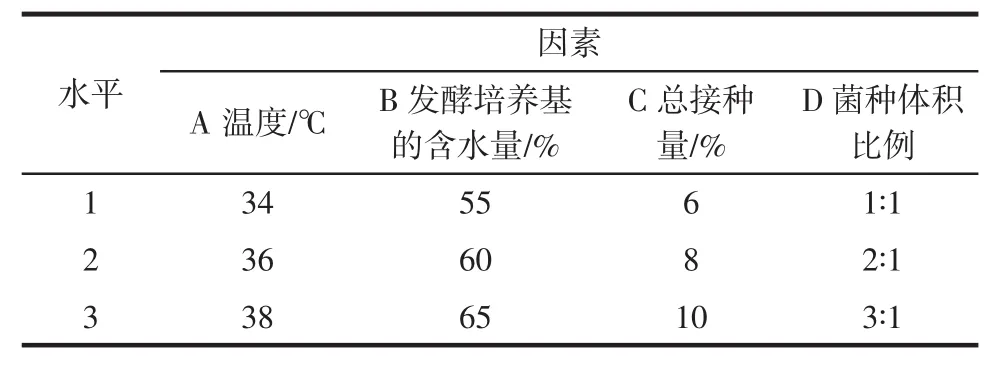
表1 正交试验因素水平表Table 1 Factors and levels of orthogonal test
1.3.3 豆粕第二步发酵单因素试验及正交试验的方法
本试验主要确定混合菌种(保加利亚乳酸杆菌和啤酒酵母)第二步发酵法最优方法,考察发酵时间、发酵温度、接种量、培养基含水量和菌种体积比例对大豆肽转化率的影响。
1.3.3.1 第二步发酵单因素试验设计
1)发酵时间对大豆肽转化率影响
总接种量为6%,菌种体积比例为1∶1,发酵温度为34℃,发酵培养基的含水量为40%设为初始条件,发酵时间分别设定为 24、36、48、60、72 h,考察发酵时间对大豆肽转化率影响。
2)发酵温度对大豆肽转化率影响
总接种量为6%,菌种体积比例为1∶1,发酵时间为48 h,发酵培养基的含水量为40%设为初始条件,发酵温度分别设定为 30、32、34、36、38 ℃,考察发酵温度对大豆肽转化率影响。
3)发酵培养基的含水量对大豆肽转化率影响
总接种量为6%,菌种体积比例为1∶1,发酵时间为48 h,发酵温度为34℃设为初始条件,发酵培养基的含水量分别设定为30%、35%、40%、45%、50%,考察发酵培养基的含水量对大豆肽转化率影响。
4)总接种量对大豆肽转化率影响
菌种体积比例为1∶1,发酵时间为48 h,发酵温度为34℃,发酵培养基的含水量为40%设为初始条件,总接种量分别设定为2%、4%、6%、8%、10%,考察总接种量对大豆肽转化率影响。
5)菌种体积比例对大豆肽转化率影响
总接种量为6%,发酵时间为48 h,发酵温度为34℃,发酵培养基的含水量为40%,设为初始条件,菌种体积比例(保加利亚乳酸杆菌∶酿酒酵母)分别设定为 1∶3、1 ∶2、1 ∶1、2 ∶1、3 ∶1,考察菌种体积比例对大豆肽转化率影响。
1.3.3.2 第二步发酵正交试验设计
根据第二步发酵单因素试验得到的结果和Box-Behnken中心组合试验设计原理,通过Design Expert软件对本试验展开设计以及数据分析处理,并检验其有效性。

表2 正交试验因素水平表Table 2 Factors and levels of orthogonal test
1.4 蛋白质及肽的转化率测定方法
1.4.1 蛋白质测定方法
采用凯氏定氮测定[11]。
1.4.2 肽的转化率测定方法[12]
大豆肽转化率/%=酸溶蛋白含量/原豆粕蛋白含量×100
酸溶蛋白含量:采用三氯乙酸法测定[13]。
2 结果与分析
2.1 种子扩培时间的确定
种子扩大培养是发酵工程一个重要的组成部分,本试验将冷冻干燥管中处休眠状态的生产菌种接入液体培养基中,通过培养一段时间后获得一定数量和质量的菌种。4种菌种的生长曲线见图1。
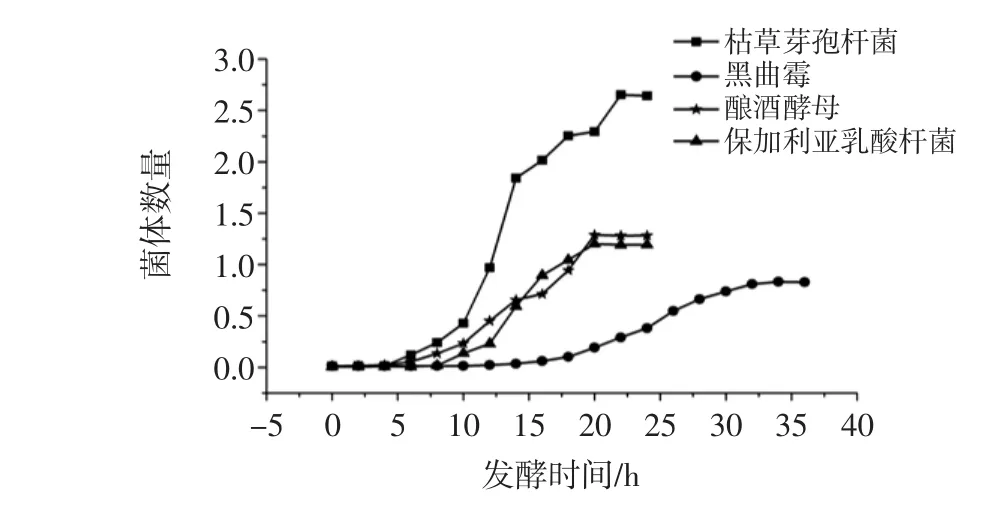
图1 4种菌种的生长曲线Fig.1 Growth curve of four strains
通过图1可以得出4种菌种种子扩培时间,4条曲线分别为枯草芽孢杆菌20 h,黑曲霉32 h,酿酒酵母菌18 h,保加利亚乳酸杆菌18 h。
2.2 第一步发酵单因素试验及正交试验结果
2.2.1 第一步发酵单因素试验结果
图2为第一步发酵时间对大豆肽转化率的影响。
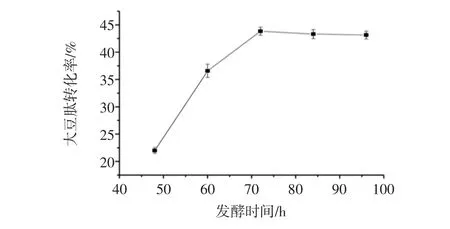
图2 第一步发酵时间对大豆肽转化率的影响Fig.2 The effect of fermentation time on the conversion rate of soybean peptide
由图2能够看出,当发酵时间从48 h延长至72 h,随着发酵时间的延长,微生物大量繁殖,分解豆粕中的蛋白质的速度加快,使大豆肽含量增加,是由于混菌之间为协同关系共同产生蛋白酶水解大豆蛋白,这是前72 h大豆肽转化率快速上升的主要原因。当发酵时间超过72 h时,大豆肽转化率基本保持不变。
图3为第一步发酵温度对大豆肽转化率的影响。
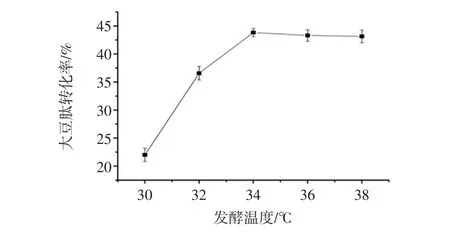
图3 第一步发酵温度对大豆肽转化率的影响Fig.3 The effect of fermentation temperature on the conversion rate of soybean peptide
由图3能够看出,当温度从30℃升高到36℃时,大豆肽的转化率也在平缓增加。这是由于温度上升,导致枯草芽孢杆菌和黑曲霉的生长繁衍加快,而且随温度升高枯草芽孢杆菌和黑曲霉产生的蛋白酶能够加快分解大豆蛋白速度。当温度超过36℃时,大豆肽的产量有下降的趋势,是因为偏高的温度抑制枯草芽孢杆菌和黑曲霉正常的生长代谢,同时损坏枯草芽孢杆菌和黑曲霉产生的分解大豆蛋白的蛋白酶功能,最后使得大豆肽的转化率值略微下降。
图4为第一步发酵培养基的含水量对大豆肽转化率的影响。

图4 第一步发酵培养基的含水量对大豆肽转化率的影响Fig.4 The effect of water content of fermentation medium on the conversion rate of soybean peptide
由图4能够看出,发酵培养基的含水量从45%上升到60%过程中,大豆肽转化率也呈现出逐步上升现象。这是因为水分是维持枯草芽孢杆菌和黑曲霉正常的生理活动的必要生命营养物质,同时也是能提高枯草芽孢杆菌和黑曲霉产生分解豆粕蛋白的蛋白酶活力。当发酵培养基的含水量超过60%,大豆肽转化率急剧下降。这是因为过多的水分可能影响枯草芽孢杆菌和黑曲霉细胞膜的通透性,从而影响枯草芽孢杆菌和黑曲霉生产蛋白酶功能,所以导致大豆肽转化率下降。
图5为第一步发酵总接种量对大豆肽转化率的影响。
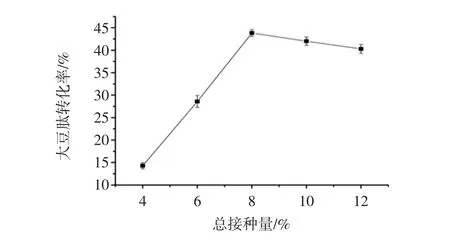
图5 第一步发酵总接种量对大豆肽转化率的影响Fig.5 The effect of inoculation amount on the conversion rate of soybean peptide
由图5能够看出,总接种量从4%到8%时,大豆肽转化率是按照一定的比例增长。这是因为加大枯草芽孢杆菌和黑曲霉接种量,使得枯草芽孢杆菌和黑曲霉生产分解大豆蛋白的蛋白酶的量增多。当总接种量超过8%时,大豆肽转化率下降。这是因为接种枯草芽孢杆菌和黑曲霉量过大,致使枯草芽孢杆菌和黑曲霉生长速度过快,从而消耗大量的营养物质,从而导致大豆肽含量下降。
图6为第一步发酵菌种体积比例对大豆肽转化率的影响。

图6 第一步发酵菌种体积比例对大豆肽转化率的影响Fig.6 The effect of volume ratio of fermentation bacteria on the conversion of soybean peptides
由图6能够看出,随着枯草芽孢杆菌占总接种量的比例逐渐增大,大豆肽转化率呈现升高趋势。这种现象可能的原因是枯草芽孢杆菌比黑曲霉生产分解大豆蛋白的蛋白酶的量多,或者枯草芽孢杆菌比黑曲霉生产蛋白酶分解大豆蛋白的能力更强。因此,发酵菌种体积比例为2∶1时大豆肽转化率最高。
2.2.2 第一步发酵正交试验结果分析
通过正交试验,以大豆肽的转化率为参考指标,来研究这四因素三水平对大豆肽的转化率的影响程度,见表 3、表 4。
通过表3、表4能够得出,最适水平组合为A1B2C3D3,即发酵温度为34℃,培养基的含水量为60%,总接种量为10%,菌种体积比例为3∶1。分别对大豆肽转化率影响的4个因素顺序为:B(发酵培养基的含水量)>C(总接种量)>D(菌种比例)>A(发酵温度)。由方差分析表显示:发酵培养基的含水量、总接种量和菌种比例3个因素都具有显著性。
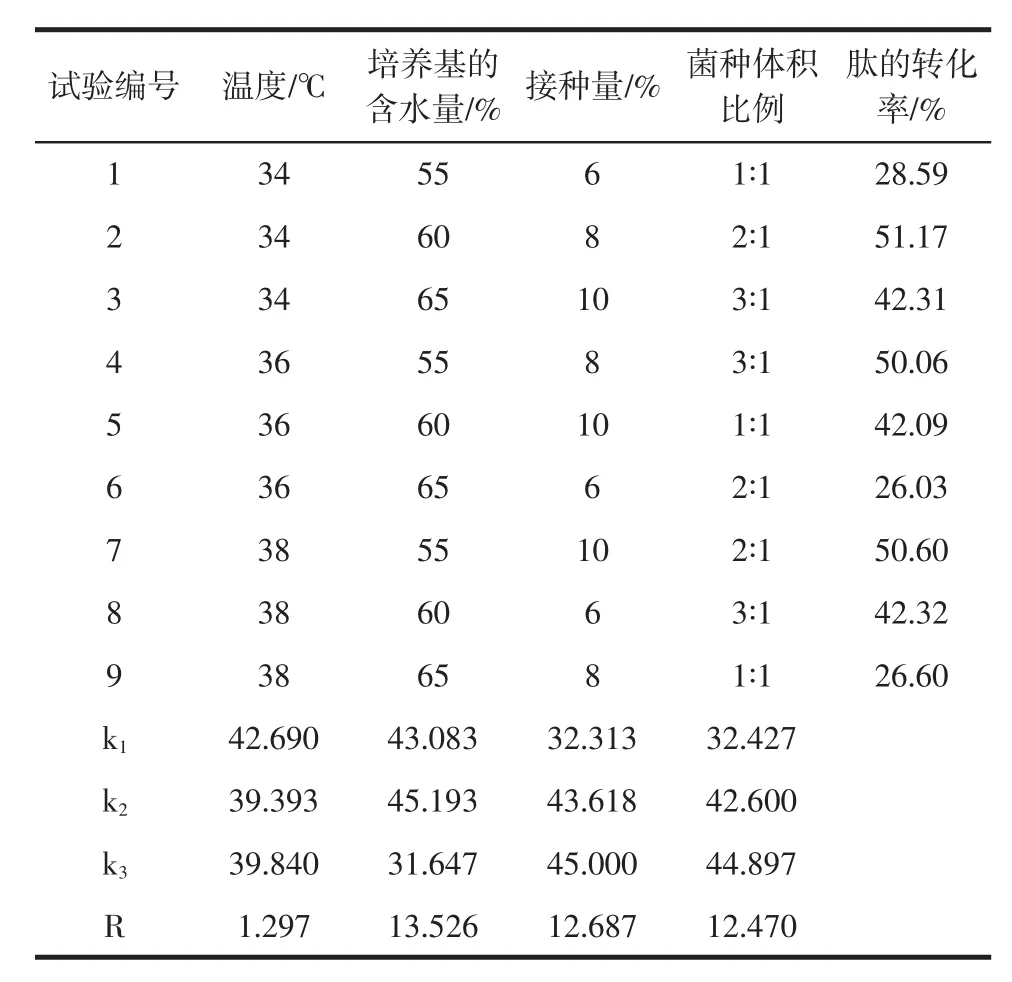
表3 正交试验结果及分析Table 3 Results and analysis of orthogonal test

表4 方差分析表Table 4 Analysis of variance table
2.2.3 验证试验
对最优组合A1B2C3D3验证试验,作3个平行,结果取平均值,验证试验结果为52.01%,同试验理论结果接近。
2.3 第二步发酵单因素试验及正交试验结果
2.3.1 第二步发酵单因素试验结果
图7为第二步发酵时间对大豆肽转化率的影响。
由图7能够看出,当发酵时间从24 h延长至48 h,随着发酵时间的延长,微生物大量繁殖,分解豆粕中的蛋白质的速度加快,使大豆肽含量增加,是由于混菌之间为协同关系共同产生蛋白酶水解大豆蛋白,这是前48 h大豆肽转化率快速上升的主要原因。当发酵时间超过48 h时,大豆肽略有下降。可能原因是发酵后期酿酒酵母和保加利亚乳酸杆菌发生自溶现象,另一原因是随着发酵时间的延伸,豆粕中的营养物质不足以使酿酒酵母和保加利亚乳酸杆菌开始变为竞争关系而相互抑制。
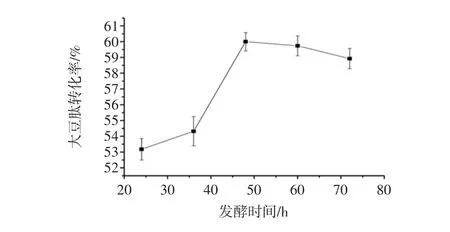
图7 第二步发酵时间对大豆肽转化率的影响Fig.7 Effect of second step fermentation time on the conversion rate of soybean peptide
图8为第二步发酵温度对大豆肽转化率的影响。

图8 第二步发酵温度对大豆肽转化率的影响Fig.8 Effect of second step fermentation temperature on the conversion rate of soybean peptide
由图8能够看出,当温度从30℃升高到36℃时,大豆肽转化率也在逐渐增加。这是由于温度上升,导致酿酒酵母和保加利亚乳酸杆菌的生长繁衍加快,而且随温度升高酿酒酵母和保加利亚乳酸杆菌的蛋白酶能加快分解大豆蛋白速度。当温度超过36℃时,大豆肽含量急速下降,是因为过高的温度抑制酿酒酵母和保加利亚乳酸杆菌生长代谢,同时损坏酿酒酵母和保加利亚乳酸杆菌产生的分解大豆蛋白的蛋白酶功能,最后使得大豆肽转化率值变小。
图9为第二步发酵培养基的含水量对大豆肽转化率的影响,由图9能够看出,发酵培养基的含水量从30%上升到45%过程中,大豆肽转化率也呈现出逐步上升现象。这是因为水分是维持酿酒酵母和保加利亚乳酸杆菌正常的生理活动的必要生命营养物质,同时也是能提高酿酒酵母和保加利亚乳酸杆菌产生分解豆粕蛋白的蛋白酶活力。当发酵培养基的含水量超过45%,大豆肽转化率急剧下降。这是因为过多的水分可能影响酿酒酵母和保加利亚乳酸杆菌细胞膜的通透性,会进一步影响酿酒酵母和保加利亚乳酸杆菌生产蛋白酶功能,所以大豆肽转化率下降。

图9 第二步发酵培养基的含水量对大豆肽转化率的影响Fig.9 Effect of water content of second step fermentation mediumon the conversion rate of soybean peptide
图10为第二步发酵总接种量对大豆肽转化率的影响。
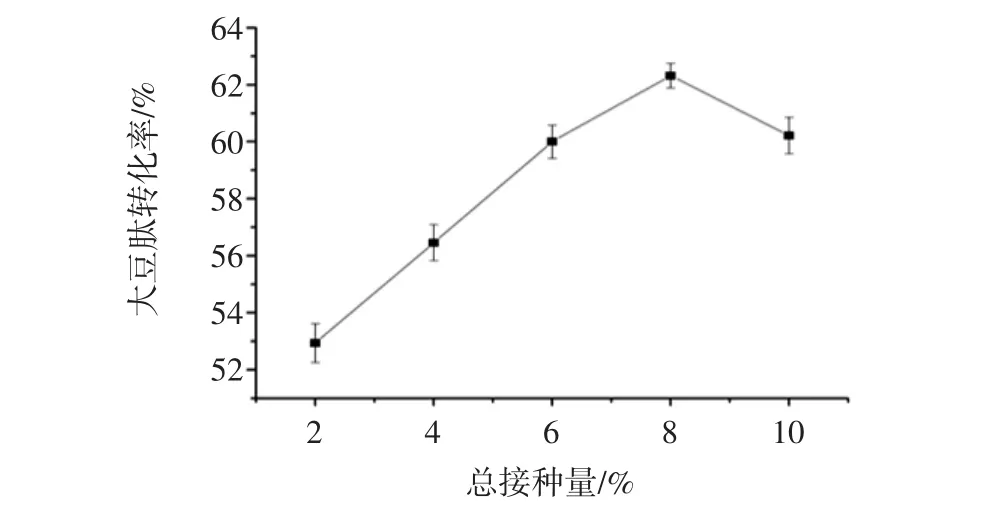
图10 第二步发酵总接种量对大豆肽转化率的影响Fig.10 Effect of second step inoculation amount on the conversion rate of soybean peptide
由图10能够看出,总接种量从2%到8%时,大豆肽的转化率是按照一定的比例增长。这是因为加大酿酒酵母和保加利亚乳酸杆菌接种量,使得酿酒酵母和保加利亚乳酸杆菌生产分解大豆蛋白的蛋白酶的量增多。当总接种量超8%时,大豆肽转化率呈下降趋势。这是因为接种酿酒酵母和保加利亚乳酸杆菌量过大,致使酿酒酵母和保加利亚乳酸杆菌生长速度过快,从而消耗大量的营养物质,从而导致大豆肽转化率呈现下降趋势。
图11为第二步发酵菌种体积比例对大豆肽转化率的影响。
由图11能够看出,随着保加利亚乳酸杆菌占总接种量的比例逐渐增大,大豆肽转化率呈现升高趋势,当菌种体积比为2∶1时肽转化率最高,此时大豆肽转化率最大值为63.43%。这种现象可能的原因是保加利亚乳酸杆菌比酿酒酵母生产分解大豆蛋白的蛋白酶的量多,或者保加利亚乳酸杆菌比酿酒酵母生产蛋白酶分解大豆蛋白的能力更强。

图11 第二步发酵菌种体积比例对大豆肽转化率的影响Fig.11 Effect of volume ratio of second step fermentation strains on conversion of soybean peptides
2.3.2 第二步发酵正交试验结果
通过正交试验,以大豆肽的转化率为参考指标,来研究这四因素对大豆肽的转化率的影响程度,见表5、表 6。

表5 正交试验结果及分析表Table 5 Results and analysis of orthogonal test
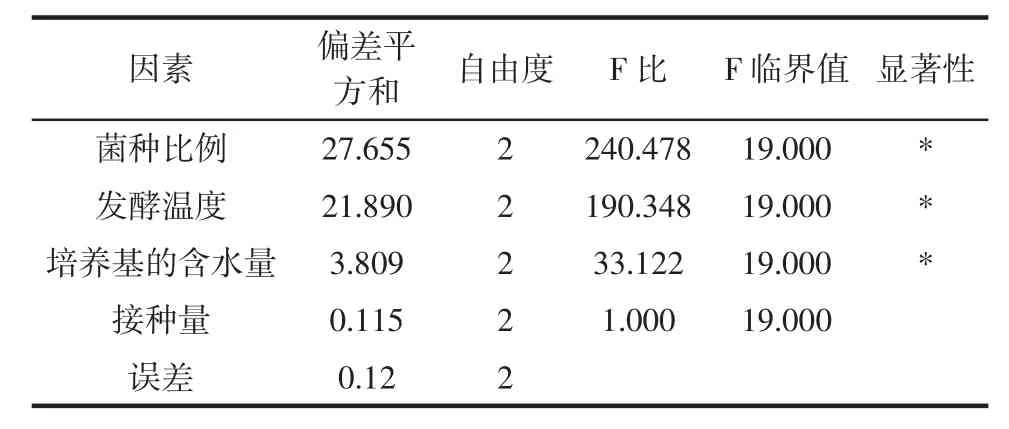
表6 方差分析表Table 6 Analysis of variance table
通过表5、表6能够得出,最适水平组合为A2B2C1D2,即菌种体积比例为2∶1、发酵温度为36℃,培养基的含水量为40%,接种量为8%。分别对大豆肽的转化率影响的4个因素顺序为:A(菌种比例)>B(温度)>C(发酵培养基的含水量)>D(总接种量)且菌种比例、发酵温度和培养基的含水量3个因素都具有显著性。
2.3.3 验证试验
对最优组合A2B2C1D2验证试验,作3个平行,结果取平均值,验证试验结果为65.08%,同试验理论结果接近。
3 讨论
本试验研究得出了两步固态发酵豆粕的最佳工艺条件:以压榨的豆粕为原料,并进行60目粉碎,首先试验选用的菌种为枯草芽孢杆菌和黑曲霉对豆粕进行有氧发酵,确定最优条件:发酵温度是34℃,发酵培养基的含水量是60%,总接种量是10%,发酵时间是72 h,菌种体积比例是3∶1。枯草芽孢杆菌在发酵过程中产生水解能力较强的蛋白酶,分解大分子物质为小分子物质,尤其在生长代谢中产生的外肽酶,能够对豆粕中的苦肽进行分解。黑曲霉发酵豆粕的过程中能够产生丰富的酶系,如酸性蛋白酶、果胶酶等,能够更好的作用于豆粕,并且降解豆粕中的多糖,蛋白质和细胞壁,进而提高发酵豆粕的蛋白质含量。然后对第一步发酵后的豆粕进行再发酵,选用的菌种保加利亚乳酸杆菌和酿酒酵母进行厌氧发酵,确定最优条件:温度是36℃,发酵培养基的含水量是40%,总接种量是8%,发酵时间是48 h,确定最优条件菌种体积比例是2∶1。保加利亚乳酸菌和酿酒酵母菌在发酵豆粕的过程中,产生大量的有机酸,使豆粕的pH值下将,有利于抑制有害微生物的生长,同时又能进一步分解大豆蛋白,提高大豆肽的浓度。经过两步发酵豆粕的大豆肽含量为26.42%与大豆肽转化率为65.08%。此结果比刘天蒙[14]等单菌发酵,李善仁[15]等一步混菌发酵的效果更好。由此得出混菌发酵比单菌发酵豆粕效果好[16-21],两步固态发酵比一步固态发酵豆粕效果好[22-25]。此结论可为发酵豆粕生产大豆肽提供新的试验依据。
[1] 吴建平.日本生理活性肽的市场动态[J].食品工业,1998(3):8-9
[2] 刘海燕.丘玉朗,魏炳栋,等.微生物发酵研究进展[J].动物营养学报,2012,24(1):35-40
[3] 杨柳,陈宇飞,王磊,等.多菌混合固态发酵豆粕的工艺研究[J].饲料加工,2016,4(12):44-47
[4] 张良,刘洋,刘嘉,等.混合菌种固态发酵豆粕生产大豆肽的工艺研究[J].饲料工艺新技术,2013,7(26):26-28
[5] 吴宝昌,宋俊梅.枯草芽孢杆菌与黑曲霉混合发酵制备豆粕饲料[J].山东轻工业学院学报,2010,24(1):54-57
[6] Laura Aguirre,Marisa S Garro,Graciela Savoy de Giori.Enzymatic hydrolysis of soybean protein using lactic acid bacteria[J].Food Chemistry,2008,111(4):976-982
[7] 管国强,崔鹏景,宋庆春,等.枯草芽孢杆菌ZC1发酵豆粕产大豆肽的条件研究[J].食品工业,2015,36(12):194-198
[8] 土金斌,马海乐,段玉清,等.豆粕固态发酵生产优质高蛋白饲料的菌种筛选试验[J].安徽农业科学,2008,36(19):8112-8114
[9] 周德庆.微生物学教程[M].北京:高等教育出版社,2002:152-166
[10]武汉大学复旦大学生物系微生物学教研室编.微生物学[M].北京:人民教育出版社,1990:448-449
[11]黄伟坤.食品检验与分析(第1版)[M].北京:轻工业出版社,1989:8-9
[12]中华人民共和国卫生部.GB/T 5009.5-2010食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2010
[13]王芳,逢瑞玥.对大豆肽粉中酸溶蛋白含量测定方法的改进[J].黑龙江粮食,2005(5):35-37
[14]刘天蒙,宋俊梅,秦思思.温度变化对固态发酵豆粕产大豆肽工艺影响的研究[J].中国酿造,2010(10):111-112
[15]李善仁,林新坚,蔡海松,等.混菌发酵豆粕制备大豆肽的研究[J].中国粮油学报,2009,24(12):52-55
[16]石慧,罗璇,刘艳.两步发酵法降解大豆抗原蛋白的研究[J].饲料工业,2011,32(3):22-25
[17]刘天蒙,宋俊梅,秦思思.温度变化对固态发酵豆粕产大豆肽工艺影响的研究[J].中国酿造,2010(10):111-112
[18]李善仁,林新坚,蔡海松,等.混菌发酵豆粕制备大豆肽的研究[J].中国粮油学报,2009,24(12):52-55
[19]Stale R,Stefan S,Erland B,et al.Lactic acid fermentation eliminates indigestible carbohydrates and antinutritional factors in soybean meal for Atlantic salmon(Salmo Salar)[J].Aquaculture,2005,246:331-345
[20]Frias J,Song YS,Martinez-Villaluenga C,Gonzalez de Mejia E,et al.Immunoreactivity and amino acid content of fermented soybean products[J].J Agric FoodChem,2008,56(1):99-105
[21]Shin R,Suzuki M,Mizutani T,et al.Improvement of experimentally induced hepatic and renal disorders in rats using lactic acid bacteria-fermented soybean extract(biofermentics TM)[J].Evid based Complement Alternat Med,2007,27:257-363
[22]Junko Y,Chen H M,Takako N,et al.Changes of Functional Components and Antioxidative Activity in the Process ofFermentation of Soybeans[J].Chemistry,Texture,andFlavorofSoy,2010(10):155-169
[23]Clelanda D,Jastrzembskia K,Stamenovab E,et al.Growth characteristics of microorganisms on commercially available animal-free alternatives to tryptic soy medium[J].Journal of Microbiological Methods,2007,69(2):345-352
[24]Chang J,Yin Q Q,Wang P P,et al.Effect of fermented protein feedstuffs on pig production performance,nutrient digestibility and fecal microbes[J].TurkishJournalofVeterinaryandAnimalSciences,2012,36(2):143-151
[25]Zhang H Y,Yi J Q,Piao X S,et al.The metabolizalbe energy value standardized ileal digestibility of amino acids in soybean meal soy protein concentrate and fermented soybean meal and the application of these products in early-weaned piglets[J].Asian Australasian Tournal of Animal Sciences,2013,26(5):691-699
Effect of Mixed Strains Fermentation on the Two Step Conversion and Quality of Soybean Meal Peptide
YANG Wen-yu,CHANG Hui,CHEN Zhao-qi,DING Zhi-en*
(College of Tea and Food Science and Technology,Anhui Agriculture University,Hefei 230000,Anhui,China)
Two-step fermentation were implemented as follows:Bacillus subtilis and Aspergillus niger aerobic fermentation were used as primary fermentation,then Saccharomyces cerevisiae and Lactobacillus bulgaricus anaerobic fermentation were used as secondary fermentation.The results showed that the percent conversion of peptide in the first step was 52.01%,the second step was 65.08%,additionally,the two-step fermentation was superior to one step fermentation.
mixed strains;solid state fermentation;soybean meal;conversion of peptide
10.3969/j.issn.1005-6521.2017.22.038
国家科技支撑计划项目(2012BAD14B13);院科创新团队项目(14C1207)
杨文宇(1990—),男(汉),硕士研究生,研究方向:食品安全检测。
*通信作者:丁之恩,教授,博士生导师,长期从事农产品加工,天然产物提取分离的教学和科学研究工作。
2017-02-23
