桑芽的组织快繁技术研究
2017-11-10刘松青祁伟亮龚壁燃任迎虹
刘松青,冯 鸿,祁伟亮,张 硕,阮 梅,龚壁燃,任迎虹
(成都师范学院 化学与生命科学学院,四川 成都 611130)
桑芽的组织快繁技术研究
刘松青,冯 鸿,祁伟亮,张 硕,阮 梅,龚壁燃,任迎虹*
(成都师范学院 化学与生命科学学院,四川 成都 611130)
不同物候期的茎段诱芽率不同,以夏季湖桑32的桑芽作为起始外植体。分别以MS和1/2MS培养基添加不同浓度的IBA、6-BA、2,4-D进行桑芽分化和生根诱导,以探究最适桑芽增殖、生根的激素浓度组合以及活性炭对桑组培苗的褐化抑制作用。实验结果表明:最佳丛芽诱导培养基组合为6-BA 1.7 mg·L-1+ 2,4-D 0.03 mg·L-1+ IBA 0.05 mg·L-1,最佳诱导生根的IBA浓度为0.05 mg·L-1,活性炭添加的最佳浓度为1.5~2.0 mg·L-1,能有效控制褐化负面影响。炼苗过程中,长势良好的桑苗先进行水培炼苗5~7 d后再移栽到土中,能提高组培苗的成活率。
桑芽;组织培养;活性炭;褐化现象
桑树(MorusalbaL.),桑科桑属多年生双子叶落叶乔木,具食用、药用、材用及观赏等多种利用价值,是一种重要的经济作物[1-3]。我国桑树种质资源丰富,但各种病虫害对其正常生长发育、产量和质量造成一定影响,成为制约蚕桑产业和桑树生态产业发展的瓶颈问题。脱毒培养是解决这一瓶颈的重要措施之一,而植物的脱毒技术与植物组织快繁技术是紧密结合在一起应用的。1968年押金健吾等首次以桑花器和桑根为外植体进行组织培养,随后又有以桑茎尖、桑(叶)冬芽、顶芽、侧芽或腋芽、胚珠、花药、愈伤组织相继作外植体在无菌条件下进行组织培养,经初代培养、继代增殖、采用1/2MS培养基添加0.25 mg·L-1吲哚丁酸(IBA)生根,大约一个月后诱导出茎段生根,幼芽培养11 d后观察到生根,两周后生根率基本接近100%,最后移栽而成功再生完整植株的报道[4-12]。在桑树组培过程中,组培苗极易出现褐化现象,主要原因是褐变过程中,产生棕褐色醌类物质,当扩散到培养基后,就会抑制其酶的活性,以及外植体的生长[13]。活性炭是一种吸附性较强的无机吸附剂,能够抑制组培苗生长和增殖组培中出现的褐化现象,使用浓度不宜过高,浓度越高,会抑制组培苗生长[14-15]。此外,在过去对桑树组织培养的研究中,可以发现,桑树的组织培养中,关于激素种类及浓度的研究众多,且相差不是很明显,但总的来说木本植物经组织培养移栽成活的几率相比草本植物而言普遍较低,另外,目前针对桑树组培苗褐化研究的报道也相对较少,所以对其激素组合及褐化处理需要继续研究[16-17]。
桑树顶芽数量不多,但是可诱导出大量的不定丛芽,且诱导出的不定丛芽几乎保留母本所有的优良品质,这十分利于植物组培苗的批量育种。本试验主要是剪取湖桑32的桑芽为外植体建立无菌体系,分别以MS和1/2MS培养基添加不同浓度的IBA、6-BA、2,4-D进行桑芽分化和生根诱导,以探究最适桑芽增殖、生根的激素浓度组合以及活性炭对桑组培苗褐化程度的抑制作用。通过诱导、细胞分裂、生长、增殖和分化,生根培养成完整植株,能够加速桑树良种的大面积快繁,减少病虫害对桑树的生长质量及应用的影响,为以后蚕桑经济和生态业的发展打下坚实的基础。
1 材料与方法
1.1 实验材料与方法
1.1.1 实验材料
供试材料选择成都师范学院实验基地中种植、长势良好、无病虫害优良桑树品种湖桑32的桑芽。
1.1.2 培养基
桑芽的丛芽诱导参照普通木本植物组织培养的方法[18],以MS培养基为基本培养基,附加不同浓度的细胞分裂素(6-Benzylaminopurine,6-BA)、2,4-二氯苯氧乙酸(2,4 -Dichlorophenoxyacetic acid,2,4-D)、吲哚丁酸(Indole butyric acid,IBA)等。桑树组培苗生根,以1/2MS为基本培养基,附加不同浓度的生长素(IBA)诱导。同时培养基中附加蔗糖30 g·L-1,琼脂7 g·L-1,pH值调为5.8~5.9。
1.2 方法
1.2.1 无菌体系的建立
1)外植体剪取:选择中午温度相对较高时,剪切桑芽,此时外植体生长旺盛,携带的病毒也相对更少。
2)消毒步骤:a.用洗衣粉进行第一次外植体清洗;b.流水冲洗1 h将外植体表面洗净;c.于超净工作台上75 %酒精处理1 min,并用无菌水洗净三次;d.用5 %次氯酸钠溶液处理10 min,再用无菌水清洗三次。
3)接种:将消毒后的桑芽接种到相应的培养基中,并定期观察记录桑芽增值生长情况。
1.2.2 分化培养基的筛选
采用MS基本培养基,利用正交实验设计4因素3水平的正交表L9(34),各因素、水平如表1。综合确定不同浓度的6-BA (6-苄氨基嘌呤)、IBA (吲哚丁酸)、2,4-D (2,4-二氯苯氧乙酸)对桑芽诱导丛芽的影响,筛选出最佳培养激素组合。
表1桑芽分化正交试验

水平A6-BA浓度(mg·L-1)B2,4-D浓度(mg·L-1)CIBA浓度(mg·L-1)D空白11.20.010.05—21.50.020.10—31.70.030.15—
1.2.3 生根培养的最优IBA浓度筛选
生根培养采用1/2MS培养基,参照YADAV的生根培养方法[19],本实验当中添加吲哚丁酸(IBA)浓度梯度为0.1 mg·L-1、0.5 mg·L-1、1.0 mg·L-1、1.5 mg·L-1、2.0 mg·L-1将培养。分化的桑芽(2 cm左右),接种到不同的生根培养基中,每瓶接种5株,诱导不定根的产生,并观察记录生根时间,生根率,测量平均根数及平均根长。
1.2.4 活性炭对桑芽褐化的影响
为确定不同浓度活性炭对桑组培苗褐化抑制作用,以丛芽诱导增值中褐化较严重的9号作为对照培养基,处理组中活性炭的浓度梯度设为1 g·L-1、1.5 g·L-1、2 g·L-1、2.5 g·L-1、3 g·L-1,并统计褐化率及褐化程度(褐化发生级别根据褐色的深浅。划分为无或很浅、浅、中、较深、深5级,分别用+、++等表示),以期筛选出能有效抑制组培苗褐化的最佳活性炭浓度。
2 结果与分析
2.1 不同激素配比及浓度组合对丛芽诱导增殖的影响
以MS培养基添加不同浓度的IBA、6-BA、2,4-D进行桑芽分化研究,结果表明不同浓度激素组合对组织培养桑芽的生长高度和增殖倍数影响较大(表2)。综合来看,9号培养基的长势最好。芽高为3.4 cm,但褐化现象也最严重,2号3号,8号组合次之(图1)。而2号组合培养基增殖倍数最高,3号、8号较好,其它的次之。
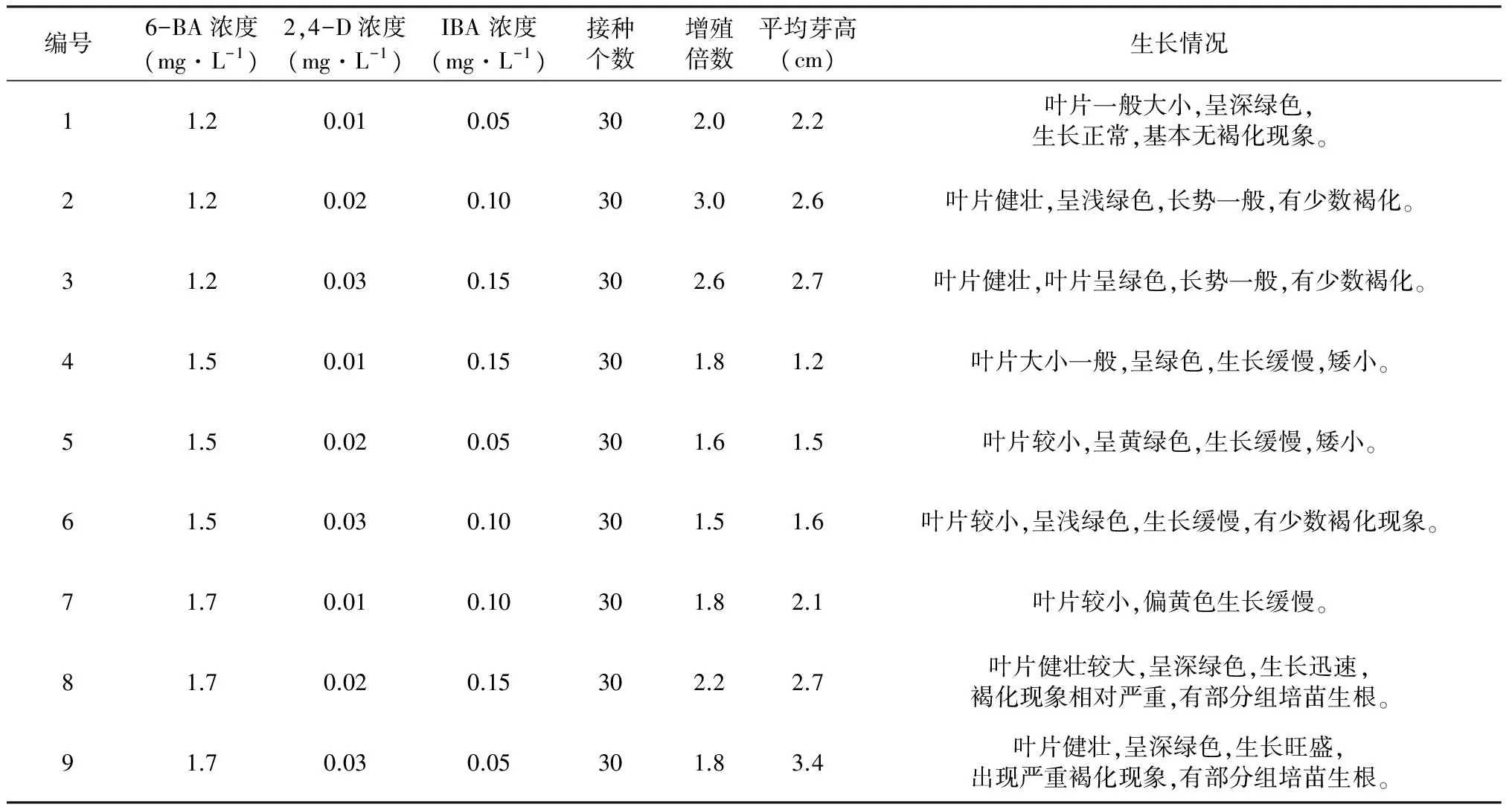
表2 不同激素配比及浓度组合对桑芽诱导的影响

图1 8号和9号培养基的桑芽生长情况
对表2中平均芽高进行SPSS分析,结果表明,激素A、B、C三因素之间存在显著差异(表3)。激素6-BA的三个水平中,A3的作用水平显著(A3>A1>A2);激素2,4-D的三个水平中,B3的作用水平显著(B3>B2>B1);激素IBA的三个水平中,C1的作用水平显著(C1>C3>C2)。综上所述,激素A、B、C三因素的最佳激素水平组合为A3B3C1,即最佳桑芽生长的培养基组合为6-BA 1.7 mg·L-1+ 2,4-D 0.03 mg·L-1+ IBA 0.05 mg·L-1。
表3桑芽生长高度的方差分析
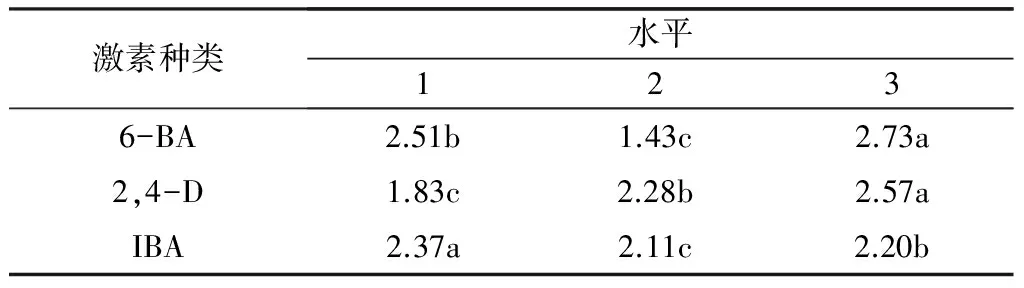
激素种类水平1236-BA2.51b1.43c2.73a2,4-D1.83c2.28b2.57aIBA2.37a2.11c2.20b
对表2增值系数进行SPSS分析,结果表明,激素A、B、C三因素之间存在显著差异(表4)。在激素6-BA的三个水平中,A1的作用水平显著,(A1>A3>A2);在激素2,4-D的三个水平中,B2的作用水平显著(B2>B3>B1);在激素IBA的三个水平中,C3的作用水平显著(C3>C2>C1)。综上所述,激素A、B、C三因素的最佳激素水平组合为A1B2C3,即最佳桑芽增值的培养基组合为6-BA 1.2 mg·L-1+ 2,4-D 0.02 mg·L-1+ IBA 0.15 mg·L-1。
表4桑芽增值生长的方差分析
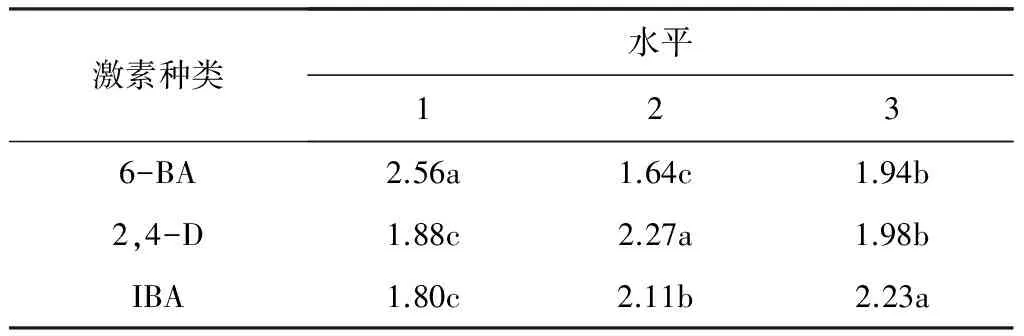
激素种类水平1236-BA2.56a1.64c1.94b2,4-D1.88c2.27a1.98bIBA1.80c2.11b2.23a
2.2 不同IBA浓度对诱导生根的影响
3号培养基IBA浓度为1.0 mg·L-1时的生根率最高达到67%,诱导平均根数为7,平均根长为6.8 cm(表5),而其他培养基的生根率、平均根数、平均根长均低于3号培养基(图2)。综上所述,生根培养基应选用 3号培养基 1/2 MS + IBA 1.0 mg·L-1。
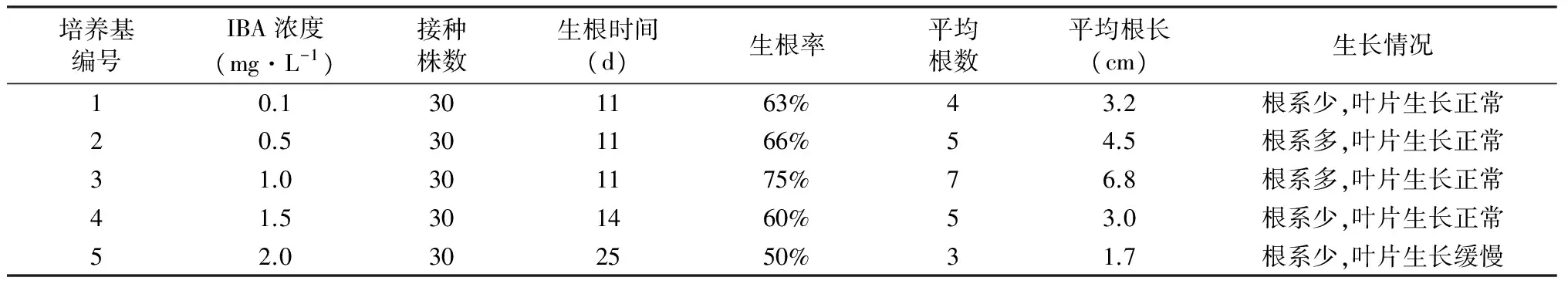
表5 生长素浓度对桑芽生根影响

IBA浓度(mg/L):a.1.0; b.1.5; c.2: d.2.5; e.3.0
2.3 活性炭对桑芽褐化的影响
活性炭对桑组培苗褐化有一定抑制作用,但是不同浓度活性炭的抑制作用差异不是很明显,抑制作用从大到小依次是5>3>4>2>1。从褐化的程度来看,3号和5号褐化程度最轻,依次减轻的是2号和4号,1号褐化程度比较严重。研究发现,在一定范围内,随着活性炭浓度的增加,褐化作用得到一定的抑制,但从生长情况来看,活性炭浓度过高时,对组培苗的生长产生一定的负效应。综合来看活性炭浓度在1.5~2.0 mg·L-1范围内的效果相对较好。
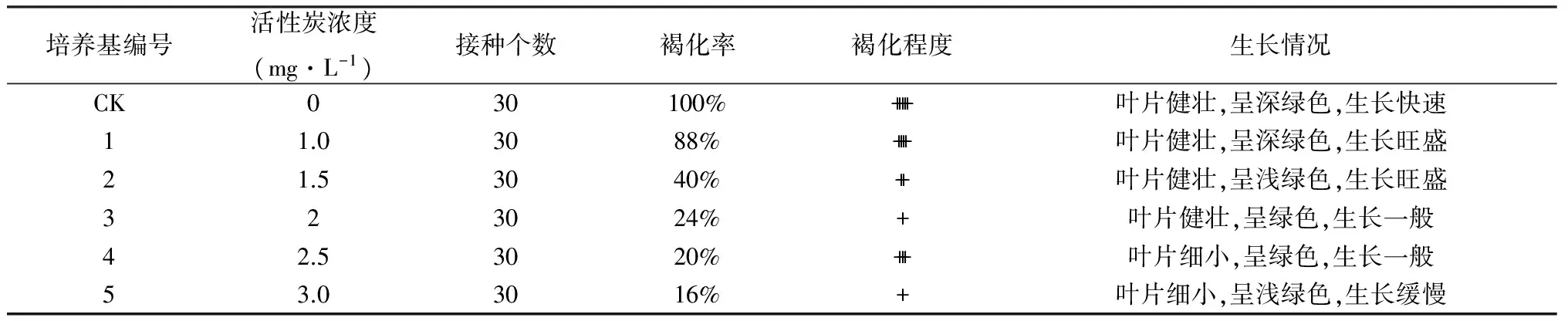
表6 活性炭对桑芽褐化影响统计表

活性碳浓度(mg/L):a.1.0; b.1.5; c.2: d.2.5; e.3.0
3 小结与讨论
3.1 外植体选择和消毒
选择4—9月的桑芽,可使增殖率提高。同时中午温度相对更高,桑芽生长旺盛,可以保证携带的病毒更少。而外植体的消毒灭菌方式在植物组培中至关重要,因此无菌体系的建立是植物组培的关键。曹伟等人通过实验,发现自来水冲洗15 min,酒精消毒0.5 min,5 %次氯酸钠消毒7 min利于“龙桑一号”幼嫩的茎段的试管内增殖[20]。李瑞雪等人用75 %的酒精消毒15 s后用0.1%氯化汞(HgCl2)溶液消毒10 min最佳,研究中也发现酒精和升汞具有较好的消毒效果[21]。但是,重金属盐杀菌剂氯化汞(HgCl2)是剧毒药品,对人体和环境都有危害。相比之下,次氯酸钠(NaClO)作用更温和,但对材料的消毒不如氯化汞彻底。综合考虑,本实验采用酒精与次氯酸钠组合的消毒方式。
3.2 丛芽诱导增值
在桑芽诱导不定丛芽的阶段,不同激素种类及浓度配比对桑芽增值生长有不同影响,细胞分裂素能促进细胞分裂增长,诱导桑芽的分化,生长素促进细胞伸长生长,当细胞分裂素与生长素比值高时,能促进桑芽生长[22]。仝爱群、李瑞雪等人试验发现6-BA、2,4-D 的浓度对组织培养桑芽分化均存在显著差异;刘佳试验得出经6-BA处理的增殖系数始终高于TDZ;本实验结果分析得出6-BA、2,4-D、IBA对桑芽丛芽诱导增殖生长都有显著影响,选用6-BA 1.7 mg·L-1+ 2,4-D 0.03 mg·L-1+ IBA 0.05 mg·L-1激素的组合,桑芽的丛芽诱导增值倍数效果最好,而6-BA 1.2 mg·L-1+ 2,4-D 0.02 mg·L-1+ IBA 0.15 mg·L-1激素组合的培养基对桑芽诱导的生长最有利。桑芽接种一个周左右,可以观察到两片幼叶开始展开,实验中2号、3号、8号、9号培养基中叶片生长较健壮,1号、4号培养基次之,而实验5号、6号、7号培养基中的叶片普遍较小,但总体来看,基本上都没有出现叶片蜷缩的不良现象。另在试验中发现,3号、8号以及9号培养基中的组培苗出现了生根现象且褐化相对严重,这说明,当细胞分裂素与生长素增加到一定浓度时,可以同时实验分化和生根的诱导,细胞分裂素过高时,更易出现褐变,这与刘佳等人的研究发现相似。
3.3 生根培养
桑芽组织培养实验中,生根较难,王琳等探究了桑芽在各种不同生根培养基中的生根情况,选择出1/2 MS + 0.10 mg·L-1NAA作为桑芽组培苗的最佳生根培养基[23];杨金福等人以1/2 MS+1 mg·L-1IBA 或 1/4 MS + 1 mg·L-1IBA 为基本培养基进行生根培养,生根率可达到98%[24];仝爱群用不同浓度NAA对桑组培苗进行生根诱导,最少生根数为3,其余普遍根数在3.6~3.8;刘佳通过实验IBA浓度为0.6 mg·L-1时,生根率接近90%,生根效果好[25]。而本实验选择生长培养基中生长状况良好的桑芽用于生根培养,1/2MS 添加不同浓度IBA,最早11 d左右就可以观察到生根发生,其中,对诱导生根的最佳培养基是3号IBA浓度为1.0 mg·L-1,生根率达到67%,平均根数为7,平均根长6.8 cm,根系粗壮且长,叶片生长正常。从结果可看出,使用IBA的诱导生根率不如前人,但从诱导根数、根长以及根的生长情况来看,本实验效果更佳。5号培养基中IBA浓度为2.0 mg·L-1,诱导桑芽生根较差,而在前人研究中也发现NAA与IBA在浓度大于0.8 mg·L-1时,生根诱导能力会出现一定的下降,所以推测IBA浓度过高时,对桑芽生根的诱导能力会相对减弱。
3.4 活性炭对褐化的抑制作用
木本植物的组织培养中很容易出现褐化现象。活性炭对褐化有抑制作用,但长时间高浓度处理也会抑制生长和增殖;李萍等研究发现木本植物牡丹在进行活性炭2.0 g·L-1的4 d短期处理,不仅能抑制褐化,还能促进增殖生长;不同浓度的活性炭对桑组培苗的褐化抑制作用不同,从本次实验结果来看,其中最好的是3号和5号,即2 g·L-1和3 g·L-1的活性炭作用相对较好。同时,活性炭在抑制桑芽褐化时也会对其增殖分化产生一定负效应,可以看到5号3 g·L-1浓度的负效应最明显。综合比较褐化情况和生长情况,培养基中活性炭浓度在1.5-2.0 g·L-1为最佳选择。另外,褐化程度与培养基的软硬程度,消毒方式、光照时间、转接时间,外植体材料的选择等都有一定关系,但在选择时,应考虑经济与简便性,同时不同褐化剂对褐化的具体抑制机理等研究还较少见报道,有待在后续的试验中进一步加以探究。
3.5 炼苗移栽
邱璐研究报道提出,炼苗时用1/2珍珠岩加1/2腐殖土,解决了营养、透气、保水问题,炼苗效果最好[26]。相关研究中也提到,不同基质中纯沙和泥沙、珍珠岩体积比为1∶1∶1时最利于桑苗植株的生长,纯沙与泥、沙、珍珠岩体积比为1∶1∶1时,两种基质可显著促进根重增长[27];本实验发现通过水培法,将组培桑苗先在水中培养5~7 d后,再移栽到土中,成活率100%,通过该方法可以大大节省组培的成本。
[1] 陈慧民,陈修渠,孙满芝.用嫩茎组织培育桑树试验[J].山东蚕业,1998,3: 2.
[2] 秦俭,何宁佳,黄先智,等.桑树生态产业与蚕丝业的发展[J].农业科学,2010,36(6): 984-989.
[3] 徐宪立,马克明,傅伯杰,等.植被与水土流失关系研究进展[J].生态学报,2006,26(9): 3137-3143.
[4] 杨海霞,朱祥瑞.1-脱氧野尻霉素 (DNJ) 的研究进展[J].蚕桑通报,2003,34(1): 6-10.
[5] 杨海霞,朱祥瑞.桑叶片培养中影响因子的研究概况[J].蚕桑通报,2002,33(2): 5-8.
[6] 谈建中.植物激素与外植体种类对愈组织初代培养不定芽分化影响初探.苏州蚕桑专科学校学报.1991(2):6-89
[7] 谈建中.桑树组织培养研究综述[J].江苏蚕业,1991,13(4): 1-6.
[8] ZHU H,WEI P,CEN X,et al.Effects of exogenous hormones on subculture multiplication and root Induction of tissue-cultured seedlings of mulberry[J].Agricultural Science & Technology,2014,15(5): 760.
[9] 赵艳燕.桑树组培快速繁育,脱毒及原生质体分离技术的研究[D].泰安:山东农业大学,2010.
[10] 董晓鸣.桑树侧芽的组培快繁技术初探[J].上海农业科技,2007 (6): 101-102.
[11] 马凤桐,刘玉荣成龄桑树冬芽分离培养的研究[J].蚕业科学,1985,11(1):80-81
[12] 黄科,唐婧,刘自震,等.生长素和细胞分裂素对桑树离体繁育的影响[J].西南大学学报(自然科学版),2015,37(3): 28-34.
[13] 李萍,成仿云,张颖星.防褐剂对牡丹组培褐化发生,组培苗生长和增殖的作用[J].北京林业大学学报,2008,30(2): 71-76.
[14] 王照红,杜建勋,孙日彦,等.延缓桑树组培苗褐化的措施探讨[J].北方蚕业,2008,29(1): 28-29.
[15] 王照红,衣葵花,周象海,等.几种药物抑制桑树组培苗褐化的研究[J].山东农业科学,2008 (7): 69-70.
[16] 王秀丽,杨煜,徐平丽,等.植物组织培养的应用及进展[J].山东农业科学,2005 (3): 78-80.
[17] 黄艳红.桑树高频再生体系建立与遗传转化体系研究[D].泰安:山东农业大学,2007.
[18] 王玉珍,徐进,罗景兰,等.草樱花组培快繁技术的研究[J].山东农业科学,2004 (6): 6-8.
[19] YADAV U,LAL M,JAISWAL V S.Micropropagation of Morus nigra L.from shoot tip and nodal explants of mature trees[J].Scientia Horticulturae,1990,44(1): 61-67.
[20] 曹伟.“龙桑一号”组织培养关键技术的研究[D].哈尔滨:东北林业大学,2011.
[21] 李瑞雪,汪泰初,胡飞,等.桑树顶芽组织培养快繁技术研究[J].北方蚕业,2011,31(4): 10-12.
[22] 田晖.桑树组织培养快繁技术研究[J].浙江农业科学,2009,(4): 831.
[23] 王琳.利用组织培养技术繁育桑树无毒苗[D].镇江:江苏科技大学,2013.
[24] 杨金富,余茂德,徐立,等.桑树试管苗生根因素研究[J].蚕学通讯,2002,22(3): 1-5.
[25] 刘佳.黑龙江省三种桑树组织培养体系建立的初步研究[D].哈尔滨: 东北林业大学,2010.
[26] 邱璐,陈善娜,杨跃仙,等.云桑组织培养中褐化问题的研究[J].蚕业科学,2000,26(2): 118-119.
[27] 仝爱群.桑树组培快繁技术研究[D].泰安: 山东农业大学,2007.
ResearchonTissueCultureofMulberryBuds
Liu Songqing,Feng Hong,Qi Weiliang,Zhang Shuo,Ruan Mei,Gong Biran,Ren Yinghong*
( College of Chemistry and Life Science,Chengdu Normal University,Chengdu 611130,China)
The stem germination numbers varied with seasons,and the stems in summer were suitable as explants.With young stem segment of mulberry bud of Husang32 as explants,mulberry buds and root induction were studied on MS and 1/2MS basal medium supplemented with different hormone combinations including BA and 6-BA,2,4-D ,respectively.The results suggested that optimum combination of 6-BA 1.7 mg·L-1+ 2,4-D 0.03 mg·L-1+ IBA 0.05 mg·L-1could markedly enhance the formation of mulberry buds induction rate.The optimal concentration of IBA 0.05 mg·L-1is beneficial to shoot induction.Activated carbon dosage could markedly affect the phenomenon of material browning.In the process of acclimatization,culturing for five to six days in water before transplanting in soil could improve the survival rate.
mulberry buds;issue culture;activated carbon;browning
10.3969/j.issn.1006-9690.2017.05.010
2017-02-16
四川省科技厅应用基础项目(2015JY0144); 四川省教育厅创新团队项目(15TD0036 );成都师范学院科研项目(CS14CX03)。
刘松青(1969—),男,博士,副教授,研究方向:微生物资源与生物技术。E-mail:biosq@126.com
*通讯作者:任迎虹(1964—),女,教授,研究方向:植物遗传育种。E-mail: renyinghong@163.com
S888.3
A
1006-9690(2017)05-0040-05
