泽漆总黄酮的制备工艺及神经保护活性
2017-11-10AunRaza欧阳臻
陈 健,谢 清,Aun Raza,汤 建,欧阳臻
(江苏大学 药学院,江苏 镇江 212013)
泽漆总黄酮的制备工艺及神经保护活性
陈 健,谢 清,Aun Raza,汤 建*,欧阳臻
(江苏大学 药学院,江苏 镇江 212013)
以总黄酮和金丝桃苷为考察指标,通过静、动态吸附和解析实验,对三种阴离子交换树脂和三种大孔吸附树脂进行筛选,确定制备泽漆总黄酮的工艺。优选FPA98阴离子交换树脂制备泽漆总黄酮,提取液与树脂的比例100∶1(v/w),以pH 2 的70%甲醇洗脱。FPA98树脂吸附总黄酮的效率为47.86 mg/g,总黄酮解析率为88.7%。产品中总黄酮和金丝桃苷含量分别为48.3%和10.3%。进一步纯化后的泽漆总黄酮对鱼藤酮诱导的神经细胞损伤有较好的保护作用。
泽漆;阴离子交换树脂;总黄酮;金丝桃苷;神经保护
金丝桃苷具有抗炎镇痛、抗氧化、抗癌、抗微血栓形成及保护心脑缺血损伤等药理活性[1]。金丝桃苷目前的来源有化学合成和植物提取等方法,市场上提供的金丝桃苷以植物提取为主[2]。前期研究[3]中发现野生植物泽漆资源丰富,且富含金丝桃苷及2''-O-没食子酰基金丝桃苷(2''-O-galloyl hyperoside),后者在碱性条件下(pH 9~11)可以水解失去没食子酰基变为金丝桃苷。本文采用大孔树脂和阴离子交换树脂,处理泽漆药材的碱性提取液,优化制备富含金丝桃苷的泽漆总黄酮的工艺,并初步测定其神经保护活性,为金丝桃苷的工业化生产以及中药材泽漆的综合利用提供依据。
1 材料与仪器
泽漆药材于2015年4月收集于江苏镇江,经本院欧阳臻教授鉴定为大戟科大戟属植物泽漆(EuphorbiahelioscopiaL.)。全草粉碎(10~20目) 后冷藏备用。金丝桃苷对照品为本实验室自制,纯度>95%。离子交换树脂:FPA90、FPA98、D201,大孔吸附树脂:XAD7HP、HP20、AB-8。甲醇(色谱纯)、双纯水,其他化学试剂均为分析纯。
Sartorius电子天平;LC-20A高效液相色谱仪(Shimadzu);PCS型紫外-可见分光光度计;R-21旋转蒸发仪(BUCHI)。
2 方法与结果
2.1 UV法测定泽漆总黄酮含量[4]
精密称取芦丁标准品用乙醇溶解,制备系列浓度的标准品溶液。以30%的乙醇为参比置于510 nm测定吸光度,以浓度对吸光度值做标准曲线:
Y=9.2436X+0.0036,R2=0.9996。
2.2 HPLC-UV测定金丝桃苷含量[5]
色谱柱为Gracesmart RP -C18柱(4.6 mm×250 mm,5 μmol/L);流动相为甲醇-水(40∶60);流速:0.8 mL/min;柱温:20 ℃;检测波长:360 nm;进样量20 μL。
精密称取金丝桃苷标准品用乙醇溶解,制备系列浓度的标准品溶液。HPLC测定,以浓度(X)对峰面积(Y)制备标准曲线:Y=32483986X-693.354,R2=0.9997。对照品及样品依上述条件检测,HPLC图如图1。

图1 HPLC图
2.3药材提取液的制备
根据前期工作的基础,选取干燥的泽漆药材,用30%乙醇(NaOH,pH 10)提取,料液比为20∶1,20 ℃下浸渍12 h。
2.3 泽漆总黄酮的制备
2.3.1 树脂的筛选[4-5]
精确称取预处理过的1 g树脂,分别加入100 mL的吸附液,期中三种离子树脂所用吸附液pH 10,三种大孔树脂所用吸附液提前用5% HCl调pH至6左右。静置、吸附24 h。用UV和HPLC两种方法检测提取液中剩余总黄酮和金丝桃苷的浓度,计算树脂对黄酮的吸附量(表1)。再将液体抽滤,树脂加入100 mL 70%甲醇(大孔树脂)或pH 2 70%甲醇(阴离子树脂)中,用UV和HPLC两种方法检测浸出液中总黄酮和金丝桃苷的浓度,计算解析率(表1)。根据表1中数据,选取FPA98阴离子交换树脂进一步优化制备泽漆总黄酮的工艺。

表1 不同树脂对总黄酮和金丝桃苷的静态吸附量和解析率(n=3)
2.3.2 FPA98树脂吸附性能
(1)FPA98树脂饱和吸附量的确定。FPA98树脂4份(1 g)分别加至60 mL、80 mL、100 mL和120 mL泽漆提取液(pH 10)中,静态吸附24 h后测液体中总黄酮浓度,计算FPA98树脂的饱和吸附量。如图2(A)所示,加入100 mL或更多提取液,树脂达到饱和吸附状态,提取液与树脂的比例达100∶1(v/w)。
(2)吸附过程。将 1 g FPA98树脂加入100 mL泽漆提取液(pH 10)中,间歇振荡,每隔6 h取1 mL液体,UV测树脂吸附总黄酮的量直至饱和为止,结果如图2(B)所示,12 h即接近饱和吸附量,12~24 h吸附量增加缓慢。为了尽可能吸附金丝桃苷等黄酮,后续静态实验中吸附时间设为24 h。
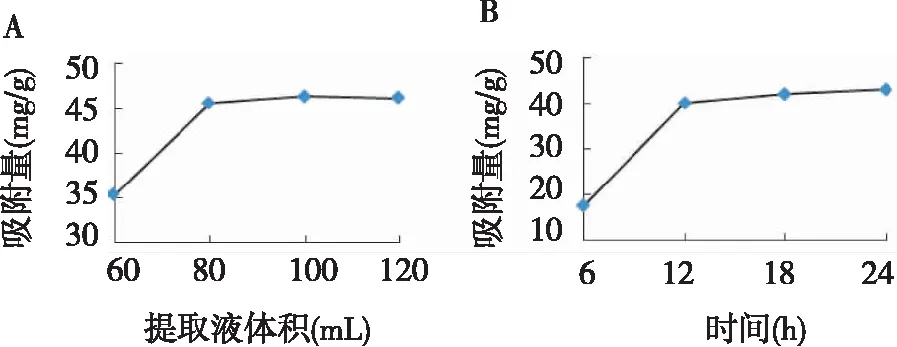
图2 FPA98树脂静态吸附参数图
2.3.3 FPA98树脂解析性能
(1)解析过程。将上述达饱和吸附状态的树脂加至100 mL 70%甲醇(pH 2)中,每隔6 h取1 mL UV检测浸出液,计算总黄酮解析率,结果如图3(A)所示,12 h解析率达82.0%,12~24 h解析率增长缓慢,24 h解析率达85.6%。
(2)甲醇含量的确定。将FPA98树脂4份(1 g)分别加入100 mL的提取液中,静置24 h后滤除液体。树脂分别加入pH值为2的30%、50%、70%、90%的甲醇,UV检测浸出液,计算总黄酮解析率,结果如图3(B)所示,70%甲醇(pH 2)解析效率最高。
(3)洗脱液pH值的确定。将FPA98树脂4份(1 g)分别加入100 mL的提取液中,静置24h后滤除液体。树脂分别加入pH值分别为1、2、3和4的70%甲醇,UV检测,计算总黄酮解析率,结果如图3(C)所示,pH 2的70%甲醇的解析效率最高。

图3 FPA98树脂静态解析参数图
2.3.4动态吸附泄露曲线考察
称取FPA98树脂40 g,置于玻璃层析柱中(2.5 cm × 24 cm),泽漆提取液(0.6 mg/mL)上样,流速1.5 mL/min,进行动态吸附。每0.5 L收集1次,UV和HPLC测流出液中总黄酮和金丝桃苷的含量,计算泄露曲线(图4:A)。2.0 L后流出液中总黄酮含量明显增加,未吸附的总黄酮比例超28%,3.5 L后流出液中总黄酮含量快速增加。金丝桃苷泄露比例在3.0 L后开始增加,4.0 L后快速增加,说明40 g FPA98树脂对3.0 L左右泽漆提取液中的金丝桃苷具有比较充分的吸收。
2.3.5 动态解析曲线考察
最优吸附条件上柱,充分吸收后用70%甲醇(pH 2)洗脱,流速1.0 mL/min,UV和HPLC测洗脱液中总黄酮和金丝桃苷的含量(图4:B)。金丝桃苷的解析速度略慢于总黄酮,1.5 L 70%甲醇(pH 2)即可将2.3.4操作中所吸附的黄酮基本解析完全。
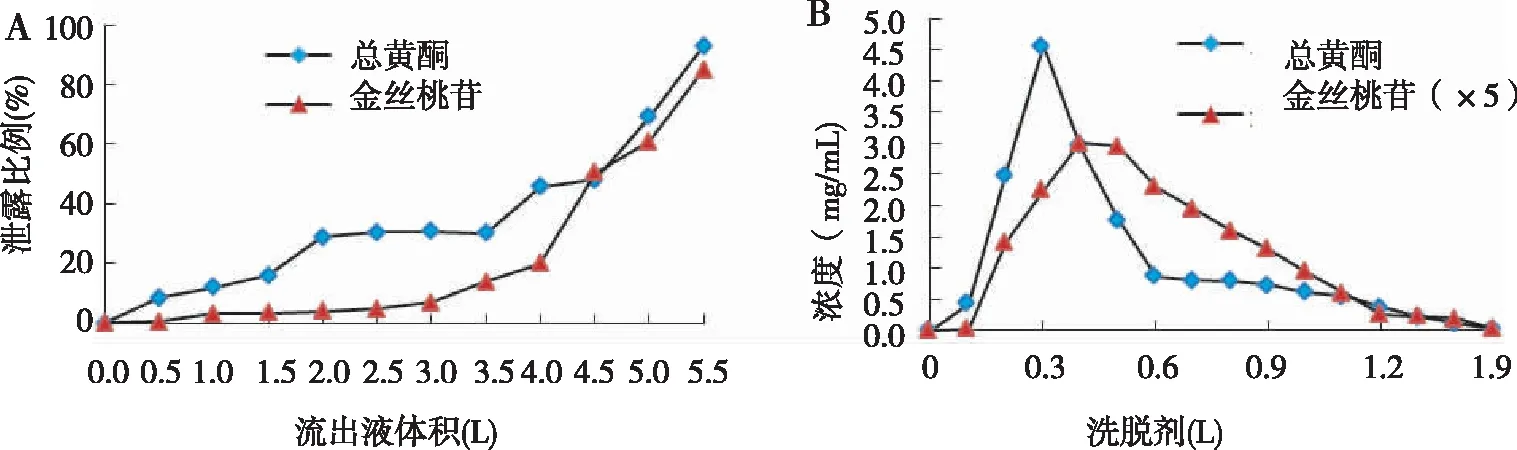
图4 FPA98树脂泄露曲线(A)和解析曲线(B)
2.3.6泽漆总黄酮的纯化
利用HW-40C凝胶柱(3.0 cm × 25 cm)进一步纯化泽漆总黄酮[3],分别以25%和70%甲醇洗脱,流速2.0 mL/min。TLC跟踪,25%甲醇(0.4 L)洗脱部位中几乎无黄酮成分,收集70%甲醇洗脱部位,蒸除容积,得泽漆总黄酮。
FPA98阴离子树脂制备产品中总黄酮和金丝桃苷含量分别为48.3%和10.3%,利用HW-40C凝胶柱进一步纯化后,其含量分别为76.6%和17.7%。
2.4泽漆总黄酮对神经细胞的保护作用[6-7]
测试2.4.6操作制备的总黄酮的神经保护作用。将SH-SY5Y细胞(0.6 ×104个/孔),加入96孔板中,5%CO2培养箱孵育过夜。次日加药,设0.8,4.0,20 和100 μg/mL 4个浓度,每个浓度设3个复孔,加药4 h后鱼藤酮(0.5 μmol/L)损伤细胞。继续孵育48 h,离心,除去上清液后加入MTT,孵育反应3~4 h。除去上清液,加入DMSO溶解。在酶标仪上570 nm处检测,计算抑制率。鱼藤酮组细胞存活率为55.8%,泽漆总黄酮组的细胞存活率分别为53.4%,54.3%,59.0%和65.5%,金丝桃苷组(1 μmol/L)细胞存活率为78.3%。说明泽漆总黄酮具有一定程度的保护鱼藤酮损伤SH-SY5Y细胞的作用,但其作用强度弱于单一成分金丝桃苷。
3 结论与讨论
金丝桃苷等黄酮类化合物在抗炎、神经保护、特别是心脑血管疾病方面具有良好的应用潜力[1,8]。本文采用FPA98阴离子树脂制备泽漆总黄酮,碱性提取液直接柱层析吸附,酸性甲醇水溶液洗脱,制备工艺简单,产率高,产品中黄酮含量较高。由于柱层析过程中阻力较大,液体流速较慢,需要给与0.01 MPa左右的压力,故未考察流速对吸附和解析的影响。经HW-40C凝胶柱进一步纯化后,泽漆总黄酮含量76.6%,其中金丝桃苷含量高达17.7%。经凝胶柱纯化后的泽漆总黄酮对鱼藤酮损伤的SH-SY5Y细胞具有一定程度的保护作用,但作用强度弱于所含质量的金丝桃苷,说明总黄酮中可能含有拮抗性成分,干扰了金丝桃苷的神经保护作用,这需要进一步研究加以确证。本文为泽漆总黄酮在神经保护及心脑血管疾病方面的应用提供了初步的科学依据。
[1] 李锦松,陈剑鸿,孟民杰.金丝桃苷药理作用及其作用机制的研究进展[J].广东药学院学报,2015,31(2): 269-272.
[2] 王燕,王先荣,马凤余,等.金丝桃苷在植物中的分布及其含量测定[J].安徽医药,2009,13(11): 1312-1315.
[3] 汤建,杨守士,龚玺.泽漆作为制备2''-O-没食子酰基金丝桃苷和金丝桃苷原料的应用及制备方法: 103012521A [P].2013-04-03.
[4] 马瑞丽,李敏,徐秀泉,等.大孔吸附树脂制备尾叶香茶菜总二萜的工艺研究[J].中成药,2014,36(4): 848-851.
[5] 欧阳玉祝,车少林,黄伟涛.大孔树脂吸附法分离海金沙总黄酮的研究[J].中国野生植物资源,2010,29(6): 40-43.
[6] 冯波,王蓉,盛树力.神经退行性疾病研究中拟神经细胞模型: 人神经母细胞瘤株 SH-SY5Y 的来源特性及应用[J].中国临床康复,2006,10(6): 121-123.
[7] 崔群力,孙圣刚.姜黄素通过抗氧化作用拮抗鱼藤酮致 PC12 细胞损伤的研究[J].华中科技大学学报(医学版),2010,39(1): 37-41.
[8] 林萍,易宏伟,张斐.金丝桃苷药理作用研究进展[J].中国现代中药,2012,14(10): 23-26.
PreparationProgressandNeuroprotectiveEffectofTotalFlavonoidsfromEuphorbiahelioscopia
Chen Jian,Xie Qing,Aun Raza,Tang Jian*,Ouyang Zhen
(School of Pharmacy,Jiangsu University,Zhenjiang 212013,China)
To prepare total flavonoids ofEuphorbiahelioscopia,three types of ion exchange resins and three types of macroporous resins were studied in adsorption and desorption tests,according to the contents of total flavonoids and hyperoside.The resin FPA98 and eluent of 70% methanol (pH 2) were selected,with the liquid-resin ratio 100∶1 (v/w).One gram of resin FPA98 could adsorb 47.86 mg of total flavonoids,with desorption ratio of 88.7%.The contents of total flavonoids and hyperoside were 48.3% and 10.3%.The purified total flavonoids fromE.helioscopiahad good neuroprotective effect on the SH-SY5Y cells.
Euphorbiahelioscopia; anion exchange resin; total flavanoid; hyperoside; neuroprotective effect
10.3969/j.issn.1006-9690.2017.05.006
2017-01-08
国家自然基金(81573529); 江苏省中医药局科技项目(YB2015186)。
陈健,主要从事天然活性成分分离鉴定研究。E-mail: chenjian1993@outlook.com
*通讯作者:汤建,E-mail: jt.u@hotmail.com
R285
A
1006-9690(2017)05-0024-03
