响应面法优化酶法提取枸杞多糖的研究
2017-11-10孙达锋
夏 凡,周 胜,孙达锋
(1.南京科技职业学院 生物与环境学院,江苏 南京210048;2.南京科技职业学院 信息技术学院,江苏 南京210048;3.南京野生植物综合利用研究院,江苏 南京 210042)
响应面法优化酶法提取枸杞多糖的研究
夏 凡1*,周 胜2,孙达锋3
(1.南京科技职业学院 生物与环境学院,江苏 南京210048;2.南京科技职业学院 信息技术学院,江苏 南京210048;3.南京野生植物综合利用研究院,江苏 南京 210042)
选用响应面法优化及正交实验法进行淀粉酶提取枸杞多糖实验设计及分析。通过单因素实验后,正交实验确定淀粉酶酶解提取枸杞多糖的最佳条件为:pH=5.0,温度50 ℃,时间80 min,加酶量为0.5%,枸杞多糖提取率12.1%;响应面分析确定淀粉酶酶解提取枸杞多糖的最佳条件为酶解温度49.56 ℃、酶解时间140 min、酶浓度0.3%,枸杞多糖提取率为13.25%。酶法提取枸杞多糖比传统热水浸提提高了枸杞多糖的提取率,反应条件温和,而且通过响应面法进行实验设计和优化比正交实验法能得到更高的枸杞多糖提取率。
响应面法优化;正交实验法优化;淀粉酶;枸杞多糖;对比研究
枸杞又名枸杞子,含有丰富的胡萝卜素、多种维生素和钙、铁等对眼睛健康作用的必须营养物质,所以别名“明眼子”。对于治疗肝血不足、肾阴亏虚等引起的视物昏花和夜盲症,有着明显的疗效[1]。枸杞之名始见于《神农本草经》,并列为上品,千百年来深受人们的喜爱。枸杞子对于人体的健康有着重要的意义,是人们不可缺的健康果实[2]。前辈学者对枸杞多糖的试验研究发现枸杞多糖(LBP)是一种水溶性多糖,由阿拉伯糖、葡萄糖、半乳糖、甘露糖等六种单糖成分组成,具有生理活性,其能够增强非特异性免疫功能,提高抗病能力,抑制肿瘤生长和细胞突变[3]。枸杞多糖(LBP)可明显提高吞噬细胞的吞噬功能,提高T淋细胞的增殖能力。其不仅是一种调节免疫反应的生物反应调节剂,而且可以通过内分泌—免疫调节网络发挥抗癌作用[4]。枸杞多糖(LBP)对于消除疲劳具有十分明显的作用,降血糖枸杞多糖能明显增强受损胰细胞内超氧化歧化酶(SOD)的活性,提高胰岛细胞的抗氧化能力,减轻过氧化物对细胞的损伤,降低丙二醛生成量,对胰岛细胞有着一定的保护作用[5]。枸杞多糖可降低大鼠血压,增加降钙素基因相关肽的释放,防止高血压形成[6]。而且美容养颜、滋润肌肤皮肤衰老等由于自由基氧化所造成的也可以由具有强力的抗氧化剂的LBP、胡萝卜素等加上枸杞所含的微量元素硒和维生素E的协同作用组成强大的抗氧化部队,以起到美容养颜,滋润肌肤的作用[7]。正是因为枸杞多糖如此多的有利作用,作为食药两用的植物,本研究对枸杞多糖的提取意义很大。
如今对于枸杞多糖的提取研究工艺各种各样,介于水提法的试验时间长,效率低;碱提法的试验复杂仔细;超声波法提取的试验设备昂贵,要求实验员的技能水平高[8],而酶解法条件温和,有利于保护产物活性,低能环保,易于实现工业化,已被广泛应用到植物多糖提取上[9]。
响应面法(Response Surface Analysis,RSA)作为一种高效的工艺优化方法[10],具有周期短、实验次数少、得到回归方程精确度高的特点,也已广泛用于天然产物提取工艺优化[11-12]。然而,枸杞多糖的酶法提取尚未见RSA法的应用。 本文利用淀粉酶提取枸杞多糖,通过正交实验得到优化的提取条件,和采用Design-Expert软件,通过RSA法优化提取工艺参数。
1 材料与方法
1.1 材料与试剂
枸杞:宁夏产,宁夏中宁县杞里香枸杞开发有限公司;淀粉酶,活力为2 000~4 000 μg/mg·s,国药集团化学试剂有限公司;无水乙醇,分析纯,南京奥佳化工有限公司;硫酸,分析纯,扬州沪宝化学试剂有限公司;苯酚,分析纯,上海实意化学试剂有限公司;葡萄糖,分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
分析天平,FA210B,梅特勒-托利多仪器有限公司;电热恒温水浴箱,STC-15B,江苏省金坛市医疗仪器厂;分光光度计,722N,上海菁华科技仪器有限公司;离心分离器,江苏省金坛市医疗仪器厂;旋转蒸发仪,SY-2000,上海亚荣生化仪器厂; SHZ-D(Ⅱ)循环水式真空泵,河南省予华仪器有限公司; 真空冷冻干燥机。
1.3 方法
1.3.1 淀粉酶解枸杞多糖的实验流程
枸杞用温水(水温45 ℃、 50 mL)浸泡30 min,然后用打浆机进行打浆,用纱布过滤得到浆液。
准确称取一定质量的淀粉酶,并按照重量比加入蒸馏水,将其置于一定温度的水浴锅中活化30 min。称取枸杞20 g,加入酶,调节溶液的酸碱度,然后置于水浴锅中浸提,温度上升到90 ℃,酶失活30 min,冷却到室温,浓缩过滤,取上清液,即得多糖溶液,然后减压浓缩,加入无水乙醇进行沉淀操作,沉淀物质用95%的乙醇、蒸馏水反复洗涤,干燥得多糖粗样品,并称量重量,最后得其提取率[13]。
1.3.2 枸杞多糖的测定
采用苯酚-硫酸法[13]测定提取液中总糖。枸杞多糖的得率计算公式为[14]:
枸杞多糖得率=C×V1×N×10-3/(V2×m)×100%
式中:C—表示经过稀释后测定的多糖含量(μg);
V1—表示提取后得到的上清体积(mL);
N—表示稀释倍数;
V2—表示用于测定的上清体积(mL);
m—表示用于提取的干枸杞质量(mg)。
其它条件一定下,枸杞多糖提取率与枸杞多糖溶液浓度呈正相关关系,而枸杞多糖浓度与葡萄糖浓度呈正相关关系,而葡萄糖溶液的490 nm的吸光度又与其浓度呈现以上线性关系:y=9.6483x-0.0104,因此枸杞多糖提取率与枸杞多糖提取液在520 nm的吸光度呈线性关系,即枸杞多糖提取液在520 nm的吸光度大,其对应实验的枸杞多糖提取率也高。
1.3.3 淀粉酶解枸杞多糖单因素实验
淀粉酶提取枸杞多糖,主要是利用淀粉酶水解纤维素,使其组成枸杞细胞的细胞壁破裂,释放细胞壁内的枸杞多糖,而多糖释放的多少和淀粉酶的加入量有着直接的关系。本实验探讨淀粉酶提取枸杞多糖时,酶解温度、酶解时间、pH以及加水量对多糖的提取的作用,进行单因素实验,考察以上各因素对淀粉酶解枸杞多糖提取的影响。
1.3.4正交实验分析
在单因素实验的基础上,确定正交实验的因素与水平,由1.3.2知,枸杞多糖提取率与枸杞多糖提取液在520 nm的吸光度呈一次线性关系,以枸杞多糖提取液在520 nm的吸光度为结果,通过正交实验对淀粉酶酶解提取枸杞多糖的条件进行优化。
1.3.5 Box-Behnken 响应面分析
在单因素实验的基础上,确定Box-Behnken响应面分析实验的因素与水平,以枸杞多糖得率为响应值,通过响应面分析对淀粉酶酶解提取枸杞多糖的条件进行优化。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 加水量对淀粉酶解枸杞多糖提取率的作用
将条件设定为取20 g的枸杞平均分配到5个锥形瓶中,加水量分别为30、40、50、60、70、80 mL,pH=4.0、时间2 h、温度55 ℃、加淀粉酶0.5%,酶解后立即升温至85 ℃灭酶,之后热水浸提2 h,经离心后,测吸光度。
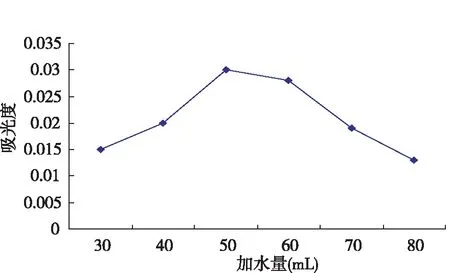
图 1 加水量对淀粉酶解枸杞多糖提取率影响
2.1.2酶解时间对淀粉酶解枸杞多糖提取率的作用
将条件设定为取20 g的枸杞平均分配到5个锥形瓶中,每个锥形瓶的加水量为50 ml,每个锥形瓶的酶解反应时间分别设置为20、40、60、80、100、120 min,其余同上2.1.1。
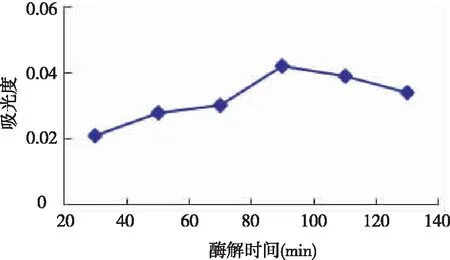
图2 酶解时间对淀粉酶解枸杞多糖提取率影响
2.1.3酶解温度对淀粉酶解枸杞多糖提取率的作用
将条件设定为取20 g的枸杞平均分配到5个锥形瓶中,每个锥形瓶的加水量为50 mL,每个锥形瓶的酶解反应温度分别设置为35、45、55、65、75、85 ℃,酶解时间为90 min,其余同上2.1.1。
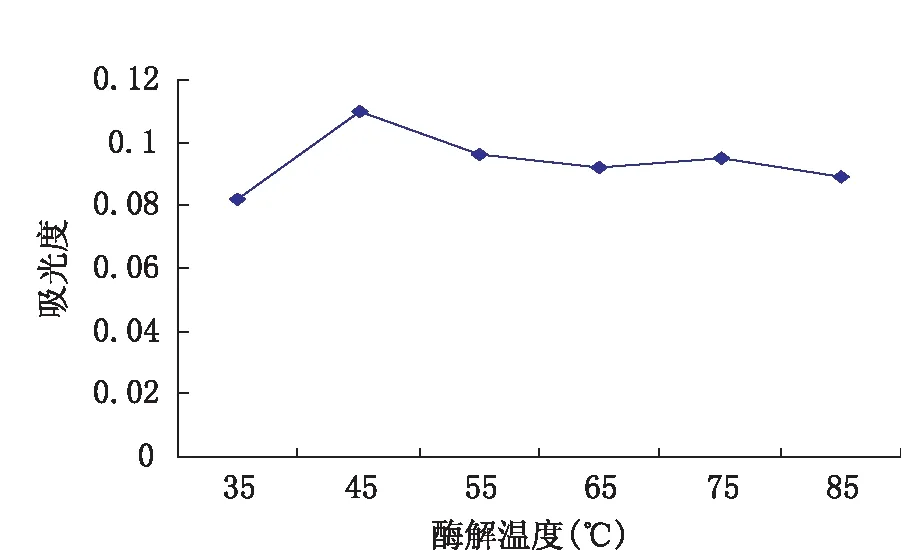
图3 酶解温度对淀粉酶酶解枸杞多糖提取率的影响
2.1.4加酶量对淀粉酶解枸杞多糖提取率的作用
将条件设定为取20 g的枸杞平均分配到5个锥形瓶中,每个锥形瓶的加水量为50 mL,酶解温度为45 ℃,pH=4.0、酶解时间为90 min、每个锥形瓶加淀粉酶量分别为0.3%,0.4%,0.5%,0.6%,0.7%,0.8%,其余同上2.1.1。
2.1.5 pH对淀粉酶解枸杞多糖提取率的作用
将条件设定为取20 g的枸杞平均分配到5个锥形瓶中,加水量50 mL,五个锥形瓶的pH 分别为3、4、5、6、7、8,酶解时间80 min、酶解温度45 ℃、加淀粉酶0.6%,其余同上2.1.1。
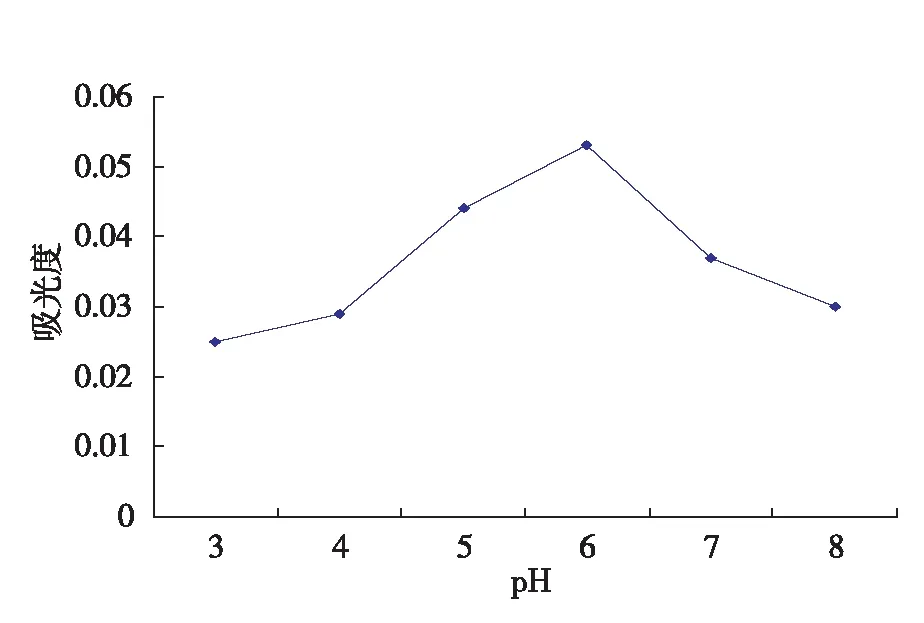
图5 pH对淀粉酶解枸杞多糖提取率的影响
2.2正交实验法对淀粉酶解枸杞多糖条件的优化
在单因素实验的基础上,固定加水量50 mL和pH=5的试验条件,选择酶解温度、酶解时间、酶浓度进行三因素三水平的正交实验设计,见表1、表2。
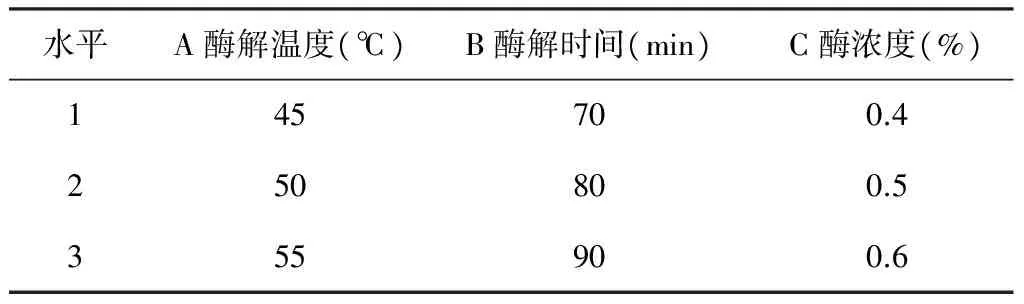
表1 正交试验因素水平表
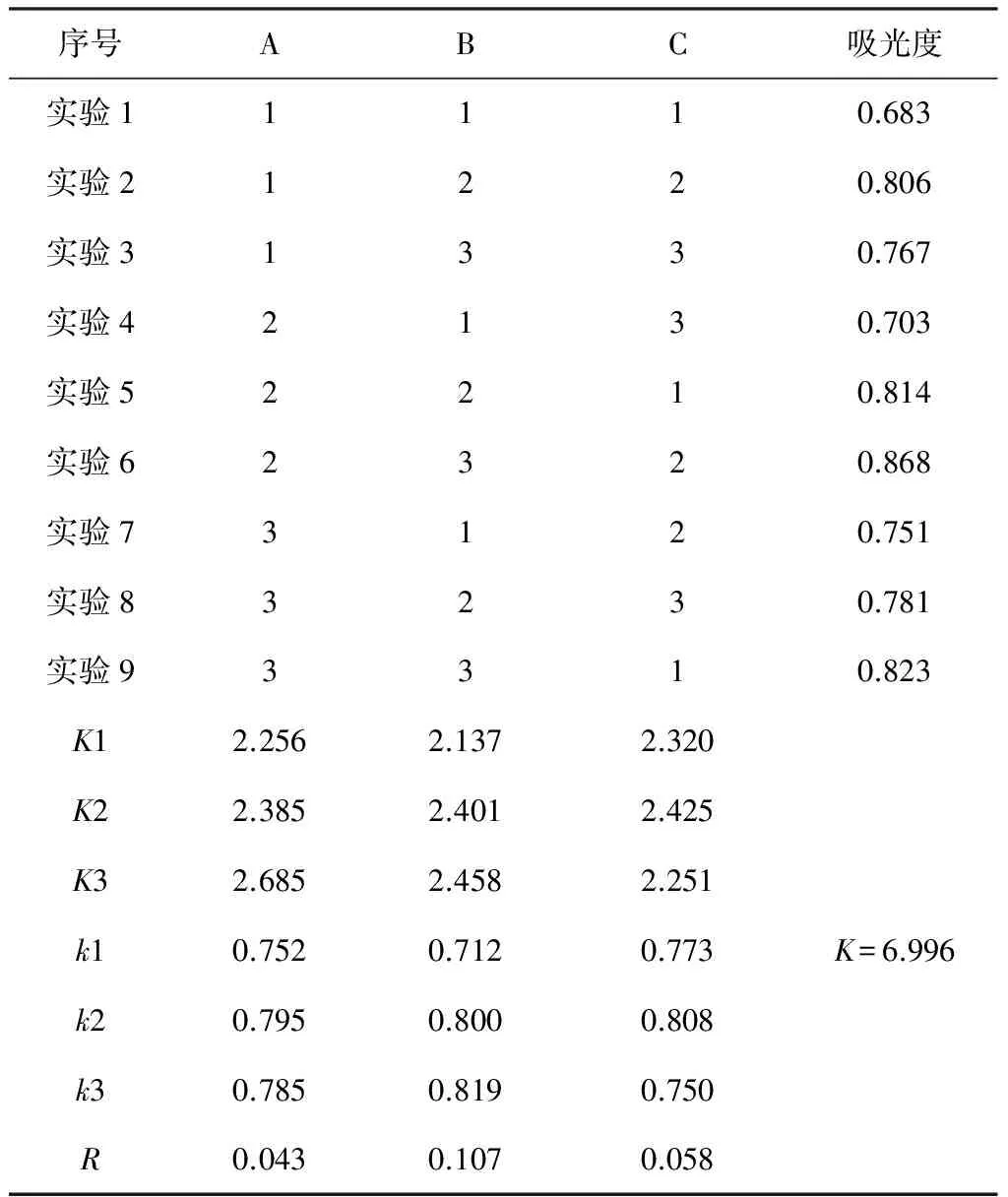
表2 正交试验设计方案及结果分析表
由表2分析结果可知,RB>RC>RA,淀粉酶提取枸杞多糖的提取率最高组合为B3C2A2,淀粉酶提取枸杞多糖的最合适条件为加水量50 mL,pH=5.0,温度50 ℃,时间80 min,加酶量为0.5%,枸杞多糖提取率12.1%。
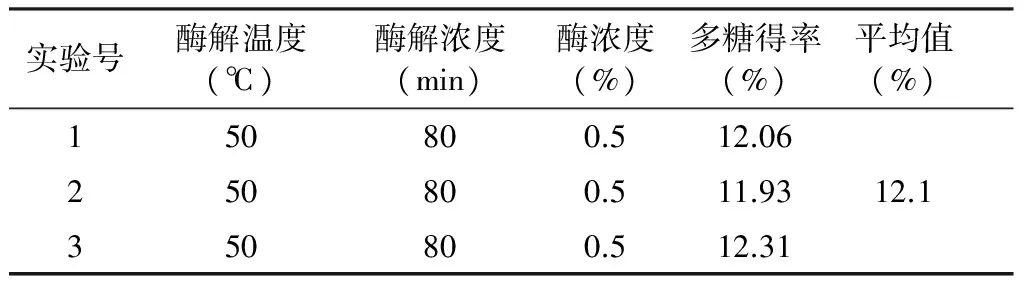
表3 最佳实验条件验证试验
2.3 响应面法对淀粉酶解提取枸杞多糖条件的优化
2.3.1 Box-Behnken实验
在单因素实验的基础上,固定加水量为50 mL、酶解pH5的实验条件,选择淀粉酶添加量、酶解温度和酶解时间进行3因素3水平的响应面实验分析。见表4、表5。
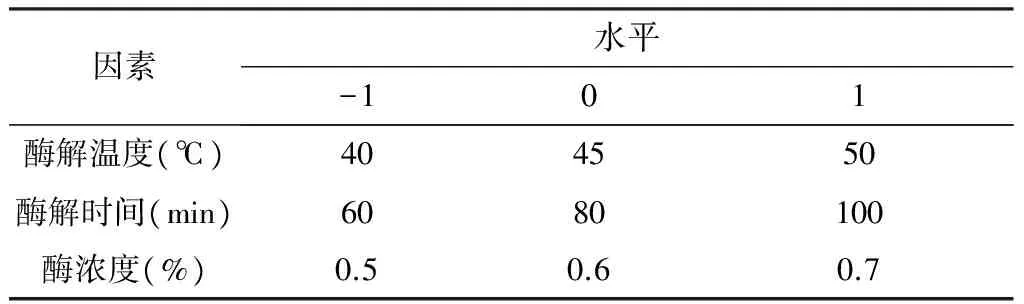
表4 响应面设计因素与水平编码值
2.3.2 响应面分析实验方案及结果
对淀粉酶法提取枸杞多糖进行响应面分析,见表5。
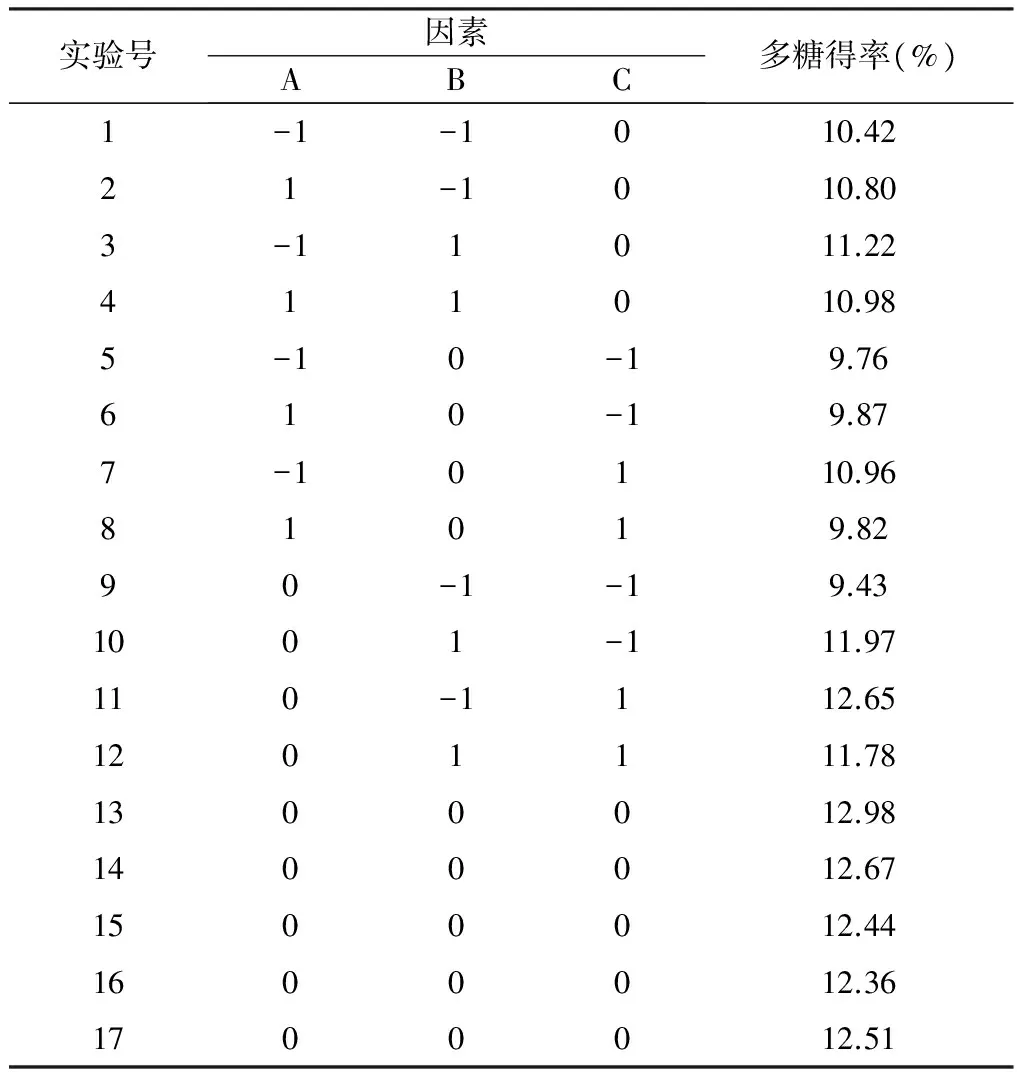
表5 Box-Behnken实验设计及实验结果
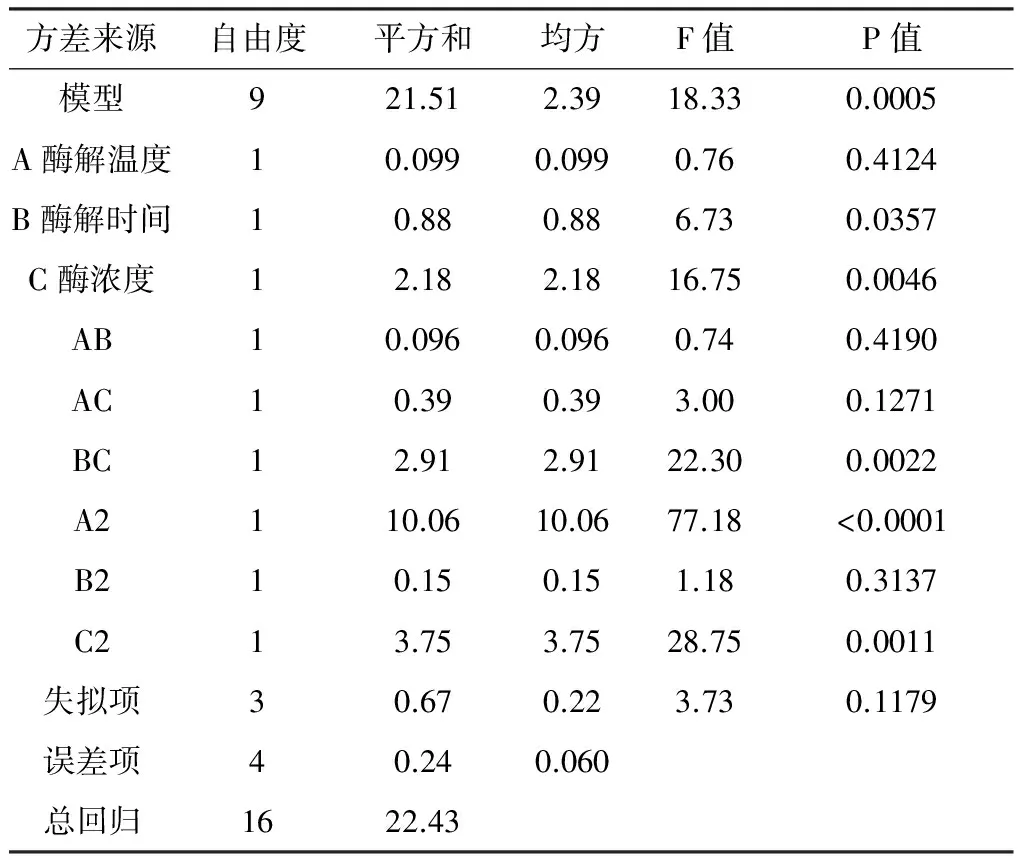
表6 二次回归模型的方差结果分析
2.3.3 二次回归模型的建立及其显著性检验
运用Design-Expert软件对表5 的实验数据进行多元回归拟合,得到枸杞多糖得率对(y)对酶解温度(x1)、酶解时间(x2)和酶浓度的二次多项回归方程为:y=12.59-0.11x1+0.33x2+0.52x3-0.16x1x2-0.31x1x2-0.85x2x3-1.55x12-0.19x22-0.94x32
用Design-Expert软件对17个实验点的响应值进行回归分析,方差分析结果见表6。模型的可靠性可从方差分析及相关系数来考察。当p<0.05,表示该项指标显著。由表3可知,模型(p=0.000 5)极显著,失拟项(p=0.117 9)不显著R2=0.959 3,Radj2=0.9070,因此该二次模型成立,可用于预测淀粉酶酶解枸杞多糖得率,优化酶解工艺条件。酶浓度对枸杞多糖得率影响高度显著,酶解时间较显著,酶解温度不显著。在所选取的各因素水平范围内,按照对结果的影响排序,其顺序为酶浓度>酶解时间>酶解温度。
2.3.4 因素间的交互影响
由图6可以看出,若酶浓度不变,酶解温度与酶解时间的交互作用对枸杞多糖得率的影响显著,多糖得率随酶解温度及酶解时间的增加而呈现由低到高再降低的趋势,即多糖得率在合适的酶解温度与酶解时间下具有极大值,该极大值存在于响应面的顶部即响应曲面的顶部,即响应面的最高点,也就是等高线最小的椭圆的中心点。
由图7可以看出,若酶解时间不变,酶解温度与酶浓度的交互作用对枸杞多糖得率的影响显著,多糖得率随酶解温度与酶浓度的增加而呈现由低到高再降低的趋势,即多糖得率在合适的酶解温度与酶浓度下具有极大值,该极大值存在于响应面的顶部,即响应面的最高点,也就是等高线最小的椭圆的中心点。
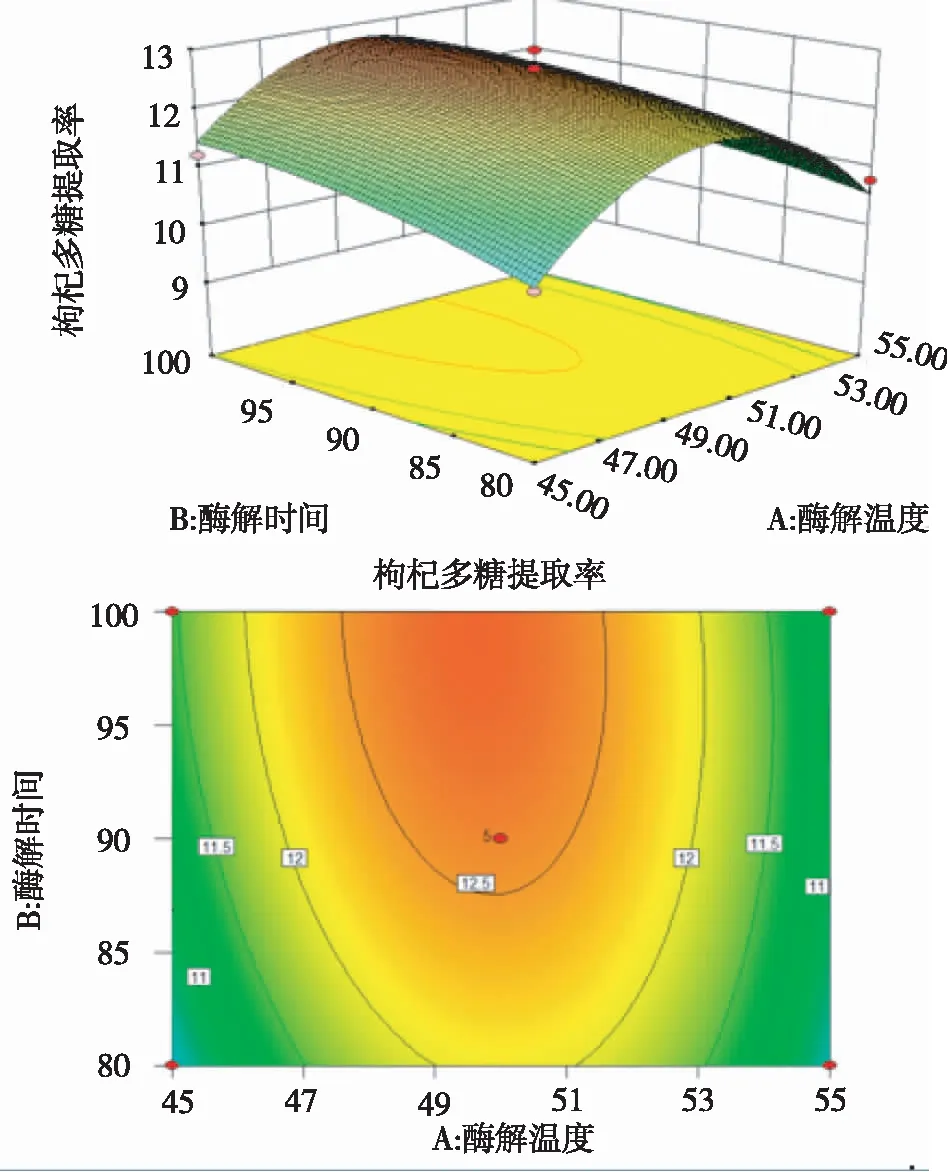
图6 酶解温度及酶解时间影响多糖得率的响应曲面图和等高线图
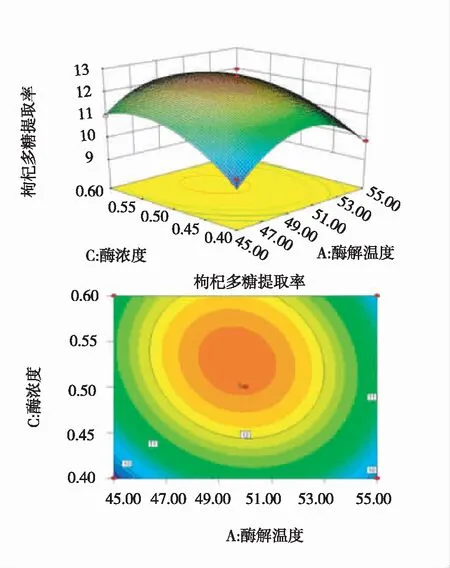
图7 酶解温度及酶浓度影响多糖得率的响应曲面图和等高线图
由图8可以看出,若酶解温度不变,酶解时间与酶浓度的交互作用对枸杞多糖得率的影响显著,多糖得率随酶解时间与酶浓度的增加而呈现由低到高再降低的趋势,即多糖得率在合适的酶解时间与酶浓度下具有极大值,该极大值存在于响应面的顶部,即响应面的最高点,也就是等高线最小的椭圆的中心点。
酶解温度与酶浓度对枸杞多糖提取得率的交互效应最为显著,表现为曲线较陡,酶解温度与酶解时间对枸杞多糖提取得率的交互效应次之,酶解时间与酶浓度对枸杞多糖提取得率的交互效应显著性差,表现为曲线较平滑。
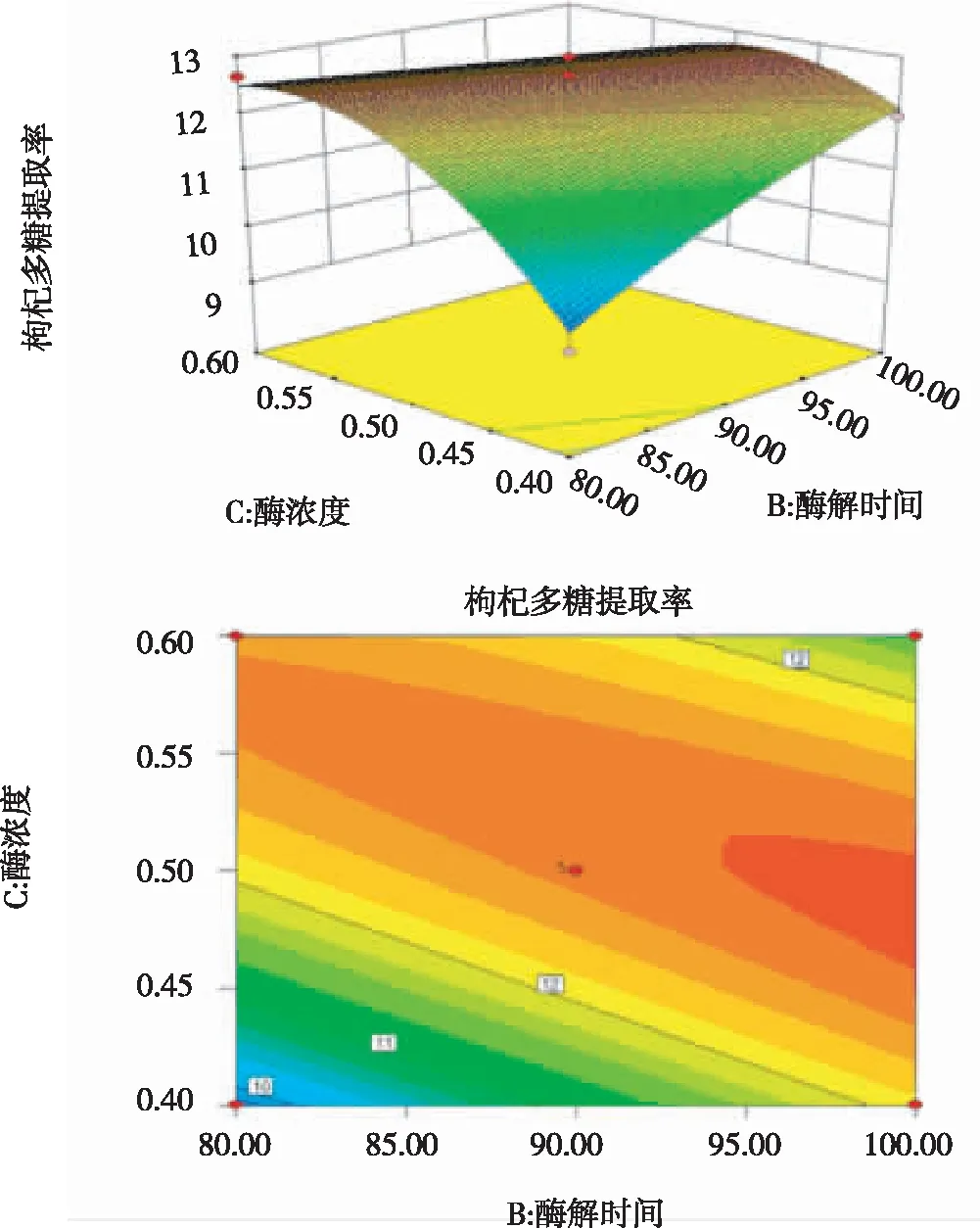
图8 酶解时间及酶浓度影响多糖得率的响应曲面图和等高线图
2.3.5 优化最佳组合条件
通过上述分析可知,合适的酶浓度、酶解时间、酶解时间有利于酶解法提取枸杞多糖,试验继续采用Design-Expert软件8.0.6的优化功能对响应面试验的最优值预测,在试验因素取值范围内选择最低点为出发点,响应值选取最大值,选取范围分别是酶解温度25~75 ℃,酶解时间50~140 min,酶浓度0.3%~0.6%,可以优化得到酶解法提取枸杞多糖的理论最优化试验条件,即最佳酶解温度49.56 ℃、酶解时间140 min、酶浓度0.3%,在此条件下,酶解法枸杞多糖的提取率理论预测值为13.1913%。
为验证RSA法的可靠性,采用上述最优提取条件进行酶解法提取枸杞多糖实验,见表7,实际提取率为13.25%,误差为0.45%。
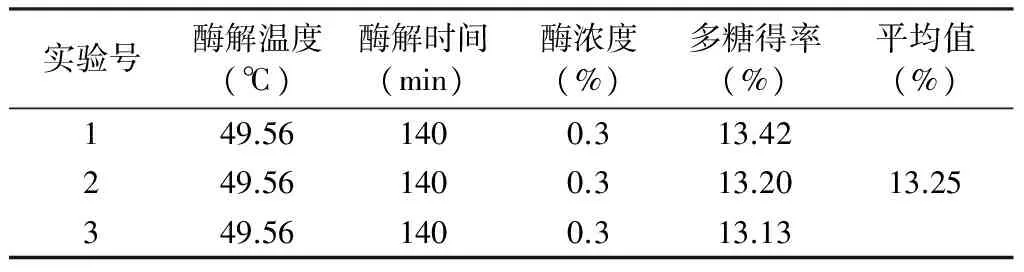
表7 最佳实验条件验证试验
3 结 论
响应面法优化通过17组实验模拟得二次多项回归方程,从而可优化得最佳提取条件及实际提取率13.25%,比正交实验最佳组合条件下的实际提取率高,因为响应面优化可模拟得二次多项回归方程,响应面优化提取最佳条件比正交实验法最佳条件增加了提取时间,减少了酶浓度,增加了提取率。由此可见,响应面优化法与正交实验优化相比,确实有周期短、回归方程精确度高的优点,最终也增加了实验结果,是一种有效的实验分析方法。
总之,酶法提取枸杞多糖比传统热水浸提提高了枸杞多糖的提取率,反应条件温和,而且通过响应面法进行实验设计和优化比正交实验法能得到更高的枸杞多糖提取率。
[1] 汪建龙.枸杞多糖药理作用的研究进展[J].时珍国医国药,2005(2):45-48.
[2] 肖华志,胡小松.我国枸杞的加工利用现状及其深加工的发展趋势[J].中国农业科技导报,2002,4(3): 53-56.
[3] 张惠玲.枸杞的营养与功效[J].农业科学研究,2011,32(3): 59-62.
[4] 霍超,徐桂花.枸杞生理功效和活性成分的研究进展[J].中国食物与营养,2007,11: 50-53.
[5] 何进.枸杞多糖的初步研究[J]食品科学,1995(2):14-21.
[6] 王金童,王秀娟.枸杞子的化学成分和药理研究概况[J].天津药学,1999,11(3):14-16.
[7] 章培军,邢雁霞.枸杞多糖对实验性肝损伤保护作用的研究[J].中国药物与临床,2011,11(11):1286-1287.
[8] 白寿宁.枸杞多糖提取及分离纯化技术探讨[J].食品工业,2000(3):9-11.
[9] WIJESINGHE W A J P,JEON Y J.Enzyme-assistant extraction(EAE) of bioactive components:A useful approach for recovery of industrially important metabolites from seaweeds[J].A review Fitoterapia,2012,83:6-12.
[10] ZHANG Kui,WANG Qiang.Optimization of ultrasonic extraction of polysaccharides from dried longan pulp using response surface methodology[J].Carbohydrat Polymers,2010,80(1):19-25.
[11] 刘琳,鄢瑞明,曾凡骏.响应面法优化枸杞多糖提取的研究[J].食品与发酵科技,2011,47(6):32-35.
[12] 彭勇胜,王江之,黄程,等.响应面法优化姬松茸多糖的提取工艺[J].现代食品科技,2011,127(9):1119-1122.
[13] DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric Method for Determination of Sugara and Related Substances[J].Analytical Chemistry,1956,28:350-356.
[14] 高丽萍,郑光耀,闫林林,等.响应面法优化亚临界水提取银耳多糖工艺研究[J].江苏农业科学,2016,44(7):339-342
SurfaceOptimizationMethodtoOptimizetheEnzymaticExtractionofLyciumbarbarumPolysaccharides
Xia Fan1*,Zhou Sheng2,Sun Dafeng3
(1.School of Biology and Environment,Nanjing Polytechnic Institute,Nanjing 210048,China;2.School of Computer and Software Engineering,Nanjing Polytechnic Institute,Nanjing 210048,China;3.Nanjing Institute for Comprehensive Utilization of Wild Plants,Nanjing 210042,China)
The response surface optimization method and orthogonal experiment method were used for design and analysis of amylase extraction experiment ofLyciumbarbarumpolysaccharide .Through single factor experiment,the optimum conditions were determined by orthogonal experiment: pH=5.0,extraction at 50℃ for 80min and cellulase concentration with 0.5%.Under this condition,the maximum yield of polysaccharides was obtained as 12.1%.Through surface optimization method,the optimal condition for the extraction was enzymolysis at 49.56℃and time for 140min and cellulase concentration with 0.3%.Under this condition,the maximum yield of polysaccharides was obtained as 13.25%.Compared with the traditional hot water extraction,the enzymic extraction method ofLyciumbarbarumpolysaccharides improved the extraction rate ofLyciumbarbarumpolysaccharides and was in mild reaction conditions.In addition,the extraction rate of LBP was better than that of the orthogonal experiment.
surface optimization method; orthogonal experiment method; amylase;Lyciumbarbarumpolysaccharide; comparison
10.3969/j.issn.1006-9690.2017.05.007
2017-02-12
“十三五”重点研发计划项目(2016YFD0400804)。
*通讯作者:夏凡,硕士,从事药物产品合成及分离研究及教学。E-mail:sissi2xf@163.com
TQ281
A
1006-9690(2017)05-0027-07
