核因子kappa B1和RelA基因多态性与汉族女性卵巢上皮性癌的关系研究
2017-11-08刘红丽郭红燕
刘红丽,刘 莹,郭红燕
1.361000 福建省厦门市妇幼保健院 林巧稚妇儿医院妇科 2.100191 北京市,北京大学医学部病理教研室 3.100191 北京市,北京大学第三医院妇科
·论著·
*通信作者:郭红燕,主任医师;E-mail:bysyghy@163.com
核因子kappa B1和RelA基因多态性与汉族女性卵巢上皮性癌的关系研究
刘红丽1,刘 莹2,郭红燕3*
1.361000 福建省厦门市妇幼保健院 林巧稚妇儿医院妇科 2.100191 北京市,北京大学医学部病理教研室 3.100191 北京市,北京大学第三医院妇科
背景炎症与肿瘤关系密切,核因子kappa B(NF-κB)信号通路是重要的炎症通路之一,单核苷酸多态性(SNPs)与疾病易感性亦存在重要关联,p50/p65复合体是NF-κB信号通路中调节靶基因转录的重要分子。目的探讨NF-κB1、RelA基因多态性与汉族女性卵巢上皮性癌的关系,以期从分子水平为卵巢上皮性癌的预防和诊治提供依据。方法2014年2月—2015年2月选取1999—2010年于北京大学第三医院、北京肿瘤医院、北京医院妇科进行手术治疗的汉族卵巢上皮性癌患者286例为病例组。同期选取与病例组年龄匹配的在上述医院体检健康的汉族女性302例为对照组。提取研究对象DNA,利用HapMap数据库中中国北京汉族人群(CHB)NF-κB1、RelA基因包含两端2 kb邻近区域的全部SNPs位点的基因分型数据,选择SNPs位点,NF-κB1基因共确定了4个SNPs位点,分别是rs3774934(A/G)、rs3774938(A/G)、rs230510(A/T)、rs909332(A/T);RelA基因共确定了3个SNPs位点,分别是rs10896027(C/G)、rs7119750(C/T)、rs11820062(C/T)。采用TaqMan探针法对SNPs位点进行基因分型,根据基因分型数据,构建单倍域图,推断每例研究对象的单体型、双体型情况。结果对照组rs3774934、rs3774938、rs230510、rs909332、rs10896027、rs7119750、rs11820062均符合Hardy-Weinberg平衡(P>0.05)。两组NF-κB1基因rs3774934、rs3774938、rs230510位点基因型和等位基因频率比较,差异均无统计学意义(P>0.05);两组NF-κB1基因rs909332位点基因型比较,差异有统计学意义(P<0.05);两组NF-κB1基因rs909332位点等位基因频率比较,差异无统计学意义(P>0.05)。多因素Logistic回归分析结果显示,NF-κB1基因rs3774934、rs3774938、rs230510、rs909332位点基因型均不是卵巢上皮性癌的影响因素(P>0.05);NF-κB1基因单体型均不是卵巢上皮性癌的影响因素(P>0.05);NF-κB1基因双体型GA-GA是卵巢上皮性癌的影响因素(P<0.05)。两组RelA基因rs10896027、rs7119750、rs11820062位点基因型和等位基因频率比较,差异均无统计学意义(P>0.05)。多因素Logistic回归分析结果显示,RelA基因rs10896027、rs7119750、rs11820062位点基因型均不是卵巢上皮性癌的影响因素(P>0.05);RelA基因单体型不是卵巢上皮性癌的影响因素(P>0.05);RelA基因双体型CC-CC是卵巢上皮性癌的影响因素(P<0.05)。结论NF-κB、RelA基因多态性与汉族女性卵巢上皮性癌易感性具有一定关系,NF-κB1基因双体型——rs3774934(G>A)和rs3774938(A>G)的GA-GA、RelA基因双体型——rs7119750(C>T)和rs11820062(C>T)的CC-CC与卵巢上皮性癌的易感性有关。
卵巢肿瘤;多态性,单核苷酸;汉族;NF-κB;RelA
根据国家癌症中心2015年公布的统计数据,卵巢癌的病死率为22.5%,仍高居我国妇科生殖道恶性肿瘤的首位[1]。越来越多的研究证实了炎症在肿瘤恶性进展中的介导和推进作用,核因子kappa B(NF-κB)信号通路是重要的炎症通路之一;NF-κB是Rel蛋白家族〔包括c-Rel、p50/p105(NF-κB1)、p52/p100(NF-κB2)、p65(RelA)及RelB 5个成员〕的成员[2]。通常所说的NF-κB指的是p50/p65复合体,大多数p50/p65复合体以异二聚体形式存在,其分别由NF-κB1、RelA基因编码。p50/p65复合体从抑制性分子中释放,进入细胞核,调节靶基因的转录,广泛参与调控免疫应答、细胞凋亡、细胞生长等多个基因的表达。有研究表明,NF-κB信号通路参与了卵巢上皮性癌的发生和发展[3-5],而且不同程度地影响肿瘤细胞对化疗的敏感性及患者的预后[6-7]。单核苷酸多态性(SNPs)是指人类基因组核苷酸序列中单个碱基的序列存在差异,并在人群中的分布频率>1%,被认为是与疾病易感性和药物反应有关的重要因素,其与卵巢癌的发生、发展、化疗耐药、预后评估方面的相关性研究也是目前国际上妇科肿瘤基因组学研究的重点[8-10]。本研究旨在探讨NF-κB1、RelA基因多态性与汉族女性卵巢上皮性癌的关系,以期从分子水平为卵巢上皮性癌的预防和诊治提供实验依据。
1 对象与方法
1.1 研究对象 2014年2月—2015年2月选取1999—2010年于北京大学第三医院、北京肿瘤医院、北京医院妇科进行手术治疗的卵巢上皮性癌患者286例为病例组。年龄25~82岁,平均年龄(54.6±11.8)岁;雌激素受体(ER)状态:阳性63例,阴性59例,缺失164例;孕激素受体(PR)状态:阳性49例,阴性70例,缺失167例;CA125情况:正常(≤35 U/L)23例,升高216例,缺失47例;肿瘤最大直径:≤5 cm 131例,>5 cm 136例,缺失19例;临床分期:Ⅰ期43例,Ⅱ~Ⅳ期213例,缺失30例;淋巴结转移情况:有淋巴结转移113例,无淋巴结转移158例,缺失15例;远处转移情况:有远处转移96例,无远处转移177例,缺失13例。纳入标准:(1)汉族;(2)术后经病理学检查证实为卵巢上皮性癌。同期选取与病例组年龄匹配的在上述医院体检健康的女性302例为对照组。年龄27~79岁,平均年龄(53.0±12.0)岁。纳入标准:(1)汉族;(2)无现患肿瘤或恶性肿瘤病史。研究对象均签署知情同意书,本研究获得北京大学医学部伦理委员会的批准。
1.2 研究方法
1.2.1 一般资料收集 收集研究对象一般资料,包括年龄、BMI、初潮年龄、绝经年龄、初产年龄、绝经状态、生育史、一级亲属肿瘤家族史、吸烟史等。其中连续或累积吸烟6个月或以上者为有吸烟史。
1.2.2 提取DNA 病例组DNA提取自甲醛溶液固定、石蜡包埋切片的非肿瘤组织,对照组DNA提取自外周血白细胞,使用酚-氯仿-异戊醇抽提液进行提取。
1.2.3 选择SNPs位点 将HapMap数据库中中国北京汉族人群(CHB)NF-κB1、RelA基因包含两端2 kb邻近区域的全部SNPs位点的基因分型数据(NF-κB1:Chr4,103、639、518-103、759、506;RelA:Chr11,65、176、393-65、188、951)上传至Haploview软件中。在“Minimum minor allele freq.”录入框中输入0.05,选择最小等位基因(MAF)>5%的SNPs进行连锁不平衡(LD)分析。采用Confidence intervals方法划定两个基因相关范围内的blocks,选取1%为单体型频率下限,确定SNPs位点。NF-κB1基因共确定了4个SNPs位点,分别是rs3774934(A/G)、rs3774938(A/G)、rs230510(A/T)、rs909332(A/T);RelA基因共确定了3个SNPs位点,分别是rs10896027(C/G)、rs7119750(C/T)、rs11820062(C/T)。
1.2.4 基因分型及质量控制 采用TaqMan探针法对SNPs位点进行基因分型,其中TaqMan探针和引物由Applied Biosystems公司合成并授权使用,HT7900实时荧光定量PCR仪购自美国应用生物系统公司。
每次基因分型实验,384孔板中均设置有阴性对照和阳性对照,若≥15%的样本分型失败则整板分型结果弃用。多个SNPs位点分型均失败的DNA样本弃用。选取3%样本进行重复检测,由2名研究员在不知道分组的情况下分别进行结果判读,两次结果的吻合率在99%以上。
1.2.5 单倍域图及单体型的构建 根据基因分型数据,采用Haploview软件分别推算病例组和对照组NF-κB1、RelA基因单个SNPs位点的D′和r2,然后构建单倍域图。采用SAS 9.1 PROC HAPLOTYPE程序,根据最大似然算法(EM算法)推断每例研究对象的单体型、双体型情况。记录研究对象NF-κB1、RelA基因单个SNPs位点、单体型、双体型情况。其中NF-κB1基因的单体型分别为:rs3774934(G>A)和rs3774938(A>G)的GG、GA,rs230510(A>T)和rs3774938(A>G)的AA,其他;双体型分别为:rs3774934(G>A)和rs3774938(A>G)的GA-GG、GG-GG、GA-GA,rs3774934(G>A)和rs909332(A>T)的AA-GG,rs230510(A>T)和rs3774938(A>G)的AA-GA,rs909332(A>T)和rs230510(A>T)的AA-AA,其他。RelA基因单体型分别为:rs7119750(C>T)和rs11820062(C>T)的CC、TT、TC,rs7119750(C>T)和rs10896027(C>G)的CT;双体型分别为:rs7119750(C>T)和rs11820062(C>T)的CC-TT、CC-CC、TT-TT、CT-TT、CT-CT及rs10896027(C>G)和rs11820062(C>T)的CC-CT,其他。

2 结果
2.1 一般资料比较 两组年龄分布、绝经年龄、初产年龄、一级亲属肿瘤家族史发生率比较,差异无统计学意义(P>0.05);病例组BMI、初潮年龄、绝经前期所占比例、有生育史率小于对照组,吸烟率大于对照组,差异有统计学意义(P<0.05,见表1)。
2.2 对照组SNPs位点的Hardy-Weinberg平衡检验 对照组rs3774934、rs3774938、rs230510、rs909332、rs10896027、rs7119750、rs11820062均符合Hardy-Weinberg平衡(χ2=2.591、2.205、1.315、1.462、2.127、1.368、1.387,P=0.143、0.146、0.982、0.809、0.584、0.916、0.825)。
2.3 NF-κB1基因单个SNPs位点、单体型、双体型与卵巢上皮性癌的关联分析
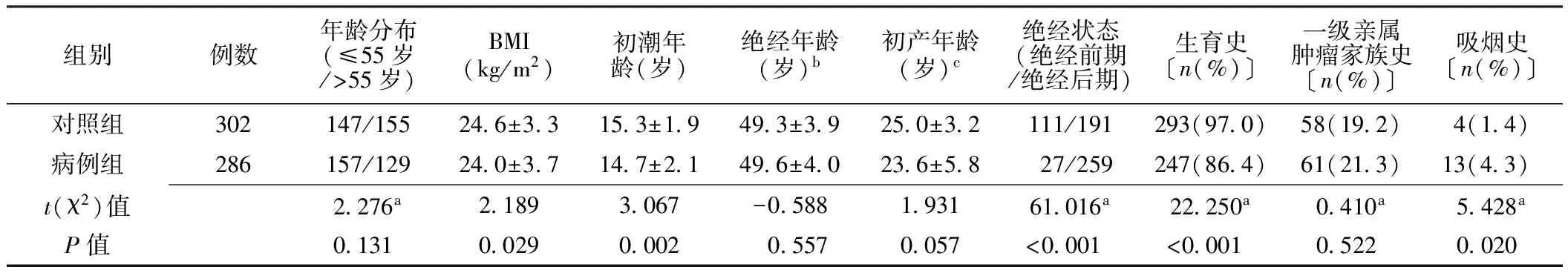
表1 两组一般资料比较
注:a为χ2值;b表示对照组、病例组分别有41、26例未绝经;c表示对照组、病例组分别有9、39例没有生育史,其初产年龄记为12.0岁
2.3.1 NF-κB1基因单个SNPs位点与卵巢上皮性癌的关联分析 两组NF-κB1基因rs3774934、rs3774938、rs230510位点基因型和等位基因频率比较,差异均无统计学意义(P>0.05);两组NF-κB1基因rs909332位点基因型比较,差异有统计学意义(P<0.05);两组NF-κB1基因rs909332位点等位基因频率比较,差异无统计学意义(P>0.05,见表2~5)。
以组别为因变量(赋值:对照组=0,病例组=1),NF-κB1基因rs3774934(赋值:GG=0,AG=1,AA=2)、rs3774938(赋值:AA=0,AG=1,GG=2)、rs230510(赋值:AA=0,AT=1,TT=2)、rs909332(赋值:AA=0,AT=1,TT=2)位点基因型为自变量,年龄(赋值:≤55岁=0,>55岁=1)、BMI(赋值:≤23.0 kg/m2=0,>23.0 kg/m2=1)、绝经状态(绝经前期=0,绝经后期=1)、生育史(赋值:有生育史=0,无生育史=1)、一级亲属肿瘤家族史(赋值:无=0,有=1)、吸烟史(赋值:无=0,有=1)为混杂因素,进行多因素Logistic回归分析,结果显示,NF-κB1基因rs3774934、rs3774938、rs230510、rs909332位点基因型均不是卵巢上皮性癌的影响因素(P>0.05,见表6)。
2.3.2 NF-κB1基因单体型与卵巢上皮性癌的关联分析 以组别为因变量(赋值:对照组=0,病例组=1),NF-κB1基因单体型(赋值:GG=0,AA=1,GA=2,其他=3)为自变量,年龄(赋值:≤55岁=0,>55岁=1)、BMI(赋值:≤23.0 kg/m2=0,>23.0 kg/m2=1)、绝经状态(绝经前期=0,绝经后期=1)、生育史(赋值:有生育史=0,无生育史=1)、一级亲属肿瘤家族史(赋值:无=0,有=1)、吸烟史(赋值:无=0,有=1)为混杂因素,进行多因素Logistic回归分析,结果显示,NF-κB1基因单体型均不是卵巢上皮性癌的影响因素(P>0.05,见表7)。
2.3.3 NF-κB1基因双体型与卵巢上皮性癌的关联分析 以组别为因变量(赋值:对照组=0,病例组=1),NF-κB1基因双体型(赋值:AA-GG=0,GA-GG=1,GG-GG=2,AA-GA=2,AA-AA=3,GA-GA=4,其他=5)为自变量,年龄(赋值:≤55岁=0,>55岁=1)、BMI(赋值:≤23.0 kg/m2=0,>23.0 kg/m2=1)、绝经状态(绝经前期=0,绝经后期=1)、生育史(赋值:有生育史=0,无生育史=1)、一级亲属肿瘤家族史(赋值:无=0,有=1)、吸烟史(赋值:无=0,有=1)为混杂因素,进行多因素Logistic回归分析,结果显示,NF-κB1基因双体型GA-GA是卵巢上皮性癌的影响因素(P<0.05,见表8)。
2.4 RelA基因单个SNPs位点、单体型、双体型与卵巢上皮性癌的关联分析
2.4.1 RelA基因单个SNPs位点与卵巢上皮性癌的关联分析 两组RelA基因rs10896027、rs7119750、rs11820062位点基因型和等位基因频率比较,差异均无统计学意义(P>0.05,见表9~11)。
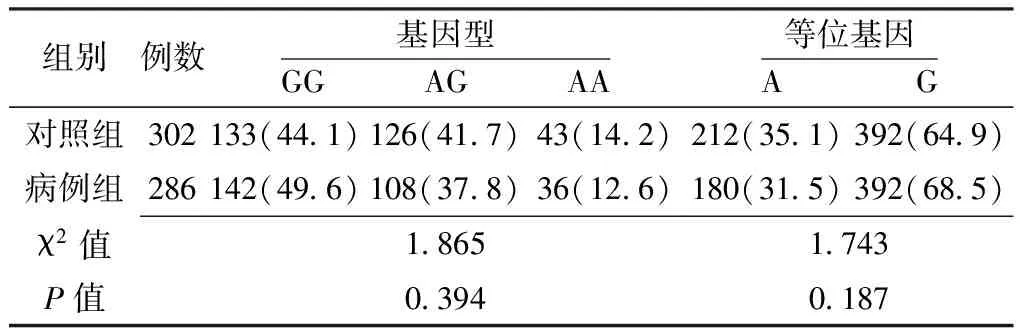
表2 两组NF-κB1基因rs3774934位点基因型和等位基因频率比较〔n(%)〕
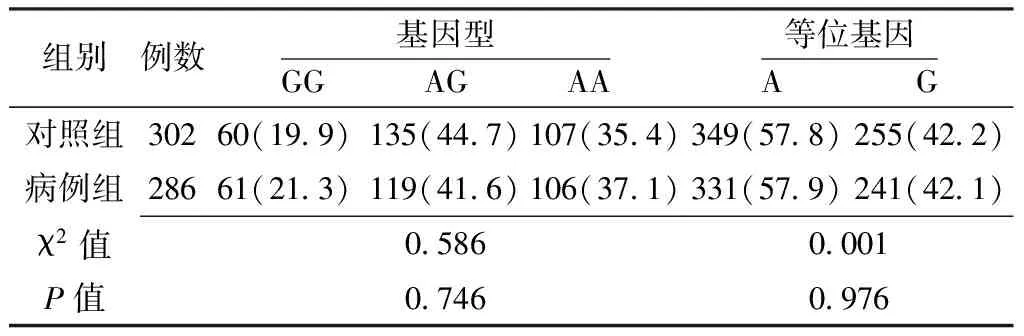
表3 两组NF-κB1基因rs3774938位点基因型和等位基因频率比较〔n(%)〕
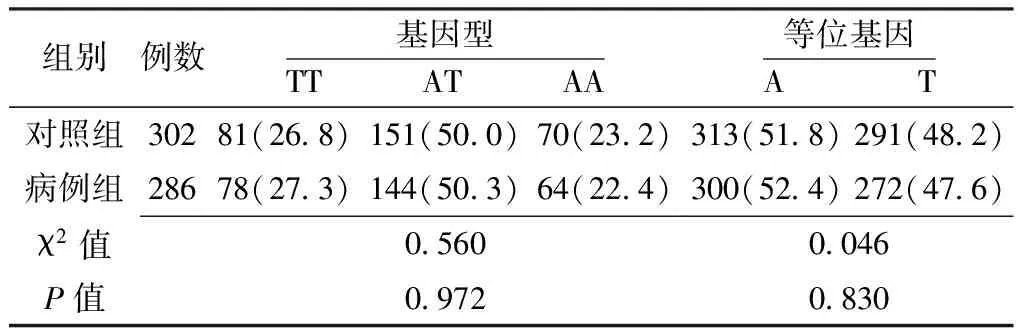
表4 两组NF-κB1基因rs230510位点基因型和等位基因频率比较〔n(%)〕
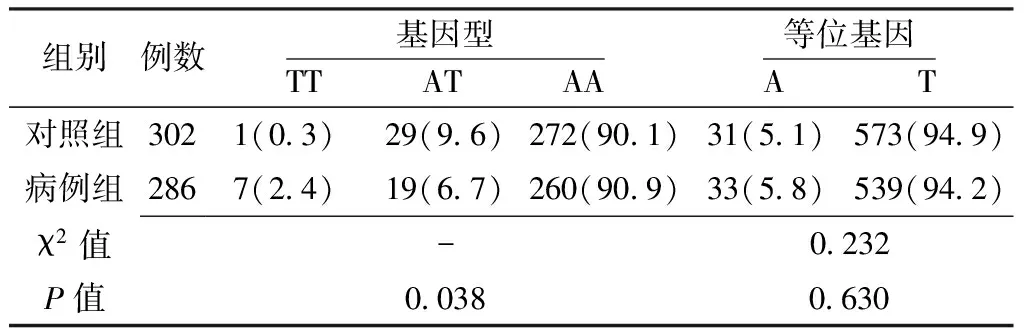
表5 两组NF-κB1基因rs909332位点基因型和等位基因频率比较〔n(%)〕
注:-为采用Fisher′s确切概率法
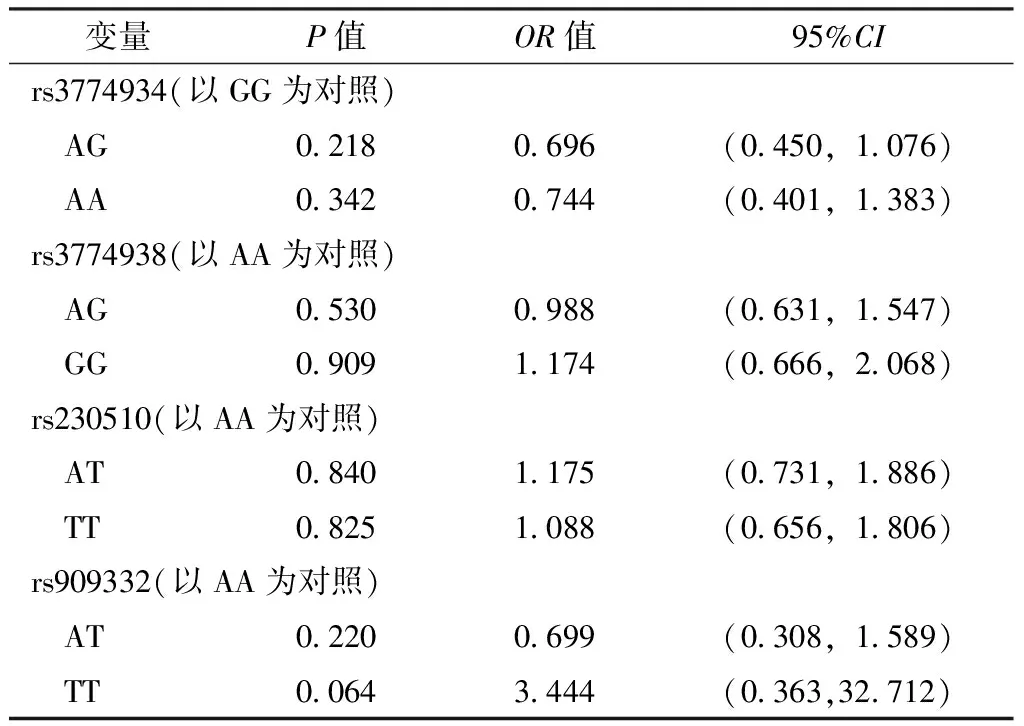
表6 NF-κB1基因单个SNPs位点对卵巢上皮性癌影响的多因素Logistic回归分析结果
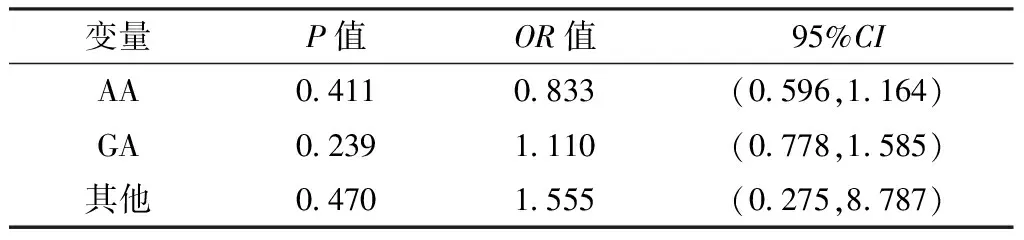
表7 NF-κB1基因单体型对卵巢上皮性癌影响的多因素Logistic回归分析结果
注:以GG为对照

表8 NF-κB1基因双体型对卵巢上皮性癌影响的多因素Logistic回归分析结果
注:以AA-GG为对照
以组别为因变量(赋值:对照组=0,病例组=1),RelA基因rs10896027(赋值:CC=0,GG=1,CG=2)、rs7119750(赋值:CC=0,CT=1,TT=2)、rs11820062(赋值:CC=0,CT=1,TT=2)位点基因型为自变量,年龄(赋值:≤55岁=0,>55岁=1)、BMI(赋值:≤23.0 kg/m2=0,>23.0 kg/m2=1)、绝经状态(绝经前期=0,绝经后期=1)、生育史(赋值:有生育史=0,无生育史=1)、一级亲属肿瘤家族史(赋值:无=0,有=1)、吸烟史(赋值:无=0,有=1)为混杂因素,进行多因素Logistic回归分析,结果显示,RelA基因rs10896027、rs7119750、rs11820062位点基因型均不是卵巢上皮性癌的影响因素(P>0.05,见表12)。
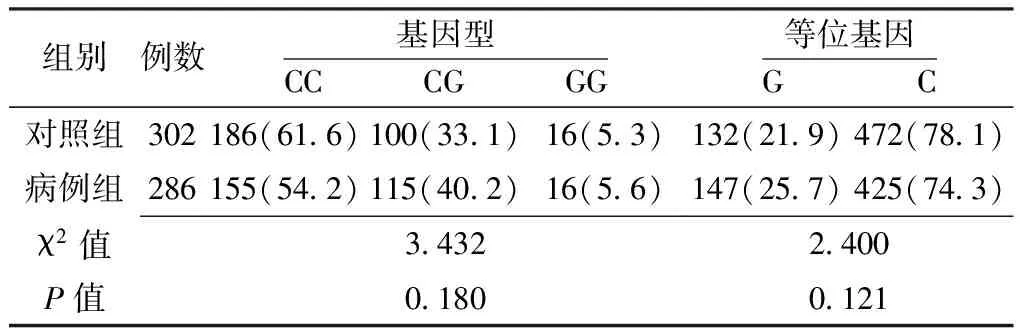
表9 RelA基因rs10896027位点基因型和等位基因频率比较〔n(%)〕

表10 RelA基因rs7119750位点基因型和等位基因频率比较〔n(%)〕
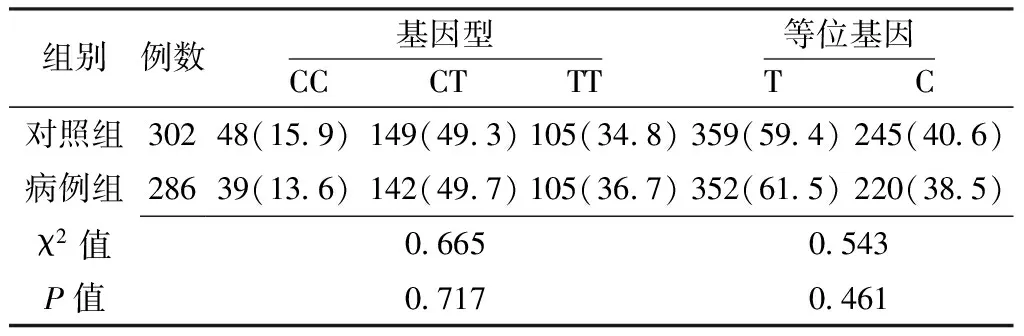
表11 RelA基因rs11820062位点基因型和等位基因频率比较〔n(%)〕
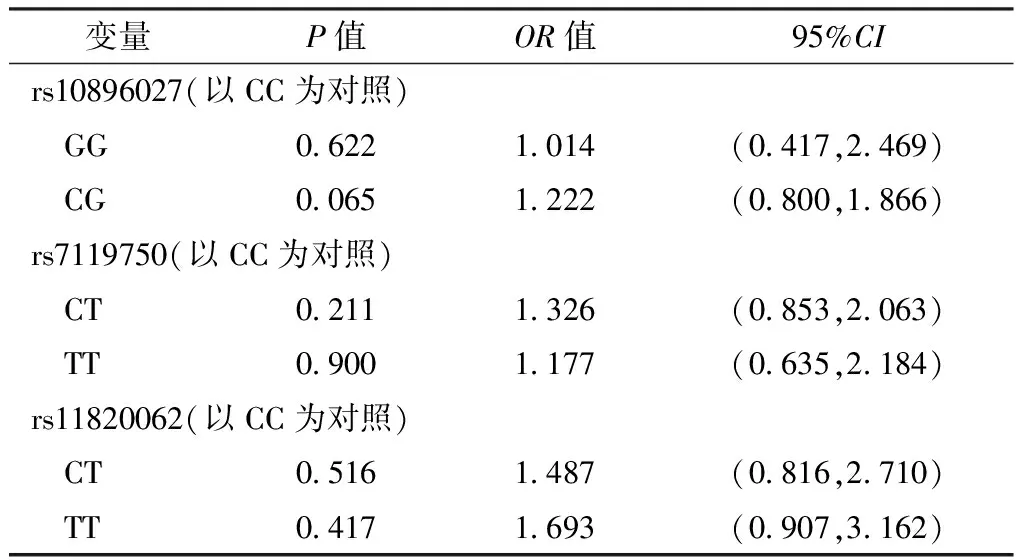
表12 RelA基因单个SNPs位点对卵巢上皮性癌影响的多因素Logistic回归分析结果
2.4.2 RelA基因单体型与卵巢上皮性癌易感性的关联分析 以组别为因变量(赋值:对照组=0,病例组=1),RelA基因单体型为自变量(赋值:CC=0,CT=1,TT=2,TC=3),年龄(赋值:≤55岁=0,>55岁=1)、BMI(赋值:≤23.0 kg/m2=0,>23.0 kg/m2=1)、绝经状态(绝经前期=0,绝经后期=1)、生育史(赋值:有生育史=0,无生育史=1)、一级亲属肿瘤家族史(赋值:无=0,有=1)、吸烟史(赋值:无=0,有=1)为混杂因素,进行多因素Logistic回归分析,结果显示,RelA基因单体型不是卵巢上皮性癌的影响因素(P>0.05,见表13)。
2.4.3 RelA基因双体型与卵巢上皮性癌易感性的关联分析 以组别为因变量(赋值:对照组=0,病例组=1),RelA基因双体型为自变量(赋值:CC-TT=0,CC-CT=1,CC-CC=2,TT-TT=3,CT-TT=4,CT-CT=5,其他=6),年龄(赋值:≤55岁=0,>55岁=1)、BMI(赋值:≤23.0 kg/m2=0,>23.0kg/m2=1)、绝经状态(绝经前期=0,绝经后期=1)、生育史(赋值:有生育史=0,无生育史=1)、一级亲属肿瘤家族史(赋值:无=0,有=1)、吸烟史(赋值:无=0,有=1)为混杂因素,进行多因素Logistic回归分析,结果显示,RelA基因双体型CC-CC是卵巢上皮性癌的影响因素(P<0.05,见表14)。
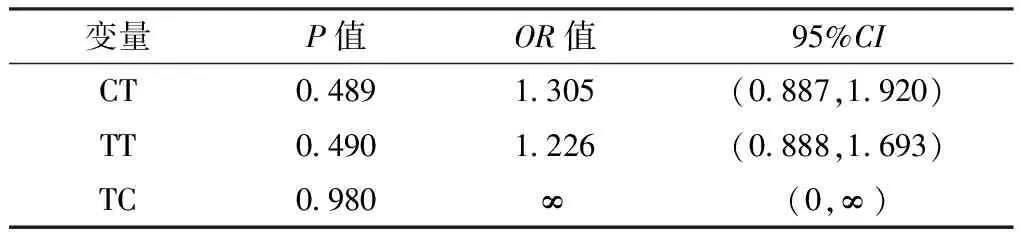
表13 RelA基因单体型对卵巢上皮性癌影响的多因素Logistic回归分析结果
注:以CC为对照
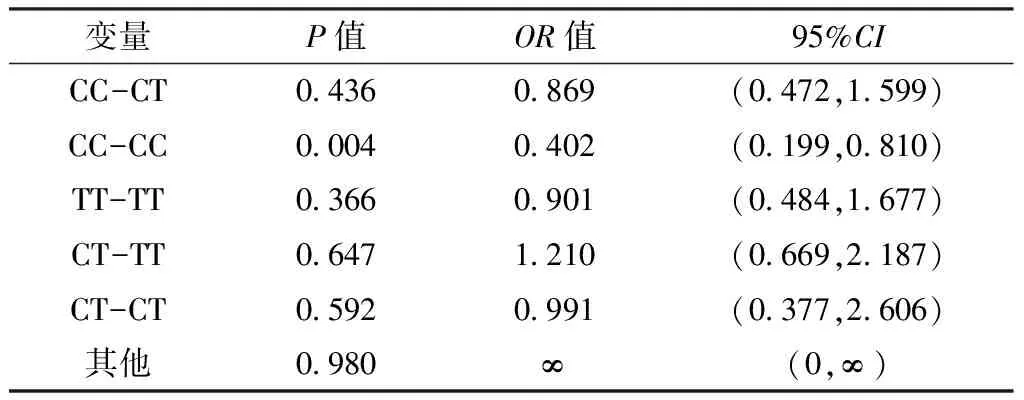
表14 RelA基因双体型对卵巢上皮性癌影响的多因素Logistic回归分析结果
注:以CC-TT为对照
3 讨论
炎症是生物抵抗外界病原体侵入的重要防御机制,越来越多的研究证实炎症在肿瘤恶性进展中的介导和推进作用[11-13]。肿瘤炎性微环境是近年来肿瘤领域的研究热点,而NF-κB信号通路是重要的炎症通路之一,在肿瘤的发生发展中起重要作用。SNPs在基因组中存在广泛变异,可用作遗传学上的分子标志物,亦可阐明疾病和基因的关系,探索疾病相关基因。卵巢癌是一种严重危害妇女健康、生命的恶性肿瘤,已有多项研究证实,在卵巢癌组织中NF-κB相关蛋白高表达[14]。本研究通过病例对照研究设计,以NF-κB1、RelA基因为候选基因,利用HapMap CHB的SNP分型数据作为SNPs位点的选点依据,共选出NF-κB1基因的4个SNPs位点和RelA基因的3个SNPs位点,在包含286例卵巢上皮性癌患者和302例正常对照的汉族人群,用TaqMan Realtime-PCR方法进行基因分型,对照组进行SNPs位点的Hardy-Weinberg平衡检验使其符合代表性和随机性,利用分型数据和Haploview软件在病例组和对照组分别进行单倍域的构建,对汉族女性遗传多态性与卵巢上皮性癌易感性及其进展相关性进行研究,目前在国内国际尚未见类似报道。
3.1 NF-κB1基因SNPs位点与卵巢上皮性癌的关系 近些年来国际上也有关于NF-κB1基因多态性与各种肿瘤的相关性研究,其中启动子区-94位插入/缺失多态性比较常见,仅在中国汉族人群中就发现与鼻咽癌、前列腺癌、膀胱癌等多种恶性肿瘤的发生存在相关性[15-17],并且在卵巢癌中也证实这种相关性[8]。但DUAN等[9]对该多态性进行meta分析提示,-94位插入/缺失多态性仅与口腔癌、卵巢癌有显著关联,而与直肠癌、膀胱癌及肾细胞癌无显著关联。NF-κB1基因其他位点多态性与肿瘤的关系也有报道,如有报道rs4648127位点多态性与肺癌易感性有显著关联[18],rs4648068位点多态性与胃癌有显著相关性[19]。上述研究只是针对NF-κB1单个位点的多态性与肿瘤关系的研究。CHANG等[20]选取欧洲及高加索血统的NF-κB1基因6个代表性位点进行与霍奇金淋巴瘤易感性的研究发现,rs1585215多态性与之显著相关〔AG vs.AA:OR=2.1,95%CI(1.5,2.9);GG vs.AA:OR=3.5,95%CI(2.2,5.7),P=1.7×10-8〕。而美国另一项研究证实rs4648022的多态性与非霍奇金淋巴瘤存在显著关系[21]。2014年美国卵巢癌协会的一项多中心研究,选取有关NF-κB通路的220个基因的2 282个tagSNP位点,在15 604例患者和23 235例对照中研究其与卵巢癌易感性的关系,其中NF-κB1基因选取8个多态性位点进行分析,仅rs1609993与卵巢癌整体风险相关,但经多因素回归分析后无统计学意义,最后仅发现白介素(IL-1)基因的rs17561与卵巢透明细胞癌易感性有显著意义[10]。
本研究结果显示,NF-κB1基因双体型GA-GA是卵巢上皮性癌的影响因素,目前尚未发现与之相同双体型与恶性肿瘤关系的相关报道,有报道rs3774934多态性与非霍奇金淋巴瘤不存在显著关系[21],另有报道rs3774938多态性与霍奇金淋巴瘤不存在显著关系[22]。至于位点的多态性是通过何种途径影响癌症的发生,针对某一位点多态性与表型的关系研究较少,有研究提示rs3774934位点多态性与CD44表型相关[23],而CD44是一种细胞表面跨膜糖蛋白分子,与许多恶性肿瘤的侵袭和转移密切相关[24-25]。
3.2 RelA基因SNPs位点与卵巢上皮性癌的关系 关于RelA基因遗传多态性的研究相对少见。有学者研究RelA基因遗传多态性与肺结核的关系,选取5个SNPs位点,其单个SNPs位点、单体型均未发现显著关联[26]。另一项日本关于RelA基因遗传多态性与精神分裂症关系研究,选取4个SNPs位点rs7119750(SNP1)、rs11568300(SNP2)、rs2306365(SNP3)和rs11820062(SNP4),其中SNP1、SNP3和SNP4与精神分裂症存在显著关系,在引入混杂因素进行多因素回归分析后发现SNP3和SNP4与精神分裂症的这种显著关系仍存在[27]。本研究结果显示,两组RelA基因rs10896027、rs7119750、rs11820062位点基因型和等位基因频率无差异;多因素Logistic回归分析结果显示,RelA基因rs10896027、rs7119750、rs11820062位点基因型均不是卵巢上皮性癌的影响因素,RelA基因单体型不是卵巢上皮性癌的影响因素,RelA基因双体型CC-CC是卵巢上皮性癌的影响因素;提示同一个SNPs位点在不同疾病发病中的作用不同,即使在同一种肿瘤中,由于人群不同,其作用也可能不同。由于不同人群间基因组的LD图不同,无法进行单体型和双体型结果的比较。
理论上说,多位点单体型所包含信息量大于单位点等位基因,而多位点双体型所包含信息量大于单位点基因型。双体型可定义为来自两个参与染色体的单体型所有可能组合的特定变异,等于所有位点上的所有基因型的分层分析和所有单体型的分层分析。因此,有研究认为,当样本量足够大时,单体型和双体型分析应比等位基因和基因型分析更有效[28]。YANG等[29]发现,白介素4中-590C>T和内含子3 VNTR中,单个位点多态性与口咽癌均无显著关联,但T、RP1/T、RP1双体型增加其发病风险,有显著关联。再有,LEE等[30]发现,CAPN10基因111单体型与多囊卵巢综合征(PCOS)风险增加有关,121单体型与PCOS无关联,而111/121双体型与PCOS易感性增加的关联性比任何单体型均高〔OR=3.4,95%CI(2.2,5.2)〕。
3.3 本研究不足 本课题采取候选基因的研究方法和SNPs的选点策略,对NF-κB1、RelA基因的SNPs位点、单体型、双体型与卵巢上皮性癌的易感性分别进行了全面的关联分析。但尚有不足之处:(1)样本量相对较少,需要继续扩大样本量进行分析。(2)仅考虑NF-κB1、RelA基因的遗传多态性,且选取单体型标签SNPs,其很可能仅作为1个标签而存在,而真正发挥作用的是与之连锁的其他SNPs或该炎症通路其他相关基因上的多态性位点上的基因-基因交互作用,应进一步扩大基因分析种类和SNPs分型数量。(3)仅选取北京部分汉族人群进行研究,如果资源和条件允许的话,还需要在另一个大的人群中进行重复研究。(4)未进行术后无进展生存期的关联研究,仍需进一步完善随访资料。
综上所述,NF-κB、RelA基因多态性与汉族女性卵巢上皮性癌易感性具有一定关系,NF-κB1基因双体型——rs3774934(G>A)和rs3774938(A>G)的GA-GA、RelA基因双体型——rs7119750(C>T)和rs11820062(C>T)的CC-CC与卵巢上皮性癌的易感性有关。本研究结果对于卵巢上皮性癌的风险预测、防治和治疗提供一条新的线索和路径,但尚需进行大样本、多地域、多民族广泛深入的协同研究进一步验证。
志谢:感谢北京大学医学部病理教研室田新霞教授、北京肿瘤医院及北京医院病理科对本实验提供样本支持,感谢本实验中涉及的500多名正常对照女性和卵巢上皮性癌患者,其对医学研究的支持是该试验顺利进行的保障。
作者贡献:刘红丽进行文章的构思与设计,研究的实施与可行性分析;刘莹进行数据收集、整理,统计学处理;刘红丽进行结果的分析与解释,撰写论文,进行论文、英文的修订,负责文章的质量控制及审校;郭红燕对文章整体负责,监督管理。
本文无利益冲突。
[1]CHEN W,ZHENG R,BAADE P D,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.DOI:10.3322/caac.21338.
[2]HANAHAN D,WEINBERG R A.The hallmarks of cancer[J].Cell,2000,100(1):57-70.
[3]SALVATORE C,CAMARDA G,MAGGI C A,et al.NF-kappaB activation contributes to anthracycline resistance pathway in human ovarian carcinoma cell line A2780[J].Int J Oncol,2005,27(3):799-806.
[4]KLEINBERG L,DONG H P,HOLTH A,et al.Cleaved caspase-3 and nuclear factor-kappa B p65 are prognostic factors in metastatic serous ovarian carcinoma[J].Hum Pathol,2009,40(6):795-806.DOI:10.1016/j.humpath.2008.10.019.
[5]HERNANDEZ L,HSU S C,DAVIDSON B,et al.Activation of NF-kappa B signaling by inhibitor of NF-kappaB kinase beta increases aggressiveness of ovarian cancer[J].Cancer Res,2010,70(10):4005-4014.DOI:10.1158/0008-5472.CAN-09-3912.
[6]KELLY M G,ALVERO A B,CHEN R,et al.TLR-4 signaling promotes tumor growth and paclitaxel chemoresistance in ovarian cancer[J].Cancer Res,2006,66(7):3859-3868.DOI:10.1158/0008-5472.CAN-05-3948.
[7]NAKANISHI C,TOI M.Nuclear factor-kappaB inhibitors as sensitizers to anticancer drugs[J].Nat Rev Cancer,2005,5(4):297-309.DOI:10.1038/nrc1588.
[8]FAN Y,YU W,YE P,et al.NFκB1 insertion/deletion promoter polymorphism increases the risk of advanced ovarian cancer in a Chinese population[J].DNA Cell Biol,2011,30(4):241-245.DOI:10.1089/dna.2010.1107.
[9]DUAN W,WANG E,ZHANG F,et al.Association between the NFκB1-94ins/del ATTG polymorphism and cancer risk:an updated meta-analysis[J].Cancer Invest,2014,32(7):311-320.DOI:10.3109/07357907.2014.911881.
[10]CHARBONNEAU B,BLOCK M S,BAMLET W R,et al.Risk of ovarian cancer and the NF-κB pathway:genetic association with IL1A and TNFSF10[J].Cancer Res,2014,74(3):852-861.DOI:10.1158/0008-5472.CAN-13-1051.
[11]OKAZAKI I M,KOTANI A,HONJO T.Role of AID in tumorigenesis[J].Adv Immunol,2007,94:245-273.DOI:10.1016/S0065-2776(06)94008-5.
[12]KULBE H,THOMPSON R,WILSON J L,et al.The inflammatory cytokine tumor necrosis factor-alpha generates an autocrine tumor-promoting network in epithelial ovarian cancer cells[J].Cancer Res,2007,67(2):585-592.DOI:10.1158/0008-5472.CAN-06-2941.
[13]WU Y,DENG J,RYCHAHOU P G,et al.Stabilization of snail by NF-kappa B is required for inflammation-induced cell migration and invasion[J].Cancer Cell,2009,15(5):416-428.DOI:10.1016/j.ccr.2009.03.016.
[14]NIESPOREK S,WCICHERT W,SINN B,et al.NF-kappa B subunit p65/RelA expression in ovarian carcinoma:prognostic impact and link to COX-2 overexpression[J].Verh Dtscb Ges Pathol,2007,91:243-249.
[15]ZHOU B,RAO L,LI Y,et al.A functional insertion/deletion polymorphism in the promoter region of NFκB1 gene increases susceptibility for nasopharyngeal carcinoma[J].Cancer Lett,2009,275(1):72-76.DOI:10.1016/j.canlet.2008.10.002.
[16]ZHANG P,WEI Q,LI X,et al.A functional insertion/deletion polymorphism in the promoter region of the NF-κB1 gene increases susceptibility for prostate cancer[J].Cancer Genet Cytogenet,2009,191(2):73-77.DOI:10.1016/j.cancergencyto.2009.01.017.
[17]LI P,GU J,YANG X,et al.Functional promoter -94 ins/del ATTG polymorphism in NFκB1 gene is associated with bladder cancer risk in a Chinese population[J].PLoS One,2013,8(8):e71604.DOI:10.1371/journal.pone.0071604.
[18]SHIELS M S,ENGELS E A,SHI J,et al.Genetic variation in innate immunity and inflammation pathways associated with lung cancer risk[J].Cancer,2012,118(22):5630-5636.DOI:10.1002/cncr.27605.
[19]LU R,GAO X,CHEN Y,et al.Association of an NFκB1 intron SNP (rs4648068) with gastric cancer patients in the Han Chinese population[J].BMC Gastroenterol,2012,12:87.DOI:10.1186/1471-230X-12-87.
[20]CHANG E T,BIRMANN B M,KASPERZYK J L,et al.Polymorphic variation in NFκB1 and other aspirin-related genes and risk of Hodgkin lymphoma[J].Cancer Epidemiol Biomarkers Prev,2009,18(3):976-986.DOI:10.1158/1055-9965.EPI-08-1130.
[21]CERHAN J R,LIU-MARES W,FREDERICKSEN Z S,et al.Genetic variation in tumor necrosis factor and the nuclear factor-kappa B canonical pathway and risk of non-Hodgkin′s lymphoma[J].Cancer Epidemiol Biomarkers Prev,2008,17(11):3161-3169.DOI:10.1158/1055-9965.EPI-08-0536.
[22]CHANG E T,BIRMANN B M,KASPERZYK J L,et al.Polymorphic variation in NFκB1 and other aspirin-related genes and risk of Hodgkin lymphoma[J].Cancer Epidemiol Biomarkers Prev,2009,18(3):976-986.DOI:10.1158/1055-9965.EPI-08-1130.
[23]LIU-MARES W,SUN Z,BAMLET W R,et al.Analysis of variation in NF-kappaB genes and expression levels of NF-kappaB-regulated molecules[J].BMC Proc,2007,1 Suppl 1:S126.
[24]DU L,WANG H,HE L,et al.CD44 is of functional importance for colorectal cancer stem cells[J].Clin Cancer Res,2008,14(21):6751-6760.DOI:10.1158/1078-0432.CCR-08-1034.
[25]SUMIYOSHI Y,YAMASHITA Y,MAEKAWA T,et al.Expression of CD44,vascular endothelial growth factor,and proliferating cell nuclear antigen in severe venous invasional colorectal cancer and its relationship to liver mestastasis[J].Surg Today,2000,30(4):323-327.DOI:10.1007/s005950050594.
[26]CAI L,DENG S L,LIANG L,et al.Identification of genetic associations of SP110/MYBBP1A/RelA with pulmonary tuberculosis in the Chinese Han population[J].Hum Genet,2013,132(3):265-273.
[27]HASHIMOTO R,OHI K,YASUDA Y,et al.Variants of the RelA gene are associated with schizophrenia and their startle responses[J].Neuropsychopharmacology,2011,36(9):1921-1931.DOI:10.1038/npp.2011.78.
[28]ZUO L,WANG K,LUO X.Use of diplotypes-matched haplotype pairs from homologous chromosomes-in gene-disease association studies[J].Shanghai Arch Psychiatry,2014,26(3):165-170.DOI:10.3969/j.issn.1002-0829.2014.03.009.
[29]YANG C M,CHEN H C,HOU Y Y,et al.A high IL-4 production diplotype is associated with an increased risk but better prognosis of oral and pharyngeal carcinomas[J].Arch Oral Biol,2014,59(1):35-46.DOI:10.1016/j.archoralbio.2013.09.010.
[30]LEE J Y,LEE W J,HUR S E,et al.111/121 diplotype of Calpain-10 is associated with the risk of polycystic ovary syndrome in Korean women[J].Fertil Steril,2009,92(2):830-833.DOI:10.1016/j.fertnstert.2008.06.023.
AssociationofGeneticPolymorphismsinNF-κB1andRelAwithEpithelialOvarianCancerSusceptibilityamongChineseHanWomen
LIUHong-li1,LIUYing2,GUOHong-yan3*
1.DepartmentofGynecology,XiamenMaternalandChildHealthCareHospital,LinqiaozhiWomenandChildren′sHospital,Xiamen361000,China2.DepartmentofPathology,PekingUniversityHealthScienceCenter,Beijing100191,China3.DepartmentofGynecology,PekingUniversityThirdHospital,Beijing100191,China
*Correspondingauthor:GUOHong-yan,Chiefphysician;E-mail:bysyghy@163.com
BackgroundNuclear factor kappa B (NF-κB) signaling pathway is one of the important inflammatory pathways that is closely related to tumor,and single nucleotide polymorphism (SNPs) are also associated with disease susceptibility.P50/p65 complex is an important molecule in NF-κB signaling pathway of regulating transcription of target genes.ObjectiveTo investigate the association of genetic polymorphisms in NF-κB1 and RelA with epithelial ovarian cancer susceptibility among Chinese Han women,so as to provide an experimental basis for the prevention,diagnosis and treatment of epithelial ovarian cancer at molecular level.MethodsFrom February 2014 to February 2015,we selected 286 Chinese Han women with epithelial ovarian cancer who
surgical treatment in Department of Gynaecology of Peking University Third Hospital,Beijing Cancer Hospital,Beijing Hospital from 1999 to 2010 as the case group,and recruited 302 age-matched healthy Chinese Han women underwent physical examination during the same period in the above hospitals as the control group.DNA of the subjects was extracted,SNPs were selected from genotyping data of NF-κB1 and RelA genes of the Chinese Han population in Beijing (CHB) containing all SNPs at the 2 kb neighborhood in the HapMap database.The identified four SNPs in NF-κB1 gene were rs3774934 (A/G),rs3774938 (A/G),rs230510 (A/T),rs909332 (A/T) respectively,and the identified three SNPs in RelA gene were rs10896027 (C/G),rs7119750 (C/T),rs11820062 (C/T) respectively.The SNPs were genotyped by TaqMan probes.Based on the genotyping data,the haplotype block map was constructed.And the haplotype and diplotype of each subject were deduced.ResultsThe rs3774934,rs3774938,rs230510,rs909332,rs10896027,rs7119750 and rs11820062 in the control group met the Hardy-Weinberg equilibrium (P>0.05).The genotypes and allele frequencies of rs3774934,rs3774938,and rs230510 in NF-κB1 gene did not differ significantly between the two groups (P>0.05).There was significant difference in genotype of rs909332 in NF-κB1 gene between the two groups (P<0.05).There was no significant difference in allele frequencies of rs909332 in NF-κB1 gene between the two groups (P>0.05).Multivariate Logistic regression analysis showed that the genotypes of rs3774934,rs3774938,rs230510 and rs909332 in NF-κB1 gene were not the influencing factors of epithelial ovarian cancer (P>0.05);haplotypes of NF-κB1 gene were not the influencing factors of epithelial ovarian cancer (P>0.05);GA-GA diplotype of NF-κB1 gene was an influencing factor of epithelial ovarian cancer (P<0.05).There were no significant differences in genotypes and allele frequencies of rs10896027,rs7119750 and rs11820062 in RelA gene between the two groups (P>0.05).Multivariate Logistic regression analysis showed that genotypes of rs10896027,rs7119750 and rs11820062 in RelA gene were not the influencing factors of epithelial ovarian cancer (P>0.05);haplotypes of RelA gene were not the influencing factors of epithelial ovarian cancer (P>0.05);CC-CC diplotype of RelA gene was an influencing factor of epithelial ovarian cancer (P<0.05).ConclusionGenetic polymorphisms of NF-κB1 and RelA are associated with the susceptibility to epithelial ovarian cancer in Chinese Han women.GA-GA diplotype of rs3774934 (G>A) and rs3774938 (A>G) of NF-κB1 gene and CC-CC diplotype of rs7119750 (C>T) and rs11820062 (C>T) of RelA gene are associated with susceptibility to epithelial ovarian cancer.
Ovarian neoplasms;Polymorphism,single nucleotide;Han nationality;NF-kappa B;RelA
R 737.31
A
10.3969/j.issn.1007-9572.2017.00.062
刘红丽,刘莹,郭红燕.核因子kappa B1和RelA基因多态性与汉族女性卵巢上皮性癌的关系研究[J].中国全科医学,2017,20(33):4142-4150.[www.chinagp.net]
LIU H L,LIU Y,GUO H Y.Association of genetic polymorphisms in NF-κB1 and RelA with epithelial ovarian cancer susceptibility among chinese han women[J].Chinese General Practice,2017,20(33):4142-4150.
2017-01-18;
2017-06-30)
(本文编辑:崔丽红)
