青海地区乳腺癌患者B淋巴细胞瘤-2基因C(-938)A多态性与临床生物学指标关系研究
2017-11-08杨勇莉王晓武王玉花韩静琦管钰琳李耀丽
杨勇莉,王晓武,王玉花,韩静琦,管钰琳,徐 婷,李耀丽
1.810001 青海省西宁市,青海大学附属医院妇科 2.810001 青海省西宁市,青海大学附属医院乳腺甲状腺外科 3.810001 青海省西宁市,青海大学附属医院病理科 4.810001 青海省西宁市,青海大学附属医院肿瘤内科
·论著·
*通信作者:王晓武,教授,主任医师;E-mail:wtqba@126.com
青海地区乳腺癌患者B淋巴细胞瘤-2基因C(-938)A多态性与临床生物学指标关系研究
杨勇莉1,王晓武2*,王玉花2,韩静琦3,管钰琳2,徐 婷2,李耀丽4
1.810001 青海省西宁市,青海大学附属医院妇科 2.810001 青海省西宁市,青海大学附属医院乳腺甲状腺外科 3.810001 青海省西宁市,青海大学附属医院病理科 4.810001 青海省西宁市,青海大学附属医院肿瘤内科
目的探讨青海地区乳腺癌(BC)患者B淋巴细胞瘤-2(Bcl-2)基因C(-938)A多态性(AA、AC、CC基因型)与临床生物学指标的关系。方法选取2014年1月—2015年12月青海大学附属医院乳腺甲状腺外科接受手术治疗的符合纳入标准的BC患者65例为研究对象。术中采集患者BC组织,采用聚合酶链反应-限制性酶切片段长度多态性分析(PCR-RFLP)法检测Bcl-2基因C(-938)A多态性(AA、AC、CC基因型);收集患者临床生物学指标,包括病理类型、肿瘤直径、临床分期、组织学分级、腋窝淋巴结转移数目、雌激素受体(ER)状态、孕激素受体(PR)状态、人表皮生长因子2(HER2)状态、分子分型。采用列联系数χ2检验分析Bcl-2基因C(-938)A多态性与临床生物学指标的关系。结果65例患者中,AA、CA、CC基因型分别为6、30、29例。由于AA基因型例数少,无法独立分析,故将AA基因型和CC基因型合并分析。Bcl-2基因C(-938)A多态性与病理类型、肿瘤直径、临床分期、组织学分级、腋窝淋巴结转移数目、ER状态、PR状态、HER2状态、分子分型均不存在关联性(P>0.05)。结论青海地区BC患者Bcl-2基因C(-938)A多态性与临床生物学指标病理类型、肿瘤直径、临床分期、组织学分级、腋窝淋巴结转移数目、ER状态、PR状态、HER2状态、分子分型无关。
乳腺肿瘤;多态性,单核苷酸;青海;B淋巴细胞瘤-2基因C(-938)A;临床生物学指标
乳腺癌(BC)是女性最常见的恶性肿瘤之一,在我国,BC占全身各种恶性肿瘤的7%~10%[1-2]。近年来我国BC发病率有明显上升的趋势,部分大城市中BC占女性恶性肿瘤之首[1]。据资料统计,全世界每年有120万~140万妇女患BC,约有50万患者死于该病[3-4]。北美、北欧地区BC发病率约为亚洲、非洲、拉美地区的4倍,而低发地区居民移居至高发地区后,第二、三代移民的BC发病率逐渐升高,提示环境因素及生活方式与BC的发病有一定关系[5-9]。
吴炅等[10]在研究BC时发现,B淋巴细胞瘤2(Bcl-2)表达水平与腋淋巴结转移、组织学分级、术后局部复发及转移呈正相关。但也有研究显示,Bcl-2表达水平随着BC组织学分级的增高逐渐降低,与腋淋巴结转移亦呈负相关[11]。而SILVESTRINI等[12]研究认为,Bcl-2表达水平与腋窝淋巴结转移无关。但Bcl-2基因多态性与BC的关联性研究较少,研究样本量亦较小,需要进行更多的研究[13]。本研究采用聚合酶链反应-限制性酶切片段长度多态性分析(PCR-RFLP)法检测青海地区汉族BC患者Bcl-2基因C(-938)A多态性,并分析其与病理类型、肿瘤直径、临床分期、组织学分级、腋窝淋巴结转移数目、雌激素受体(ER)状态、孕激素受体(PR)状态、人表皮生长因子2(HER2)状态、分子分型等临床生物学指标的关系。
1 对象与方法
1.1 纳入与排除标准 纳入标准:(1)术后病理证实为BC;(2)有区域淋巴结转移,经术后病理证实转移数目;(3)青海地区世居汉族女性;(4)既往无恶性肿瘤病史;(5)未行放、化疗及内分泌等治疗;(6)无严重的心、肝、肾功能损害。排除标准:(1)同时接受放、化疗或其他系统抗肿瘤药物治疗,或其他研究药物治疗;(2)伴有其他恶性疾病;(3)既往患有其他肿瘤或其他较大手术后尚未恢复;(4)有其他严重生理功能紊乱;(5)妊娠期或哺乳期。
1.2 研究对象 选取2014年1月—2015年12月青海大学附属医院乳腺甲状腺外科接受手术治疗的符合纳入标准的BC患者65例为研究对象。患者均签署知情同意书。
术中采集患者BC组织,其中少部分BC组织立刻置于-80 ℃冰箱保存,用于基因多态性检测;大部分BC组织在本院病理科取材后常规组织脱水、透明、浸蜡,制成组织蜡块,用于免疫组织化学SP法检测。
1.3 仪器与试剂 水浴锅(北京六一生物科技有限公司),苯酚-氯仿-异戊醇溶液(25∶24∶1)、1% DNA琼脂糖凝胶、无水乙醇〔生工生物工程(上海)股份有限公司〕,BccI酶〔NEB(北京)有限公司〕、Rnase free water(美国Promega公司),PBS(南京生兴生物技术有限公司)。
1.4 研究方法
1.4.1 基因组DNA的提取 采用液氮将BC组织冷冻,研磨,形成组织液;加入500 μl细胞裂解液,置于42 ℃水浴锅孵育20 min;加入50 μl蛋白酶K,置于42 ℃水浴锅孵育24 h;加入50 μl RNA降解酶,室温下(25 ℃)静置5 min;加入与待裂解组织液等体积的苯酚-氯仿-异戊醇溶液,静置2 min,10×g离心2 min,取上清液,置于新的离心管中;重复上一步步骤;加入约占离心管1/3体积的醋酸铵溶液,颠倒混匀;吸取700 μl混合液于DNA吸附柱中,10×g离心1 min,弃去上层废液;加入700 μl无水乙醇,加入500 μl清洗液,混匀,10×g离心1 min,弃去上层废液;加入约200 μl洗脱液,静置5 min,10×g离心2 min,收集离心管中的DNA,置于-200 ℃冰箱保存。记录检测到的基因组DNA情况。
1.4.2 Bcl-2基因C(-938)A的基因分型 采用PCR-RFLP法进行基因分型。PCR反应体系:PCR Master Mix 25 μl,模板DNA 200 ng,PCR上、下游引物各1 μl,加Rnase free water至总体积50 μl。Bcl-2基因C(-938)A上游引物:5′-CTGCCTTCATTTATCCAGCA-3′,下游引物:5′-GGCGGCAGATGAATTACAA-3′;内参β-actin上游引物:5′-CTCCAT CCTGGCCTCGCTGT-3′,下游引物:5′-GCTGTCACCTTCACCGTTCC-3′。PCR反应条件:95.0 ℃预变性5 min,95.0 ℃ 30 s、(68.0±0.5)℃ 45 s、72.0 ℃ 60 s,共30个循环,最后72 ℃延伸6 min。采用BccI 酶切PCR产物,取酶切产物20 μl上样于1% DNA琼脂糖凝胶行DNA电泳,溴化乙啶染色后用DNA凝胶成像系统分析Bcl-2基因C(-938)A的基因分型。野生型AA为189、111 bp 2个条带,杂合型CA为300、189、111 bp 3个条带,纯合型CC为300 bp 1个条带(见图1)。
1.4.3 年龄及临床生物学指标收集 收集患者年龄及临床生物学指标,后者包括病理类型、肿瘤直径、临床分期(参照美国癌症联合会第七版乳腺癌分期标准[14])、组织学分级(参照BC Scarff-Bloom-Richardson评分法[15])、腋窝淋巴结转移数目、ER状态、PR状态、HER2状态、分子分型。其中ER状态、PR状态、HER2状态采用免疫组织化学SP法检测。
1.4.3.1 免疫组织化学SP法 4 μm石蜡切片脱蜡和水化;枸橼酸盐缓冲液高温高压修复;3% H2O2阻断内源性过氧化物酶,室温下孵育10 min,以阻断内源性过氧化物酶;PBS冲洗,3 min×3次;弃去PBS,分别加适当比例稀释的一抗工作液,4 ℃冰箱过夜;PBS冲洗,3 min×3次;弃去PBS,每张切片滴加1滴聚合物增强剂(试剂A),室温下孵育20 min;PBS冲洗,3 min×3次;弃去PBS,每张切片滴加1滴酶标抗鼠/兔聚合物(试剂B),室温下孵育30 min;PBS冲洗,3 min×3次;弃去PBS,每张切片滴加2滴新鲜配制的DAB显色液,显微镜(×40~×400)下观察3~15 min,阳性显色为棕黄色;蒸馏水漂洗,苏木素复染,0.1%盐酸分化,自来水冲洗,PBS冲洗返蓝;脱水透明、中性树胶封固;显微镜(×40~×400)下至少观察10个以上视野染色情况。
1.4.3.2 ER、PR、HER2表达结果判定标准 ER、PR阳性细胞表现为癌细胞的细胞核内有棕黄色颗粒。阳性细胞数所占比例<10%为(-),10%~25%为(+),26%~50%为(+ +),>50%为(+ + +)。本研究将(-)判定为阴性,(+)~(+ + +)判定为阳性(见图2,本文图2~3彩图见本刊官网www.chinagp.net电子期刊相应文章)。
HER2阳性细胞表现为癌细胞的细胞膜上有棕黄色颗粒。无阳性细胞判定为(-),任何比例的癌细胞细胞膜呈现微弱、不完整的着色判定为(+),>10%的癌细胞细胞膜呈弱到中度、完整但不均匀的棕黄着色或<30%的癌细胞细胞膜呈现强且完整的棕黄着色判定为(+ +),>30%的癌细胞细胞膜呈现强且完整的棕黄着色判定为(+ + +)。本研究将(-)~(+ +)判定为阴性,(+ + +)判定为阳性(见图3)。

2 结果
2.1 Bcl-2基因C(-938)A多态性分析结果 65例患者中,AA、CA、CC基因型分别为6、30、29例。由于AA基因型例数少,无法独立分析,故将AA基因型和CC基因型合并分析。
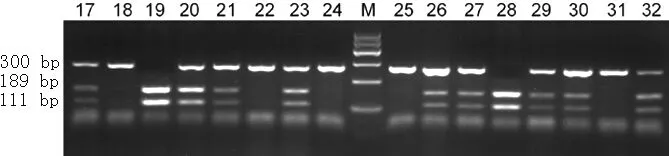
注:17~32为乳腺癌组织,野生型AA为189、111 bp 2个条带,杂合型CA为300、189、111 bp 3个条带,纯合型CC为300 bp 1个条带
图1 Bcl-2基因C(-938)A PCR产物电泳图
Figure1 Electrophoresis of B-cell lymphoma-2 Gene C (-938) A PCR product
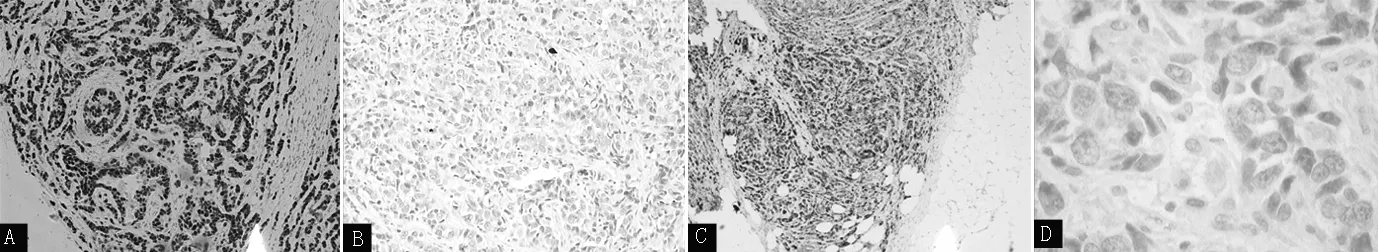
注:A为雌激素受体(ER)阳性(×100),B为ER阴性(×100),C为孕激素受体(PR)阳性(×40),D为PR阴性(×400)
图2 ER、PR在乳腺癌组织中的表达情况(免疫组织化学SP法染色)
Figure2 Expression of ER and PR in BC tissues
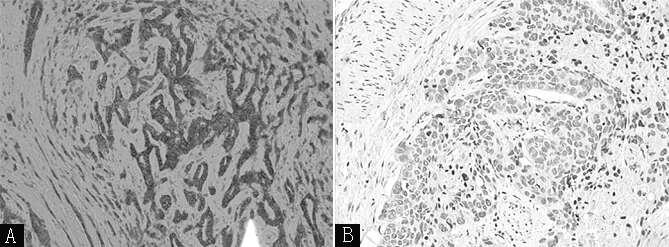
注:A为人表皮生长因子2(HER2)阳性,B为HER2阴性
图3 HER2在乳腺癌组织中的表达情况(免疫组织化学SP法染色,×100)
Figure3 Expression of HER2 in BC tissues
2.2 年龄及临床生物学指标 65例患者年龄34~85岁,平均年龄(53.5±11.3)岁;病理类型:浸润性导管癌60例,其他5例;肿瘤直径:≤2 cm 21例,>2 cm 44例;临床分期:I期12例,Ⅱ期40例,Ⅲ期13例;组织学分级:Ⅰ级7例,Ⅱ级46例,Ⅲ级12例;腋窝淋巴结转移数目:0个32例,1~3个15例,≥4个18例;ER状态:阳性47例,阴性18例;PR状态:阳性41例,阴性24例;HER2状态:阳性15例,阴性50例;分子分型:Luminal A型9例,Luminal B型30例,三阴型11例,HER2阳性型15例。
2.3 Bcl-2基因C(-938)A多态性与临床生物学指标的关系 Bcl-2基因C(-938)A多态性与病理类型、肿瘤直径、临床分期、组织学分级、腋窝淋巴结转移数目、ER状态、PR状态、HER2状态、分子分型均不存在关联性,差异无统计学意义(P>0.05,见表1)。
3 讨论
Bcl-2是从淋巴瘤中分离出来的原癌基因,主要参与细胞凋亡的调控,是Bcl-2家族中唯一一个抑制凋亡而不促进细胞增殖的癌基因[16]。ROSSI等[17]、ZENZ等[18]研究了高加索地区274例浸润性BC患者Bcl-2基因C(-938)A多态性情况发现,在淋巴结阴性的浸润性BC患者中,携带AA基因型与生存率的提高有显著相关性;进一步多因素Cox回归模型分析显示,CC基因型可作为淋巴结阴性的BC患者癌症死亡的一个独立预测因素;其认为Bcl-2基因C(-938)A多态性可作为判断淋巴结阴性BC患者预后及筛查高危患者的指标,而在淋巴结阳性的浸润性BC患者中没有发现Bcl-2基因C(-938)A多态性与患者的预后有关联。KIDD等[19]假设AA基因型抑制Bcl-2的表达,从而加速了细胞的凋亡,降低了患病风险;CC基因型促进Bcl-2的表达,从而抑制了细胞的凋亡,使肿瘤最终形成并具有侵袭性,以此解释AA基因型患者前列腺癌的患病风险降低。ROSSI等[17]、ZENZ等[18]研究结论似乎支持上述假设。但白杨等[20]通过研究得出,AA基因型与组织学分级差和腋窝淋巴结转移率高明显相关,未发现与临床分期、肿瘤大小、病理类型、ER/PR状态及HER2状态相关,结论不支持上述假设。
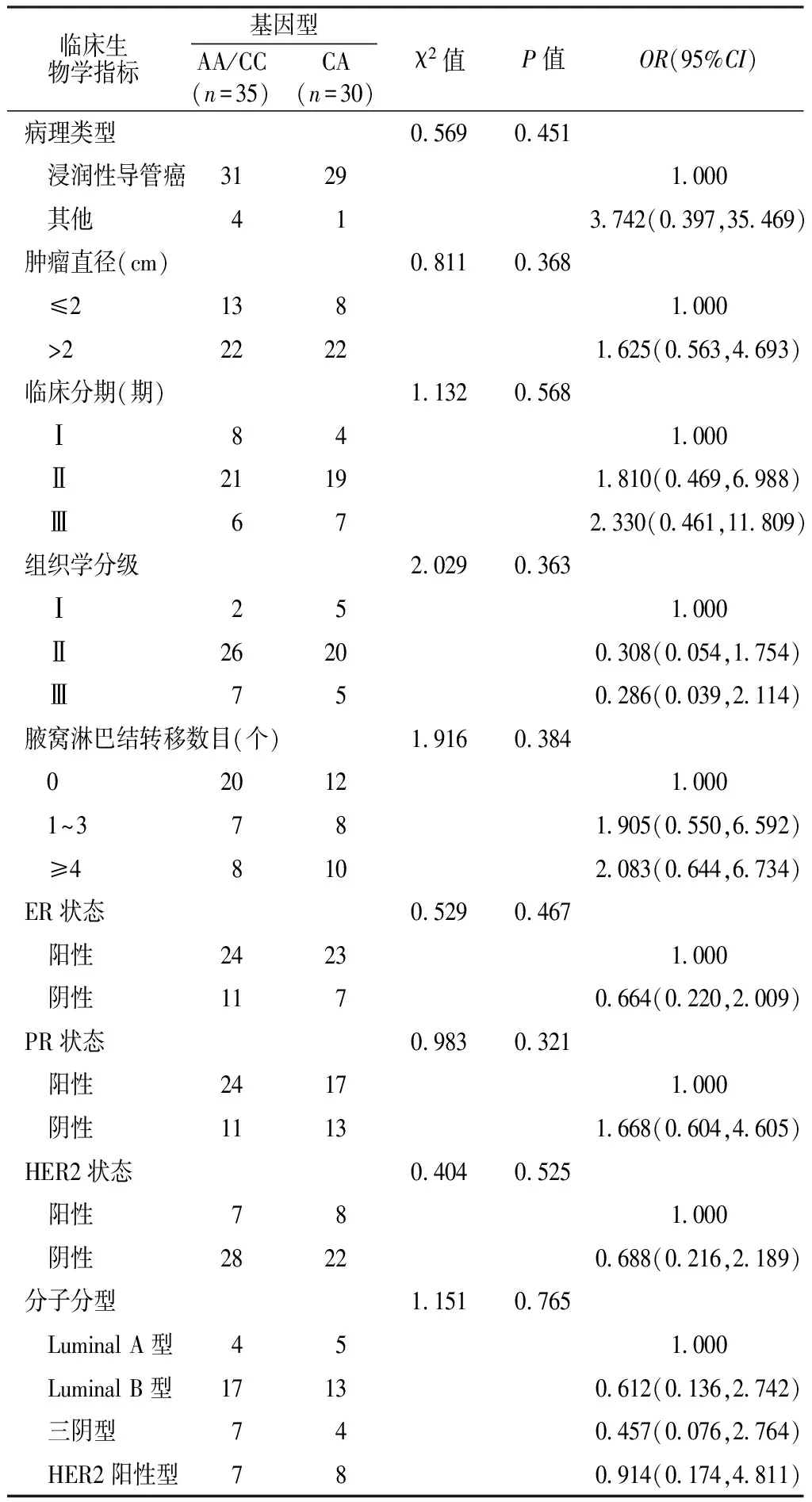
表1 Bcl-2基因C(-938)A多态性临床生物学指标的关系
注:ER=雌激素受体,PR=孕激素受体,HER2=人表皮生长因子2
本项目组前期研究结果显示,Bcl-2基因C(-938)A多态性与青海地区汉族BC易感性无关[21],同时本研究结果亦显示,Bcl-2基因C(-938)A多态性与病理类型、肿瘤直径、临床分期、组织学分级、腋窝淋巴结转移数目、ER状态、PR状态、HER2状态、分子分型均不存在关联性。考虑因在细胞凋亡过程中,牵涉到多个因子,如细胞膜表面FAS凋亡受体、上游含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-8及下游caspase-7或caspase-3凋亡效应因子等,肿瘤细胞逃避免疫监视及躲避凋亡的具体分子机制目前尚不清楚,Bcl-2基因在凋亡过程中扮演重要角色,但其也是参与整个凋亡信号途径的因子之一。而ROSSI等[17]、ZENZ等[18]及KIDD等[19]研究显示,Bcl-2基因多态性与BC易感性具有一定相关性,提示患者遗传背景及高原环境压力或许也在其中扮演一定角色。
本研究的不足之处是样本量少,实验技术单一,并未考虑环境致癌因素及基因-基因交互作用等,这些均可能影响结果的可靠性。此外,在今后的研究中,需要进一步扩大样本量及加入其他民族BC患者作为研究对照,以确认Bcl-2基因多态性与BC易感性的关系。
综上所述,青海地区BC患者Bcl-2基因C(-938)A多态性与临床生物学指标病理类型、肿瘤直径、临床分期、组织学分级、腋窝淋巴结转移数目、ER状态、PR状态、HER2状态、分子分型无关。
作者贡献:杨勇莉、王晓武进行研究设计与实施、资料收集整理,撰写论文并对文章负责;王玉花、韩静琦、管钰琳、徐婷、李耀丽进行研究实施、评估、资料收集;王晓武对文章总体负责,并进行质量控制及审校。
本文无利益冲突。
[1]吴在德,吴肇汉.外科学[M].7版.北京:人民卫生出版社,2012:308-309.
[2]梅雅琪,李惠萍,杨娅娟,等.乳腺癌患者乐观倾向和应对方式与益处发现的关系[J].中国全科医学,2016,19(23):2824-2827.DOI:10.3969/J.issn.1007-9572.2016.23.017.
MEI Y Q,LI H P,YANG Y J,et al.Relationship between optimism tendency,coping style and benefit finding of patients with breast carcinoma[J].Chinese General Practice,2016,19(23):2824-2827.DOI:10.3969/J.issn.1007-9572.2016.23.017.
[3]M BRADEN A,V STANKOWSKI R,M ENGEL J,et al.Breast cancer biomarkers:risk assessment,diagnosis,prognosis,prediction of treatment efficacy and toxicity,and recurrence[J].Curr Pharm Des,2014,20(30):4879-4898.
[4]AFSHARFARD A,MOZAFFAR M,ORANG E,et al.Trends in epidemiology,clinical and histopathological characteristics of breast cancer in Iran:results of a 17 year study[J].Asian Pac J Cancer Prev,2013,14(11):6905-6911.
[5]MOORE S P,FORMAN D,PINEROS M,et al.Cancer in indigenous people in Latin America and the Caribbean:a review[J].Cancer Med,2014,31(1):70-80.DOI:10.1002/cam4.134.
[6]SAIKA K,SOBUE T.Cancer statistics in the world[J].Gan To Kagaku Ryoho,2013,40(13):2475-2480.
[7]ZHANG J G,LIU S Z,CHEN Q,et al.Analysis of cancer incidence and mortality in Henan province,2009[J].Zhonghua Yu Fang Yi Xue Za Zhi,2013,47(7):597-602.
[8]HUSSAIN S A,SULLIVAN R.Cancer control in Bangladesh[J].Jpn J Clin Oncol,2013,43(12):1159-1169.DOI:10.1093/jjco/hyt140.
[9]KASUM M,BEKETIC-ORESKOVIC L,PEDDI P F,et al.Fertility after breast cancer treatment[J].Eur J Obstet Gynecol Reprod Biol,2014,173:13-18.DOI:10.1016/j.ejogrb.2013.11.009.
[10]吴炅,沈镇宙,邵志敏.乳腺癌细胞凋亡及相关基因表达的预后研究[J].上海医学,1999,22(1):27-31.DOI:10.3969/j.issn.0253-9934.1999.01.007.
[11]LIPONEN P,PIETILAINEN T,KOSMA V M,et al.Apoptosis suspressing protein bcl-2 is expressed in well differenciated breast carcinoma with favourable prognosis[J].J Pathl,1995,177(1):49-55.DOI:10.1002/path.1711770109.
[12]SILVESTRINI R,VENERONI S,DAIDONE M G,et al.The Bcl-2 protein:a prognostic indicator strongly related to p53 protein in lymph node-negative breast cancer patients[J].J Natl Cancer Int,1994,86(7):499-504.
[13]王晓武.Bcl-2和Bax基因及多态性与乳腺癌关系的研究进展[J].青海医药杂志,2013,43(2):78-79.
WANG X W.The research progress of relationship of Bcl-2,Bax and their polymorphism with breast cancer[J].Qinghai Journal of Medicine,2013,43(2):78-79.
[14]SOBIN LH G M,WITTEKIND C.TNM classification of malignant tumours (7th Edition)[M].7th ed.Oxford,UK:Wiley-Blackwell,2009:345-376.
[15]MEYER J S,ALVAREZ C,MILIKOWSKI C,et al.Breast carcinoma malignancy grading by Bloom-Richardson system vs proliferation index:reproducibility of grade and advantages of proliferation index[J].Mod Pathol,2005,18(8):1067-1078.DOI:10.1038/modpathol.3800388.
[16]KORSMEYER S J.Regulators of cell death[J].Trends Genet,1995,11(3):101-105.DOI:10.1016/S0168-9525(00)89010-1.
[17]ROSSI D,RASI S,CAPELLO D,et al.Prognostic assessment of Bcl-2-938C>A polymorphism in chronic lymphocytic leukemia[J].Blood,2008,111(1):466-468.DOI:10.1182/blood-2007-08-106823.
[18]ZENZ T,BENNER A,DUHRSEN U,et al.Bcl-2-938C>A polymorphism and disease progression in chronic lymphocytic leukemia[J].Leuk Lymphoma,2009,50(11):1837-1842.DOI:10.3109/10428190903207530.
[19]KIDD L R,COULIBALY A,TEMPLTON T M,et al.Germline BCL-2 sequence variants and inherited predisposition to prostate cancer[J].Prostate Cancer Prostatic Dis,2006,9(3):284-292.DOI:10.1038/sj.pcan.4500884.
[20]白杨,戴殿禄,马国明,等.Bcl-2基因多态性与乳腺癌临床生物学指标的关系[J].肿瘤,2010,30(1):48-52.DOI:10.3781/j.issn.1000-7431.2010.01.010.
[21]王晓武,邓勇,杨勇莉,等.MMP-9、Bcl-2基因多态性与青海汉族乳腺癌易感性[J].青海医学院学报,2013,34(1):31-37.DOI:10.3969/j.issn.1006-8252.2013.01.006.
RelationshipofB-CellLymphoma-2GeneC(-938)APolymorphismwithClinicalandBiologicalIndicatorsinBreastCancerPatientsinQinghaiArea
YANGYong-li1,WANGXiao-wu2*,WANGYu-hua2,HANJing-qi3,GUANYu-lin2,XUTing2,LIYao-li4
1.DepartmentofGynecology,QinghaiUniversityAffiliatedHospital,Xining810001,China2.DepartmentofBreastandThyroidSurgery,QinghaiUniversityAffiliatedHospital,Xining810001,China3.DepartmentofPathology,QinghaiUniversityAffiliatedHospital,Xining810001,China4.DepartmentofMedicalOncology,QinghaiUniversityAffiliatedHospital,Xining810001,China
*Correspondingauthor:WANGXiao-wu,Professor,Chiefphysician;E-mail:wtqba@126.com
ObjectiveTo explore the relationship of B-cell lymphoma-2 Gene C (-938) A〔Bcl-2 (-938 C> A)〕 polymorphism (AA,AC,CC genotypes) with clinical and biological indicators in patients with breast cancer (BC) in Qinghai area.MethodsSixty-five patients with breast cancer who
surgical treatment in Breast and Thyroid Surgery of Qinghai University Affiliated Hospital from January 2014 to December 2015 and met the study inclusion criteria were selected as the subjects.Bcl-2 (-938 C> A) polymorphism (AA,AC,CC genotypes) in BC tissues collected during the surgery were detected by polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP) method.The clinical and biological indicators,including pathological type,tumor diameter,clinical stage,histological grade,the number of metastatic axillary lymph nodes,ER level,PR level,HER2 level and molecular typing were collected.The relationship of Bcl-2(-938 C>A) polymorphism with clinical and biological indicators was analyzed by χ2test for contingency coefficients.ResultsAmong the subjects,AA,AC and CC genotypes were found in 6,30 and 29 cases,respectively.Since the number of patients with AA genotype was too small to be analyzed independently,they were merged with those with CC genotype for analyzing.Bcl-2(-938 C>A) polymorphism was not related with pathological type,tumor diameter,clinical stage,histological grade,the number of metastatic axillary lymph nodes,ER level,PR level,HER2 level and molecular typing (P>0.05).ConclusionBcl-2 (-938 C> A) polymorphism is not significantly associated with clinical and biological indicators (pathological type,tumor diameter,clinical stage,histological grade,the number of metastatic axillary lymph nodes,ER level,PR level,HER2 level and molecular typing) in BC patients in Qinghai area.
Breast neoplasms;Polymorphism,single nucleotide;Qinghai;B-cell lymphoma-2 Gene C (-938) A;Clinical and biological indicators
青海省应用基础研究计划项目(2014-ZJ-743);青海大学附属医院中青年科研基金项目(ASRF-2012-10)
R 737.9
A
10.3969/j.issn.1007-9572.2017.00.127
杨勇莉,王晓武,王玉花,等.青海地区乳腺癌患者B淋巴细胞瘤-2基因C(-938)A多态性与临床生物学指标关系研究[J].中国全科医学,2017,20(33):4151-4155.[www.chinagp.net]
YANG Y L,WANG X W,WANG Y H,et al.Relationship of B-cell lymphoma-2 gene C (-938) A polymorphism with clinical and biological indicators in breast cancer patients in Qinghai area[J].Chinese General Practice,2017,20(33):4151-4155.
2017-04-08;
2017-09-01)
(本文编辑:崔丽红)
