ERK1/2和PI3-K通路抑制剂对蛛网膜下腔出血大鼠海马区神经细胞自噬的协同作用
2017-11-08安朝旺刘瑶赵晓云韩颖赵雅宁赵旭李建民薛承景
安朝旺,刘瑶,赵晓云,韩颖,赵雅宁,赵旭,李建民,薛承景
(华北理工大学 1. 附属医院神经外科; 2. 护理与康复学院临床教研室,河北 唐山 063000)
ERK1/2和PI3-K通路抑制剂对蛛网膜下腔出血大鼠海马区神经细胞自噬的协同作用
安朝旺1,刘瑶2,赵晓云2,韩颖2,赵雅宁2,赵旭1,李建民1,薛承景1
(华北理工大学 1. 附属医院神经外科; 2. 护理与康复学院临床教研室,河北 唐山 063000)
目的通过观察联合抑制细胞外信号调节激酶(ERK1/2)和磷脂酰肌醇3激酶(PI3-K)蛋白对神经细胞自噬的影响,探讨蛛网膜下腔出血(SAH)救治靶点。方法将200只雄性SD大鼠按照数字表法随机分为假手术(Sham)组、模型(SAH)组、ERK1/2抑制剂U0126组、PI3-K抑制剂LY294002组、U0126+LY294002组。二次注血法制作SAH大鼠模型;HE染色观察海马区神经细胞的形态变化;实时荧光定量PCR法检测ERK1/2、PI3-K、自噬相关蛋白beclin-1和微管相关蛋白1轻链(LC3) mRNA的表达,免疫组化法检测海马区磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ蛋白的表达水平。结果SAH组海马区神经细胞死亡率、ERK1/2、PI3-K、beclin-1和LC3 mRNA以及磷酸化ERK1/2 、PI3-K、beclin-1和LC3-Ⅱ蛋白水平均高于Sham组 (均P < 0.05);U0126组和LY294002组海马区神经细胞死亡率高于SAH组,而ERK1/2、PI3-K、beclin-1和LC3 mRNA以及磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ蛋白水平均低于SAH组 (均P < 0.05);U0126+ LY294002组海马区神经细胞死亡率高于U0126或 LY294002组,而ERK1/2、PI3-K、beclin-1和LC3 mRNA以及磷酸化ERK1/2 、PI3-K、beclin-1和LC3-Ⅱ蛋白水平分别低于U0126和 LY294002组 (均P < 0.05)。结论联合抑制ERK1/2和PI3-K通路激活可显著降低SAH后神经细胞自噬,加重神经细胞丢失。
蛛网膜下腔出血; 细胞外信号调节激酶; 磷脂酰肌醇3激酶; 自噬相关蛋白; 微管相关蛋白1轻链
网络出版时间:
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)残障率约为60%以上[1],早期脑损伤(early brain injury,EBI)神经细胞丢失是SAH患者不良预后的关键环节[2]。自噬是细胞的一种防御机制,自噬的程度对维持应激损伤状态下细胞内环境平衡以及细胞的存活有不可忽视的作用[3],调控自噬可改善SAH后 EBI阶段的神经细胞死亡程度,对防治SAH后神经功能障碍有重要意义[4]。细胞外调节蛋白激酶1/2(extracellular regulated protein kinases,ERK1/2)和磷酸酰肌醇3激酶(phosphatidylinositol 3 kinase,PI3K)是调控细胞自噬通路的2个关键激酶,在多种中枢神经疾病(如脑缺血、帕金森综合征、阿尔茨海默病)的病理过程中起关键作用[5-7]。因此,针对这2个激酶与SAH后自噬的关系以及联合靶向干预的研究可能为SAH的早期救治提供潜在依据。本研究拟建立SAH模型大鼠,并分别或同时抑制ERK1/2、PI3-K信号通路,观察其对神经细胞自噬和神经细胞丢失的影响。
1 材料与方法
1.1 动物分组与模型建立
清洁级雄性SD大鼠200只,体质量350~450 g,购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2009-003。按照数字表法将大鼠随机分为5组:假手术组(Sham组)、蛛网膜下腔出血模型组(SAH组)、ERK1/2抑制 剂U0126组、PI3-K抑 制 剂LY294002组以及U0126+LY294002组,每组40只;各组大鼠按时间点再分为6 h、24 h、48 h、72 h 4个时间亚组。
采用自体血二次枕大池注血法[8]制备SAH大鼠模型。Sham组向大鼠枕大池注入2次0.3 mL生理盐水,余操作均与SAH组一致。U0126组、LY294002组、U0126+LY294002组分别在模型制备前30 min对每只大鼠侧脑室相应给予5 μ g/μ L的 U0126注射,500 nmol/5 μ L的 LY294002注射,或U0126和LY294002联合用药。
建模成功判定标准:行二次枕大池注血时在穿刺部位见少量血性脑脊液渗出,提示穿刺针位置准确;肉眼见脑底基底池部位有明显的血性液体分布。剔除不符合模型判断标准以及制作过程中死亡大鼠 , Sham 组、 SAH 组、 U0126 组、 LY294002 组以及U0126+LY294002组最终纳入统计学分析动物数量分别为40、33、32、32、32只。
1.2 指标检测
1.2.1 脑组织海马区形态结构观察:每组各时间点取4只或5只大鼠,常规麻醉后处死。用4%多聚甲醛灌注固定,取视交叉平面至大脑横裂的脑组织进行石蜡包埋,冠状切片(片厚5 μ m), HE染色,光学显微镜下观察。光镜下(×400)观察海马区神经元形态变化,每只大鼠取4张海马区切片,每张切片选取5个不重复的视野,用Motic-6.0图像采集以及分析系统分析,计数每个视野下死亡细胞百分率(死亡细胞数量与总细胞数量的比值)。
1.2.2 实时荧光定量PCR法检ERK1/2、PI3-K、beclin-1和LC3表达:每组于各时间点取4只或5只大鼠处死,快速断头取脑,冰上分离双侧海马组织,称量0.6 g。加入1 mL RNAiso Plus溶液后匀浆,4 ℃、12 000 r/min离心5 min,取上清移至1.5 mL离心管内,加入1/5 RNAiso Plus溶液体积的氯仿,震荡混匀后室温静置5 min,4 ℃、12 000 r/min离心15 min,将上清液转移至新离心管中,加入0.5~1倍RNAiso Plus溶液体积的异丙醇,室温静置10 min,4 ℃、12 000 r/min离心10 min,弃上清,用与RNAiso Plus溶液等量的75%乙醇清晰沉淀,4 ℃离心(7 500 r/min) 5 min,弃上清并保留沉淀,自然干燥,溶解于30 μ L DEPC处理水中,测量OD260/280值,计算RNA浓度,-80 ℃保存。
实时荧光定量PCR反应:行基因组DNA的除去反应,在PCR管中依次加入5×gDNA Eraser Buffer 2 μ L、g DNA Eraser 1 μ L、Total RNA1 μ g,混合均匀后42 ℃孵育2 min或室温孵育5 min;反转录反应,在逆转录仪器进行,反应条件为37 ℃ 15 min,85 ℃ 5 s,最后温度降至4℃,如有需要,-20 ℃冻存cDNA;PCR反应条件:95 ℃ 30 s、95 ℃ 5 s、60 ℃ 30 s,40个循环;定量分析,以标准曲线和样本扩增的Ct值算得样本所检测目的基因mRNA相对拷贝数,每个检测基因与内参基因GAPDH作比,将比值作统计学处理,(∆Ct=目的基因平均Ct值-内参基因平均Ct值,∆∆Ct=实验组∆Ct-对照组∆Ct,相对表达量=2-△△Ct。引物由上海生工生物技术有限公司合成,序列见表1。
1.2.3 免疫组织化学法检测磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ蛋白表达:标本采集同HE染色。切片常规脱蜡至去离子水,滴加复合消化液,37 ℃孵育20 min,PBS洗涤3 次(5 min/次),3%过氧化氢封闭内源性过氧化物酶15 min,PBS洗涤,滴加兔抗鼠磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ多克隆抗体(1∶200,1∶200,1∶250,1∶250),4 ℃过夜。37 ℃复温45 min,PBS洗涤,滴加生物素化二抗,37 ℃孵育40 min,PBS洗涤,DAB显色,苏木精轻度复染,脱水透明,封片,镜下观察。阳性率的定量分析:每只动物取5张海马区切片,每张切片再选取相同部位的4个视野,应用Motic-6.0图像采集及图像分析系统分析各组阳性细胞吸光度(absorbance,A)。
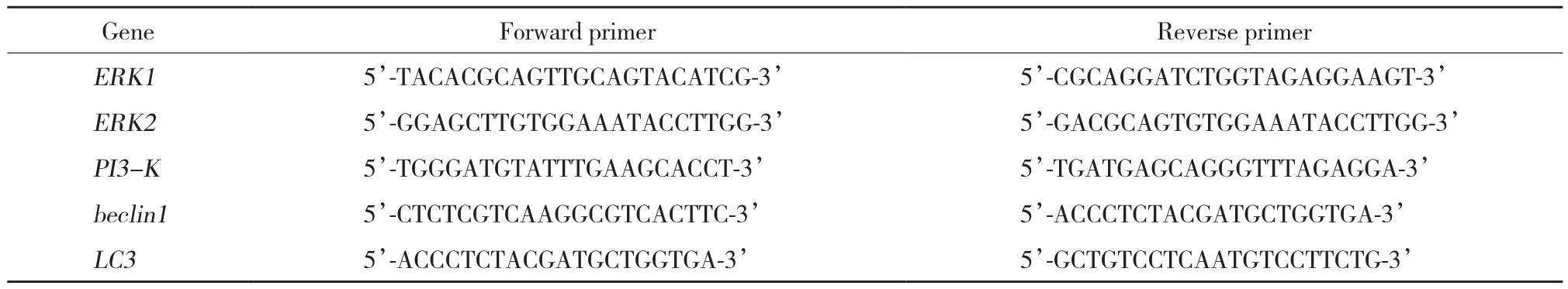
表1 PCR引物序列Tab.1 Sequence of PCR primers
1.3 统计学分析
采用SPSS 17.0 统计软件进行统计学分析。数据以x-±s表示,组间比较采用单因素方差分析,2组比较采用SNK- q分析,P < 0.05为差异有统计学意义。
2 结果
2.1 各组大鼠海马区神经元形态学变化
Sham组海马区神经细胞结构正常,排列整齐,细胞核大而圆,核仁清晰;SAH组海马区可见神经细胞变性、水肿、坏死(核溶解、核碎裂或核消失结构不清)。SAH组神经细胞死亡率较Sham组明显增高。U0126组和LY294002组神经细胞损伤进一步加重,神经细胞死亡率高于SAH组(P < 0.05)。U0126+LY294002组神经细胞死亡率显著高于U0126组和LY294002组(P < 0.05)。见图1,表2。
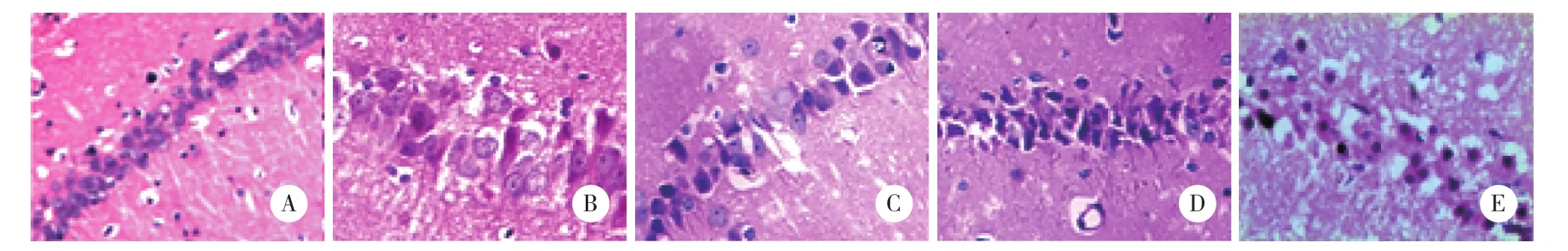
图1 各组大鼠72 h海马区神经细胞HE染色 ×400Fig.1 HE staining of neurons in the hippocampus in each group ×400
表2 各组海马区神经细胞死亡率比较 Tab.2 Comparison of neuronal death rates in the hippocampus of rats from each group

表2 各组海马区神经细胞死亡率比较 Tab.2 Comparison of neuronal death rates in the hippocampus of rats from each group
1) P < 0.05 vs Sham group;2) P < 0.05 vs SAH group;3) P < 0.05 vs U0126 group;4) P < 0.05 vs LY294002 group.
Group 6 h 24 h 48 h 72 h Sham 1.189±0.070 1.200±0.069 1.190±0.070 1.119±0.069 SAH 15.449±2.3361) 25.664±4.5531) 37.652±4.6641) 48.339±5.2881)U0126 28.338±5.6622) 33.448±7.1422) 45.886±8.6202) 51.204±9.8822)LY294002 29.226±6.3392) 33.278±7.1282) 46.339±9.8142) 50.546±8.9982)U0126+LY294002 39.368±5.9973),4) 48.869±9.6843),4) 58.966±10.8203),4) 62.339±12.5593),4)
2.2 实时荧光定量PCR结果
以Sham组ERK1/2、PI3-K、beclin-1和LC3 mRNA表达量为1,计算各组ERK1/2、PI3-K、beclin-1和LC3 mRNA值。SAH组ERK1/2、PI3-K、beclin-1和LC3 mRNA水平高于Sham组,其中beclin-1和LC3于24 h达高峰,72 h迅速下降,但仍高于Sham组(P < 0.05);U0126组和LY294002组中ERK1/2、PI3-K、beclin-1和LC3 mRNA均低于SAH组(P < 0.05);U0126+LY294002组ERK1/2、PI3-K、beclin-1和LC3 mRNA分别显著低于 U0126组和LY294002组(P < 0.05)。见表3。
表3 各组海马区ERK1/2、PI3-K、beclin-1和LC3 mRNA表达水平的比较Tab.3 Comparison of ERK1/2,PI3-K,beclin-1 and LC3 mRNA expression levels in the hippocampus of rats in different groups
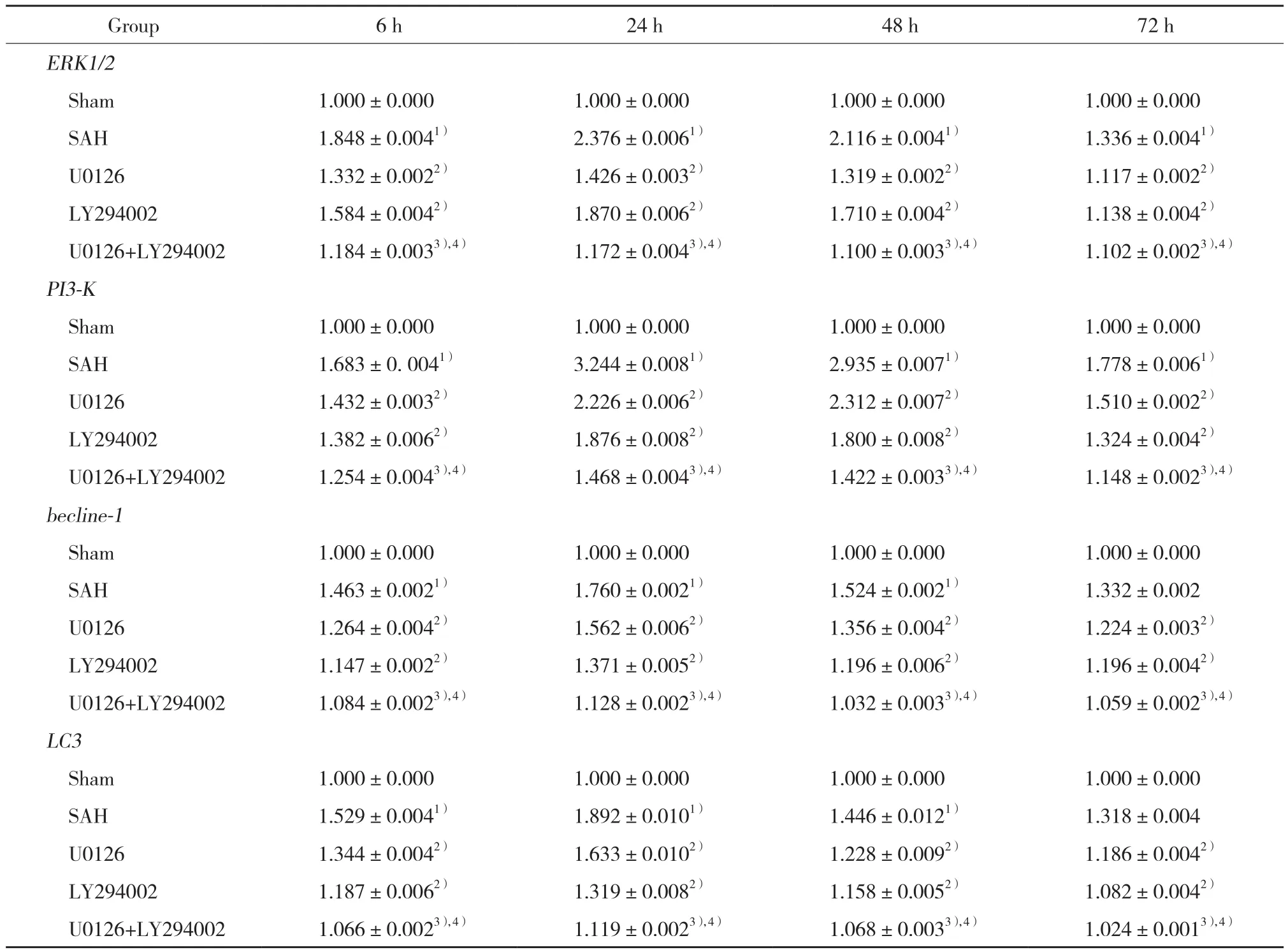
表3 各组海马区ERK1/2、PI3-K、beclin-1和LC3 mRNA表达水平的比较Tab.3 Comparison of ERK1/2,PI3-K,beclin-1 and LC3 mRNA expression levels in the hippocampus of rats in different groups
1) P < 0.05 vs Sham group;2) P < 0.05 vs SAH group;3) P < 0.05 vs U0126 group;4) P < 0.05 vs LY294002 group.
Group 6 h 24 h 48 h 72 h ERK1/2 Sham 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 SAH 1.848±0.0041) 2.376±0.0061) 2.116±0.0041) 1.336±0.0041)U0126 1.332±0.0022) 1.426±0.0032) 1.319±0.0022) 1.117±0.0022)LY294002 1.584±0.0042) 1.870±0.0062) 1.710±0.0042) 1.138±0.0042)U0126+LY294002 1.184±0.0033),4) 1.172±0.0043),4) 1.100±0.0033),4) 1.102±0.0023),4)PI3-K Sham 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 SAH 1.683±0. 0041) 3.244±0.0081) 2.935±0.0071) 1.778±0.0061)U0126 1.432±0.0032) 2.226±0.0062) 2.312±0.0072) 1.510±0.0022)LY294002 1.382±0.0062) 1.876±0.0082) 1.800±0.0082) 1.324±0.0042)U0126+LY294002 1.254±0.0043),4) 1.468±0.0043),4) 1.422±0.0033),4) 1.148±0.0023),4)becline-1 Sham 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 SAH 1.463±0.0021) 1.760±0.0021) 1.524±0.0021) 1.332±0.002 U0126 1.264±0.0042) 1.562±0.0062) 1.356±0.0042) 1.224±0.0032)LY294002 1.147±0.0022) 1.371±0.0052) 1.196±0.0062) 1.196±0.0042)U0126+LY294002 1.084±0.0023),4) 1.128±0.0023),4) 1.032±0.0033),4) 1.059±0.0023),4)LC3 Sham 1.000±0.000 1.000±0.000 1.000±0.000 1.000±0.000 SAH 1.529±0.0041) 1.892±0.0101) 1.446±0.0121) 1.318±0.004 U0126 1.344±0.0042) 1.633±0.0102) 1.228±0.0092) 1.186±0.0042)LY294002 1.187±0.0062) 1.319±0.0082) 1.158±0.0052) 1.082±0.0042)U0126+LY294002 1.066±0.0023),4) 1.119±0.0023),4) 1.068±0.0033),4) 1.024±0.0013),4)
2.3 各组磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ免疫组织化学检测结果
磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ的阳性表达主要位于细胞核,阳性细胞核内可见细小的棕黄色颗粒。Sham组可偶见磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ阳性细胞,染色浅黄。SAH 组磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ阳性反应增强(P < 0.05);U0126组和LY294002组中磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ阳性反应均低于SAH 组(P <0.05);U0126+LY294002组 磷 酸 化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ阳性反应分别显著低于U0126组和LY294002组(P < 0.05)。见图2,表4。
3 讨论
自噬是细胞通过溶酶体途径对功能受损的白质和细胞器进行识别、降解和修复的一种现象,是细胞除坏死和凋亡外的第3种死亡方式。前期的研究[9]显示SAH后自噬对神经细胞具有保护作用,采用神经保护剂BQ-l23对SAH大鼠进行干预后,大鼠脑水肿减轻,LC3-Ⅱ表达水平升高,表明BQ-l23对SAH的脑保护作用是通过促进自噬来完成的。至今,自噬被证实广泛存在于中枢神经系统疾病病理进程中,且研究[5-7]认为自噬主要对脑应激损伤的神经细胞具有保护作用。
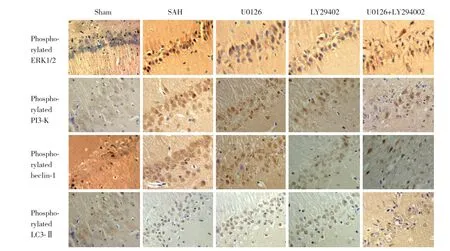
图2 各组大鼠24 h海马区磷酸化ERK1/2、PI3-K、beclin-1和LC3-Ⅱ免疫组织化学检测结果 ×400Fig.2 Immunohistochemical staining of phosphorylated ERK1/2,PI3-K,beclin-1,and LC3-Ⅱ in the hippocampus in each group ×400
表4 各组大鼠海马区磷酸化ERK1/2、PI3-K、beclin-1、LC3-Ⅱ表达水平的比较 Tab.4 Comparison of phosphorylated ERK1/2,PI3-K,beclin-1,and LC3-Ⅱexpression levels in the hippocampus of rats in different groups
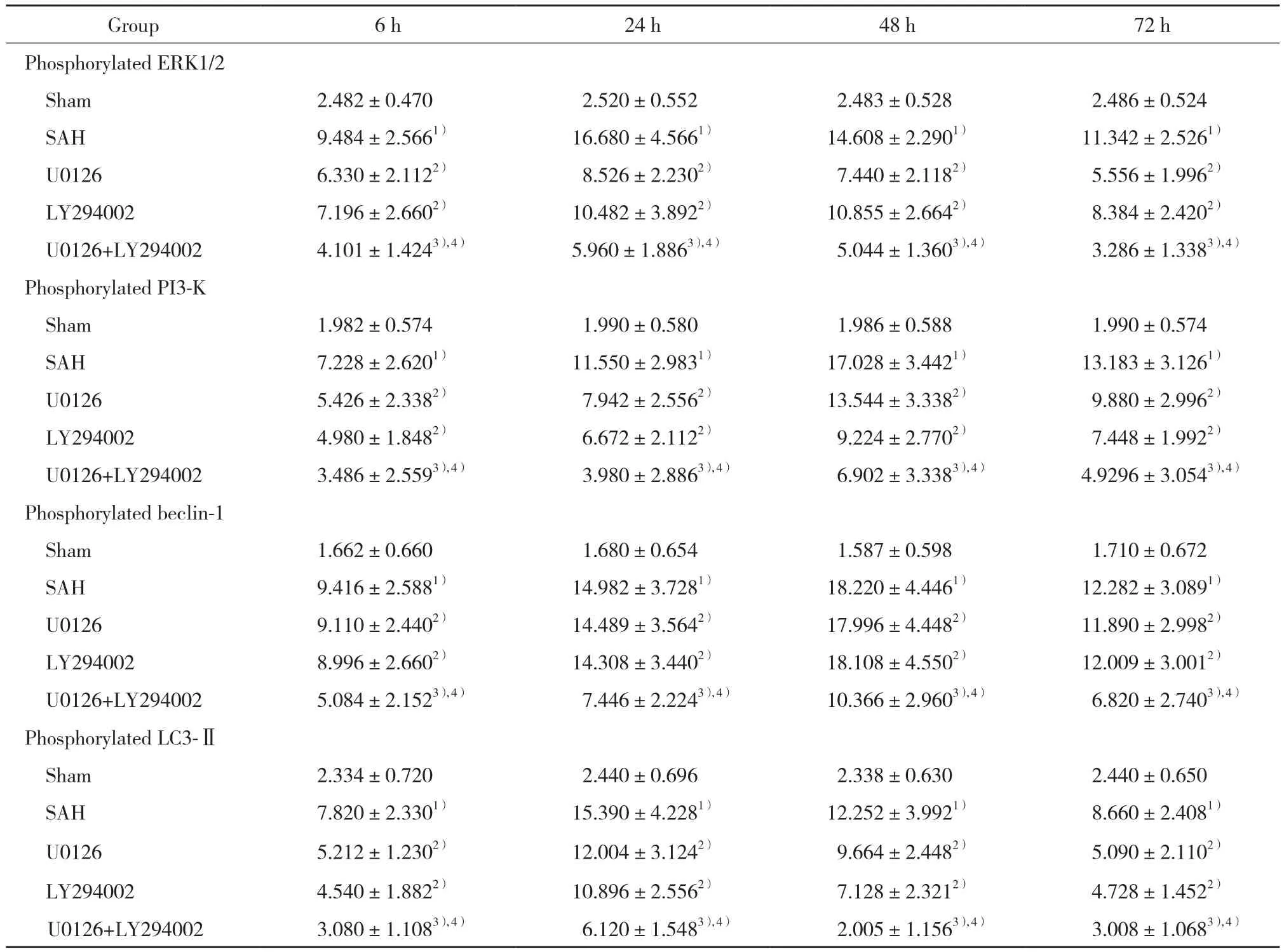
表4 各组大鼠海马区磷酸化ERK1/2、PI3-K、beclin-1、LC3-Ⅱ表达水平的比较 Tab.4 Comparison of phosphorylated ERK1/2,PI3-K,beclin-1,and LC3-Ⅱexpression levels in the hippocampus of rats in different groups
1) P < 0.05 vs Sham group;2) P < 0.05 vs SAH group;3) P < 0.05 vs U0126 group;4) P < 0.05 vs LY294002 group.
Group 6 h 24 h 48 h 72 h Phosphorylated ERK1/2 Sham 2.482±0.470 2.520±0.552 2.483±0.528 2.486±0.524 SAH 9.484±2.5661) 16.680±4.5661) 14.608±2.2901) 11.342±2.5261)U0126 6.330±2.1122) 8.526±2.2302) 7.440±2.1182) 5.556±1.9962)LY294002 7.196±2.6602) 10.482±3.8922) 10.855±2.6642) 8.384±2.4202)U0126+LY294002 4.101±1.4243),4) 5.960±1.8863),4) 5.044±1.3603),4) 3.286±1.3383),4)Phosphorylated PI3-K Sham 1.982±0.574 1.990±0.580 1.986±0.588 1.990±0.574 SAH 7.228±2.6201) 11.550±2.9831) 17.028±3.4421) 13.183±3.1261)U0126 5.426±2.3382) 7.942±2.5562) 13.544±3.3382) 9.880±2.9962)LY294002 4.980±1.8482) 6.672±2.1122) 9.224±2.7702) 7.448±1.9922)U0126+LY294002 3.486±2.5593),4) 3.980±2.8863),4) 6.902±3.3383),4) 4.9296±3.0543),4)Phosphorylated beclin-1 Sham 1.662±0.660 1.680±0.654 1.587±0.598 1.710±0.672 SAH 9.416±2.5881) 14.982±3.7281) 18.220±4.4461) 12.282±3.0891)U0126 9.110±2.4402) 14.489±3.5642) 17.996±4.4482) 11.890±2.9982)LY294002 8.996±2.6602) 14.308±3.4402) 18.108±4.5502) 12.009±3.0012)U0126+LY294002 5.084±2.1523),4) 7.446±2.2243),4) 10.366±2.9603),4) 6.820±2.7403),4)Phosphorylated LC3-ⅡSham 2.334±0.720 2.440±0.696 2.338±0.630 2.440±0.650 SAH 7.820±2.3301) 15.390±4.2281) 12.252±3.9921) 8.660±2.4081)U0126 5.212±1.2302) 12.004±3.1242) 9.664±2.4482) 5.090±2.1102)LY294002 4.540±1.8822) 10.896±2.5562) 7.128±2.3212) 4.728±1.4522)U0126+LY294002 3.080±1.1083),4) 6.120±1.5483),4) 2.005±1.1563),4) 3.008±1.0683),4)
研究[10]证实ERK1/2参与细胞自噬的形成,用氧化应激诱导剂VK3诱导Hela细胞自噬,ERK1/2激活,U0126可阻断该过程中LC3-Ⅱ的表达;在小鼠SAH模型中发现代谢型谷氨酸受体1选择性拮抗剂可降低海马区beclin-1、LC3-Ⅱ表达水平,且在该变化过程中伴随ERK1/2活性的改变[11],提示ERK1/2通路可能是调控细胞自噬的靶点。PI3-K信号是维持细胞存活的经典通路。李晓晖等[12]发现应用PI3-K抑制剂LY294002干预SAH小鼠,可造成p53表达显著增加、海马区神经元严重丢失。PI3-K激活后,可催化肌醇环上的3位羟基生成3,4,5三磷酸磷脂酰肌醇,使Akt发生磷酸化,进而减少其下游雷帕霉素靶蛋白的表达,调控真核细胞的自噬,促进细胞存活[13]。本研究中,U0126组和LY294002组中beclin-1和LC3-Ⅱ的蛋白和mRNA表达水平(二者是自噬标记蛋白,反映细胞自噬发生和程度)均较SAH组显著下降,提示ERK1/2和PI3-K信号激活共同参与SAH后神经细胞自噬的调控。结合本研究中神经细胞死亡率的变化,笔者认为SAH后ERK1/2和PI3-K通路激活可促进自噬,从而拮抗神经细胞的丢失。本研究亦发现联合应用ERK1/2和PI3-K通路抑制剂后神经细胞死亡率进一步增加,且beclin-1和LC3-Ⅱ蛋白和mRNA表达水平持续降低,提示SAH后二者可相互促进,协同发挥对早期脑损伤的保护作用。研究[14-15]显示,ERK1/2和PI3-K通路不仅存在共同的活化因子(如Ras、神经生长因子等),亦存在某些共同的底物(如GSK3β、反应元件结合蛋白等),可能是SAH后二者相互影响的原因。 SAH后PI3-K和ERK1/2途径之间的关系以及二者调控自噬的机制仍需深入研究。
综上所述,本研究发现ERK1/2和PI3-K通路激活共同参与SAH后神经细胞自噬的调节,联合抑制ERK1/2和PI3-K通路激活可显著降低SAH后神经细胞自噬,加重神经细胞丢失,提示SAH早期救治时应注意ERK1/2和PI3-K的协同效应,同时对二者进行调控可能会取得更好的效果。
[1] SEHBA FA,HOU J,PLUTA RM,et al. The importance of early brain injury after subarachnoid hemorrhage [J]. Prog Neurobiol,2012,97(1):14-37. DOI:10.1016/j.pneurobio.2012.02.003.
[2] TOPKORU BC,ALTAY O,DURIS K,et al. Nasal administration of recombinant osteopontin attenuates early brain injury after subarachnoid hemorrhage [J]. Stroke,2013,44(11):3189-3194. DOI:10.1161/STROKEAHA.113.001574.
[3] 李乐兴,戴汉川. 细胞自噬调控的分子机制研究进展[J]. 中国细胞 生 物 学 学 报,2015(2):263-270. DOI:10.11844/cjcb.2015.02.0271.
[4] JI C,CHEN G. Signaling pathway in early brain injury after subarachnoid hemorrhage:news update [J]. Acta Neurochir Suppl,2016,121:123-126. DOI:10.1007/978-3-319-18497-5_21.
[5] 周广正,官亚东,张华,等. 脑缺血损伤后细胞外信号调节蛋白激酶1/2信号通路及胡黄连苷Ⅱ的干预作用 [J]. 中国现代医学杂志,2015,25(27):22-26. DOI:10.3969/j.issn.1005-8982.2015.27.005.
[6] 郭向飞,赵雅宁,李建民,等. PI3K/mTOR/自噬通路在间歇性低氧加重全脑缺血大鼠神经损伤中的作用[J]. 中国医科大学学报,2017,46(1):62-67. DOI:10.12007/j.issn.0258-4646.2017.01.014.
[7] 聂志玲,周小莉,晁利芹. 补肾活血化痰方对阿尔茨海默病模型大鼠海马细胞外调节蛋白激酶1、蛋白激酶2蛋白表达的影响[J].河 南 中 医,2015,35(1):47-49. DOI:10.16367/j.issn.1003-5028.2015.01.0021.
[8] 马朝晖,李贵福,罗望池,等. 改良“二次枕大池注血法”构建Wistar大鼠蛛网膜下腔出血模型[J]. 中国神经精神疾病杂志,2012,38(3):190-192. DOI:10.3969 / j.issn.1002-0152.2012.03.012.
[9] 赵雅宁,赵旭,李建民,等. 内皮素受体拮抗剂BQ-123经PI3-K/Akt信号通路改善蛛网膜下腔出血大鼠早期脑损伤的效果[J]. 中 国 脑 血 管 病 杂 志,2016,13(5):249-256. DOI:10.3969/j.issn.1672-5921.2016.05.006.
[10] 于春艳,刘希,于春荣,等. 维生素K3诱导氧化应激经ERK信号途径介导HeLa细胞发生自噬[J]. 吉林大学学报(医学版),2014,40( 2):229-232. DOI:10.13481/j.1671-587x.20140203.
[11] 李冉,刘江,崔建忠,等. 蛛网膜下腔出血后自噬活性调节中代谢型谷氨酸受体1与细胞外信号调节激酶的作用及其相互关系[J]. 解剖学杂志,2012,35 (6):713-717. DOI:10.3969/j.issn.1001-1633.2012.06.003.
[12] 李晓晖,李冉,田艳霞,等. p53在蛛网膜下腔出血小鼠脑皮质的表达及其与PI3K/Akt信号通路的关系[J]. 解剖学报,2011,42(4):446-450. DOI:10. 3969 /j.issn. 0529-1356. 2011. 04. 003.
[13] 丁亦含,李玉峰. mTOR信号通路与自噬、凋亡之间的相互关系[J]. 现代医学,2015,43(6):801-804.
[14] MI Y,XIAO C,DU Q,et al. Momordin Ic couples apoptosis with autophagy in human hepatoblastoma cancer cells by reactive oxygen species (ROS)-mediated PI3K/Akt and MAPK signaling pathways [J].Free Radic Biol Med,2016,90:230-242. DOI:10.1016/j.freeradbiomed.2015.11.022.
[15] ZENG B,LI Y,NIU B,et al. Involvement of PI3K/Akt/FoxO3a and PKA/CREB signaling pathways in the protective effect of fluoxetine against corticosterone-induced cytotoxicity in PC12 cells [J]. Mol Neurosci,2016,59(4):567-578. DOI:10.1007/s12031-016-0779-7.
(编辑 王又冬)
Synergistic Effects of ERK1/2 and PI3-K Pathway Inhibitors on Autophagy in the Hippocampus of Rats with Subarachnoid Hemorrhage
AN Chaowang1,LIU Yao2,ZHAO Xiaoyun2,HAN Ying2,ZHAO Yaning2,ZHAO Xu1,LI Jianmin1,XUE Chengjing1
(1. Neurosurgery Department,Affiliated Hospital of North China University of Science and Technology,Tangshan 063000,China;2. Clinical Department,College of Nursing and Rehabilitation,North China University of Science and Technology,Tangshan 063000,China)
ObjectiveTo investigate synergistic effects of extracellular signal regulated kinase (ERK1/2) and phosphatidylinositol 3 kinase (PI3-K) pathway inhibitors on autophagy in the hippocampus of rats with subarachnoid hemorrhage (SAH),for identification of therapeutic targets in SAH.MethodsTotally,200 male SD rats were randomly divided into a sham operated group,SAH group,inhibitor U0126 group,inhibitor LY294002 group,and a U0126+ LY294002 group. Animal models were established by injecting autologous blood twice into the cisterna magna. Morphological changes in the hippocampus nerve cells were detected by HE staining;ERK1/2,PI3-K,beclin-1,and LC3 mRNA expression in the hippocampus were detected by real-time PCR,and phosphorylated ERK1/2,PI3-K,beclin-1,and LC3-Ⅱ protein expression were detected by immunohistochemistry.ResultsNeuronal death rate and phosphorylated ERK1/2,PI3-K,beclin-1,and LC3-Ⅱlevels in the hippocampus in the SAH group were higher than in the sham group (all P < 0.05). Neuronal death rate in U0126 or LY294002 group was higher than in SAH group,while ERK1/2,PI3-K,beclin-1,and LC3 mRNA and phosphorylated ERK1/2,PI3-K,beclin-1,and LC3-Ⅱprotein levels were lower than in SAH group (all P < 0.05). Neuronal death rate in U0126 +LY294002 group was higher than in U0126 or LY294002 group,while ERK1/2,PI3-K,beclin-1,LC3 mRNA and phosphorylated ERK1/2,PI3-K,beclin-1,and LC3-Ⅱprotein levels in the hippocampus were lower than in U0126 or LY294002 group (all P < 0.05).ConclusionCo-targeting the inhibition of ERK1/2 and PI3-K pathways can significantly reduce neuronal cell autophagy and aggravate cells loss after SAH.
subarachnoid hemorrhage;extracellular signal regulated kinase;phosphatidylinositol 3 kinase;autophagy
R651.1
A
0258-4646(2017)11-0995-06
10.12007/j.issn.0258-4646.2017.11.008
河北省省级重大医学科研课题(zd2013087);唐山市科技计划(14130220B)
安朝旺(1980-),男,主治医师,硕士.
李建民,E-mail:18531776202@163.com
2016-11-22
