PIM1对老年食管癌患者癌细胞增殖和凋亡的影响
2017-11-07徐崇明段丽群
罗 燕 徐崇明 段丽群
(湖北省肿瘤医院胸部放疗科,湖北 武汉 430079)
PIM1对老年食管癌患者癌细胞增殖和凋亡的影响
罗 燕 徐崇明 段丽群
(湖北省肿瘤医院胸部放疗科,湖北 武汉 430079)
目的探讨PIM1对老年食管癌患者癌细胞增殖和凋亡的影响。方法将RNAi重组质粒(PIM1-shRNA-3) 经脂质体介导转染食管癌ECA-109细胞株。PIM1基因沉默(PPIM1-shRNA-3)稳定转染的ECA-109细胞(转染组),用空质粒载体稳定转染的ECA-109细胞(空白转染组)和正常培养的ECA-109细胞(对照组)作为对照进行体外研究。通过细胞计数法绘制细胞生长曲线图,RT-PCR法测量PIM1基因表达水平,CCK-8法计算其增殖抑制率,AnnexinV-FITC/PI流式法和TUNEL法测算凋亡情况来检测细胞的增殖能力。结果载体成功转入到食管癌细胞中并表达,转染组ECA-109细胞数量减少;转染组肿瘤细胞PIM1基因表达水平明显低于空白转染组和对照组(P<0.05),且转染组PIM1 mRNA相对表达与空白转染组和对照组相比显著降低(P<0.05);相比空白转染组和对照组,ECA-109细胞计数和增殖能力在转染组明显降低(P<0.05);与空白转染组和对照组比较,转染组细胞的细胞抑制率明显升高,P<0.05;TUNEL和AnnexinV-FITC/PI法检测结果表明:PIM1基因沉默可促进细胞的凋亡反应,进而抑制细胞的增殖水平。结论食管癌ECA-109细胞株可通过PIM1基因沉默抑制增殖,增加凋亡。
食管癌;PIM1;基因沉默;细胞增殖;细胞凋亡
大多数食管癌患者在就诊时已处于中晚期,相当一部分病人已经不能进行手术治疗,总的5年生存率低于10%,因此食管癌的治疗仍强调早期诊断〔1〕。随着我国人口老年化进程,高龄食管癌患者日益增多〔2〕。当前,从基因角度出发,探寻食管癌的发病机制、诊断标准以及治疗手段对于食管癌的诊疗具有重要意义〔3,4〕。PIM1属于丝氨酸/苏氨酸激酶PIM家族,可抑制细胞凋亡,被认为与肿瘤的发生密切相关〔5〕。本研究拟探讨PIM1基因沉默对食管癌细胞增殖和凋亡的影响。
1 材料和方法
1.1细胞转染及分组 在含有10% FBS的RPMI1640培养基中对食管癌ECA-109细胞株(购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所,常规培养质粒提取试剂盒购自北京天为时代生物有限公司)常规培养。于转染前1 d用2×105个/孔将细胞接种到24孔板上,具体转染方法严格根据LipofectamineTM2000 Reagent的使用说明进行。培养转染细胞48 h后,再换成RPM1-1640完全培养基,此培养基含有G418(600 mg/L)。经过大约3 w的筛选,最后获取稳定转染的 PIM1基因沉默的重组质粒组(转染组);与此同时,采用空载体质粒组转染的PIM1细胞作为阴性对照组(空白转染组),以正常ECA-109细胞作为对照组。对细胞进行收集并冷冻保存,留置待用。
1.2荧光定量RT-PCR法检测PIM1基因表达 采用Trizol(Invitrogen公司)一步法〔6〕,提取标本总RNA,并通过紫外分析技术及甲醛变性电泳检测获得的RNA质量。取1 μg RNA逆转录成DNA。内参照β-actin上游引物5'-TCCCGGCATGTGCAAGGCC-3',下游引物5'-CATCTCTTGCTCGAAGTCCA-3',目的片段545 bp;PIM1上游引物5'-CTCCACCGCGACATCAAGGA-3',下游引物5'-GATGGTCTCAGGGCCAAGCA-3',目的片段338 bp。PCR反应条件:94℃ 5 min→(94℃ 30 s→50℃ 30 s→72℃ 30 s)30个循环→72℃ 10 min,在1% 琼脂糖凝胶中对PCR产物进行电泳分析〔7〕。
1.3检测细胞增殖及其抑制率并绘制生长曲线 分别取各组的PIM1细胞,以1×104/孔接种到24孔板中,每小组分别取4个平行孔,接种48 h后,倒立放置在显微镜下观察并进行拍照记录,记录72 h和96 h后的细胞数。每个小组接种7个复孔,并在37℃和5% CO2的培养箱中进行常规培养,每天对1孔进行3次计数,连续7 d,采用3次的平均数绘制细胞生长曲线。以4×105/孔接种3组细胞到在96孔培养板上,每小组24复孔。分别添加CCK-8试剂(购于同仁化学研究所)10 μl,在接种后的24、48、72 h,测定450 nm处的吸光度值(OD值)。取培养液作为空白对照,取其平均值。细胞增殖抑制率公式:抑制率 = (1-实验组 OD值/对照组OD值)×100%〔8〕。
1.4TUNEL法检测细胞凋亡 预置盖玻片的24孔板中对各组食管癌细胞进行接种,培养72 h,使用TUNEL试剂盒法(TUNEL法凋亡检测试剂盒购于Roche公司)检测细胞凋亡情况;采用光学显微镜观察凋亡细胞,计算凋亡指数。结果判定:随机选取5个400倍高倍镜视野,凋亡细胞为出现在细胞核内的棕黄色或深褐色颗粒。
1.5AnnexinV-FITC/PI流式法检测细胞凋亡率 各组转染细胞接种在6孔板中,并置于37℃、5% CO2的培养箱中培养,长至80% 融合时,换新的DMEM培养基。以不含EDTA的胰酶消化处理后,收集1×105细胞,加入500 μl binding buffer重悬细胞,然后加入5 μl Annexin V-FITC溶液混匀后加入5 μl Propidum Iodide混匀(凯基生物有限公司,南京,中国),室温下避光反应5~15 min。以流式细胞仪FACSCalibur(BD Bioscience,USA) 检测各组细胞凋亡情况。
1.6统计学分析 采用SPSS21.0软件计量资料组间比较采用t检验,多组之间的比较采用单因素方差分析。
2 结 果
2.1各组细胞株的转染效果 转染PIM1基因沉默的重组质粒组和阴性对照组中,约70%~80%的细胞都能检测到荧光信号,而在正常对照组中不出现荧光信号。见图1。
2.2各组肿瘤细胞基因PIM1表达水平 转染组肿瘤细胞PIM1基因表达水平(0.29±0.02)明显低于空白转染组(0.42±0.03)和对照组(0.44±0.04),转染组与空白转染组和对照组相比差异显著(均P<0.05);空白转染组和对照组间无明显差异(P>0.05)。
2.3细胞生长曲线 3组细胞均随着时间生长,但增殖能力和速率不一样。相比空白转染组和对照组,转染组ECA-109细胞在各检测时间点明显减少(均P<0.05)。而空白转染组和对照组差异无统计学意义(P>0.05)。见表1。
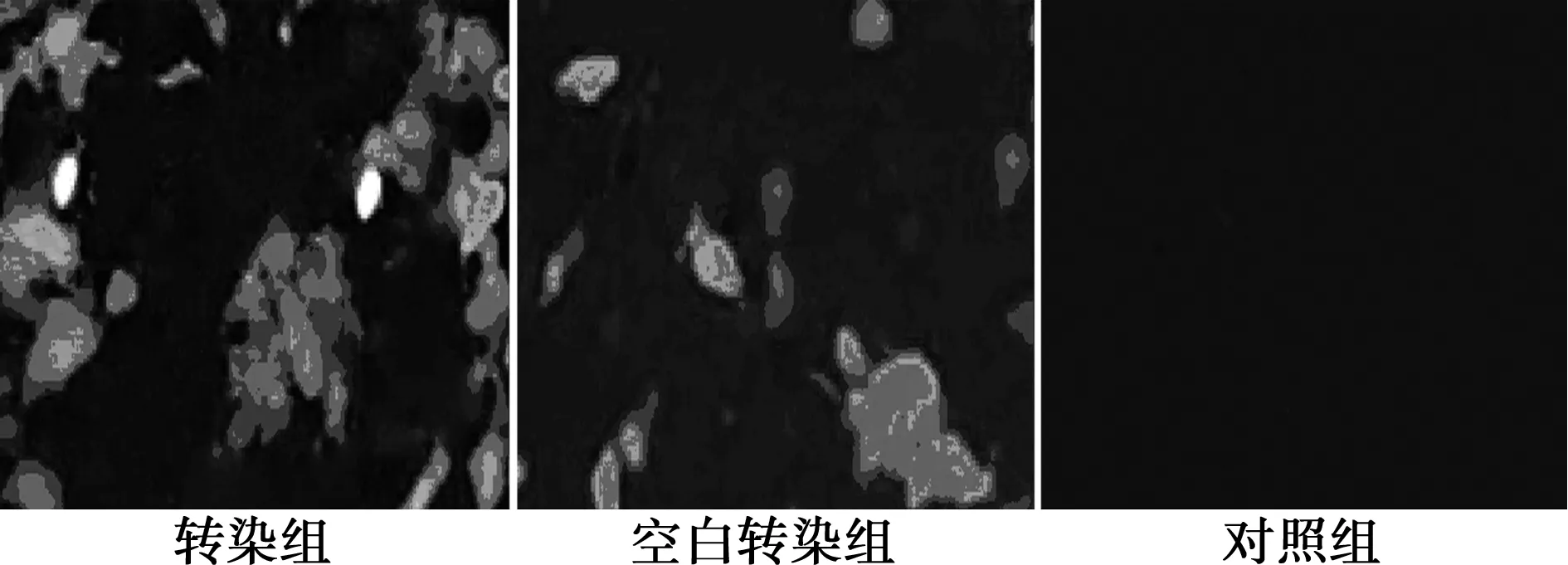
图1 荧光显微镜检测转染效率

组别48h72h96h转染组229±0211)314±0251)398±0331)空白转染组411±028603±038712±041对照组434±028639±041754±059
与空白转染组和对照组相比:1)P<0.05
2.4细胞增殖抑制率测定 结果显示转染组在24、48、72 h的细胞抑制率分别为(30.32±4.24)%、(38.39±5.87)%、(58.45±7.22)%,与空白转染组〔(3.32±0.10)%,(4.01±0.14)%,(6.24±0.18)%〕和对照组(0)相比明显升高(P<0.05);而空白转染组和对照组比较差异不明显(P>0.05)。
2.5各组细胞凋亡情况比较 经过TUNEL染色后,凋亡细胞将会显示棕黄色,在对照组和空白转染组中棕色颗粒并不明显,反映细胞凋亡程度并不高。而在转染的 PIM1基因沉默的重组质粒组(转染组)中,能观察到明显的凋亡细胞,说明凋亡程度较高。与空白转染组〔(3.02±0.14)%〕和对照组〔(2.95±0.10)%〕相比,转染组〔(12.36±0.45)%〕的凋亡率较高(P<0.05),而空白转染组与对照组比较无显著差异(P>0.05)。
3 讨 论
有关研究显示,在前列腺癌中,PIM1有显著的高表达,提示PIM1可为诊断前列腺癌的新标志物〔9〕。PIM1表达与前列腺癌的分期和预后有关〔10〕。不仅仅是前列腺癌,与配对的正常组织相比,PIM1 mRNA水平在肺癌、膀胱癌、胃癌等众多疾病组织中均呈高表达状态,这也提示了PIM1基因高表达可抑制肿瘤细胞凋亡,促进肿瘤细胞增殖〔11,12〕。
本研究表明PIM1基因沉默对食管癌细胞有显著抑制作用。有研究显示,经过转染的PC细胞中发现PIM1表达,且过表达PIM1的细胞增殖速度明显大于对照组,表明PIM1基因对PC细胞增殖有调控作用〔13〕。Li等〔14〕在研究食管癌细胞株EC9706中,用siRNA干扰PIM1的表达后得出结论:通过下调食管癌细胞中PIM1的表达,癌细胞的凋亡速度随着PIM1基因表达量下降而增快,而增殖速度则随着PIM1基因表达量下降而减慢。提示在食管癌的进展中PIM1可能发挥相当重要的作用,也为大家提供了一条新的研究思路,抑制PIM1表达也许可作为对食管癌分子的靶向治疗。
1Zhang Y.Epidemiology of esophageal cancer〔J〕.World Journal of Gastroenterology,2013;19(34):5598.
2王 凯.高龄食管癌患者术后肺不张防治分析〔J〕.浙江临床医学,2012;14(11):1407-8.
3Ghadimi MR,Rasouli M,Mahmoodi M,etal.Prognostic factors for the survival of patients with esophageal cancer in Northern Iran〔J〕.J Res Med Sci,2011;16(10):1261-72.
4Li GN,Li XM,Liu YQ,etal.Association between glutathione S-transferases M1 and T1 gene polymorphisms and esophageal cancer prognosis〔J〕.Int J Clin Exp Med,2015;8(3):3300-8.
5Zhang G,Liu Z,Cui G,etal.MicroRNA-486-5p targeting PIM-1 suppresses cell proliferation in breast cancer cells〔J〕.Tumor Biol,2014;35(11):11137-45.
6Liu SG,Qin XG,Zhao BS,etal.Differential expression of miRNAs in esophageal cancer tissue〔J〕.Oncol Lett,2013;5(5):1639-42.
7Sharma P,Saraya A,Gupta P,etal.Decreased levels of circulating and tissue miR-107 in human esophageal cancer〔J〕.Biomarkers,2013;18(4):322-30.
8郑学芝,孙 卫,张绪东,等.Nucleostemin基因沉默对食管癌细胞增殖和凋亡的影响〔J〕.中国老年学杂志,2011;31(21):3121-3.
9Kim J,Roh M,Abdulkadir SA.Pim1 promotes human prostate cancer cell tumorigenicity and c-MYC transcriptional activity〔J〕.BMC Cancer,2010;10(1):1-15.
10He HC,Bi XC,Zheng ZW,etal.Real-time quantitative RT-PCR assessment of PIM-1 and hK2 mRNA expression in benign prostate hyperplasia and prostate cancer〔J〕.Med Oncol,2009;26(3):303-8.
11Guo S,Mao X,Chen J,etal.Overexpression of Pim-1 in bladder cancer〔J〕.J Exp Clin Cancer Res,2010;29(1):1-7.
12Yan B,Yau EX,Samanta S,etal.Clinical and therapeutic relevance of PIM1 kinase in gastric cancer〔J〕.Gastric Cancer,2012;15(2):188-97.
13Kim J,Roh M,Abdulkadir SA.Pim1 promotes human prostate cancer cell tumorigenicity and c-MYC transcriptional activity〔J〕.Bmc Cancer,2010;10(3):1-15,443-51.
14Li S,Xi Y,Zhang H,etal.A pivotal role for PIM-1 kinase in e-sophageal squamous cell carcinoma involving cell apoptosis in-duced by reducing Akt phosphorylation〔J〕.Oncol Rep,2010;24( 4):997-1004.
罗 燕 (1979-),女,博士,住院医师,主要从事肿瘤学研究。
R73
A
1005-9202(2017)20-5005-02;
10.3969/j.issn.1005-9202.2017.20.022
〔2017-04-06修回〕
(编辑 曲 莉)
