白蒿挥发油成分的测定及其抗氧化活性分析
2017-11-06孙志恒吕敏兰张智嘉韩晓军
孙志恒 吕敏兰 张智嘉 张 迎 韩晓军
(新能源转换与储存关键材料技术工信部重点实验室,城市水资源与水环境国家重点实验室,哈尔滨工业大学化工与化学学院,哈尔滨 150001)
白蒿挥发油成分的测定及其抗氧化活性分析
孙志恒 吕敏兰 张智嘉 张 迎 韩晓军*
(新能源转换与储存关键材料技术工信部重点实验室,城市水资源与水环境国家重点实验室,哈尔滨工业大学化工与化学学院,哈尔滨 150001)
采用乙醇浸提法提取生长期和花果期白蒿的挥发油,通过正交实验确定最佳提取条件为:提取3次、浸提90 min、对于生长期和花果期白蒿液料比分别为10 mL∶1 g和8 mL∶1 g。通过红外光谱和液相色谱-质谱联用分析了产物的主要成分,生长期白蒿挥发油的主要成分为桉树脑、樟脑、右旋龙脑、石竹烯、Cadina-1,4-diene、白菖烯、棕榈酸乙酯等; 花果期白蒿挥发油的主要成分为樟脑、石竹烯、龙脑、甲酸橙花酯等。通过1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除实验对产物的自由基清除活性进行了测定,生长期和花果期白蒿挥发油对0.05 mmol/L DPPH溶液的IC50值分别为0.40和1.66 mg/mL。研究结果表明,乙醇浸提的生长期和花果期白蒿的挥发油具有较好的抗氧化活性。
白蒿挥发油; 乙醇浸提法; 自由基清除活性
2017-05-26收稿; 2017-09-26接受
本文系国家自然科学基金项目(Nos. 21773050, 21528501)、城市水资源与水环境国家重点实验室(哈尔滨工业大学)自主课题(No. 2017DX05)和哈尔滨工业大学环境生态创新专项基金项目(No. HSCJ201607)资助
* E-mail: hanxiaojun@hit.edu.cn
1 引 言
蒿属植物是生产天然抗氧化剂和杀虫剂的重要原料[1]。白蒿(Herba Artimisiae Sieversianae)为菊科植物大籽蒿全草,分布广泛[2,3]。白蒿在《神农本草经》中被列为上品,具有治疗肿热咳嗽、湿热黄疸、风湿痹痛、疥瘌恶疮等功效。白蒿挥发油是白蒿体内一类重要的次生代谢产物,存在于花、叶片、果实、种子和树皮中,一般由几十种甚至上百种化合物组成。研究表明,白蒿的挥发油中含有大量活性成分,是体现白蒿生物活性的重要物质[4,5]。挥发油中的萜烯类物质具有杀虫、抑菌的功效[6~8],而薁类物质具有一定的抗癌作用[9]。目前,提取植物中活性成分的方法主要有水蒸气蒸馏法[10,11]、溶剂萃取法[12]、蒸馏萃取法[13]、固相微萃取法[14]、分子蒸馏法[15]、超临界流体萃取法[16]等,这些提取方法均可用于提取白蒿挥发油[17]。相比而言,溶剂萃取法中的浸提法无需加热,具有萃取温度低、萃取成分较完全、提取率较高等优点。韩小冰等[18]分别以石油醚、三氯甲烷、丙酮和乙醇为溶剂,对比了索氏提取法、冷浸法和超声波法提取白蒿的活性成分,结果表明,以乙醇为溶剂,冷浸法提取的白蒿活性成分生物活性最好。
目前,对于天然产物的活性成分分析手段有红外光谱[19]、液相色谱[20]、核磁[21]、质谱[22]以及仪器联用技术(如ICP-MS[23]、GC-MS[24]等),这些方法均可用于白蒿挥发油成分的分析[25,26]。波谱的指纹区可用于比较不同地区的天然产物活性成分的差异。虽然波谱手段可以准确确定未知成分的化学结构,但是对被分析物的纯度要求高。对于含有上百种成分的挥发油,由于部分成分含量较低,利用波谱手段鉴定其结构,不但耗时长,且工作量巨大。GC-MS可以快速准确鉴定多种化合物的混合物,是目前最常用、最为灵敏的分析方法之一。Suleimenov等[27]采用GC-MS检测鉴定出白蒿挥发油中104种化学成分。截至目前,对于白蒿挥发油的研究主要包括挥发油的成分分析、挥发油的生物活性分析等几个方面[28~30]。然而对于白蒿不同生长时期挥发油的成分分析、生物活性的异同,相关的研究较少。研究不同生长时期对白蒿挥发油成分及活性的影响对于提高白蒿中有效成分的产率,高效综合利用白蒿提取物有重要意义。所以,本实验针对这一方面进行了研究。
本研究采用乙醇浸提法提取生长期和花果期白蒿的挥发油,分别确定了二者浸提的最佳条件; 通过傅里叶红外光谱(FT-IR)和气相色谱-质谱联用(GC-MS)技术分析了二者产物的主要成分; 测定并比较了二者清除自由基的能力。本研究为白蒿的进一步开发提供了技术支持。
2 实验部分
2.1仪器、试剂与材料
气相色谱-质谱联用仪(Agilent HP-5色谱柱,6890GC/5973N质谱仪,美国Agilent公司); Nicolet 6700傅里叶变换红外光谱仪(美国Nicolet公司); Cary-60 UV-Vis紫外可见分光光度计(美国Agilent公司); RE52-86A旋转蒸发仪(上海亚荣生化仪器厂)。
白蒿原料(菊科植物白蒿全草,分别于6月份(生长期)和9月份(花果期)采于黑龙江省哈尔滨市,阴干保存,粉碎备用)。 KBr(色谱纯,科密欧化学试剂有限公司); 1,1-二苯基-2-三硝基苯肼(DPPH)、维生素C(VC)和无水乙醇(分析纯, 阿拉丁试剂公司); 实验用水为蒸馏水。
2.2挥发油的提取
白蒿挥发油的提取方法以提取生长期白蒿挥发油的过程为例,提取条件为浸提3次,浸提时间90 min,液料比10 mL∶1 g,具体方法为:准确称取生长期白蒿10 g,置于250 mL玻璃瓶中,加入无水乙醇100 mL,浸提90 min后过滤,收集浸提液,余下原料按上述方法再次浸提,共浸提3次,合并浸提液。将浸提液置于20℃条件下冷冻24 h后,迅速滤去白色不溶物,得到的滤液经减压蒸馏除掉乙醇后即为挥发油产品。 其它条件下的提取过程同上。
2.3挥发油成分分析
采用GC-MS对挥发油样品进行分析,其中气相色谱表征条件:HP-5色谱柱(30 m×0.25 mm×0.25 μm); 载气:He; 流速:1.0 mL/min; 进样方式:不分流进样; 进样量:1.0 μL。程序升温:柱温50℃保留3 min,以20℃/min升至280℃,恒温2 min。质谱条件:电离方式EI,电离能量70 eV,离子源温度230℃,扫描范围:5~500 amu。溶剂延迟时间为3 min。用计算机谱库NIST进行检索。
本实验采用傅里叶变换红外光谱(FT-IR)对获得的挥发油样品进行表征。检测条件为:KBr压片法,测定范围4000~500 cm,扫描信号累加64次,分辨率为4 cm,OPD速度为0.2 cm/s,扫描时实时扣除KBr的干扰。
2.4DPPH自由基清除实验[31]
配制浓度为0.1 mmol/L DPPH的乙醇溶液作为反应液,将不同挥发油分别配制成特定浓度的待测样品。将反应液分别与待测样品等体积混合,避光静置30 min,测定混合液在517 nm处的吸光度,计算自由基清除率:
自由基清除率=[A0-(Ai-Aj)]/A0×100%
其中,A0为反应液/无水乙醇等体积混合后的吸光度;Aj为待测样品/无水乙醇等体积混合后的吸光度;Ai为DPPH/待测样品等体积混合后的吸光度。以各挥发油样品的自由基清除率对样品浓度绘制拟合曲线,即可得到待测样品清除DPPH自由基的IC50值。
3 结果与讨论
3.1提取条件的优化
分别考察了液料比、提取次数、浸提时间3个因素对生长期和花果期白蒿挥发油的提取率的影响, 设计了三因素三水平的正交实验。表1为乙醇浸提生长期白蒿挥发油的实验结果。对表1中的数据进行极差分析后可得到, 乙醇浸提法提取生长期白蒿挥发油的最佳提取条件为:液料比10 mL∶1 g; 提取次数3次; 浸提时间90 min。表2为乙醇浸提花果期白蒿挥发油的实验结果,对表2中的数据进行极差分析后,可以确定用乙醇浸提法提取花果期白蒿挥发油的最佳提取条件为:液料比8 mL∶1 g; 提取次数3次; 浸提时间90 min。分析上述结果可知,对于提取不同生长时期白蒿的挥发油,提取次数均为影响提取率的关键因素, 提取次数过少,则提取不完全,收率低; 提取次数过多,则提取效率降低,本实验确定的最佳提取次数为3次。 提取生长期白蒿挥发油的最佳液料比为10 mL∶1 g,而提取花果期白蒿挥发油的最佳液料比为8 mL∶1 g,这可能是由于生长期的白蒿代谢更为旺盛,植物中产生的生长素等植物激素促进了相关的次生代谢产物的生成和累积,含量相对较多,故需要更多的溶剂才能将挥发性成分提取完全,而花果期的白蒿中,植物激素影响了萜类物质、黄酮类物质的合成和转化,故其次生代谢产物含量有所下降,所需溶剂较少[32],可见,在提取白蒿挥发油时,选取生长期白蒿作为原料比选择花果期白蒿作为原料可以得到更多的挥发油。相比于文献报道的提取蒿类植物挥发油的研究[33,34], 利用乙醇浸提法提取白蒿挥发油,方法简单、节能环保,且其提取率更高。
表1 提取生长期白蒿挥发油正交实验结果
Table 1 Orthogonal experimental results of extracting essential oil of Herba Artimisiae Sieversianae in growth period
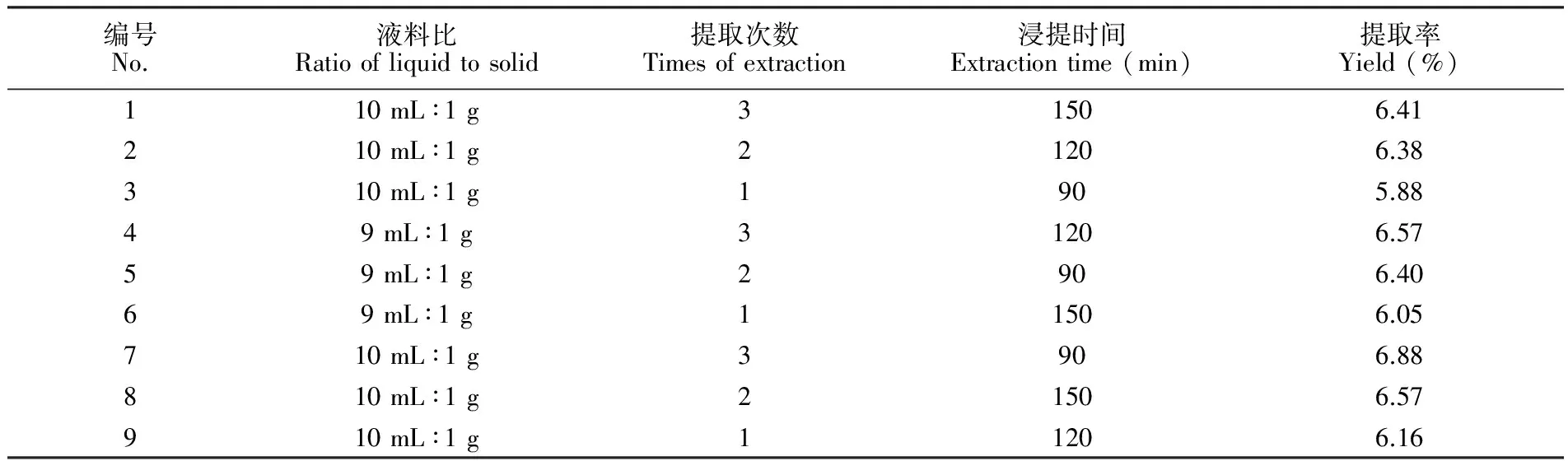
编号No.液料比Ratioofliquidtosolid提取次数Timesofextraction浸提时间Extractiontime(min)提取率Yield(%)110mL∶1g31506.41210mL∶1g21206.38310mL∶1g1905.8849mL∶1g31206.5759mL∶1g2906.4069mL∶1g11506.05710mL∶1g3906.88810mL∶1g21506.57910mL∶1g11206.16
表2 提取花果期白蒿挥发油正交实验结果
Table 2 Orthogonal experimental results of extracting essential oil of Herba Artimisiae Sieversianae in flower/fruit bearing period
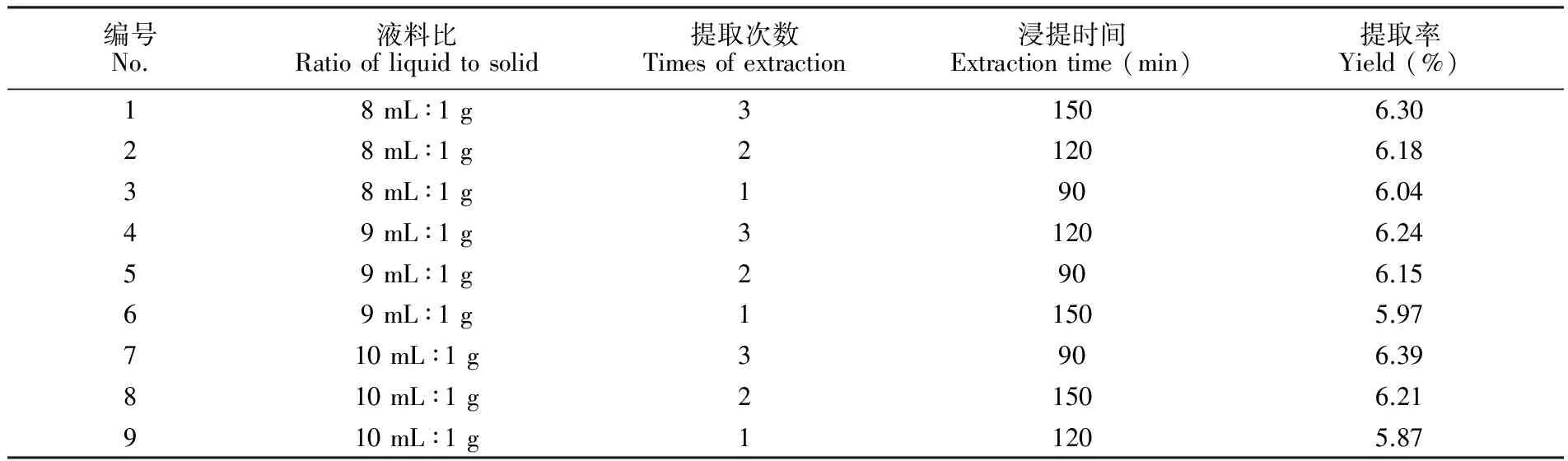
编号No.液料比Ratioofliquidtosolid提取次数Timesofextraction浸提时间Extractiontime(min)提取率Yield(%)18mL∶1g31506.3028mL∶1g21206.1838mL∶1g1906.0449mL∶1g31206.2459mL∶1g2906.1569mL∶1g11505.97710mL∶1g3906.39810mL∶1g21506.21910mL∶1g11205.87
3.2挥发油成分的分析
通过FT-IR和GC-MS分析了挥发油的主要成分。生长期和花果期白蒿挥发油的FT-IR图如图1所示。图1a为生长期白蒿挥发油的红外光谱,在3360 cm处的吸收峰为的伸缩振动峰,2926和2854 cm处的吸收峰为饱和烷烃中的伸缩振动峰,1737 cm处的吸收峰为酯的的伸缩振动峰,1622和1463 cm处的多重峰为苯环的特征峰,1378 cm处的吸收峰为的伸缩振动峰,1238、1167和1054 cm处的多重峰为的伸缩振动峰,723 cm处的吸收峰为的特征峰。图1b为花果期白蒿挥发油的红外光谱,在3465 cm处的吸收峰为的伸缩振动峰,2925和2855 cm处的吸收峰为饱和烷烃中的伸缩振动峰,1744 cm处的吸收峰为酯的的伸缩振动峰,1594和1458 cm处的多重峰为苯环的特征峰,1378 cm处的吸收峰为的伸缩振动峰,1236和1158 cm处的多重峰为酚或醇结构中的伸缩振动峰,724 cm处的吸收峰为的特征峰。红外光谱表征结果说明提取的挥发油中含有芳香化合物、羰基化合物等[35],同时基于本研究组以往的研究经验,基本可以确定产物中含有醇、酚、酯、烃等化合物。挥发油的具体成分可以通过GC-MS进一步加以鉴别。
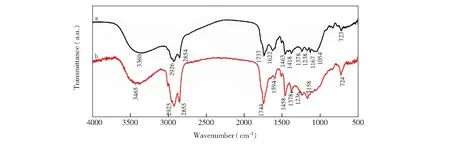
图1 不同生长时期白蒿挥发油的FT-IR图:(a) 生长期白蒿挥发油; (b) 花果期白蒿挥发油Fig.1 Fourier transform-infrared (FT-IR) spectra of essential oil of Herba Artimisiae Sieversianae in different growth period: (a) growth period, (b) flower/fruit bearing period
生长期和花果期白蒿挥发油的GC-MS分析结果如表3所示。白蒿挥发油中主要含有桉树脑、石竹烯、母菊薁等成分。两种生长时期白蒿的挥发油都含有较多的烷烃、烯烃成分,这与分析FT-IR图得出的结论一致。对比两种生长时期白蒿的挥发油的成分可以发现,不同生长时期白蒿的挥发油成分和含量不尽相同,生长期白蒿挥发油的主要成分为桉树脑、樟脑、右旋龙脑、石竹烯、白菖烯、棕榈酸乙酯; 花果期白蒿挥发油主要含有龙脑、石竹烯、甲酸橙花酯、母菊薁、二十烷。生长期的白蒿挥发油具有0.97%的萜品烯,而花果期的白蒿挥发油却没有,萜烯类化合物是具有代表性的抗氧化活性物质,因此可以推测生长期的白蒿挥发油具有更高的抗氧化活性。同时, 生长期和花果期白蒿挥发油都含有石竹烯和樟脑,但相对含量差异很大,生长期白蒿挥发油中石竹烯和樟脑的含量分别为10.43%和2.75%,花果期白蒿挥发油中石竹烯和樟脑的含量仅约为1.35%和0.46%。不同生长时期白蒿的挥发油成分和含量有所不同,其原因可能是不同时期,植物所处的环境和生长状态有较大差异,这会导致植物的次生代谢产物存在不同。光照、温度、细菌、昆虫等都是影响植物次生代谢产物的环境因素,会对产物的成分和相对含量产生较大的影响。处于生长期时的白蒿,更易遭受虫害,故其次生代谢产物中石竹烯、樟脑的含量较多,具有较强的杀虫、抑菌能力; 相比而言,处于花果期的白蒿,产生的石竹烯、樟脑量较低[36,37]。不同时期白蒿的挥发油中组分的差异以及各组分相对含量的不同,会导致其生物活性和生理功能存在差异,所以,在提取挥发油时,需要根据挥发油的用途选择相应生长时期的原料。
表3 生长期和花果期的白蒿挥发油成分及相对含量
Table 3 Composition and content of Herba Artimisiae Sieversianae in different growth periods
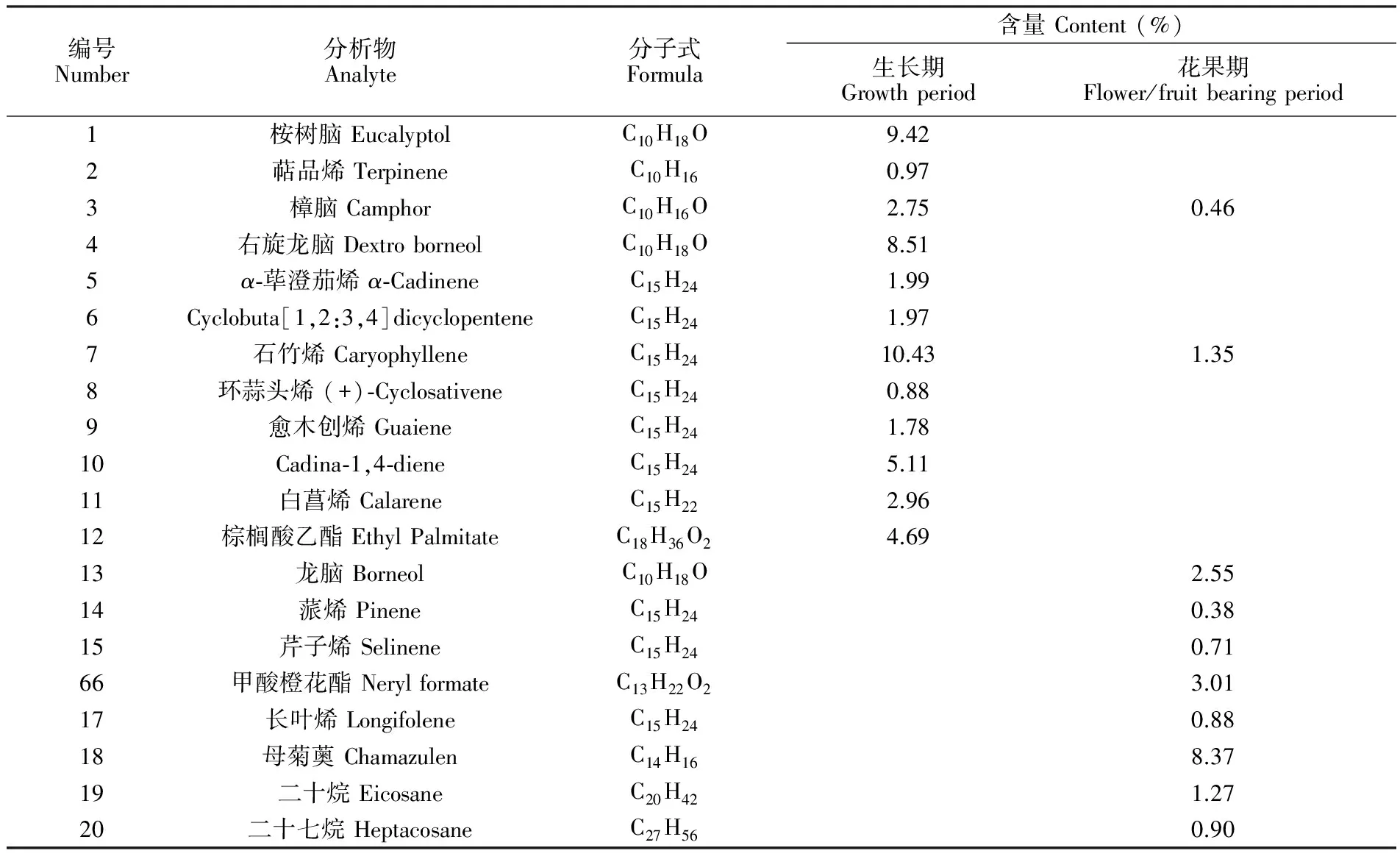
编号Number分析物Analyte分子式Formula含量Content(%)生长期Growthperiod花果期Flower/fruitbearingperiod1桉树脑EucalyptolC10H18O9.422萜品烯TerpineneC10H160.973樟脑CamphorC10H16O2.750.464右旋龙脑DextroborneolC10H18O8.515α⁃荜澄茄烯α⁃CadineneC15H241.996Cyclobuta[1,2:3,4]dicyclopenteneC15H241.977石竹烯CaryophylleneC15H2410.431.358环蒜头烯(+)⁃CyclosativeneC15H240.889愈木创烯GuaieneC15H241.7810Cadina⁃1,4⁃dieneC15H245.1111白菖烯CalareneC15H222.9612棕榈酸乙酯EthylPalmitateC18H36O24.6913龙脑BorneolC10H18O2.5514蒎烯PineneC15H240.3815芹子烯SelineneC15H240.7166甲酸橙花酯NerylformateC13H22O23.0117长叶烯LongifoleneC15H240.8818母菊薁ChamazulenC14H168.3719二十烷EicosaneC20H421.2720二十七烷HeptacosaneC27H560.90
3.3DPPH自由基清除实验
本实验以VC为阳性对照,通过测定待测样品对DPPH自由基的清除效果,确定其抗氧化活性。样品对DPPH自由基的清除效果采用DPPH底物浓度为0.05 mmol/L时,样品的IC50值评价,实验结果见图2,当DPPH底物浓度为0.05 mmol/L时,生长期和花果期白蒿的挥发油的IC50值分别为0.40和1.66 mg/mL。在此条件下,阳性对照物VC的IC50值为0.03 mg/mL。结果表明,生长期和花果期白蒿的挥发油均具有一定的抗氧化活性,但相比于VC,其抗氧化活性较低。对比两种挥发油的抗氧化活性,生长期白蒿挥发油的抗氧化活性高于花果期白蒿挥发油的抗氧化活性,其原因可能是在生长期白蒿的挥发油中,具有多种花果期挥发油没有的活性成分,如桉树脑、萜品烯、右旋龙脑、α-荜澄茄烯、愈木创烯、白菖烯、棕榈酸乙酯等,特别是萜品烯已经被证明具有很强的抗氧化活性[38,39]。有些共同成分的含量也比花果期白蒿挥发油中的含量高,如樟脑、石竹烯等。这与上述成分分析所得结果一致。因此,为了提高抗氧化活性物质的产率,应在白蒿生长期进行挥发油提取。
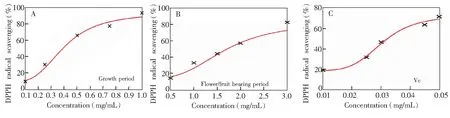
图2 生长期(A)、花果期(B)白蒿挥发油及维生素C(C)自由基清除效果Fig.2 1,1-Diphenyl-2-picrylhydrazyl(DPPH) radical scavenging effect of Herba Artimisiae Sieversianae in growth period (A) and flower/fruit bearing period (B), vitamin C (C)
挥发油是一种混合物,其清除自由基的机理比较复杂,与挥发油中大量存在具有抗氧化活性的物质有关,挥发油中含有的高活性抗氧化成分(如黄酮类、酚类、不饱和脂肪酸类物质)可以补充机体的抗氧化物质,使机体内源性抗氧化酶活性提高,有效防止自由基链式反应的形成及其引起的机体损伤。白蒿挥发油中主要体现抗氧化活性的成分是萜烯类物质,而这类物质的种类和含量受植物自身生长调节和环境影响较大,故而不同生长时期以及不同环境条件下,植物代谢活动的不同是造成不同生长时期白蒿挥发油抗氧化活性不同的根本原因。
4 结 论
本研究通过正交实验法确定了提取生长期和花果期白蒿挥发油的最佳条件。通过FT-IR和GC-MS的分析,发现不同生长时期白蒿的挥发油主要包含桉叶油素、樟脑、蒎烯、龙脑、母菊薁、乙酸香叶酯、棕榈酸甲酯、衣兰烯、花侧柏烯、愈木创烯、长叶蒎烯、萜品烯、植酮、石竹烯、水芹烯等萜烯类、醇类、酯类化合物。生长期白蒿挥发油中的萜烯类物质种类和含量均多于花果期白蒿挥发油。研究了不同生长时期白蒿中挥发油的抗氧化生物活性,确定了其对于底物浓度为0.05 mmol/L DPPH自由基的IC50分别为0.40 mg/mL(生长期)和1.66 mg/mL(花果期)。在白蒿生长期提取的挥发油具有更高的抗氧化活性。本研究为白蒿的深入开发和利用提供了技术支持,也为研究类似的天然产物提供了参考。
1 Smith-Palmer A, Stewart J, Fyfe L.FoodMicrobiol.,2001, 18(4): 463-470
2 LI Hong-Ling, ZHANG Ai-Dong, QING Ge-Le, MU Zong-Jie, SUN Jie.AnimalHusbandryandFeedScience,2014, 35(1): 46-48
李洪玲, 张爱东, 青格乐, 慕宗杰, 孙 杰. 畜牧与饲料科学,2014, 35(1): 46-48
3 Morán A, Montero M J, Martín M L, San R L.J.Ethnopharmacol.,1989, 26(2): 197-203
4 Gouveia S C, Castilho P C.IndustrialCropsProd.,2013, 45(1): 170-181
5 Abad M J, Bedoya L M, Apaza L, Bermejo P.Molecules,2012, 17(3): 2542-2566
6 Hashem M.Mycopathologia,2011, 172(1): 37-46
7 Maregesi S M, Pieters L, Ngassapa O D, Apers S, Vingerhoets R, Cos P, Berghe D A, Vlietinck A J.J.Ethnopharmacol.,2008, 119(1): 58-66
8 Suleimenov E M, Ozek T, Demirci F, Demirci B, Baser K H C, Adekenov S M.Chem.Nat.Compounds,2009, 45(1): 120-123
9 Vasylievna Z S, Erdemovna R T, Dorzhievna R L, Arnoldovich A O, Long C S, Gao Q, Qi Z F.J.Essent.OilBear.Plants,2015, 18(3): 637-641
10 Chemat F, Lucchesi M E, Smadja J, Favretto L, Colnaghi G, Visinoni F.Anal.Chim.Acta,2006, 555(1): 157-160
11 Wang R, Wang R J, Yang B.Innov.FoodSci.EmergingTechnol.,2009, 10(2): 289-292
12 Charles D J, Simon J E.J.Am.Soc.Hortic.Sci.,1990, 115(3): 458-462
13 YAN Ke-Yu, JIA Yu-Hong, YAN Hong-Yang.JournalofHenanAgriculturalSciences,2008, 37: 91-93
闫克玉, 贾玉红, 闫洪洋. 河南农业科学,2008, 37(7): 91-93
14 XUE Yue-Qin, YUAN Ke, ZHU Mei-Xiao, LOU Lu-Huan.ChineseJournalofPharmaceuticalAnalysis,2009, 6: 954-960
薛月芹, 袁 珂, 朱美晓, 楼炉焕. 药物分析杂志,2009, 6: 954-960
15 CUI Gang.FoodScience,2010, 31(24): 236-240
崔 刚. 食品科学,2010, 31(24): 236-240
16 XIE Li-Sha, GONG Zhi-Qiang, OUYANG Wei, HUANG Zhen-Yuan.JournalofAnhuiAgriculturalSciences,2012, 40(20): 10397-10398
谢丽莎, 龚志强, 欧阳炜, 黄振园. 安徽农业科学,2012, 40(20): 10397-10398
17 LIU Chun-Xiu.JournalofAnhuiAgriculturalSciences,2011, 39(3): 1273-1274
刘春秀. 安徽农业科学,2011, 39(3): 1273-1274
18 HAN Xiao-Bing, MA Ling, MA Wei, WANG Hui, TIAN Jun.ForestEngineering,2008, 24(3): 13-16
韩小冰, 马 玲, 马 伟, 王 慧, 田 军. 森林工程,2008, 24(3): 13-16
19 QI Kai-Long, LIN Li, XIAO Feng-Xia, TAN Dong-Shan.TraditionalChineseDrugsResearchandClinicalPharmacology,2014, 25(2): 197-200
祁龙凯, 林 励, 邓 韬, 肖凤霞, 谭东山. 中药新药与临床药理,2014, 25(2): 197-200
20 LIU Guo-Xiong, LI Hua, ZHANG Jun.ChineseJournalofExperimentalTraditionalMedicalFormulae,2017, 1: 64-68
刘国雄, 李 华, 张 军. 中国实验方剂学杂志,2017, 1: 64-68
21 HUANG Lan-Ping, JIN Li-Ping, XIE Jia-Ni, ZHANG Ying-Lao.ScienceandTechnologyofFoodIndustry,2017, 11: 291-294
黄兰平, 靳丽萍, 谢佳妮, 张应烙. 食品工业科技,2017, 11: 291-294
22 WANG Ru-Bing, DENG Shi-Dong, QU Jing, YU Shi-Shan.NaturalProductResearchandDevelopment,2017, 29(5): 787-790
王汝冰, 邓仕东, 屈 晶, 庾石山. 天然产物研究与开发,2017, 29(5): 787-790
23 QIANG Zheng-Ze, LI Cheng-Yi, WANG Yan, WANG Ming-Wei, LI Shuo.NaturalProductResearchandDevelopment,2017, 10: 439-443
强正泽, 李成义, 王燕, 王明伟, 李 硕. 天然产物研究与开发,2017, 10: 439-443
24 CHEN Tong, CAO Yong, LIU Fei, GUO Bin.ModernFoodScienceandTechnology,2017, 33(2): 217-222
陈 彤, 曹 庸, 刘 飞, 郭 斌. 现代食品科技,2017, 33(2): 217-222
25 Liu Z M, Li X H, Li R P, Luo Y M, Wang H M, Jiang D M, Nan Y H.ActaPrataculturaeSinica,2003, 12(5): 55-61
26 Tan R X, Tang H Q, Hu J, Shuai B.Phytochemistry,1998, 49(1): 157-161
27 Suleimenov E M, Ozek T, Demirci F, Demirci B, Baser K HC, Adekenov S M.Chem.Nat.Compd.,2008, 44(2): 263-265
28 Liu S J, Liao Z X, Liu C, Ji L J, Sun H F.Fitoterapia,2014, 97(17): 43-49
29 Jiang C H.J.Med.PlantRes.,2012, 6(18): 3464-3469
30 Chu S S, Jiang G H, Liu Z L.DaruJ.Pharmaceut.Sci.,2012, 20(1): 14
31 Blois M S.Nature,1958, 181: 1199-1200
32 MA Lin, GAO Yu-Gang, ZANG Pu, ZHANG Lian-Xue.CentralSouthPharmacy,2016, 8: 834-837
马 琳, 郜玉钢, 臧 埔, 张连学. 中南药学,2016, 8: 834-837
33 YAO Xiao-Yun, CHAO Qun-Fang, CHEN Zhi-Dan, YANG Bin-Yin, WANG Gui-E.ChineseJournalofExperimentalTraditionalMedicalFormulae,2012, 18(16): 30-33
姚小云, 晁群芳, 陈志丹, 杨滨银, 王桂娥. 中国实验方剂学杂志,2012, 18(16): 30-33
34 Dong Y, Qi W, Xiao C Y.ChinesePharmaceut.J.,2013, 48: 1359-1362
35 NING Yong-Cheng.StructuralIdentificationofOrganicCompoundswithSpectroscopicTechniques. Beijing: Science Press,2014
宁永成. 有机化合物结构鉴定与有机波谱学. 第3版. 北京: 科学出版社,2014
36 LU Shou-Ping, SUI Xin-Xia, SUN Qun, SUN Bao-Qi.NaturalProductResearch&Development,2006, 18(6): 1027-1032
鲁守平, 隋新霞, 孙 群, 孙宝启. 天然产物研究与开发,2006, 18(6): 1027-1032
37 YAN Xiu-Feng, WANG Yang, LI Yi-Meng.ActaEcologicaSinica,2007, 27(6): 2554-2562
阎秀峰, 王 洋, 李一蒙. 生态学报,2007, 27(6): 2554-2562
38 CHEN Qin-Qin, GAN Zhi-Lin, DAI Yun-Qing, YANG Yang, NI Yuan-Ying.ScienceandTechnologyofFoodIndustry,2011, 11: 111-113
陈芹芹, 甘芝霖, 戴蕴青, 杨 阳, 倪元颖. 食品工业科技,2011, 11: 111-113
39 XU Ting, WU Shi-Min, MEI Jun.ChinaCondiment,2010, 35(4): 5-8
徐 婷, 吴时敏, 梅 俊. 中国调味品,2010, 35(4): 5-8
This work was supported by the National Natural Science Foundation of China (Nos. 21773050, 21528501), State Key Laboratory of Urban Water Resource and Environment (Harbin Institube of Technology)(No. 2017DX05), and HIT Environment and Ecology Innovation Special Funds (No. HSCJ201617).
ComponentsandTheirAntioxidantActivityofEssentialOilofHerbaArtimisiaeSieversianaefromDifferentGrowthPeriods
SUN Zhi-Heng, LYU Min-Lan, ZHANG Zhi-Jia, ZHANG Ying, HAN Xiao-Jun*
(MIITKeyLaboratoryofCriticalMaterialsTechnologyforNewEnergyConversionandStorage,StateKeyLaboratoryofUrbanWaterResourceandEnvironment,SchoolofChemistryandChemicalEngineering,HarbinInstituteofTechnology,Harbin150001,China)
The effective exploitation of natural products is of great significance. Herein the essential oil from Herba Artimisiae Sieversianae in growth period and flower/fruit bearing period was extracted by ethanol extraction method. The optimal extraction condition was determined by orthogonal experiment, including extracting 3 times, soaking for 90 min, and the ratios of liquid to solid for Herba Artimisiae Sieversianae in growth period and flower/fruit bearing period were 10 mL∶1 g and 8 mL∶1 g, respectively. The main components of the products were confirmed by FT-IR and GC-MS, which were cineole, camphor, d-borneol, caryophyllene, cadina-1, 4-diene, calamenene, ethyl palmitate, etc. in herba artimisiae sieversianae in growth period, and camphor, caryophyllene, borneol, neryl formate, etc. in Herba Artimisiae Sieversianae in flower/fruit bearing period. The radical scavenging activity of the products was determined. The results showed that the IC50values of the essential oil from Herba Artimisiae Sieversianae in growth period and flower/fruit bearing period for 0.05 mmol/L DPPH solution were 0.40 mg/mL and 1.66 mg/mL, respectively. The essential oil extracted by ethanol from Herba Artimisiae Sieversianae was confirmed to possess good antioxidant activity.
Essential oil of Herba Artimisiae Sieversianae; Ethanol extraction; Radical scavenging activity
26 May 2017; Accepted 26 September 2017)
10.11895/j.issn.0253-3820.170333
