基于室温磷光量子点/硼酸基联吡啶盐纳米复合材料检测果糖
2017-11-06苗艳明孙晓杰闫桂琴
杨 琪 苗艳明 李 艳 孙晓杰 闫桂琴
(山西师范大学生命科学院, 临汾 041004)
基于室温磷光量子点/硼酸基联吡啶盐纳米复合材料检测果糖
杨 琪 苗艳明*李 艳 孙晓杰 闫桂琴
(山西师范大学生命科学院, 临汾 041004)
以Mn掺杂的ZnS(Mn-ZnS)室温磷光(RTP)量子点的磷光为信号,以2-溴甲基苯硼酸与4,4′-联吡啶为原料合成的硼酸基联吡啶盐(BBV)为受体,带负电的量子点与带正电BBV通过静电作用形成Mn-ZnS/BBV纳米复合材料,Mn-ZnS量子点磷光猝灭,加入果糖,BBV与果糖形成阴离子硼酸酯,降低了对量子点猝灭效率,RTP恢复。考察了时间、pH值对Mn掺杂的ZnS QDs/BBV纳米复合材料磷光强度的影响,在最优条件下,此传感器检测果糖的线性范围为0.05~1.00 mmol/L,检出限为0.01 mmol/L,相关系数r为0.99。本磷光分析法简便快速、灵敏度高,有望应用于食品、医药行业中果糖含量的检测分析。
量子点; 室温磷光; 硼酸基联吡啶盐; 果糖
2017-06-05收稿;2017-09-04接受
本文系山西省青年科技研究基金(No.201601D021109)和山西省重点化学优势学科建设项目(No.912019)资助
*E-mail: mym8207@126.com
1 引 言
糖类是机体能源物质之一,同时参与许多生理和病理过程,在生物体中起着极其重要的作用,糖类与许多疾病的发生和治疗密切相关。果糖是天然糖类甜度最高的糖,是一种无需通过胰岛素,直接进入人体肠道内被人体消化吸收便可代谢的糖,相比其它糖类具有口感好、热量低、吸湿性好等优点,被广泛应用于食品、药品、糖尿病人的饮食及化妆品中[1~3]。因此,设计一种快速、灵敏检测果糖含量的方法十分重要。硼酸及其衍生物能与二醇高效可逆地共价结合,形成环状硼酸酯,可作为生物传感器的分子探针识别糖类[4,5]。目前,关于果糖的检测方法主要有紫外可见吸收光谱法、气相色谱法、电化学法和荧光光谱法[6~9]。 邓启良等[10]利用果糖能够猝灭间氨基苯硼酸-间苯二胺聚合物的荧光,实现对果糖含量的检测;Sun等[11]将巯基苯硼酸自组装于纳米金电极表面,通过循环伏安法对果糖进行检测。 但这些方法因具有操作复杂、反应灵敏性低等缺点不能在实践中广泛应用。
随着对量子点研究的不断深入,量子点的室温磷光性质引起了广大学者极大的兴趣。与荧光相比,磷光是较为少见的能量释放形式,磷光检测可免于自体荧光和散射光的干扰,可在不需要任何复杂的样品预处理情况下,实现样品快速、准确的检测[12~16]。因此,室温磷光分析法广泛应用于分析检测领域。
目前,基于室温磷光法并利用硼酸化合物作探针检测果糖的研究未见报道。本研究合成了3-巯基丙酸(MPA)包裹的Mn-ZnS量子点并将其室温磷光作为光指示信号,硼酸基联吡啶盐(BBV)作为识别果糖的受体,利用二者形成的纳米复合材料对果糖进行了痕量检测。
2 实验部分
2.1仪器与试剂
JEM-2100透射电子显微镜(日本电子株式会社); Cary Eclipse荧光分光光度计(美国瓦里安有限公司); pH值由pH 400酸度计(上海安莱立思仪器科技有限公司)。
3-巯基丙酸(3-Mercaptopropionic acid, MPA)、4,4′-联吡啶(4,4′-Dipyridyl),购于北京百灵威科技有限公司;Zn(Ac)2·2H2O、Mn(Ac)2·4H2O、Na2S·9H2O(天津市科密欧化学试剂有限公司);果糖(Fructose,天津市光复精细化工研究所); 2-溴甲基苯硼酸(2-Bromomethyl-phenylboronic acid,美国Sigma公司)。上述试剂均为分析纯。超纯水(18.2 MΩ cm) 采用WaterPro超纯水系统(美国Labconco公司)制备。
针对性训练2:已知某多肽链的分子量为1.032×104,每个氨基酸的平均分子量为120,则组成该多肽链的氨基酸数为___________。
2.2Mn掺杂的ZnS量子点的合成
Mn掺杂的ZnS量子点的合成参照已有方法, Mn-ZnS合成量子点是在水溶液中进行的[16,17]。首先将10 mL 0.1 mol/L Zn(Ac)2、4 mL 0.01 mol/L Mn(Ac)2和100 mL 0.04 mol/L MPA添加到250 mL 三颈瓶中,用1 mol/L NaOH将混合溶液调节至pH 11。在室温条件下通氩气30 min,在隔绝空气的条件下将10 mL 0.1 mol/L Na2S加入到溶液中,继续搅拌反应20 min后,在50℃的空气中陈化2 h,即可得到MPA包覆的Mn掺杂的ZnS量子点。然后用乙醇沉淀,经离心、乙醇洗涤, 在真空干燥箱干燥24 h,得到极易溶于水的量子点粉末。
2.3BBV的合成
根据文献[12,15], 采用2-溴甲基苯硼酸与4,4′-联吡啶一步合成法制得,其合成方法如下:首先将4.05 mmol 2-溴甲基苯硼酸溶于15 mLN,N-二甲基甲酰胺(DMF)中,置于50 mL三颈瓶中磁力搅拌, 然后加入1.6 mmol/L 4,4′-联吡啶,混合液于Ar气保护下70℃反应48 h, 冷却、 过滤, 所得固体先后用DMF、丙酮、乙醚洗涤,真空干燥后得到最终产物BBV[17~19]。产品经红外光谱、1H NMR表征,结果与文献[12,15]报道一致。
2.4室温磷光的测定
为了研究BBV对Mn-ZnS量子点RTP强度的影响,配制4.0×10mol/L BBV溶液。向一系列10 mL比色管中加入500 μL 0.2 mol/L磷酸盐缓冲液(pH 7.4),将Mn-ZnS量子点溶于水中获得2.0 mg/mL溶液,向上述每个比色管中添加100 μL 此量子点溶液,接着添加不同量的BBV溶液,制备一系列不同浓度的样品溶液,补加超纯水至5 mL,摇匀, 反应5 min后检测室温磷光。
在上述实验基础上,为了检测果糖对量子点磷光强度的影响,配制5.0×10mol/L果糖溶液,向一系列10 mL比色管依次加入500 μL 0.2 mol/L磷酸盐缓冲液(pH 7.4)、100 μL 2.0 mg/mL Mn-ZnS量子点溶液、200 μL 4.0×10mol/L BBV溶液;然后再依次向比色管中分别加入不同量的果糖溶液,补加超纯水至5 mL,摇匀,待其反应5 min后进行室温磷光检测。荧光分光光度计选取磷光模式,磷光光谱的检测范围为500~700 nm,激发波长为295 nm,激发狭缝和发射狭缝均为10 nm。
3 结果与讨论
图1为Mn-ZnS QDs/BBV纳米复合材料对果糖的检测示意图、MPA包裹的Mn-ZnS量子点的结构示意图及BBV结构示意图。
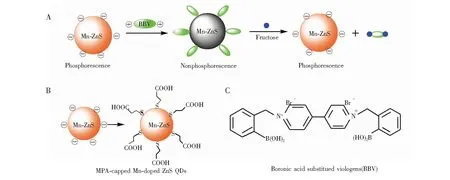
图1 (A)Mn掺杂ZnS QDs/BBV纳米复合材料对果糖的检测示意图;(B)MPA包裹的Mn-ZnS量子点的结构;(C)硼酸基联吡啶盐(BBV)的结构Fig.1 (A) Schematic illustration of synthesizing Mn-doped ZnS quantum dots (QDs)/bronic acid substitued viologen (BBV) nanohybrids for fructose dection; (B) structure of 3-mercaptopropionic acid (MPA)-capped Mn-doped ZnS QDs; (C) structure of BBV
由图2A量子点的透射电镜图可见, MPA包裹的Mn-ZnS量子点的粒径约为3.5 nm。MPA包裹的Mn-ZnS量子点最大的激发峰在295 nm处,最大发射峰约在590 nm处。量子点发光机理如图2B所示,激发光被ZnS母体吸收后,其电子受到激发,空穴则被Mn2+俘获,电子和空穴各自在Mn2+上复合, 导致Mn2+的激发,Mn2+由三重态4T1跃迁到基态6A1, 以磷光形式释放能量[20,21]。

图2 (A)MPA包裹的Mn掺杂的ZnS量子点透射电镜图;(B) Mn掺杂的ZnS量子点的发光示意图Fig.2 (A)TEM image of MPA-capped Mn-ZnS QDs; (B) schematic diagram of luminescence from MPA-capped Mn-ZnS QDs
3.2MPA包裹的Mn掺杂的ZnS量子点与BBV的相互作用

图3 (A)不同浓度BBV对Mn-ZnS量子点RTP的影响;(B) Mn-ZnS量子点RTP随不同浓度BBV的变化;(C) pH对Mn-ZnSQDs/BBV RTP的影响;(D)时间对Mn-ZnS QDs/BBV相对磷光强度的影响。Fig.3 (A) Effect of BBV concentration on RTP of Mn-ZnS QDs, concentrations of BBV are 0, 0.04, 0.08, 0.16, 0.32, 0.48, 0.64, 0.8, 1.6, 3.2 μmoL/L, respectively. (B) change of RTP with BBV concentration; (C) effect of pH value on RTP of the Mn-ZnS QDs/BBV nanohybrids; (D) effect of time on relative RTP intensity of Mn-ZnS QDs/BBV nanohybrids.
考察了BBV对Mn-ZnS量子点磷光强度的猝灭情况,如图3A所示。当量子点粉末溶于水后,包裹在Mn-ZnS量子点表面的MPA的羧基在水中分散而使量子点的表面带负电荷(如图1C),而BBV带正电荷,因此量子点与BBV通过静电作用形成Mn-ZnS QDs/BBV纳米复合材料。如图3A所示,随着BBV浓度增加,量子点的RTP强度在590 nm处逐渐降低。向溶液中加入BBV,仅对量子点的发光强度有影响,并不会改变量子点的发射波长。当BBV的浓度达到1.6 μmol/L时,继续增加BBV浓度,量子点的RTP强度趋于平缓,1.6 μmol/L BBV与量子点作用后形成的纳米复合材料的RTP强度相比量子点初始RTP强度下降约29倍。此现象表明,BBV对Mn-ZnS量子点的RTP强度有很大的影响,且二者发生相互作用后所形成的纳米复合材料具有优越的磷光性质,可作为检测果糖的光学传感器。
3.3影响Mn掺杂的ZnS量子点/BBV纳米复合材料稳定性的因素
为了实现对果糖的灵敏检测,在最佳反应条件下,考察了溶液pH值和反应时间对Mn-ZnS QDs/BBV纳米复合材料的影响,并分别对这些因素进行了优化。结果表明,pH值对Mn-ZnS QDs/BBV磷光强度有一定影响。由图3C可见,pH=4.5~6.5时,QDs/BBV体系的 RTP 强度相对稳定,但当 pH>7.5 时,BBV对 QDs 的RTP 猝灭程度减弱。在酸性环境下,除了带正电的BBV和量子点通过静电作用形成复合物,H+也可以中和量子点所带的负电,导致酸性条件下RTP磷光强度较低。由于H+的大量存在会降低量子点的磷光强度,导致不能准确判断BBV对量子点磷光强度的猝灭效果,纳米复合材料的灵敏性下降。碱性条件下,BBV需要中和带负电的OH,能够中和量子点表面负电荷的BBV减少,导致量子点磷光增强。中性环境下,H+和OH恰好能够中和,对Mn-ZnS QDs/BBV纳米复合材料的影响较小,另外人体体液的pH=7.4,因此选择 pH=7.4为实验最佳 pH 值。反应时间对体系的影响如图3D。结果表明,5 min后纳米复合材料的磷光强度不再发生明显变化且30 min内保持稳定。
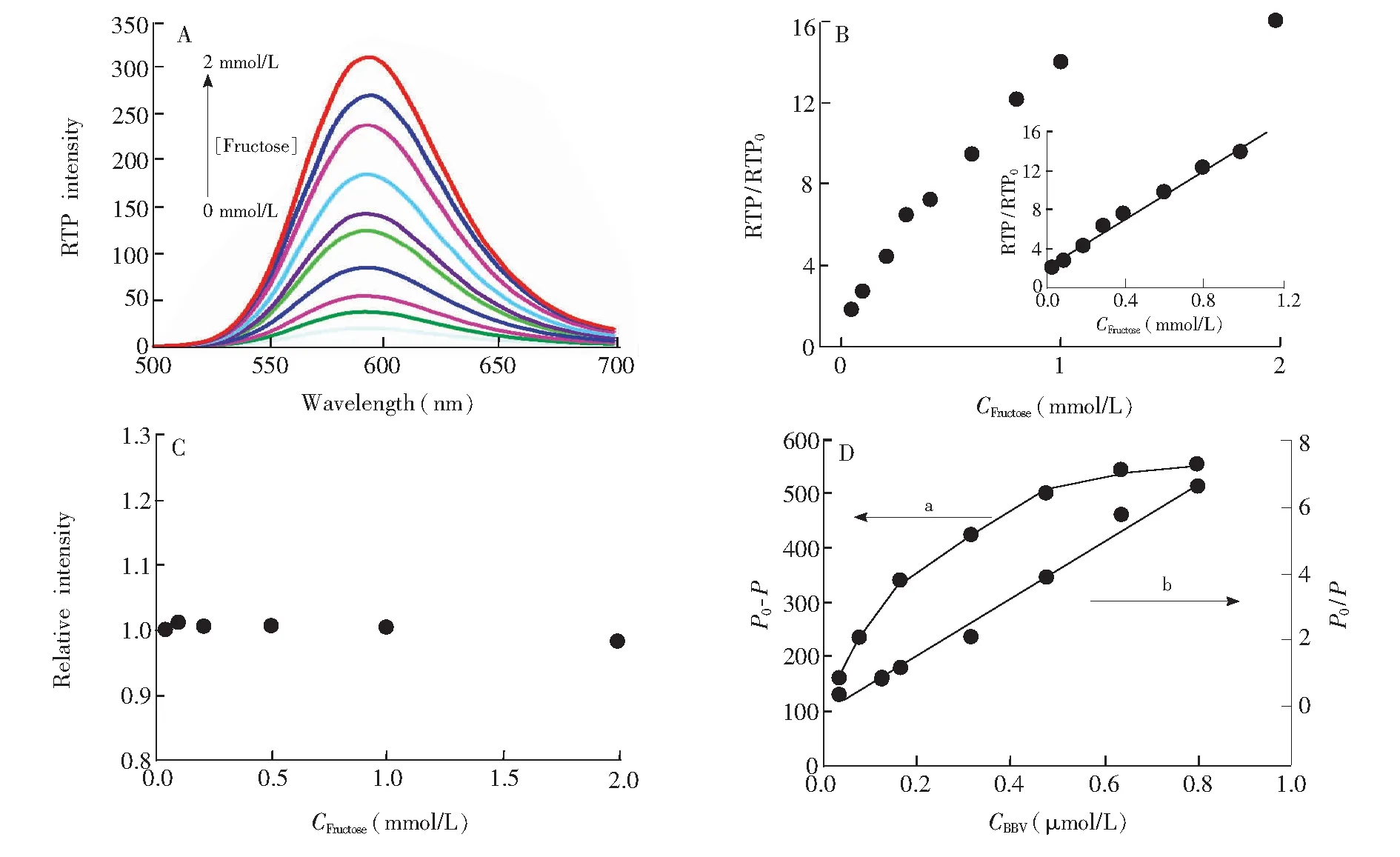
图4 (A)不同浓度果糖对Mn-ZnS QDs/BBV的RTP的影响;(B)不同浓度果糖与Mn-ZnS QDs/BBV纳米复合材料RTP的线性关系;(C)不同浓度果糖对不含BBV的Mn-ZnS量子点的相对磷光强度的影响;(D)BBV对Mn-ZnS量子点猝灭的Lineweaver-Burk双倒数函数曲线(a)和Stem-Volmer方程(b), P和P0分别为加和不加BBV时,体系的RTP。Fig.4 (A) Effect of fructose concentrations on RTP of Mn-ZnS QDs/BBV, concentrations of fructose are 0, 0.05, 0.1, 0.2, 0.3, 0.4, 0.6, 0.8, 1, 2 mmoL/L. (B) linear relationship between fructose concentrations and the RTP of Mn-ZnS QDs/BBV nanohybrids; (C) effects of fructose concentration on relative RTP intensity of BBV-free Mn-ZnS QDs; (D) Lineweaver-Burk double-reciprocal curve (a) and Stem-Volmer equation (b) underlying how BBV quenches the Mn-ZnS QDs,P and P0 are the RTP intensity of the system in the presence and absence of BBV respectively.
3.4Mn掺杂的ZnS量子点/BBV纳米复合材料作为RTP探针对果糖的检测
图4A表明,随着果糖浓度的增加,纳米复合材料的RTP强度逐渐增加。当向该体系中加入果糖后,硼酸与果糖结合形成阴离子硼酸酯,有效中和了BBV本身的正电荷,使得BBV从QDs上脱落,RTP得到恢复。为了证明此纳米复合材料RTP强度的降低不是果糖与量子点之间相互作用的结果,向不含BBV的Mn-ZnS量子点溶液中加入不同浓度果糖溶液,可以观察到在0~2 mmoL/L的浓度范围内量子点的磷光强度几乎未发生变化(图4C)。结果表明,低浓度的果糖对量子点的磷光强度几乎没有影响,同时说明加入果糖的纳米复合材料磷光强度发生变化的原因是果糖和BBV之间发生了相互作用。
3.5BBV猝灭MPA包裹的Mn掺杂的ZnS量子点的RTP机制
随着BBV浓度的逐渐增加,Mn-ZnS量子点的RTP被明显猝灭,说明BBV与Mn-ZnS量子点之间发生了相互作用。磷光猝灭过程通常分为动态猝灭和静态猝灭两类,可通过两个方程判断猝灭类型,动态猝灭过程遵从Stem-Volmer方程(1),静态猝灭过程遵从Lineweaver-Burk双倒数函数曲线(2)[22,23]。
P0/P=1+Ksvcq
(1)
1/(P0-P)=1/P0+KLB/(P0cq)
(2)
式中,P0代表发光体的磷光强度,P代表加入猝灭剂后的磷光强度,cq为猝灭剂浓度,Ksv为Stem-Volmer常数,KLB是静态猝灭结合常数。方程拟合的曲线(图4D)表明,P0/P与BBV的浓度关系符合Stem-Volmer方程,据此推测Mn-ZnS量子点与BBV属于动态猝灭。
有报道表明,甲基紫(MV2+)通过电子转移猝灭量子点的荧光[24,25],BBV与甲基紫有相似结构,推测为发生了电子转移而使量子点磷光猝灭。BBV中存在吡啶环,吡啶环成盐后,氮原子上带有正电荷,吸电子效应加强。故BBV猝灭量子点磷光的机理解释为带正电的BBV与带负电的量子点相互产生静电吸引,Mn-ZnS量子点的激发态电子转移到含强吸电子基团的BBV,电子和Mn2+无法在空穴重新组合,量子点磷光强度减弱,最终猝灭,如图5所示。
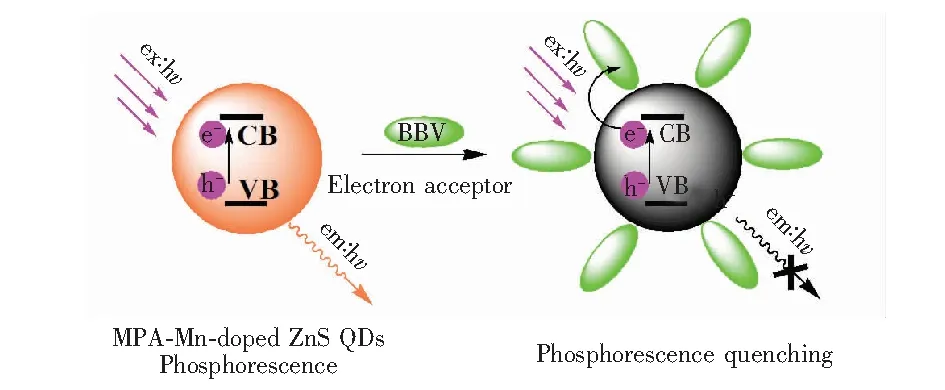
图5 BBV 猝灭MPA包裹的Mn-ZnS量子点的RTP作用机制Fig.5 Action mechanism between BBV and MPA capped Mn-ZnS QDs
3.6果糖与BBV的相互作用机制
Lorand等[26]的研究表明,在碱性环境下,苯硼酸化合物与糖类物质中的二醇结构能够可逆生成五元或六元环酯。因此果糖与BBV具体的反应步骤应为:第一步,在碱性溶液中,硼酸接受OH上的孤对电子形成硼酸阴离子,并释放出H+,硼酸中的硼原子由sp2杂化变为sp3杂化,同时空间构象也从平面三角形转换为四面体结构,最终导致苯硼酸化合物的构象发生改变;第二步,硼酸阴离子与果糖结合生成环状硼酸酯,如图6所示。果糖与BBV结合形成更酸的阴离子硼酸酯,有效中和了BBV本身的正电荷,BBV与Mn-ZnS 量子点的静电结合能力下降,导致BBV 从量子点表面脱落,量子点RTP 恢复。
3.7Mn掺杂的ZnS量子点/BBV纳米复合材料RTP探针对果糖的检测分析特性
在最优条件下,向Mn-ZnS QDs/BBV纳米复合材料中加入果糖,在一定范围内,此纳米复合材料RTP强度的变化值(RTP/RTP0)与果糖的浓度呈线性关系,线性回归方程为RTP/RTP0=245.55CFructose+16.451,相关系数r=0.993, 线性范围为0.05~1.00 mmol/L, 检出限为0.01 mmol/L,相对标准偏差为1.9%。对利用硼酸化合物做受体,基于不同方法的检测果糖的线性范围进行了比较,结果表明, 本方法的性范围较宽(表1)。
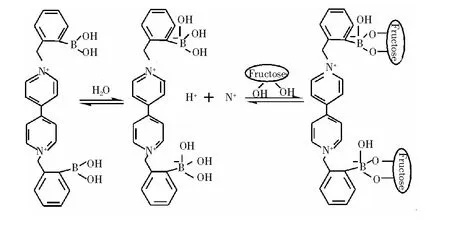
图6 BBV和果糖的作用机理Fig.6 Mechanism of interaction between BBV and frucose
表1 果糖含量测定的不同方法的比较
Table 1 Comparision of different analytical techniques for determination of fructose concerntration

检测方法Detectionmethod线性范围Linearrange(mmol/L)Ref.Electrochemicalanalysis0.3~5[27〛UV0.5~2.5[28]检测方法Detectionmethod线性范围Linearrange(mmol/L)Ref.Flourescence0.5~50[29]RTP0.05~1.0Thiswork
4 结 论
本研究合成了带负电的MPA包裹的Mn-ZnS量子点和带正电的BBV,利用二者之间的静电作用构建了Mn-ZnS QDs/BBV纳米复合材料,并将其作为识别果糖的RTP探针。该果糖检测体系设计简单、操作方便, 且不受体液背景荧光的干扰,不需要复杂的预处理过程即可测定果糖的含量。 本方法对于食品和药品中果糖的检测具有潜在的应用前景。
1 Heller A, Feldman B.Chem.Rev.,2008, 108(7): 2482-2505
2 Murrey H E, Hsieh-Wilson L C.Chem.Rev.,2008, 108(5): 1708-1731
3 Nakagawa T, Hu H, Zharikov S, Tuttle K R, Short R A, Glushakova O, Ouyang X, Feig D I, Block E R, Herrera-Acosta J, Patel J M, Johnson R J.Am.J.Physiol.RenalPhysiol.,2006, 290(3): F625-F631
4 Antiochia R, Gorton L.Sens.ActuatorsB,2014, 195: 287-293
5 Nishiyabu R, Kubo Y, James T D, Fossey J S.Chem.Commun.,2011, 47(4): 1106-1123
6 Shimpuku C, OzawaR, Sasaki A, Sato F, Hashimoto T, Yamauchi A, Suzuki I, Hayashita T.Chem.Commun.,2009, (13): 1709-1711
7 Wahjudi P N, Patterson M E, Lim S, Yee J K, Mao C S, Lee W N P.Clin.Biochem.,2010, 43(1): 198-207
8 Wu X, Li Z, Chen X X, Fossey J S, James T D, Jiang Y B.Chem.Soc.Rev.,2013, 42(20): 8032-8048
9 Xu S Y, Ruan Y B, Luo X X, Gao Y F, Zhao J S, Shen J S, Jiang Y B.ChemCommun.,2010, 46(32): 5864-5866
10 DENG Qi-Liang, CHEN Yang, WANG Yang, ZHANG Zhi-Jun, SU Ri-Na, LI Yan-Li, WANG Shuo.JournalofTianjingUniversityofScienceandTechnology,2014, 29(2): 71-74
邓启良, 陈 洋, 王 阳, 张志俊,苏日娜,李燕丽,王 硕. 天津科技大学学报,2014, 29(2): 71-74
11 Sun F, Bai T, Zhang L, Ella-Menye J-R, Liu S J, Nowinski A K, Jiang S Y, Yu Q M.Anal.Chem.,2014, 86(5): 2387-2394
12 Miao Y, Yang M, Yan G.RSCAdv.,2016, 6(11): 8588-8593
13 DU Bao-An, LIU Cheng, CAO Yu-Jiang, CHEN Li-Na.SpectroscopyandSpectralAnalysis,2014, 34(4): 1070-1074
杜保安, 刘 澄, 曹雨虹, 陈丽娜. 光谱学院光谱分析,2014, 34(4): 1070-1074
14 Costa-Fernández J M, Pereiro R, Sanz-Medel A.TrAC-TrendsAnal.Chem.,2006, 25(3): 207-218
15 Traviesa-Alvarez J M, Sánchez-Barragán I, Costa-Fernández J M, Pereiro R, Sanz-Medel A.Analyst,2007, 132(3): 218-223
16 He Y, Wang H F, Yan X P.Anal.Chem.,2008, 80(10): 3832-3837
17 Wu P, Zhao T, Tian Y, Wu L, Hou X.Chem.Eur.J.,2013, 19(23): 7473-7479
18 Sharrett Z, Gamsey S, Fat J, Cunningham-Bryant D, Wessling R A, Singaram B.TetrahedronLett.,2007, 48(29): 5125-5129
19 Feng L, Liang F, Wang Y, Xu M, Wang X.Org.Biomol.Chem.,2011, 9(8): 2938-2942
20 Thakar R, Chen Y, Snee P T.NanoLett.,2007, 7(11): 3429-3432
21 Chung J H, Ah C S, Jang D J.J.Phys.Chem.B,2001, 105(19): 4128-4132
22 Sauer K, Scheer H, Sauer P.Photochem.Photobiol.,1987, 46(3): 427-440
23 Lakowicz J R, Weber G.Biochemistry,1973, 12(21): 4171-4179
24 Suri J T, Cordes D B, Cappuccio F E, Wessling R A, Singaram B.Langmuir,2003, 19(12): 5145-5152
25 Cordes D B, Gamsey S, Sharrett Z, Miller A, Thoniyot P, Wessling R A, Singaram B.Langmuir,2005, 21(14): 6540-6547
26 Lorand J P, Edwards J O.J.Org.Chem.,1959, 24(6): 769-774
27 Li J, Sun Y Q, Wei Y M, Zheng J B.Chin.Chem.Lett.2013, 24(4): 291-294
28 Cannizzo C, Amigoni-Gerbier S, Larpent C.Polymer,2005, 46(4): 1269-1276
29 ZHU Wen-Bing, QI Li, WU Fang-Ying.ChineseJournalofAnalysisLaboratory,2012, 31(1): 63-67
朱文兵, 戚 丽, 吴芳英. 分析试验室,2012, 31(1): 63-67
SynthesisofQuantumDot/BoronicAcid-substitutedBipyridiniumSaltNanohybridsasRoom-temperaturePhosphorescenceProbeforFructoseDetection
YANG Qi, MIAO Yan-Ming*, LI Yan, SUN Xiao-Jie, YAN Gui-Qin
(CollegeoflifeScience,ShanxiNormalUniversity,Linfen041004,China)
Trace level of fructose was successfully detected by a sensor, in which the phosphorescence of Mn-doped ZnS (Mn-ZnS) room-temperature phosphorescence (RTP) quantum dots (QDs) was used as signals, and boronic acid-substituted bipyridinium salt (BBV) synthesized from 2-(bromomethyl) phenylboronic acid and 4,4′-bipyridyl was used as the receptor. The negatively-charged Mn-ZnS QDs and the positively-charged BBV electrostatically attracted each other to form Mn-ZnS QDs/BBV nanohybrids, which quenched the RTP of Mn-ZnS QDs. After addition into these nanohybrids, the fructose bonded with BBV to form an anionic borate, which largely restricted the quenching of BBV on Mn-ZnS QDs, thus the RTP was restored. In this work, we investigated the effects of pH and reaction time on the RTP of the Mn-ZnS QDs/BBV nanohybrids. Under the optimal conditions, the novel probe had a fructose detection limit of 0.01 mmol/L and a linear range of 0.05-1.0 mmol/L was achieved with correlation coefficient of 0.99. This phosphorescence sensor was superior with convenience and high speed, and can be potentially applied to the detection and analysis of fructose in foods and medicine fields.
Quantum dots; Room-temperature phosphorescence; Boronic acid-substituted bipyridinium salt; Fructose
5 June 2017; accepted 4 September 2017)
10.11895/j.issn.0253-3820.170355
