脊髓损伤模型中胞外抗坏血酸浓度的活体在线分析
2017-11-06张雅文纪文亮毛兰群
吕 扬 张雅文 谭 磊 纪文亮 于 萍 毛兰群* 周 方*
1(北京大学第三医院, 北京100191)2(中国科学院化学研究所活体分析化学重点实验室, 北京100190)
脊髓损伤模型中胞外抗坏血酸浓度的活体在线分析
吕 扬1张雅文1谭 磊1纪文亮2于 萍2毛兰群*2周 方*1
1(北京大学第三医院, 北京100191)2(中国科学院化学研究所活体分析化学重点实验室, 北京100190)
利用活体微透析技术结合在线高选择性抗坏血酸电化学检测技术,以实验性胸10节段脊髓钳夹损伤为动物模型,研究了脊髓损伤过程中胞外抗坏血酸的变化规律。结果表明,微透析探针植入及钳夹损伤瞬间,均存在脊髓抗坏血酸浓度高峰,随后浓度回到稳定水平,对照组大鼠脊髓细胞外液中抗坏血酸的平均基础浓度为(26.17±1.25) μmol/L (n=8)。实验组脊髓钳夹损伤后,胞外抗坏血酸水平显著增加,达到(53.24 ± 1.95) μmol/L(n=8),这种显著性升高可能与继发性脊髓损伤保护机制导致胞内抗坏血酸外流相关。本研究结果为抗坏血酸参与调节继发性脊髓损伤提供了直接的实验证据。
抗坏血酸; 脊髓损伤; 活体微透析; 在线电化学检测
2017-07-13收稿; 2017-09-13接受
本文系北京市科技计划项目(新)(No.2144000021)资助
* E-mail: zhou.md@126.com; lqmao@iccas.ac.cn
1 引 言
急性脊髓损伤(SCI)是一种骨科常见疾病,通常发生在年轻人群中。在北美,每百万人中就有39人患有急性SCI[1]。 SCI的治疗一直是骨科研究重点之一。急性SCI的损害包括两种机制,即原发性损伤(包括机械压迫、出血、电解质从受损细胞中外溢等)和继发性损伤(包括损伤后缺血、离子失衡、氨基酸兴奋毒性、自由基氧化应激、炎症介质等)。原发性损伤发生于损伤当时且不可逆转,而继发性损伤是细胞和分子水平的主动调节过程,其演变过程可达数天之久,具有可逆性且可能被控制[2]。
抗坏血酸(AA)作为重要的抗氧化剂和自由基清除剂之一,在SCI研究领域中越来越受到关注[3]。AA能中和在SCI中产生的活性氧(ROS),并通过谷氨酸-AA异向交换减少谷氨酸的积累[4]。因此,作为SCI的神经保护剂,研究SCI中AA水平的变化显得尤为重要。动态监测脊髓中AA浓度对于研究AA抗氧化潜力和损伤后AA的其它可能作用机制至关重要。传统的用于AA活体检测的方法主要有高效液相色谱法(HPLC)[5,6]和活体微电极伏安法[7],但由于AA容易化学氧化且SCI的原发性损伤时间短等特点,使得上述方法用于SCI中AA水平的检测仍然存在不足。如HPLC方法由于时间分辨率较低,且在实验过程中可能会导致AA的氧化,使测得的结果与真实数值不符。此外,尽管活体微电极伏安法可实时反映AA浓度变化,但AA产物在电极上沉积,电极灵敏度会随着测定时间的延长而逐渐减低,并且电极的准确标定较为困难。近年来的研究[8,9]表明,利用碳纳米管的电化学催化作用构建的检测体系,可以有效实现AA在电极上的选择性电化学氧化,避免了其它小分子物质的干扰; 该体系利用微透析技术滤过了大分子蛋白质等容易吸附于电极表面并影响电极稳定性的物质,从而保证了检测体系的重现性和稳定性。同时,由于微透析样品无须经过分离就直接进入电解池进行电化学检测,所以具有良好的时间分辨率。将微透析技术与选择性电化学检测池结合发展起来的活体在线电化学检测技术(Online electrochemical system, OECS)由于其高的时空分辨率、稳定可靠的矫正和检测方法,近年来受到了越来越多的关注[10]。
本研究利用活体微透析技术结合在线高选择性AA电化学检测技术,以SCI为动物模型,成功测定了SCI过程中胞外AA的动态变化规律,相关研究未见文献报道。研究结果表明,急性SCI后,AA基础浓度显著增加,这为治疗急性SCI的研究提供了有效的分析手段和理论依据。
2 实验部分
2.1材料和试剂
抗坏血酸钠(AA,美国Sigma公司);人工脑脊液(aCSF)由1.2 mmol/L CaCl2、2.0 mmol/L Na2HPO4、1.0 mmol/L MgCl2、2.7 mmol/L KCl、145 mmol/L NaCl配制,调至pH=7. 4。单壁碳纳米管(Single-walled carbon nanotubes, SWCNTs,深圳市纳米科技有限公司),使用前在2.6 mol/L HNO3溶液中回流5 h,经离心、重新分散、过滤、烘干, 备用。纯化后的SWCNTs在真空下500℃加热回流2 h。实验用水为超纯水(18.2 MΩ cm, Milli-Q超纯水系统,美国Millipore公司)。
2.2活体微透析-在线电化学检测系统(OECS)
本研究采用的活体微透析-在线电化学检测系统如图1所示,主要包括薄层电化学池(BASCo)和微透析取样两部分。电化学检测采用三电极体系:玻碳工作电极(GCE,直径6 mm,Bioanalytical Systems Inc.(BAS),West Lafayette, IN)、Ag/AgCl参比电极和不锈钢对电极。为了实现AA高选择性测量,薄层电解池的玻碳电极首先在抛光布上分别用0.30和0.05 μm的Al2O3粉末悬浮液抛光,再于超纯水中超声处理10 min,氮气吹干。将4 μL 2 mg/mL SWNTs的N,N二甲基甲酰胺的悬浮液滴在处理好的玻碳电极上,常温挥发除去溶剂,制得SWCNT修饰电极,用于AA的高选择性检测。
将微透析探针(2 mm; BAS Carnegie Medicine)插入水合氯醛麻醉的大鼠脊髓后。用人工脑脊液以2 μL/min的流速连续灌注,通过微量注射泵(CMA/100; CMA Microdialysis AB,Stockholm,Sweden)驱动,将脊髓微透析液通过微透析导管直接递送至薄层电化学流动池中,用于实时在线测量AA。
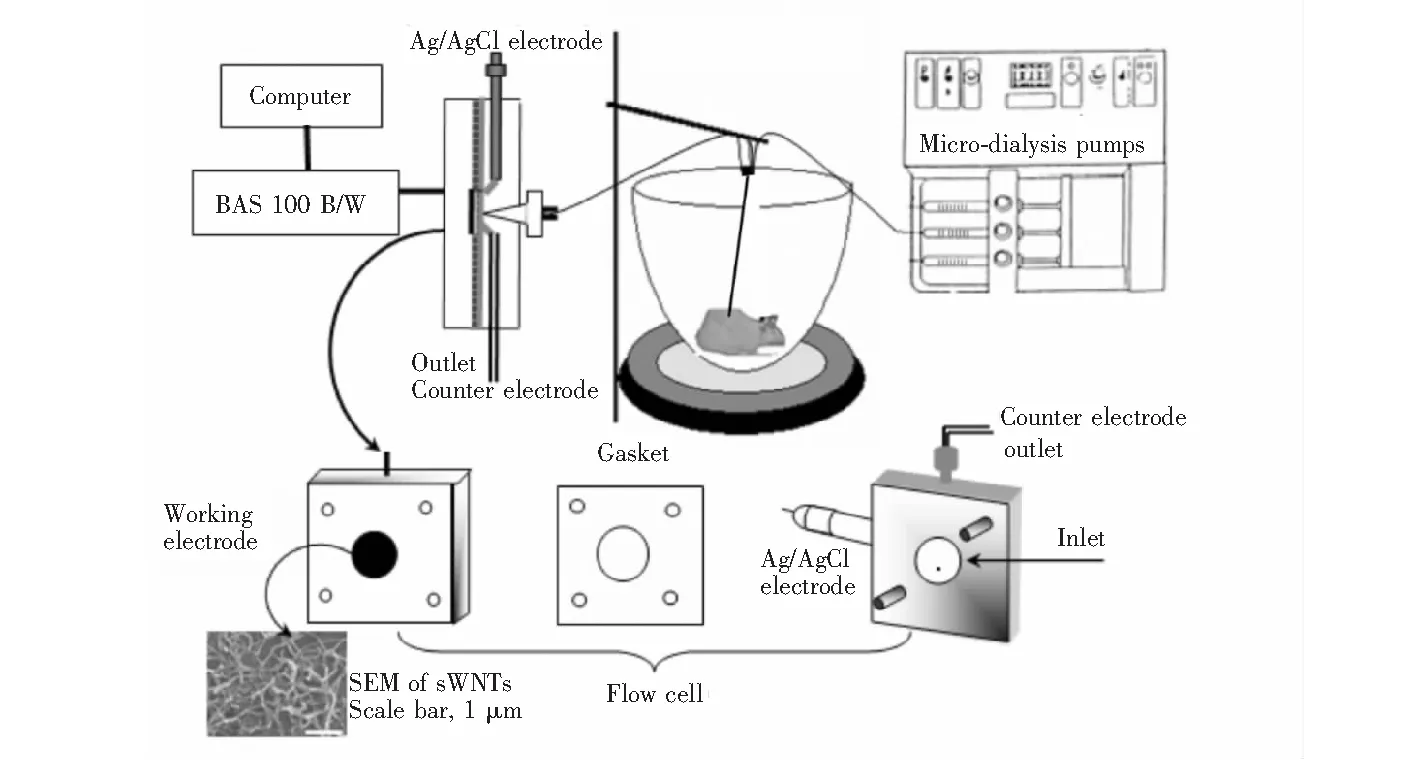
图1 活体微透析-在线电化学检测系统示意图Fig.1 Schematic illustration of experimental setup of online-electrochemical system (OCES) for continuously monitoring spinal cord ascorbate change in acute traumatic spinal cord injury (SCI) models
2.3动物实验
健康雄性Sprague-Dawley大鼠(3月龄,重270~330 g)购于北京大学医学部实验动物中心。将大鼠分开饲养,随意食用食物和水,并以12 h光/暗循环维持。实验当日用水合氯醛(350 mg/kg腹膜内注射)将大鼠麻醉,术中用加热垫维持体温在37.8℃。从T8-T12打开大鼠的背部区域,暴露脊髓。将微透析探针在脊髓T10处插入背角中,用人工脑脊液进行60 min微透析平衡后接入检测器进行分析。实验过程中将大鼠分成对照组和损伤组(每组8只大鼠)。对照组后续未进行任何操作并保持透析至180 min; 对于损伤组,在T10的脊髓上进行钳夹损伤[11],随后保持透析至180 min。
3 结果与讨论
3.1抗坏血酸定量分析
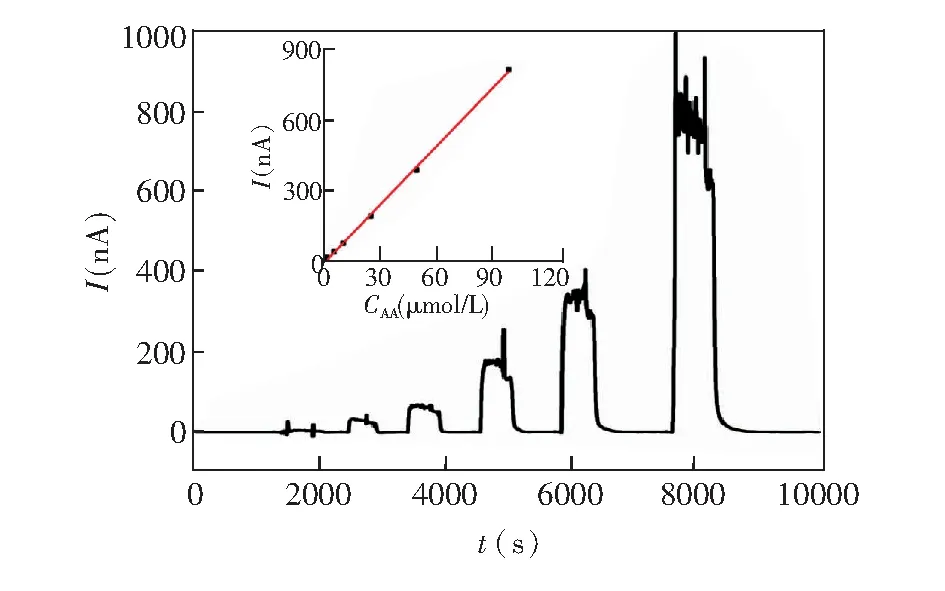
图2 在线电化学方法检测不同浓度AA标准溶液的电流响应。插图为浓度与电流值的线性关系,电极施加电位为+30 mV,参比电极为Ag/AgCl,流速2 μL/minFig.2 Current response recorded for ascorbic acid (AA) standard solutions in artificial cerebrospinal fluid (aCSF) with on-line electrochemical system. Inset is plot of current vs. AA concentration. The microdialysis probe was perfused with aCSF at flow rate of 2 μL/min. Working electrode is polarized at +30 mV(vs. Ag/AgCl electrode)
为了更好地研究动物模型中AA的变化规律,在进行SCI动物实验之前,先用AA标准溶液进行定量分析。碳纳米管具有优良的电化学性质,其修饰的玻碳电极可用于选择性检测AA[8,9],碳纳米管侧壁碳的性质类似于高温热解石墨电极的层状碳, 其电化学性质不活泼。相反,碳纳米管的端口碳的性质类似于高温热解石墨电极的边缘碳,而且具有良好的电化学活性,能加快氧化还原物质的异相电子转移[12,13],利用层层组装的技术制备的稳定的碳纳米管膜电极,有效实现了AA在电极上的选择性电化学氧化。本研究制备了单壁碳纳米管修饰的玻碳电极,以此作为工作电极,用于选择性检测AA。如图2所示,分别将1、5、10、25、50和100 μmol/L AA溶液由微量注射器经微透析管路泵进薄层电解池内,可以测得明显的电流梯度变化,电流强度与AA浓度呈良好的线性关系,线性方程为:y=8.058x-16.18(R2=0.9995)。表明本研究构建的在线电化学检测系统可以用于生理状态下的AA变化规律的研究。

图3 (A)探针植入后,将人工脑脊液泵入薄层电解池,基线第一次回归平稳,然后钳夹T10脊髓处制造急性损伤模型,基线再次回归平稳,较未损伤之前显著升高。箭头分别表示探针植入、AA水平、基础值SCI、AA水平升高时间;(B) 对照组(方块点线)和损伤组(圆点线)脊髓AA的变化 (n=8),箭头指示开始施加急性损伤的时间。急性SCI引起大鼠脊髓AA水平显著性升高,而未损伤组脊髓AA水平无明显变化(p< 0.05)Fig.3 (A) Typical current-time responses of ascorbate recorded in micro-dialysates continuously sampled from spinal cord in SCI group rats. Other conditions were the same as those in Fig.2. (B) Statistical results of spinal cord ascorbate levels in control group (cube line)and SCI group(dot line). The time interval for data acquisition is 10 min. Data were obtained from the results of 16 different rats, and represented as mean p<0.05 by unpaired t-test between the lesion group and the control group
3.2SCI过程中AA变化规律的研究
由连续实时测定AA的典型结果(图3A)可知,本体系可以实现从探针植入到SCI全过程的实时检测,其中,在探针插入和SCI造模过程中引起的尖峰是由于仪器在再次充电过程中引起的充电电容的衰减以及手术过程中引起的噪音导致的。为避免由此引起的实验误差,在插入微透析探针平衡60 min基线回归稳定后,再进行测量电流信号。经过线性回归曲线矫正,测得麻醉大鼠脊髓(T10)处的细胞外液中AA的平均基础水平为(26.17±1.25) μmol/L(n=8,图3A)。在SCI发生时(图3A),损伤区域脊髓胞外AA浓度急剧升高,可能是由于神经细胞死亡后,细胞膜上通道蛋白质的失活或者细胞膜完整性破坏,细胞内储存的高浓度AA会瞬间大量释放到细胞间液,导致细胞外AA浓度明显增加。随后AA浓度缓慢下降,推测是由于坏死细胞内自由水的释放以及损伤后血管壁通透性增加,组织间液增多,导致AA溶液被稀释,浓度降低。随后,AA浓度在60 min左右达到稳定,测得实验组脊髓基础浓度变为(53.24±1.95) μmol/L (n=8)(图3B)。基础浓度的升高一方面可能是由于针对ROS的防御机制而引起的;另一方面,AA释放可能与兴奋性毒性谷氨酸的摄取有关。已知谷氨酸在SCI期间释放和积累[14],通过直接损伤神经元[15,16]和少突胶质细胞[17],以及通过活性氧的产生导致神经毒性[18]。损伤还会触发大量谷氨酸的释放,而谷氨酸作为神经细胞内重要的兴奋性神经递质又进一步加重神经细胞去极化扩散和能量物质的消耗。这也进一步增加了神经细胞内AA向细胞间液的释放,同时也触发了“级联放大”效应,即神经去极化与谷氨酸释放互为因果,不断恶性循环,逐渐加重。AA的增加可能是通过异交换转运蛋白吸收细胞外谷氨酸[4],由损伤诱导的AA释放可促进从细胞外液吸收积聚的谷氨酸以防止其积累。除这两种机制外,由于能量失效和三磷酸腺苷(ATP)在SCI发生初始阶段耗尽所引起的缺氧去极化,神经细胞内的AA流出[19],这也可能是导致细胞外AA增加的原因。因此,SCI期间细胞外AA的变化所提供的信息,不仅可用于理解SCI中的复杂神经化学过程,而且还可用于后期开发这种疾病的治疗药物。
4 结 论
利用活体微透析技术结合在线高选择性AA电化学检测技术,以SCI为动物模型,研究了SCI过程中胞外AA的变化规律。发现T10处SCI后,胞外AA水平显著增加,这种显著性升高可能与继发性SCI保护机制导致胞内AA外流相关。本研究为AA参与调节继发性SCI提供了直接的实验证据。同时,本研究进一步证明活体在线微透析系统可以用于SCI模型中生理活性小分子变化规律的研究。
1 Chehensse C, Bahrami S, Denys P, Clement P, Bernabe J, Giuliano F.Hum.Reprod.Update,2013, 19(5): 507-526
2 Serarslan Y, Yonden Z, Ozgiray E.J.Clin.Neurosci.,2010, 17(3): 349-352
3 Tsai P J, Chen W Y, Tzeng S F, Liang W M, Yang C S.Clin.Chim.Acta,2005, 362(1-2): 94-100
4 Yusa T.BrainRes.,2001, 897(1-2): 104-113
5 Szultka M, Buszewska-Forajta M, Kaliszan R, Buszewski B.Electrophoresis,2014, 35(4): 585-592
6 Jin P, Xia L, Li Z, Che N, Zou D, Hu X.J.Pharm.Biomed.Anal.,2012, 70: 151-157
7 Zhu M, Zeng C, Ye J.Electroanalysis,2011, 23(4): 907-914
8 Liu K, Yu P, Lin Y, Wang Y, Ohsaka T, Mao L.AnalChem.,2013, 85(20): 9947-9954
9 Li L, Zhang Y, Hao J, Liu J, Yu P, Ma F, Mao L.Analyst,2016, 141(7): 2199-2207
10 Tao L, Song C, Sun Y.Anal.Chim.Acta,2013, 761: 194-200
11 Talac R, Friedman J A, Moore M J.Biomaterials,2004, 25(9): 1505-1510
12 ZHANG Ren-Yan, ZHANG Xue-Ao, JIA Hong-Hui, LI Xin-Hua.ChineseJ.Anal.Chem.,2012, 40(6): 909-914
张仁彦, 张学骜, 贾红辉, 李新华. 分析化学,2012, 40(6): 909-914
13 ZHANG Cui-Zhong, WANG Li-Wei, LU Yong-Ke, ZHENG Guang-Jin, PENG Jin-Yun.ChineseJ.Anal.Chem.,2016, 44(8): 1263-1269
张翠忠, 王丽伟, 卢永课, 郑广进, 彭金云. 分析化学,2016, 44(8): 1263-1269
14 Barabas J, Nagy E, Degrell I.Arch.Gerontol.Geriatr.,1995, 21(1): 43-48
15 Liu D, Xu G Y, Pan E, McAdoo D J.Neuroscience,1999, 93(4): 1383-1389
16 McAdoo D J, Xu G Y, Robak G, Hughes M G.Exp.Neurol.,1999, 159(2): 538-544
17 Xu G Y, Hughes M G, Ye Z, Hulsebosch C E, McAdoo D J.Exp.Neurol.,2004, 187(2): 329-336
18 McAdoo D J, Wu P.Pharmacol.Biochem.Behav.,2008, 90(2): 282-296
19 Thompson R J, Zhou N, MacVicar B A.Science,2006, 312(5775): 924-927
This work was supported by the Beijing Science and Technology Project (New), China (No.2144000021).
ContinuouslyMonitoringofConcentrationofExtracellularAscorbicAcidinSpinalCordInjuryModel
LYU Yang1, ZHANG Ya-Wen1, TAN Lei1, JI Wen-Liang2, YU Ping2, MAO Lan-Qun*2, ZHOU Fang*1
1(PekingUniversityThirdHospital,Beijing100191,China)2(KeyLaboratoryofAnalyticalChemistryforLivingBiosystems,InstituteofChemistry,ChineseAcademyofSciences,Beijing100190,China)
Acute traumatic spinal cord injury (SCI) represents one of the most devastating injuries that afflict the human body. Ascorbic acid (AA) plays an important role in mammalian central nervous system, especially in SCI. In this study, the change of AA concentration after SCI was investigated by using an on-line electrochemical method integrated withinvivomicrodialysis. A microdialysis probe (2 mm in length) was implanted into the spinal cord of an anesthetized rat (Thoracic-10). Microdialysis perfusate (2 μL/min) was collected in the sample loop of an on-line injector for direct injection onto a glassy carbon electrode which was modified with the heat-treated single-walled carbon nanotubes (SWNTs). Normal ascorbic acid concentration in the extracellular fluids of spinal cords was (26.17 ± 1.25) μmol/L (n=8). The experimental spinal cord injury, induced by a lesion at T-10, significantly increased the extracellular ascorbic acid levels to (53.24±1.95) μmol/L (n=8). This study provides the experimental evidence on the essential roles of ascorbic acid in spinal cord injuries.
Ascorbic acid; Spinal cord injury;Invivomicrodialysis; On-line electrochemical detection
13 July 2017; accepted 13 September 2017)
10.11895/j.issn.0253-3820.171091
