多功能芯片对合成样本中肝癌细胞HepG2的测试研究
2017-11-06张泽杰喜1
张泽杰 苏 喜1, 徐 溢 陈 李
(重庆大学 新型微纳器件与系统技术重点学科实验室1,化学化工学院2,光电工程学院微系统研究中心3,微纳系统及新材料技术国际研发中心4,重庆 400044)
多功能芯片对合成样本中肝癌细胞HepG2的测试研究
张泽杰2,4苏 喜1,2,4徐 溢*1,2,3,4陈 李*1,3,4
(重庆大学 新型微纳器件与系统技术重点学科实验室1,化学化工学院2,光电工程学院微系统研究中心3,微纳系统及新材料技术国际研发中心4,重庆 400044)
设计并制作了一种集多孔流分离(Multi-orifice flow fractionation, MOFF)技术与磁捕获技术于一体的用于特异性分离和捕获合成样本中肝癌细胞HepG2的多功能微流控细胞芯片。此芯片由玻璃基片和PDMS微通道盖片组成,PDMS盖片上含有3条进样通道、MOFF分离区和六边形腔体的细胞富集检测区。其中,MOFF分离区总长20 mm, 由80组长度为0.18 mm、深度为50 μm、收缩区域宽度为0.06 mm、扩张区域宽度为0.20 mm的半菱形收缩/扩张重复单元组成,每组收缩/扩张重复单元间的夹角为103.0°。实验以肝癌细胞HepG2 -血细胞混悬液为样本;根据磁珠表面修饰c-Met抗体能与肝癌细胞HepG2特异性结合的原理,通过表面羧基化的磁珠、EDC(1 mg/mL)、NHS(1 mg/mL)和c-Met抗体制备了浓度为50 μg/mL的免疫磁珠(Anti-MNCs)悬浮液。在样本流速为50 μL/min条件下,利用外加磁场实现了血细胞合成样本中微量肝癌细胞HepG2的有效捕获;采用微波加热法以柠檬酸、硫脲为原料制备了用于荧光标记HepG2的碳量子点,在芯片上实现了血液中肝癌细胞HepG2的原位荧光可视化观测。对芯片检测区捕获到的HepG2进行了显微计数分析,对500 μL血细胞(107cell/mL)中含10个HepG2细胞的合成样本,捕获效率达到88.5%±6.7% (n=20)。结果表明,所设计的多模式多功能的微流控芯片具有良好的肿瘤细胞分离和检测功能。
微流控芯片; 多孔流分离; 磁捕获; 荧光可视化; 肝癌细胞HepG2
2017-07-13收稿;2017-09-06接受
本文系国家自然科学基金项目(No.21375156)、 国家高技术研究发展计划(863)项目(No.2015AA021104)、重庆市前沿研究重点项目(No. cstc2015jcyjBX0010)和重庆市科学技术委员会社会民生科技创新项目 (No. cstc2015shms zx00014)资助
* E-mail: xuyibbd@sina.com; CL2009@cqu.edu.cn
1 引 言
循环肿瘤细胞(Circulating tumour cells, CTCs)的分离检测在癌症早期诊断,肿瘤转移判断,肿瘤患者临床针对性治疗以及治疗效果评估等方面具有重要意义[1,2]。微流控芯片因其高通量、高内涵、样本需求少等优点,在CTCs分离、富集方面已得到广泛研究与关注[3]。
基于微流控芯片的物理分离具有操作简便,分离过程快速等优势,包括基于细胞尺寸的离心分离、多孔流分离和磁分离等[4,5]。Lee等[6]基于细胞间尺寸差异采用离心法在芯片上对2~4 mL乳腺癌细胞-血细胞合成样本进行分离,30 s实现了肿瘤细胞的分离,分离效率达61%。基于离心技术的微流控芯片具有分离快速的优势,但离心过程易产生肿瘤细胞丢失,导致分离效率较低。Hyun等[7]依据不同粒径的微粒在收缩/扩张的多孔通道中水动力惯性力作用不同的原理,采用多孔流分离(Multi-orifice flow fractionation, MOFF)技术对24组7.5 mL的合成样本进行细胞分离,30 min内分离出的肿瘤细胞数量在0~21个之间。Shen等[8]采用的MOFF芯片在每分钟分离2.24 ×107个细胞的情况下,分离出合成样本中的肿瘤细胞。单一MOFF分离模式的芯片分离过程快速,但分离出的细胞通常只能在芯片外检测,无法实现芯片上原位检测。Tang等[9]在平行排列的金属镍阵列通道上通过外加磁场对磁珠-细胞复合物进行吸附,而实现600~800 μL血液中MCF-7分离,分离效果为43.0% ± 1.2% (n=3)。Kang等[10]采用相同的方法成功对样本中大鼠M6C乳腺癌细胞进行了分离。磁分离法通过外加磁场可以将分离出的细胞吸附在芯片上具有原位检测的优势,但血液样本中大量血细胞的自然沉降和非特异吸附会影响分离效果。目前,各种单一细胞分离模式的研究相对较多,但将多种分离模式有效结合实现高效分离测试的却很少,如何集成多模式分离依然是研究热点。
目前,荧光检测以其检测灵敏度高和易于集成的特点,成为微流控芯片上应用最多的检测技术[11,12],Chen 等[13]通过典型的蔗糖-油酸加热法制备的碳量子点和Li等[14]通过硫脲-柠檬酸微波消解制备的碳量子点都成功用于肿瘤细胞的荧光标记。碳量子点具有荧光性能稳定、细胞毒性低、生物相容性好、易于大量合成及功能化修饰、制备成本低廉等优点,其在细胞成像和检测方面备受关注[15~17]。
本研究将多孔流分离与磁分选两种分离模式相结合,针对肝癌细胞HepG2-血细胞混悬液样本,利用多孔流模式初步分离大部分血细胞,进而在外加磁场作用下进行目标肿瘤细胞的第二次磁分离和捕获。同时,采用碳量子点和免疫磁珠对HepG2细胞进行荧光标记及免疫磁标记,在优化的流速条件下,利用外加磁场在微流控芯片的检测区对血细胞中微量HepG2细胞进行有效分离和捕获,最后通过显微观测对芯片检测区捕获到的HepG2细胞进行原位计数分析。
2 实验部分
2.1仪器与试剂
70-4505微流控注射泵(美国Harvard Apparatus公司),OLYMPUS IX71倒置荧光显微镜(日本奥林巴斯株式会社),UV-2450紫外可见分光光度计(日本 岛津公司)。
NaCl、KCl、Na2HPO4·12H2O和KH2PO4(分析纯,重庆川东化工有限公司);柠檬酸(分析纯,重庆博艺化学试剂有限公司);硫脲(分析纯,重庆化学试剂厂);羧基修饰Fe3O4纳米粒子(150 nm,天津市倍思乐色谱技术开发中心);c-Met(E999)pAb(美国Bioworld Technology公司);N-甲基羟琥珀酰亚胺(NHS,分析纯,成都市科龙化工试剂厂);1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐 (EDC,98.5%,上海阿拉丁生化科技股份有限公司);磷酸盐缓冲液(PBS)、肝癌细胞HepG2悬液(104cell/mL)、血细胞悬液(107cell/mL)。
2.2实验方法
2.2.1微流控芯片制作制作的微流控芯片包含有微通道的PDMS盖片及玻璃基片(图1)。PDMS的微通道包含3条进样通道、MOFF分离区和六边形腔体的细胞富集检测区。其中,MOFF分离区总长20 mm,由80组长度为0.18 mm、深度为50 μm、收缩区域宽度为0.06 mm、扩张区域宽度为0.20 mm的半菱形收缩/扩张重复单元组成,每组收缩/扩张重复单元间的夹角为103.0°(图1A)。所涉及的微流控盖片采用模塑法制备(图1B)。
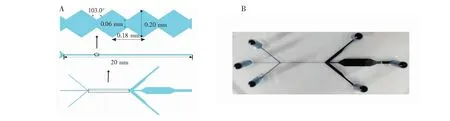
图1 (A)MOFF结构及尺寸示意图;(B)芯片实物图Fig.1 (A) Scheme of structure and size of multi-orifice flow fractionation (MOFF);(B) figure of polydimethylsiloxane (PDMS) cover plate
2.2.2碳量子点制备[14]称取柠檬酸和硫脲各0.5 g,加入20 mL去离子水溶解,将其置于微波炉加热反应7 min,取出冷却至室温。于10000 r/min 离心5 min后,0.22 μm过滤膜过滤,4℃避光保存,得碳量子点(Carbon quantum dots, CQDs)。对所得碳量子点进行荧光光谱检测。
2.2.3免疫磁珠制备向500 μg表面羧基化的磁珠中,加入新配制的1 mL EDC (1 mg/mL)和1 mL NHS(1 mg/mL),室温振摇30 min,活化磁珠表面的羧基,加入8 μLc-Met抗体(1 μg/μL),继续孵育5 h,PBS清洗3次。在室温下与500 μL BSA(1 mg/mL)封闭液孵育3 h。重悬于PBS中使其终浓度为50 μg/mL免疫磁珠(Anti-MNCs)悬浮液,4℃保存备用。
2.2.4碳量子点和免疫磁珠标记血液样本中的HepG2细胞将HepG2细胞(104个/mL)与血细胞悬液(107cell/mL)按体积比1∶1混合得混合细胞悬液,向100 μL混合细胞悬液中加入500 μL CQDs,PBS缓冲液定容至1 mL。37℃恒温摇床中150 r/min孵育30 min,离心,PBS清洗3次,加入1 mL Anti-MNCs免疫磁珠(100 μg/mL), 37℃振摇避光孵育30 min,制得碳量子点和免疫磁珠标记的HepG2细胞。
2.2.5微流控芯片上血液样本中CTCs可视化检测向500 μL血细胞悬液中加入按比例浓度稀释获得的10个HepG2细胞,按照2.2.4节的操作方法加入500 μL CQDs和Anti-MNCs免疫磁珠,制备得到后续CTCs检测样本。将微流控芯片d、e、f接口与微流控注射泵相连(图2),用无水乙醇、PBS缓冲液清洗通道, a接口通入2.2.4节的碳量子点和免疫磁珠标记的混合细胞混悬液,b和c接口通入实验用PBS缓冲液,分别设置流速为30、40、50和 60 μL/min,在芯片通道中对流体流速进行优化。
取500 μL CTCs样本,在已优化的流速条件下,按照上述实验步骤,通过外加磁场在微流控芯片上进行分选富集,芯片富集区通过倒置荧光显微镜观察捕获的HepG2细胞个数,重复操作20次。

图2 血细胞中HepG2细胞的MOFF分离-磁富集-荧光观测芯片分析流程Fig.2 Analytical process of HepG2 in red blood cells on microfluidic chip with MOFF separation-magnetic enrichment-fluorescent detection
3 结果与讨论
3.1微流控芯片上CTCs检测策略
本实验的芯片分析流程如图2所示。首先,利用多孔流分离通道实现血液样本中HepG2第一步分离,即在一系列的收缩/扩张微通道中,利用流体中微粒的惯性升力和动力变化诱导产生惯性力,并将其用于大小不一的球形微粒的连续分离,通过重复的收缩/扩张单元实现大量的血红细胞分离。该过程可以避免细胞的损伤,还可避免不必要的非特异性沉积,实现快速分离。然后,对HepG2细胞进行碳量子点和免疫磁珠标记后,在芯片检测区对进入的免疫磁珠标记的HepG2细胞进行第二步磁富集。芯片上检测区与通道相比面积较大,能实现更多细胞的磁富集,当流体由较窄的多孔流分离通道到芯片富集区后,流体流速减慢,更有利于HepG2细胞在此区域被捕获,并便于荧光显微镜观测。
3.2碳量子点和免疫磁珠标记HepG2
碳量子点作为荧光纳米颗粒对细胞进行标记,在实现细胞的检测及成像方面具有很大的优势。碳量子点加入细胞溶液中,其会粘附在细胞表面,通过细胞对纳米颗粒的胞吞作用,纳米颗粒能够进入细胞,从而实现细胞的荧光标记。实验采用柠檬酸和硫脲为原料制备了粒径在2~4 nm[14]范围的碳量子点,对制备的碳量子点进行荧光测试(图3A),碳量子点在波长420~530 nm变化范围内均有激发和发射现象,在430 nm波长处有最大激发,发射波长在520 nm,为绿色荧光。碳量子点标记细胞经显微镜观测,可见所制备的碳量子点具有良好的荧光效能,可满足后续微流控芯片上荧光标记观测HepG2细胞的要求(图3B)。
实验中HepG2细胞与免疫磁珠孵育30 min,免疫磁珠成功标记HepG2细胞,并可实现芯片上的磁捕获(图3C)。实验中将碳量子点与免疫磁珠成功标记的HepG2细胞通过外磁场作用,在芯片检测区进行捕获,显微镜观测,可见HepG2细胞明显的富集现象(图3D)。
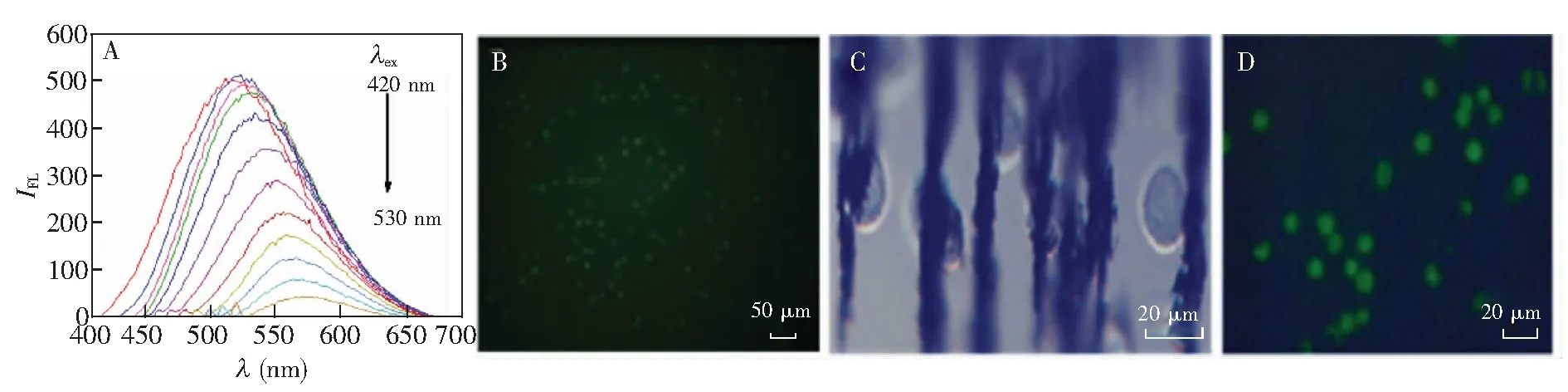
图3 (A) 不同激发波长下碳量子点的荧光发射光谱;(B) 碳量子点标记HepG2荧光显微图;(C) c-met免疫磁珠与肝癌HepG2细胞结合30 min显微图;(D) 碳量子点和免疫磁珠标记 HepG2细胞显微图Fig.3 (A) Fluorescence emission spectrum of carbon quantum dots (CQDs) at different excitation wavelength; (B) Fluorescence micrograph of CQDs labeled HepG2; (C) Image of HepG2 connected immunomagnetic beads at 30 min; (D) Micrograph of CQDs and c-met immunomagnetic beads labeled HepG2
3.3流速对分离效果的影响
实验中设置进样流速30 ~40 μL/min,此时合成样本中的癌细胞和血红细胞未被分离开,部分癌细胞在分离区末端进入e和f,被排出芯片外,造成肿瘤细胞的流失(图2),且在此流速下细胞易沉降;进样流速为50 μL/min时,绝大多数血细胞从出口e和f被排出芯片外,HepG2细胞和少量血细胞进入富集区,因外加磁场作用HepG2细胞在此区域富集,而少量血细胞从出口d流出片外;流速为60 μL/min时,由于流速较大,磁捕获区的HepG2细胞部分被冲走。因此,选择最佳进样流速为50 μL/min。图4A为最佳进样流速下血细胞及荧光标记的HepG2细胞的流向,大量血细胞在MOFF结构单元g区域被分离到e和f出口流出芯片外,而尺寸较大的HepG2细胞从h区域进入磁捕获富集区。以上结果表明,设计的多功能芯片在进样流速50 μL/min时能成功实现大量血细胞的分离。
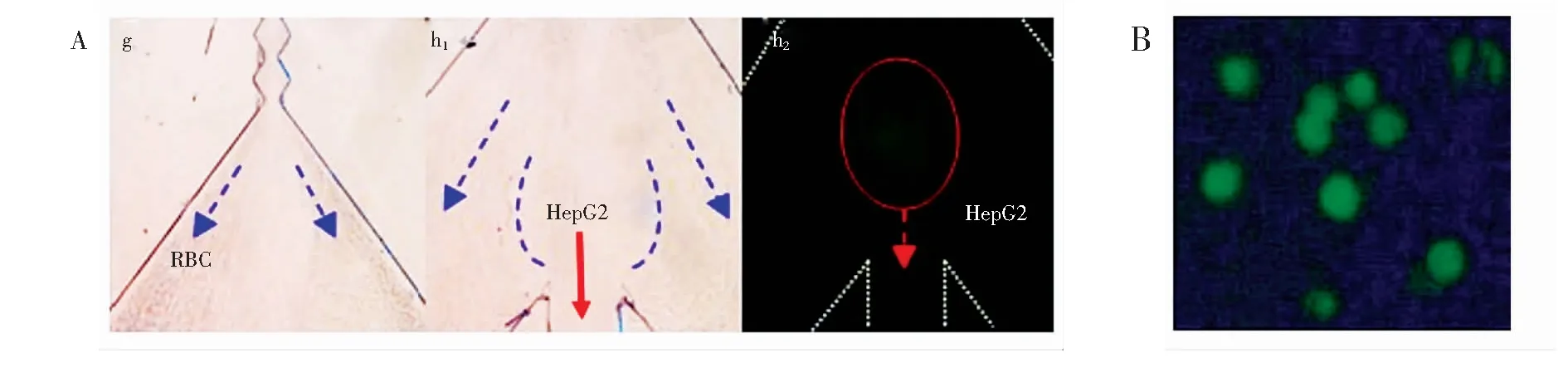
图4 (A) 混合细胞样本进样流速50 μL/min时g和 h区显微成像图;(B) 微流控芯片捕获区HepG2细胞显微图Fig.4 (A) Micrographs of g, h areas when mixture sample introduction rate is 50 μL/min; (B) Micrograph of HepG2 on microfluidic chip capture area
3.4血液合成样本中HepG2细胞的可视化分析
对血液合成样本中HepG2细胞进行碳量子点和磁珠标记,在进样流速50 μL/min条件下,对500 μL HepG2细胞-血细胞混合样本(含10个碳量子点和磁珠标记的HepG2细胞)进行芯片上的分离和荧光显微观测。通过对芯片富集捕获区HepG2细胞进行计数,从标记到可视化观测仅需70 min。根据公式(1)计算出捕获效率(CR),细胞捕获结果见表1。
CR(%)=N1/N×100
其中,N1为捕获HepG2细胞个数;N为样本中HepG2细胞个数。
采用碳量子点和免疫磁珠对HepG2细胞的标记,在进样流速50 μL/min和外加磁场条件下,通过倒置荧光显微镜在芯片富集区可观测到呈绿色荧光的HepG2细胞(图4B),对少量细胞进行数量统计,计算出样本的捕获效率为88.5%±6.7%(n=20)。此结果表明,所设计的MOFF分离-磁捕获-原位荧光观测微流控芯片可用于血液中微量肿瘤细胞的分离、富集及可视化观测。
表1 微流控芯片上血细胞-HepG2合成样本中HepG2捕获结果
Table 1 Capture results of HepG2 from artificial sample of RBC-HepG2 on microfluidic chip

SamplevolumeBloodcellsHepG2cellsRecoveryFrequencyCapturerate(%)102Sample500μL5×1061091488.5±6.78371
4 结 论
设计了集细胞分离、磁捕获及原位荧光观测于一体的多功能微流控芯片,包含MOFF分离区和磁富集荧光检测区。针对血细胞-HepG2混悬液样本,通过流体流速优化,在进样流速为50 μL/min时,可以在芯片MOFF分离区分离除去大量血细胞,减少了其对HepG2细胞富集过程的干扰;在检测区,利用外磁场对免疫磁珠标记的HepG2细胞进行二次富集。采用制备简单、生物相容性好的碳量子点对HepG2细胞进行标记,实现了可视化观测。通过倒置荧光显微镜,采用人工计数的方法对捕获到的微量HepG2细胞进行了定量分析,样本的捕获效率达到88.5%±6.7% (n=20)。本方法集成了细胞的分离富集及荧光观测,通过微流控芯片能对肿瘤细胞-血细胞样本进行分析检测,为CTCs临床快速检测提供基础。
1 Cristofanilli M, Hayes D F, Budd G T, Ellis M J, Stopeck A, Reuben J M, Doyle G V, Matera J, Allard W J, Miller M C, Fritsche H A, Hortobagyi G N, Terstappen L W.J.Clin.Oncol.,2005, 23(7): 1420-1430
2 Smerage J B, Hayes D F.CancerInvest.,2008, 26: 109-114
3 HUO Dan-Qun, GUO Ming-Yi, DENG Yan, YANG Mei, FA Huan-Bao, HOU Chang-Jun.ChineseJ.Anal.Chem.,2015, 43(12): 1801-1807
霍丹群, 郭明遗, 邓 艳, 杨 眉, 法焕宝, 侯长军. 分析化学,2015, 43(12): 1801-1807
4 Myung J H, Hong S.LabChip,2015, 15: 4500-4511
5 HU Ning, YANG Jun, HOU Wen-Sheng, ZHENG Xiao-Lin, CAO Yi, YANG Jing, XU Rong, ZHANG Rui-Qiang.Chem.J.ChineseUniversities,2009, 30(1): 42-45
胡 宁, 杨 军, 侯文生, 郑小林, 曹 毅, 杨 静, 许 容, 张瑞强. 高等学校化学学报,2009, 30(1): 42-45
6 Lee A, Park J, Lim M, Sunkara V, Kim S Y, Kim G H, Kim M H, Cho Y K.Anal.Chem.,2014, 86: 11349-11356
7 Hyun K A, Kwon K, Han H, Kim S, Jung H.Biosens.Bioelectron.,2013, 40: 206-212
8 Shen S F, Ma C, Zhao L, Wang Y L, Wang J C, Xu J, Li T B, Pang L, Wang J Y.LabChip,2014, 14: 2525-2538
9 Tang M, Wen C Y, Wu L L, Hong S L, Hu J, Xu C M, Pang D W, Zhang Z L.LabChip,2016, 16: 1214-1223
10 Kang J H, Krause S, Tobin H, Mammoto A, Kanapathipillai M, Ingber D E.LabChip,2012, 12: 2175-2181
11 Yu T, Auguste D T.Biosens.Bioelectron.,2016, 81: 431-437
12 Galletti G, Sung M S, Vahdat L T, Shah M A, Santana S M, Altavill G, Kirbyd B J, Giannakakou P.LabChip,2014, 14: 147-156
13 Chen B S, Li F M, Li S X, Weng W, Guo H X, Guo T, Zhang X Y, Chen Y B, Huang T T, Hong X L, You S Y, Lin Y M, Zeng K H, Chen S.Nanoscale,2013, 5: 1967-1971
14 Li H, Shao F Q, Huang H, Feng J J, Wang A J.Sens.ActuatorsB,2015, 226: 506-511
15 Zhu A, Qu Q, Shao X, Kong B, Tian Y.Angew.Chem.Int.Ed.,2012, 124: 7297-7301
16 Luo P G, Sahu S, Yang S T, Sonkar S K, Wang J, Wang H, Le Croy G E, Cao L, Sun Y P.J.Mater.Chem.B,2013, 1: 2116-2127
17 Niu W J, Li Y, Zhu R H, Shan D, Fan Y R, Zhang X J.Sens.ActuatorsB,2015, 218 : 229-236
This work was supported by the National Natural Science Foundation of China (No. 21375156), the National High Technology Research and Development Program of China (863 program) (No. 2015AA021104), the Frontier Research Key Projects of Chongqing Science and Technology Committee, China (No. cstc2015jcyjBX0010), and the Scientific and Technical Innovation Projects for People's Livelihood of Chongqing Science and Technology Committee, China (No. cstc2015shmszx00014).
DetectionofHepG2CellsinArtificialSamplesbyMultifunctionalMicrofluidicChip
ZHANG Ze-Jie2,4, SU Xi1,2,4, XU Yi*1,2,3,4, CHEN Li*1,3,4
(KeyDisciplinesLabofNovelMicro-nanoDevicesandSystemTechnology1,SchoolofChemistryandChemicalEngineering2,SchoolofOptoelectronicEngineering,ResearchCenterofMicrosystem3,InternationalR&DcenterofMicro-nanoSystemsandNewMaterialsTechnology4,ChongqingUniversity,Chongqing400044,China)
A multi-functional microfluidic chip with multi-orifice flow fractionation (MOFF) and magnetic capture technique was developed to specifically separate and capture the HepG2 cells in artificial samples. The chip contained a glass substrate and a polydimethylsiloxane (PDMS) microchannel cover plate. The PDMS cover plate consisted of 3 injection channels of 10-mm-long, a MOFF separation zone and a hexagonal cavity cell enrichment-detection zone. Among which, the MOFF separation zone had a total length of 20 mm and was consisted of 80 semi-rhombic shrinkage/expansion units with a length of 0.18 mm, a depth of 50 μm, a shrinkage area width of 0.06 mm, and an expansion area of 0.20 mm. The angle between each group of shrinkage/expansion units was 103.0°. In this experiment, HepG2-blood cell suspension was used as the sample. Based on the principle that the magnetic bead surface-modifiedc-Met antibody could specifically bind to HepG2 cells, an immunomagnetic bead (Anti-MNCs) suspension at a concentration of 50 μg/mL was prepared by surface carboxylated beads, EDC (1 mg/mL), NHS (1 mg/mL) andc-Met antibody. Under the optimized flow rate (50 μL/min), a few HepG2 in suspension samples were efficiently captured at the detection zone of chip via a magnetic field; the carbon quantum dots were prepared by microwave heating with citric acid and thiourea to label HepG2 cells which achieved in-situ fluorescence visualization of captured HepG2. Cells captured in the chip detection area were counted by microscope. The capture rate of HepG2 cells was 88.5%±6.7% (106blood cells and 10 HepG2 cells per 500 μL). The results demonstrated that the developed multifunctional microfluidic chip may serve as a promising tool for separation and capture of tumour cells.
Microfluidic chip; Multi-orifice flow fractionation; Magnetic capture; Fluorescence visualization; HepG2
13 July 2017; accepted 6 September 2017)
10.11895/j.issn.0253-3820.171092
