荧光光谱结合表面增强拉曼光谱法研究紫檀芪与人血清白蛋白相互作用
2017-11-06申炳俊金丽虹刘昱鑫刘占伟刘荣娟
申炳俊 金丽虹 刘昱鑫 柴 浩 刘占伟 刘荣娟 田 坚*
(长春理工大学清洁能源技术研究所1, 生命科学技术学院2, 长春 130022)
荧光光谱结合表面增强拉曼光谱法研究紫檀芪与人血清白蛋白相互作用
申炳俊1金丽虹*2刘昱鑫2柴 浩2刘占伟2刘荣娟2田 坚*1
(长春理工大学清洁能源技术研究所1, 生命科学技术学院2, 长春 130022)
在模拟人体生理条件下,应用荧光光谱和表面增强拉曼光谱法研究了紫檀芪(PTE)与人血清白蛋白(HSA)之间相互作用机制。结果表明,HSA的荧光能被PTE静态猝灭,并伴随有非辐射能量转移作用,两者形成了1∶1复合物,结合距离r=1.495 nm,结合常数KA=1.12 × 104(298 K)、4.07 × 104(304 K)和2.45 × 105L/mol (310 K)。表面增强拉曼光谱研究揭示, PTE分子通过甲氧基与HSA进行结合; 热力学数据表明,二者间的作用主要为疏水作用; 标记竞争实验指出PTE优先结合HSA的位点Ⅲ。三维荧光光谱、同步荧光光谱和表面增强拉曼光谱结果显示,与PTE作用后,HSA构象发生变化,导致色氨酸残基周围环境疏水性降低,但对PTE分子构象影响不大。
紫檀芪; 人血清白蛋白; 荧光光谱; 表面增强拉曼光谱; 构象变化
2017-05-29收稿; 2017-07-19接受
本文系国家自然科学基金(No.21153003)、 吉林省教育厅项目(No.201574)和长春理工大学博士后基金项目(2014年)资助
* E-mail: jinlh@cust.edu.cn; tianjian@cust.edu.cn
1 引 言
紫檀芪(Pterostilbene,PTE)化学名称为3,5-二甲氧基-4′-羟基反式二苯乙烯,是白藜芦醇(Resveratrol, RES)的甲基化衍生物。PTE广泛存在于葡萄、蓝莓和西红柿等水果和蔬菜中,是一种天然的含有芪结构非黄酮类多酚化合物。近年来,PTE的广泛生物活性引起了研究人员的关注,PTE不仅具有抗心血管疾病、抗炎、抗氧化、降血糖等药理活性[1~3],还对食道癌、胃癌、肺癌、乳腺癌和恶性黑素瘤等多种肿瘤细胞均具有抑制作用[4~6]。研究表明,在同等情况下,PTE的某些生物活性、生物利用度和安全性高于同源物RES[7]。目前,对于PTE药理作用研究多集中于生物学活性。然而,药物的临床效果通常与抑制类型、药物的吸收、体内的分布与组织浓度及消除方式等药代动力学有关。因此,开展PTE药动力学研究,将有助于PTE的开发和应用。
人血清白蛋白(HSA)是血浆中最丰富的蛋白质,其表面具有亲脂性的结合位点,可与多种内源和外源性化合物结合,是体内重要的载体[8]。药物分子进入人体内后,一般无法直接作用于病灶部位,通常与HSA以非共价方式结合进行运输,药物与HSA的亲和性将直接影响其释放、代谢和生物活性。因而HSA常被用作研究药物小分子与蛋白质相互作用的模型蛋白。目前,与蛋白质相互作用研究多集中于黄酮类和生物碱类活性成分,而萜类、蒽醌类、多酚类、香豆素类及醌类活性成分研究相对较少。光谱法作为研究药物与蛋白质相互作用的一种常用且有效的方法,被广泛应用于中药活性成分与HSA结合作用研究中。曹团武等[9]利用荧光光谱结合紫外吸收光谱研究了环烯醚萜类化合物哈巴俄苷与HSA的结合反应,获得了结合常数、结合位点数和热力学参数等信息。吴秋华等[10]利用荧光光谱和吸收光谱法从分子水平研究了萜类化合物RES与HSA的相互作用。Maya等[11]利用荧光光谱、吸收光谱和红外光谱结合分子模拟技术对比分析了PTE、RES与HSA的相互作用,得到了结合常数、结合位点数、结合距离、具体结合位置和结合力等信息,但未对PTE与HSA两者间相互作用的化学键进行实验验证,而且两者结合对PTE构象的影响也未提及。
本研究利用密度泛函理论(DFT)获得PTE分子构象和理论拉曼光谱信息,在详细归属PTE拉曼特征峰基础上,通过PTE与HSA结合前后SERS光谱变化情况探讨两者间化学键结合方式以及构效关系。同时在模拟人体生理条件下,利用荧光光谱法对PTE与HSA相互作用机理进行研究。本研究对于阐明PET构效关系、药代动力学、指导临床合理用药以及PET的开发及利用等均具有重要参考意义。
2 实验部分
2.1仪器与试剂
F-280型荧光分光光度计(中国天津港东公司); QE65000型激光拉曼光谱仪(美国Ocean Optics公司); DELTA320型pH计(瑞士Mettler Toledo公司); DC-4006型高精度水浴(上海菁海仪器公司)。人血清白蛋白(HSA,Sigma公司),使用时用0.05 mol/L Tris-HCl缓冲液配成1.00 × 10mol/L储备液。紫檀芪(PTE,纯度≥98%,成都普菲德生物技术有限公司); 保泰松(Phenylbutazone)、布洛芬(Ibuprofen)、洋地黄毒苷(Digitoxin),纯度≥98%(德国Dr. Ehrenstorfer公司)。上述标准品均用无水乙醇配制成2.00 × 10mol/L溶液,储备液及溶液均于4℃下避光保存。其它试剂均为分析纯,实验用水为二次蒸馏水。
2.2实验方法
2.2.1荧光光谱和同步荧光光谱在7 mL比色管中加入40 μL HSA储备液和适量PTE溶液,用Tris-HCl缓冲液定容至4 mL,获得HSA: PTE (浓度比)分别为1∶0,1∶1,1∶3,1∶5,1∶7和1∶9混合液,充分混合后,于298 K(304 K或310 K)恒温水浴中作用30 min。固定激发波长为280 nm,激发/发射狭缝宽度为10/5 nm,记录荧光发射谱。荧光值用Fcor=Fobs× e(Aex +Aem)/2“内滤光效应”公式进行校正[8]。固定Δλ= 15 nm和Δλ=60 nm(Δλ=λem-λex),记录同步荧光光谱。
2.2.2位点竞争实验HSA和位点标记试剂(保泰松/布洛芬/洋地黄毒苷)的浓度均固定为1.0 × 10mol/L,充分混合后,于298 K恒温水浴中作用30 min,向标记试剂-HSA体系中加入适量PTE溶液,混合均匀,继续在该温度水浴中反应30 min,测定荧光光谱。
2.2.3三维荧光光谱配制HSA∶PTE(浓度比)为1∶0和1∶6混合液,其激发波长范围为200~350 nm,发射波长范围为250~700 nm,激发和发射波长间隔均为5 nm,扫描三维荧光光谱。
2.2.4DFT理论计算利用密度泛函理论(DFT),在B3LYP/6-311+ +(d,p)基组水平上优化PTE几何结构,获得该分子的全部振动频率。频率修正因子为0.9613[12],所有计算均采用Guassian 09程序完成。
2.2.5拉曼光谱和表面增强拉曼光谱将PTE固体标样置于载玻片上,进行普通拉曼光谱(NRS)测试。配制HSA与PTE终浓度比分别为0∶1,1∶0和1∶2的混合液,pH 7.4 条件下作用30 min进行药物与HSA识别; 与等体积银溶胶溶液(由经典的Lee法[13]制备银溶胶)混合,作用30 min后进行SERS测定。激发光源为785 nm激光,扫描0~2000 cm范围的拉曼光谱,分辨率为2 cm,积分时间10 s,累积3次。
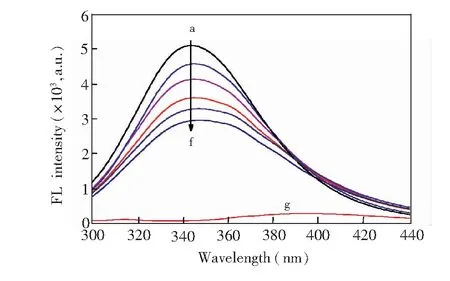
图1 紫檀芪对人血清白蛋白荧光光谱的影响Fig.1 Fluorescence quenching spectra of human serum albumin (HSA) in Pterostilbene (PTE)c(HSA)=1.0 μmol/L, c(PTE) (a-f): 0, 1.0, 3.0, 5.0, 7.0, 9.0 μmol/L; curve g: CHSA=0, CPTE=1.0 μmol/L; T=298 K, λex=280 nm
3 结果与讨论
3.1荧光猝灭机制及猝灭常数
HSA的内源性荧光主要来自于色氨酸(Try)、酪氨酸(Tyr)和苯丙氨酸(Phe)残基。由于苯丙氨酸荧光量子产率(φ)为0.03~0.04,只有酪氨酸(φ=0.21)和色氨酸(φ=0.20)的1/10,而酪氨酸被电离或者接近羧基时其荧光几乎全部猝灭,大多数情况下,可以认为蛋白质的荧光主要来自色氨酸的贡献。不同浓度PTE对HSA荧光光谱影响见图1,其中HSA在343 nm处有较强的荧光峰(曲线a),而PTE较弱荧光(曲线g)不会对体系荧光强度的测量产生影响。随着PTE浓度增加,HSA的荧光强度逐渐下降,峰形基本不变,但峰位略红移4.1 nm(343.4 nm到347.5 nm)。由此推测,PTE与HSA两者间发生了相互作用,可能形成了复合物。
在严格控制pH值和温度的条件下,能使HSA荧光猝灭的原因有3种可能,即静态猝灭、动态猝灭及非辐射共振能量转移。其中,静态猝灭是一种与复合物稳定性有关的过程,温度升高可降低复合物的稳定性,使猝灭常数Ksv减小; 而动态猝灭过程则依赖于扩散过程,温度升高将增加有效碰撞的离子数,并加快电子转移过程,其猝灭常数Ksv随温度的升高而增大。
为了探讨PTE对HSA的荧光猝灭机制,采用Stern-Volmer方程[14]:F0/F=1+Kqτ0[Q]=1+Ksv[Q]处理数据。由于猝灭剂(PTE)浓度高过HSA浓度多倍,故可用猝灭剂加入初始浓度代替平衡浓度[Q]。以F0/F对[Q]作图,Stern-Volmer拟合,由直线斜率获得298、304和310 K时,PTE对HSA的猝灭常数Ksv和Kq值。由表1可知,Ksv值随温度升高而减小,说明PTE猝灭HSA荧光的机制属于静态猝灭[8,14]。 此外,3个温度条件下的Kq值均大于生物大分子的最大分散碰撞猝灭常数(2 × 1010L/(mol·s))[9],这进一步验证PTE对HSA的荧光猝灭过程是由于两者之间结合形成复合物而引起的静态猝灭。
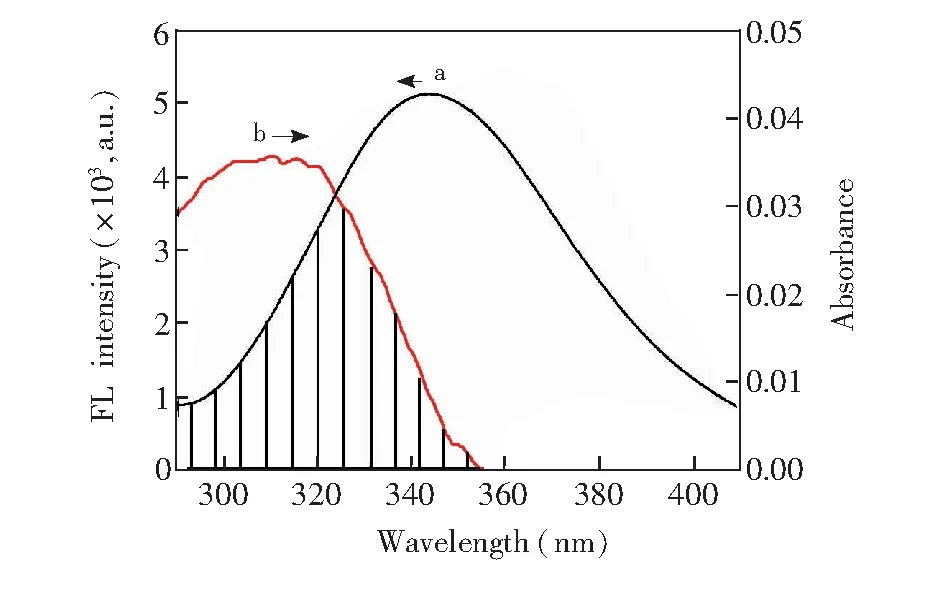
图2 HSA荧光发射光谱(a)与PTE吸收光谱(b)重叠图Fig.2 Overlapping drawing of fluorescence spectrum of HSA (a) and absorbance spectrum of pterostilbene (b)CHSA=CPTE=1.0 μmol/L
表1 不同温度下PTE对HSA的猝灭参数
Table 1 Quenching constants of interaction of PTE with HSA at different temperatures
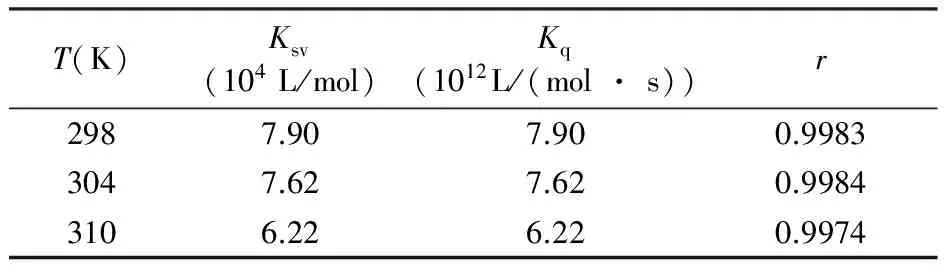
T(K)Ksv(104L/mol)Kq(1012L/(mol·s))r2987.907.900.99833047.627.620.99843106.226.220.9974
3.2结合距离
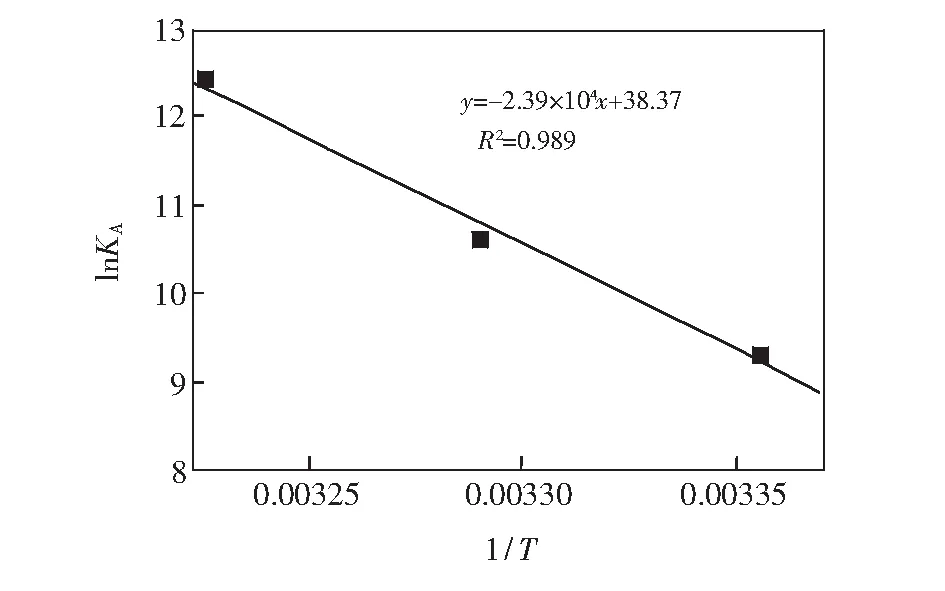
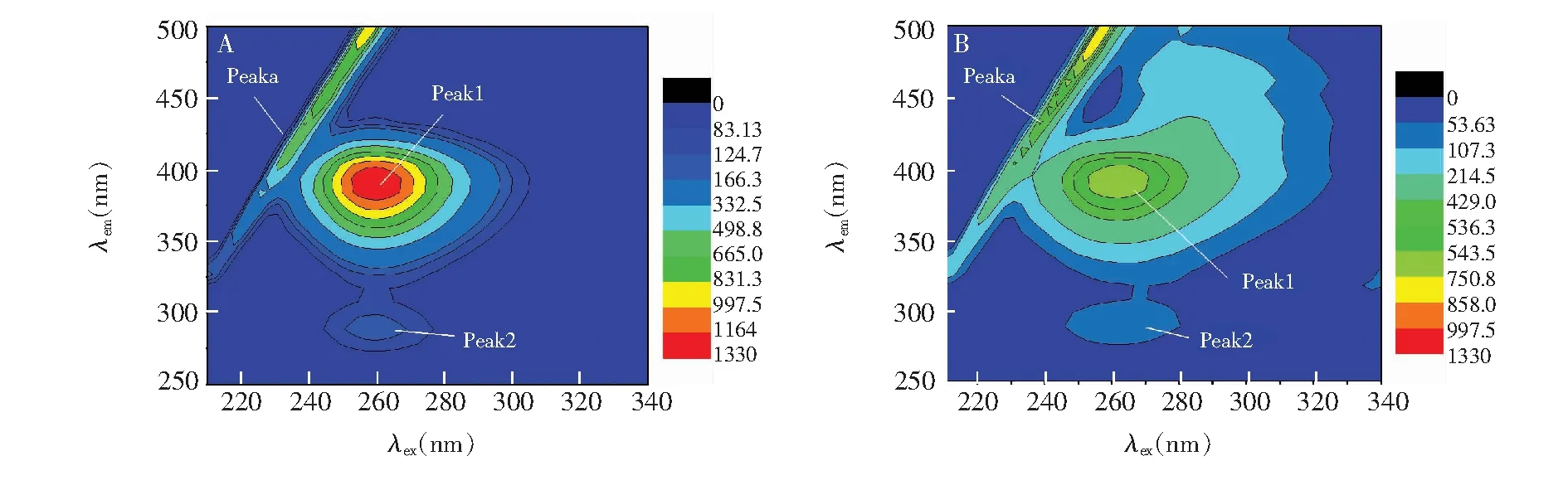
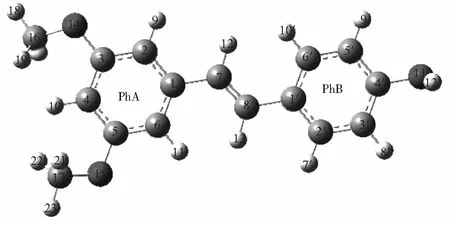
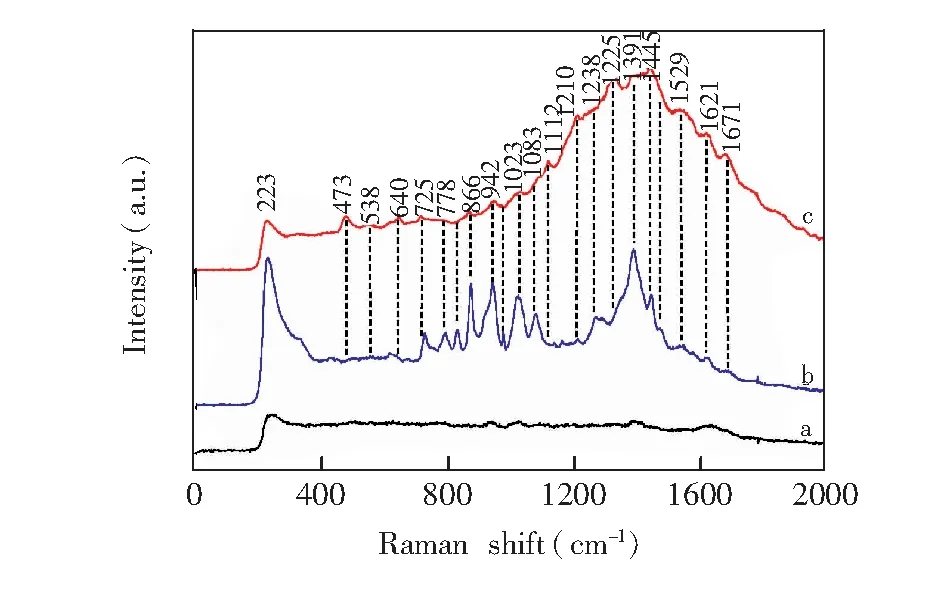
根据Förster偶极-偶极非辐射能量转移理论,由HSA的荧光发射光谱和PTE的吸收光谱的重叠谱图(见图2),采用矩形分割法可求得298 K时PTE与HSA浓度比为1∶1时的重叠积分J=2.008×10(cm3·L)/mol。对于HSA体系,φ=0.118,N=1.336,K2=2/3,可知R0=1.046 nm。而能量转移效率E=0.105,求得r=1.495 nm。由于r<7 nm且0.5R0 3.3结合常数、结合位点数及作用力类型 对于静态猝灭,若生物大分子中有n个相似且独立的结合点位,则可应用Lineweacer-Burk双对数方程[15](lg[(F0-F)/F] =lgKA+nlg[Q])求得PTE与HSA的结合常数KA和结合位点数n。以不同温度下的lg[(F0-F)/F对lg[Q]作图,其曲线的截距即为KA,而斜率即为n,相应的计算结果列于表2。由曲线良好的线性关系及相关系数(r>0.99)可以判断,PTE与HSA之间只有1个键合位,这与计算所得到的结合位点数n≈ 1是一致的。另外,结合常数随着温度的升高而增大,说明高温有利于PTE-HSA复合物生成。结合常数数量级达104以上,表明PTE与HSA间的结合能力较强,在血浆中PTE能够通过HSA运输和储存,PET可在体内持续发挥其药理功效。 表2 PTE与HSA作用的结合常数(KA)、结合位点数(n)和热力学参数 Table 2 Binding constants(KA), number of binding sites(n) and thermodynamic parameters for the interaction of PTE with HSA at different temperatures T(K)KA(L/mol)nrΔH(kJ/mol)ΔG(kJ/mol)ΔS(J/(mol·K))2981.12×1040.840.9982197.23-22.87738.623044.07×1040.950.9989-27.313102.45×1051.120.9920-31.74 小分子与蛋白质间作用力主要包括氢键、范德华力、静电相互作用及疏水作用力四种非共价形式[16]。通常可以根据反应热力学参数焓变(ΔH)和熵变(ΔS)的大小及正负来大致确定作用力的类型,方程如下[8, 13]: ΔG=RTlnKA=ΔH-TΔS (1) lnKA=ΔH/RT+ ΔS/R (2) 图3 PTE与HSA相互作用的Van't Hoff曲线Fig.3 Van't Hoff plot of interaction between HSA and PTE 式中,R为气体常数;KA为不同温度下的结合常数。当温度变化不大时,反应过程的ΔH可以视作常数。以不同温度下的lnKA对1/T作图3,由直线斜率和截距可以获得PTE与HSA结合的ΔH和ΔS,结果见表2。ΔH和ΔS值均为正值,根据文献[17]推断PTE与HSA间主要作用力为疏水作用力。ΔG为负值,说明PTE与HSA作用过程为自由能降低的自发、吸热(ΔH为正值)过程。 3.4结合位置 Sudlow等[18]研究发现,小分子配体在血清白蛋白上至少有3个特异的高亲和药物结合位点,即SiteⅠ、SiteⅡ和SiteⅢ。本研究以保泰松、布洛芬和洋地黄毒苷分别作为HSA的SiteⅠ、 SiteⅡ和SiteⅢ位点标记物,进行了位点竞争结合实验, 通过考察PTE对标记物-HSA复合物体系荧光性质的影响,研究PTE分子在HSA上的结合位点。Sudlow等[18]提出标记物取代百分数的表达式: (3) 式中,F2和F1分别为存在和不存在位点标记物时的荧光强度。以取代百分数对PTE浓度作图,发现随着PTE浓度逐渐增加,洋地黄毒苷-HSA二元体系荧光强度降低幅度较保泰松-HSA、布洛芬-HSA两二元体系更显著。表明PTE取代了洋地黄毒苷与HSA发生结合。另外,对3种位点标记物-HSA二元体系加入PTE后的表观结合常数KA′和结合常数的变化率φ(φ=(KA′-KA)/KA)进行计算。由表3可知,与不存在标记物的PTE-HSA体系相比,洋地黄毒苷的存在对于表观结合常数的影响最大。这再次说明PTE在HSA上的结合位置主要是Site Ⅲ。 表3 位点标记物对PTE与HSA相互作用的表观结合常数的影响 Table 3 Effect of site marker probes on binding constants of PTE-HSA systems MarkerprobeBlankPhenylbutazoneIbuprofenDigitoxinKA′(L/mol)1.12×1049.29×1037.49×1035.48×103φ(%)—-17.05-33.13-51.07 3.5PTE对HSA构象的影响 3.5.1同步荧光光谱同步荧光光谱能提供蛋白质中氨基酸残基周围微环境变化信息,可用于研究药物分子作用对HSA构象的影响。Δλ= 60 nm同步荧光仅表现色氨酸残基的光谱性质; 而Δλ= 15 nm同步荧光仅表现酪氨酸残基的光谱性质[9,19]。随着PET浓度逐渐增加,HSA同步荧光强度均发生明显猝灭(图4)。其中,酪氨酸残基的同步荧光峰位没有发生位移,而色氨酸残基同步荧光峰位红移3 nm,表明PTE的加入使HSA的构象发生了一定程度的改变,令色氨酸残基所处微环境极性增加。即HSA与PTE结合导致其内部的疏水腔有所瓦解,结构变得松散[14]。 图4 PTE-HSA的同步荧光光谱Fig.4 Synchronous fluorescence spectra of PTE-HSA system(A) Δλ=15 nm, (B)Δλ=60 nm. CHSA=1.0 μmol/L, CPTE(a-f): 0, 1.0, 3.0, 5.0, 7.0, 9.0 μmol/L 3.5.2三维荧光光谱通常蛋白质与药物结合后,若其三维荧光光谱中出现荧光峰位置迁移、荧光峰消失或出现新的荧光峰,则可以推测蛋白质的构象、荧光团微环境发生了改变。图5为HSA(A)和PTE-HSA(B)体系的三维荧光等高图。其中,“山脊”形状的峰a为瑞利散射峰(λem=λex),其强度随PTE加入而降低,原因在于血清白蛋白表面结合PTE后,破坏了蛋白质表面的保护水膜,使原来较为分散的蛋白质更加分散,即发生所谓的解聚作用,进而引起蛋白质粒径减小,荧光强度减弱,这与同步荧光光谱的结果一致。另外,HSA具有的两个典型荧光峰1(F=1329.8,λem=285 nm,λex=345 nm)和荧光峰2(F=150.0,λem=230 nm,λex=345 nm),与PTE作用后其复合物的荧光峰1(F=727.0,λem=285 nm,λex=350 nm)和荧光峰2(F=84.0,λem=230 nm,λex=350nm)的荧光强度均发生了降低和荧光峰位置红移5 nm现象,说明PTE的加入导致HSA色氨酸、酪氨酸残基微环境及多肽骨架结构(二级构象)发生了变化。 图5 HSA(A)和PTE-HSA(B)的三维荧光等高光谱Fig.5 Three-dimensional fluorescent contour spectra of (A) HSA and (B) PTE-HSA complex(A) CHSA=1.0 μmol/L, CPTE=0; (B) CHSA=1.0 μmol/L, CPTE=6.0 μmol/L 3.6化学键及对PTE构象影响 由于PTE分子结构,其溶液SERS特征峰振动模式归属对于分析PTE-HSA体系中两者间结合状态非常重要。基于此,文中首先利用密度泛函理论(DFT)获得PTE分子构象和DFT拉曼光谱信息。 3.6.1PTE的分子结构应用DFT的B3LYP方法在6-311++(d,p)[12, 20]水平上对PTE分子几何构型进行优化,获得PTE理论拉曼光谱。优化后的PTE分子结构式如图6所示,PTE分子中除酚羟基的H12′、两个甲基的8个原子C16、H18、H19、H20、C17、H21、H22和H23在平面外,其它27个原子基本位于同一个平面上,无虚频存在,说明优化结构是最稳定的。 3.6.2PTE的理论拉曼光谱、NRS和SERS的振动模式指认图7为PTE理论拉曼光谱(曲线a)、固体粉末的NRS(曲线b)和其在生理pH值银溶胶体系中的SERS(曲线c)。PTE的NRS和SERS峰位与理论计算拉曼光谱基本一致,其主要基团的拉曼峰都存在,只是存在峰位稍有偏移或强度的变化。结合PTE理论拉曼光谱并参考文献[15,21],对PTE分子各振动峰进行归属分析,结果表明,这些谱峰均不同程度由多个振动模式叠加而成,详见表4。 PTE的SERS图谱中,最明显的增强模式位于1393和942 cm附近。其中,1393 cm谱峰对应于A环和B环的14型伸缩振动和乙烯基连接H12、H13的面内摇摆振动。表面选择定则认为[22],垂直于增强基底表面的振动模式能够被显著增强,而平行于增强基底表面的振动模式增强较小。由此可知,PTE的A和B两环及乙烯基连接的两个H原子是垂直于银纳米粒子的表面。另外,942 cm 图6 PTE的最优结构Fig.6 Optimal structure of PTE 谱峰对应于B环的12型面内变形振动和动和C3—O14—C16、C5—O15—C17伸缩振动, 该振动峰在NRS中是一个弱峰,但在SERS中是一个较强峰,这再次表明PTE分子以垂直方式结合于基底表面。而1628和1593 cm两处苯环伸缩振动和 图7 PTE理论拉曼光谱(a)、NRS(b)和SERS(c)的比较Fig.7 Comparison of colloid SERS (a), normal Raman spectrum (b), and DFT spectrum (c) of PTE in Raman shift region of 0-2000 cm1 表4 PTE的实测拉曼特征峰与理论计算值及其归属 Table 4 Band assignments for a calculated Raman, normal Raman and SERS spectra of pterostilbene adsorbed on silver colloid Ramanshift(cm-1)DFTNRSSERSAssignment167716321628v(C7=C8)+v(C=C)8aA,B159315971593v(C=C)8aA+v(C7=C8)+v(C=C)8bB14981507—v(C=C)19aA+ρ(CH3)+v(C=C)19bB145114451445v(C=C)19bA+δ(CH3)140413541393v(C=C)14B+ρ(C7—H12,C8—H13)+v(C=C)14A132613151288v(C=C)14B+ρ(C7—H12,C8—H13)+v(C=C)14A118012041214δ(CCC)12A+v(C1—C7,C3—O14,O15—C17)112011721166v(C8—C1′)+δ(CCC)12B109111461025v(C4′—O11′)+ρ(O11′—H12′)+δ(CCC)1B1022985942v(O14—C16,O15—C17,C1—C7)981959918δ(CCC)12B+v(C3—O14—C16,C5—O15—C17)888862—v(C7—C1)+δ(CCC)6aA+v(C3—O14,C5—O15)831795829γ(C—H)11B+γ(H12—C7=C8—H13)774—791v(C4′—O11′)+δ(CCC)6aB+σ(C8=C7—C1)+v(C3—O14,C5—O15)ν:伸缩振动;δ:面内弯曲振动;γ:面外弯曲振动;σ:剪切;ρ:摇摆.ν:Stretching;δ:in⁃planbending;γ:out⁃ofplanebending;σ:scissoring;ρ:wagging. 图8 HSA (a)、PTE(b)和PTE-HSA(c)的SERS谱图Fig.8 SERS of HSA(a), PTE(b) and PTE-HSA complex (c) on silver colloid substratea-c: HSA∶PTE=0∶1, 1∶0 and 1∶2 3.6.3PTE与HSA作用后的SERS所制备的银溶胶对HSA拉曼振动峰的增强效果很小(图8曲线a)。这是因为HSA为生物大分子,其空间结构复杂、分子量大,导致HSA在不同增强基底上的SERS无论是振动峰位、强度,还是峰与峰的相对强度等方面有一定的差别[24]。制备的银溶胶尽管对PTE分子的拉曼振动峰有增强作用(图8曲线b),但对HSA的增强效果却很小。 PTE溶液的SERS中除了表4中列出的振动类型外,还包含乙醇溶剂分子的拉曼振动峰(866、1023和1083 cm)。PTE溶液与HSA作用后乙醇振动峰的强度明显减弱,溶剂的存在对实验结果分析影响不大。另外,PTE的SERS中还存在甲氧基伸缩振动峰(718 cm),与HSA作用后,此振动峰红移至725 cm,且相对强度降低,这说明PTE以甲氧基团嵌入到HSA的疏水位点中。由能量最低就近原则可知,HSA与PTE进行相互作用时,HSA首先与距离较近的甲氧基团嵌合,但所需能量很低, 不会影响PTE分子的空间取向。PTE与HSA作用后, 1393 cm附近的振动峰减弱,这应是受到与HSA非共价键结合甲氧基团的干扰。而其它振动峰的相对强度和相对位移变化不明显,且信噪比较差,这再次说明上述过程的发生。另外,与HSA作用前后的PTE的SERS中,始终都有伸缩振动峰223 cm的存在,表明PTE虽然以甲氧基团与HSA进行结合,但PTE与HSA作用后仍然通过与银表面进行吸附,该嵌合过程没有影响PTE分子在银纳米粒子上的空间取向,吸附方式仍为倾斜吸附。 本研究采用荧光光谱结合表面增强拉曼光谱法,在模拟人体生理条件下,研究了PTE与HSA的相互作用。阐明PTE对HSA的荧光猝灭机制为静态猝灭并伴随有非辐射能量转移,推断PTE分子以甲氧基通过疏水作用方式与HSA的SiteⅢ进行结合,两者间的结合作用较强,其结合常数为104数量级,结合位点数≈1,结合距离为1.495 nm。与PTE作用引起了HSA构象发生变化,但PTE构象没有显著影响。说明PTE以非共价方式与HSA结合,进而被运输、释放、发挥药理功效。 1 Zhang L, Zhou G Z, Song W, Tan X R, Guo Y Q, Zhou B, Jing H J, Zhao S J, Chen L K.Apoptosis,2012, 17(1): 26-36 2 Kawabori M, Yenari M A.Curr.Med.Chem.,2015, 22(10): 1258-1277 3 Youdim K A, Mcdonald J, Kalt W, Joseph J A.J.Nutr.Biochem.,2002, 13(5): 282-288 4 FENG Ying-Tong, LIU Hong-Gang, PANG Sai-Nan, YANG Yang, YAN Xiao-Long, LI Xiao-Fei.ModernOncology,2015, 23(6): 731-735 冯英同, 刘红岗, 庞赛楠, 杨 阳, 闫小龙, 李小飞. 现代肿瘤医学,2015, 23(6): 731-735 5 Pan M H, Chang Y H, Badmaev V, Nagabhushanam K, Ho C T.J.Agr.FoodChem.,2007, 55(19): 7777-7785 6 Nikhil K, Sharan S, Chakraborty A, Bodipati N, Peddinti R K.Exp.CellRes.,2014, 320(2): 311-328 7 Osborne C K, Schiff R.Annu.Rev.Med.,2011, 62(6): 1-7 8 JIANG Tao, MA Liang, ZHANG Yu-Hao, WANG Jia-Man.ChineseJ.Anal.Chem.,2016, 44(1): 54-60 江涛, 马良, 张宇昊, 王佳曼. 分析化学,2016, 44(1): 54-60 9 CAO Tuan-Wu, ZHOU Kun, HUANG Wen-Bing, SHI Jian-Wei, TAN Xiao-Ping, HUANG Chun-Lin, RAN Yuan.ChineseJ.Anal.Chem.,2017, 45(5): 700-706 曹团武, 周 坤, 黄文兵, 时建伟, 谭晓平, 黄春林, 冉 嫒. 分析化学,2017, 45(5): 700-706 10 WU Qiu-Hua, ZHOU Xin, ZANG Xiao-Huan, WANG Chun, ZHANG Zhi-Heng, WANG Zhi.SpectroscopyandSpectralAnalysis,2009, 29(1): 226-230 吴秋华, 周 欣, 臧晓欢, 王 春, 张志恒, 王 志. 光谱学与光谱分析,2009, 29(1): 226-230 11 Maya S N.J.Photoch.Photobio.B,2015, 149: 658-671 12 Sundaraganesan N, Joshua B D, Settu K.Spectrochim.ActaA,2007, 66(2): 381-388 13 Lee P C, Meisel D.J.Phys.Chem.,1982, 86(17): 3391-3395 14 LEI Hong-Tao, TANG Qiu-Shi, HUANG Wen-Kai, Chen Situ, LIU Ying-Ju, SUN Yuan-Ming.ChineseJ.Anal.Chem.,2012, 40(8): 1231-1235 雷红涛, 唐秋实, 黄文凯, Chen Situ, 刘英菊, 孙远明. 分析化学,2012, 40(8): 1231-1235 15 SHEN Bing-Jun, Jin Li-Hong, ZHANG Jia-Jia, LIU Rong-Juan, LIU Zhan-Wei, LIU Yu-Xin, CHAI Hao, TIAN Jian.ChineseJournalofLuminescence,2016, 37(10): 1259-1266 申炳俊, 金丽虹, 张佳佳, 刘荣娟, 刘占伟, 刘昱鑫, 柴 浩, 田 坚. 发光学报,2016, 37(10): 1259-1266 16 Ye Z W, Ying Y, Yang X L, Zhang Z Q, Shi J N, Sun Y F, Huang P.J.Incl.Phenom.Macrocycl.Chem.,2014, 78: 405-413 17 Ross P D, Subramanian S.Biochemistry,1981, 20(11): 3096-3102 18 Sudlow G, Birkett D J, Wade D N.Mol.Pharmacol,1976, 12(6): 1052-1061 19 GUO Wen-Jing, LIU Xiao-Xia, DENG Fan-Zheng.ChineseJournalofInorganicChemistry,2014, 4(3): 71-74 郭文静, 刘晓侠, 邓凡政. 中国无机分析化学,2014, 4(3): 71-74 20 JIA Ting-Jian, LI Peng-Wei, SHANG Zji-Guo, ZHANG Ling, MO Yu-Jun.JournalofLightScattering,2007, 19(1): 1-5 贾廷见, 李朋伟, 尚治国, 张 玲, 莫育俊. 光散射学报,2007, 19(1): 1-5 21 Alcolea P M.Int.J.QuantumChem.,2000, 77(3): 661-684 22 ZHU Zi-Ying, GU Ren-Ao, LU Tian-Hong.ApplicationofRamanSpectruminChemistry. Northeastern University Press, Shenyang,1998: 262-263 朱自莹, 顾仁敖, 陆天虹. 拉曼光谱在化学中的应用. 沈阳: 东北大学出版社,1998: 262-263 23 HAN Li-Gang, TAO Ya-Ping, LIU Zhao-Jun.JournalofLightScattering,2013, 25(2): 109-115 韩礼刚, 陶亚萍, 刘照军. 光散射学报,2013, 25(2): 109-115 24 Feng M, Tachikawa H.J.Am.Chem.Soc.,2008, 130 (23): 743-744 This work was supported by the National Natural Science Foundation of China (No.21153003). StudyofIntermolecularInteractionsBetweenPterostilbeneandHumanSerumAlbuminbyFluorescenceSpectrometry-SurfaceEnhancedRamanSpectroscopy SHEN Bing-Jun1, JIN Li-Hong*2, LIU Yu-Xin2, CHAI Hao2, LIU Zhan-Wei2, LIU Rong-Juan2, TIAN Jian*1 The binding mechanism between pterostilbene (PTE) and human serum albumin (HSA) was investigated by fluorescence spectrometry and surface enhanced Raman spectroscopy (SERS) under simulated physiological conditions. The experiment result showed that the effect between PTE and HSA was a static fluorescence quenching with Förster′s non-radioactive energy transformation, and PTE could bind HSA strongly with a 1∶1 molar ratio. The binding distances between PTE and HSA was 1.495 nm, and the binding constants (KA) between PTE and HSA were 1.12 × 104(298 K), 4.07 × 104(304 K) and 2.45 ×105L/mol (310 K). SERS revealed that PTE combined with HAS by methoxy group. Thermodynamic data indicated that the interaction between PTE and HSA was mainly hydrophobic interaction. Marker competition experiments pointed out that the primary binding site for PTE was located at site III in HSA. Three-dimensional, synchronous fluorescence spectrum and SERS showed that the conformation of HSA changed apparently with the addition of PTE, resulting in the tryptophan residue of HSA exposing to a less hydrophobic micro-environment. However, the conformation of PTE did not change apparently with the addition of HSA. Pterostilbene; Human serum albumin; Fluorescence; Surface enhanced Raman spectroscopy; Conformation change 29 May 2017; accepted 19 July 2017) 10.11895/j.issn.0253-3820.170341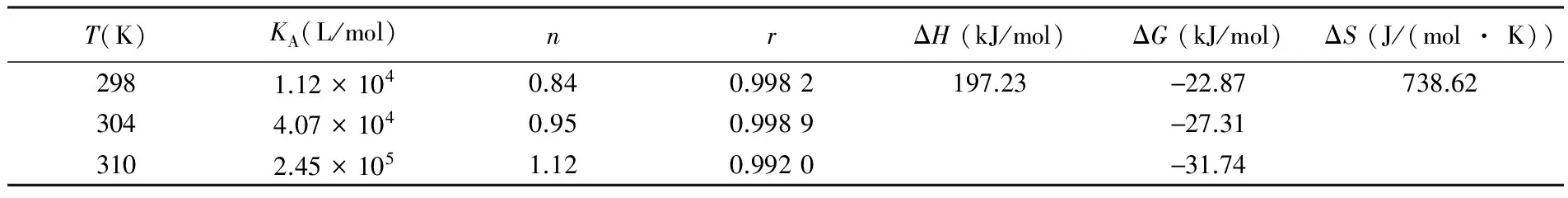
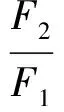





4 结 论
(LaboratoryofCleanEnergyTechnology1,SchoolofLifeScienceandTechnology2,ChangchunUniversityofScienceandTechnology,Changchun130022,China)
