电喷雾离子迁移谱检测氨基酸及多肽的研究
2017-11-06孔景临刘卫卫丁俊杰李宝强秦墨林李海洋
孔景临 刘卫卫 丁俊杰 张 琳 李宝强 秦墨林 陈 创 李海洋
1(防化研究院, 北京 102205) 2(中国科学院大连化学物理研究所, 大连 116023)
研 究 报 告
电喷雾离子迁移谱检测氨基酸及多肽的研究
孔景临*1刘卫卫1丁俊杰1张 琳1李宝强1秦墨林1陈 创2李海洋2
1(防化研究院, 北京 102205)2(中国科学院大连化学物理研究所, 大连 116023)
建立了氨基酸及多肽的电喷雾离子迁移谱检测方法。采用自制的电喷雾离子迁移谱装置,在室温条件下以甲醇为溶剂,空气为漂移气体,流速为1000 mL/min,电喷液流速为2L/min,测试了甘氨酸、胱氨酸、组氨酸、精氨酸4种氨基酸及缓激肽片段 (1~7) 和P物质2种多肽的离子迁移谱,计算出上述化合物的约化迁移率。离子迁移谱图反映出化合物的结构信息,具有指纹谱特征。此装置在1 min的检测时间内对P物质的检测灵敏度达到855 ng/mL。结果表明,电喷雾离子迁移谱可用于氨基酸及多肽类化合物的现场快速鉴定。
电喷雾; 离子迁移谱; 氨基酸; 多肽; 约化迁移率
2017-06-30收稿;2017-09-08接受
* E-mail: jlkong@sina.com
1 引 言
多肽是一类由氨基酸脱水缩合而成的化合物。自然界中多肽种类繁多,参与了生物体的生长、发育、免疫、代谢等多个环节。抗菌肽、生物调节剂以及有毒动植物中的多肽毒素等具有显著的生物活性,是药物开发研究关注的对象。同时,某些多肽(如芋螺毒素、槲寄生毒素)因具有在生化恐怖活动中被使用的风险而被列入美国卫生与公共福利部选择剂清单和澳大利亚集团核心清单[1]。目前,对于多肽类化合物的检测方法主要有高效液相色谱(HPLC)、毛细管电泳(CE)、质谱(MS)以及一些联用技术,如液相色谱-质谱联用(LC-MS)、毛细管电泳-质谱联用(CE-MS)等。这些方法准确可靠,但都依赖大型实验室设备,不满足方便部署、响应快速、使用便捷的现场检测要求,对多肽的现场快速检测是反化学生物恐怖活动中排查各类可疑物质亟需的方法。
离子迁移谱(Ion mobility spectrometry, IMS)因能够在常压条件下工作,且具有探测灵敏度高、分析速度快、能耗低、结构简单、易于小型化等优点,成为侦检化学战剂、爆炸物、毒品等的常用分析手段[2]。目前离子迁移谱仪是军事上部署使用最多的点源化学检测装备[3]。但现有装备主要以放射源(如63Ni)为电离源,不仅存在着使用和处置放射性物质的风险,检测对象也只限于挥发性化合物。受生物质谱的电喷雾电离源技术启发,20世纪90年代初,Hill等[4]研究了电喷雾-离子迁移谱(Electrospray ionization-ion mobility spectrometry, ESI-IMS)的仪器设计及影响分辨率的因素。与质谱相比,除质量电荷信息外,IMS还可提供更加丰富的结构信息,能够分离质荷比相同但空间构型不同的同分异构多肽[5,6],还可由测得的迁移率数据计算气相离子的平均碰撞截面积,推断气相离子的可能构型和电荷分布。目前, ESI-IMS与MS联用成为蛋白质组学以及蛋白质和多肽的结构研究的新手段,用于复杂肽类组分的分离、转译后修饰等研究[7,8]。
ESI-IMS扩大了传统IMS技术检测对象的范围,成为药物[9,10]、毒素[11]、爆炸物[12]等现场快速检测领域的研究热点,国内一些单位使用自制装置或商品化仪器,进行了食品安全、保健品违法添加等方面的研究[13,14],但这些工作的检测对象均为小分子化合物。本研究在自制ESI-IMS实验装置上[15]测试4种氨基酸和P物质、缓激肽片段(Bradykinin fragment(1-7))2种具有重要生理功能的生物调节剂的离子迁移谱行为,发现谱图与化合物结构的相关性,具有指纹谱特征。P物质是被外军系统进行威胁评估的生物调节剂,具有被滥用为躯体或精神失能剂的潜在威胁[16]。氨基酸是多肽的降解产物,对氨基酸的检测可作为使用多肽的溯源性分析佐证。本方法为多肽的现场快速检测提供了途径,也为今后发展此类国产设备奠定了基础。
2 实验部分
2.1试剂
甘氨酸、胱氨酸、组氨酸、精氨酸及缓激肽片段(Bradykinin Fragment (1~7),BF)均购自Sigma公司; 甲醇(色谱纯,Fluka公司); P物质(Substance P, SP)通过Fmoc固相合成的方法制备,购自上海吉尔生化公司,经Agilent 1120高效液相色谱(HPLC)分析及Bruker ultraflex基质辅助激光解吸飞行时间质谱(MALDI-TOF-MS)测定为纯品。
电喷液的配制:准确称取4种氨基酸及2种多肽样品,以甲醇-水(4∶1,V/V)溶解,并配制不同浓度的样品溶液。Bradykinin Fragment (1~7) 及P物质以甲醇溶解,逐级稀释为不同浓度的电喷液。
2.2实验装置与方法
2.2.1实验装置使用本研究组前期工作搭建的ESI-IMS实验装置[15]。实验中电喷液经配有注射器的步进电机推出后,高电压下形成带电液滴,在去溶剂化腔体中形成离子,离子门脉冲作用下进入IMS迁移区进行分离,分离后的离子最终到达法拉第盘被检测。
2.2.2氨基酸及多肽的离子迁移谱测定离子迁移管内气压为环境气压,使用Bradbury-Nielsen型离子门,离子门开门时间设置为200s,离子门关门电压控制为150 V; 迁移管工作温度0~120℃; 漂气流速500~2000 mL/min; 迁移区长度 8.8 cm; 迁移区电场强度为368.75 V/cm; 电喷雾电压3000 V; 喷雾针针尖与对电极之间的距离在0.5~2.0 cm可调。电喷液流速控制在2L/min。离子迁移谱图的扫描时间为40 ms,平均次数为16次,单次检测时间小于1 s。正离子检测模式,采用Origin 8.0软件处理数据。考虑现场使用的实际需要,实验以空气为漂气,迁移管工作温度为室温25℃。参照前期工作中优化的参数[14],设置漂气流速为1000 mL/min,喷雾针针尖与对电极之间的距离为1.0 cm,测试4种氨基酸和2种多肽的离子迁移谱图。
2.2.3约化迁移率的计算在获得迁移时间td等参数的基础上,可以计算化合物的离子迁移率。当一束离子群进入均匀弱电场(E/N2Td)中,通过公式(1)[17]求得离子的约化迁移率K0:
式中,L为迁移区长度,即一种离子群从离子栅门迁移到收集极这段距离(cm)、td为离子群的迁移时间(s)、P和T分别为实验条件下的压力(mm Hg)及温度(K)。
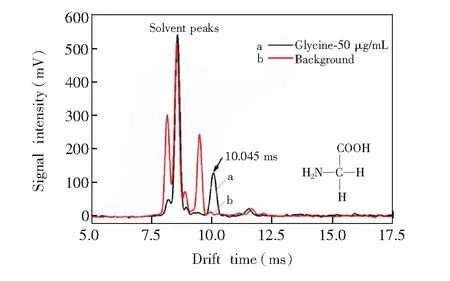
图1 甘氨酸在ESI-IMS中的响应Fig.1 Ion mobility spectra of glycine
3 结果与讨论
3.14种氨基酸的离子迁移谱
3.1.1甘氨酸图1是甘氨酸(Glycine)在自制ESI-IMS装置上的测试结果,其中a,b分别对应50g/mL的甘氨酸溶液、甲醇-水溶剂的离子迁移谱图。由空白对照谱线(图1b)可见,迁移时间td在7.8~9.7 ms之间的峰簇为甲醇-水溶剂峰,即反应离子峰簇(RIP)。谱线a与b相比,溶剂峰强度降低,在10.045 ms处出现离子峰,由甘氨酸分子结构可知,其对应的是氨基被质子化的甘氨酸离子。
3.1.2胱氨酸图2是胱氨酸(Cystine)的测试结果,其中a,b,c分别对应100 和150g/mL的胱氨酸溶液及甲醇-水溶剂的离子迁移谱。与图1相同,图2中的反应峰簇也在td为7.8~9.7 ms之间出现。以谱线c为空白对照,含有胱氨酸的溶液在td为10.76 ms处出现离子峰,此峰强度与浓度正相关,浓度高的样品即谱线b此处的离子峰信号强。此外,在td为12.20 ms处,胱氨酸溶液出现了微弱的信号。由胱氨酸分子结构判断,td为10.76 和12.20 ms的峰分别对应两个氨基均被质子化的带双电荷的胱氨酸离子和一个氨基被质子化的离子。
3.1.3组氨酸图3给出了组氨酸(Histidine)的测试结果,其中a,b,c分别对应320 和32g/mL的组氨酸溶液及甲醇-水溶剂经ESI-IMS测得的谱线。作为空白对照的谱线c同样在迁移时间td为7.8~9.7 ms之间出现反应峰簇。谱线a和b则在td为11.17 ms处出现明显信号,紧邻此峰,td为11.58 ms处还有一个强度弱的离子峰。根据组氨酸结构分析,td为11.17和11.58 ms的峰分别对应氨基和含氮的咪唑环均被质子化的带双电荷组氨酸离子和仅咪唑环被质子化的单电荷组氨酸离子。比较谱线a和b信号峰强度可见,td为11.17 ms对应的离子峰与浓度正相关,浓度高的离子峰信号强。
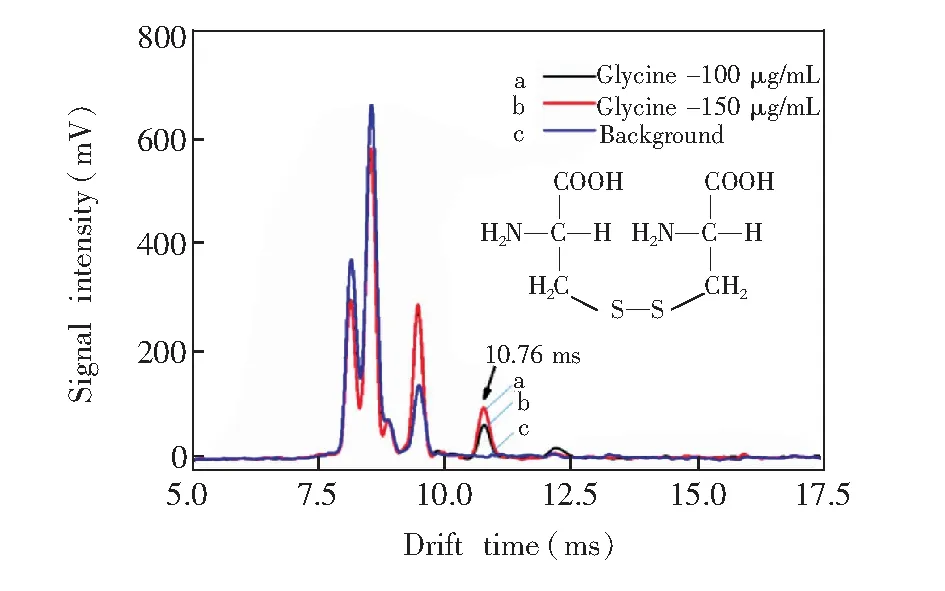
图2 不同浓度胱氨酸在ESI-IMS中的响应Fig.2 Ion mobility spectra of different concentrations of cystine

图3 不同浓度组氨酸在ESI-IMS中的响应Fig.3 Ion mobility spectra of different concentrations of histidine
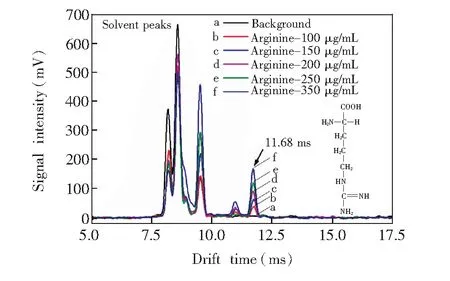
图4 不同浓度精氨酸在ESI-IMS中的响应Fig.4 Ion mobility spectra of different concentrations of arginine
3.1.4精氨酸图4给出了精氨酸(Arginine)的测试结果,其中谱线b、c、d、e和f分别对应100、150、200、250 和350g/mL的精氨酸溶液及甲醇-水溶剂的离子迁移谱。作为空白对照的谱线a在迁移时间td为7.8~9.7 ms之间出现反应峰簇。对比可见,精氨酸溶液经电喷雾离子化后,在10.92及11.68 ms处出现两个离子峰,由其结构可知,这两个峰分别对应的是氨基及胍基均被质子化的带双电荷的精氨酸离子和仅胍基被质子化的单电荷离子。由图4可见,在精氨酸浓度100~350g/mL的范围内增加时, 这两个峰的信号强度随之变强。
由图1~图4可知,结构简单、分子量最小的甘氨酸迁移时间td最短,随着氨基酸分子量的逐渐增加和分子结构的复杂化,td随之变长。在正离子模式下,组氨酸、精氨酸两种碱性氨基酸因其除含有氨基外,还有碱性的侧链R,可以检测到两个离子峰,而由半胱氨酸缩合而成的胱氨酸含有两个氨基,也检测到了两个峰。由此可见,离子迁移谱反映出化合物的结构信息,而这是定性鉴定的基础。
3.2两种多肽的离子迁移谱

图5 不同浓度BF在ESI-IMS中的响应Fig.5 Ion mobility spectra of different concentrations of Bradykinin fragment (1-7) BF
3.2.1Bradykininfragment(1-7)(BF) BF为缓激肽Bradykinin的片段,为其N端的1~7个氨基酸, 序列为Arg-Pro-Pro-Gly-Phe-Ser-Pro,该7肽化合物的分子量为756.85 Da。图5是不同浓度BF的离子迁移谱图。谱线a为不含样品的空白对照,谱线b、c、d、e、f和g分别对应浓度为0.8、4、8、40、80和400g/mL的BF溶液的离子迁移谱图。在正离子检测模式下, BF在迁移时间td为11.94和13.06 ms处有明显的信号。由BF的分子中氨基酸组成可知,其N端1位精氨酸残基的氨基和胍基均可带上正电荷,相应在ESI-IMS谱图上出现了两个谱峰。寡肽BF的骨架刚性,多电荷引起的静电斥力对碰撞截面积的影响不大。因迁移时间与离子带电荷数成反比,根据峰的位置,可知td为11.94 ms的谱峰对应的是带双电荷的BF离子,而13.06 ms对应的则是单电荷离子。由图5可见,双电荷峰与单电荷峰强度之比随着BF的浓度降低而增大直至基本保持不变。这是因为电喷雾过程中产生的反应离子数一定,当BF的浓度高时,电荷转移反应主要生成单电荷离子,而当BF的浓度降低,反应离子数过量时,单电荷离子会进一步与反应离子作用生成双电荷离子,直至反应达到平衡。根据40g/mL BF在13.06 ms处离子峰的强度(50 mV),推测该物质的检出限(LOD)约为3g/mL, 相当于0.004 mmol/L。

图6 不同浓度P物质在ESI-IMS中的响应Fig.6 Ion mobility spectra of different concentrations of Substance P
3.2.2P物质P物质是一种广泛分布于脑神经纤维内的神经肽,属于速激肽家族,其氨基酸序列为Arg-Pro-Lys-Pro-Gln -Gln-Phe-Phe-Gly-Leu-Met,分子量1347.63 Da。图6给出了浓度从ng/mL到g/mL量级的P物质在自制ESI-IMS装置上的响应情况。谱线g为空白对照, a、b、c、d、e、f谱线分别对应浓度为285、142.5、28.5、2.85、1.425和855 ng/mL的P物质甲醇溶液离子迁移谱。在正离子检测模式下, P物质有2个信号峰,对应的迁移时间td分别为13.37和18.24 ms。经电喷雾质谱分析, 前者对应的是双电荷离子峰,后者为单电荷峰。18.24 ms处单电荷峰的强度与P物质的浓度呈正相关,其与13.37 ms处双电荷峰的强度变化与BF的离子迁移谱行为相似,即当P物质浓度高时,离子转移反应以生成单电荷产物为主,浓度降低时,双电荷产物的量高于单电荷。由图6可见, P物质浓度为855 ng/mL时,仍可检出3倍信噪比(S/N)的信号强度,推测该物质的LOD在855 ng/mL的水平,相当于0.63 μmol/L。
综上可知,不同化合物因其分子量、结构、带电荷状态的差异, 反映在离子迁移谱图特征的差异,这些具有指纹谱特征的数据可用于化合物的定性鉴定。同时,自制的离子迁移谱实验装置对不同电荷状态的离子具有优良的分离能力,这对于研究生物大分子结构以及开发国产实验设备具有重要意义。
3.3氨基酸及多肽的约化迁移率
将测得的迁移时间代入式(1),计算4种氨基酸和2种多肽约化迁移率,结果见表1。采用约化迁移率,避免了温度和压力对离子迁移率的影响。在实际应用中,离子迁移谱图中谱峰对应的迁移时间可转化成离子迁移率,它是化合物的特征常数。根据实验结果求出的约化迁移率与标准离子迁移谱数据库对照,可进行化合物快速鉴定。
表1 4种氨基酸及2种多肽的约化迁移率
Table 1 Reduced ion mobility of 4 amino acids and 2 polypeptides
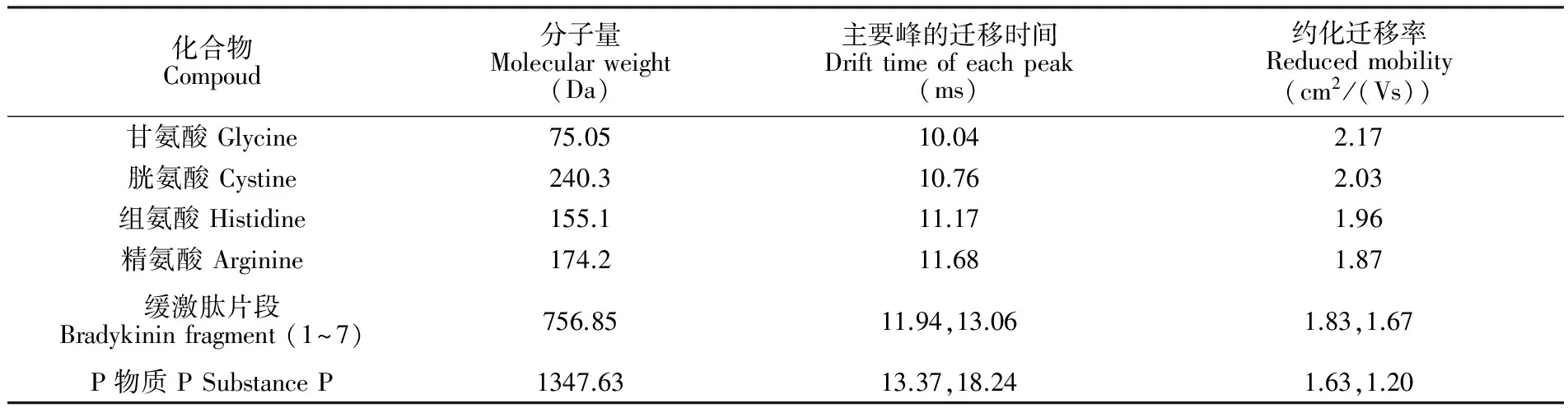
化合物Compoud分子量Molecularweight(Da)主要峰的迁移时间Drifttimeofeachpeak(ms)约化迁移率Reducedmobility(cm2/(Vs))甘氨酸Glycine75.0510.042.17胱氨酸Cystine240.310.762.03组氨酸Histidine155.111.171.96精氨酸Arginine174.211.681.87缓激肽片段Bradykininfragment(1~7)756.8511.94,13.061.83,1.67P物质PSubstanceP1347.6313.37,18.241.63,1.20
4 结 论
离子迁移谱与质谱相似,却没有昂贵的真空部件,经济性好; 与HPLC相比,电喷雾离子迁移谱在测试过程中无有机溶剂消耗,也无需更换色谱柱,基于待测物迁移率差异实现的分离无需方法开发,适用于现场快速检测领域。本实验利用自制的电喷雾离子迁移谱装置研究了6种氨基酸及多肽样品的离子迁移谱行为。在通常条件下,以空气为漂移气体,在十几毫秒时间内完成待测物离子的迁移和分离, 1 min内即可获得检测结果,分析速度快。待测物的迁移时间与其分子量、分子结构及带电荷情况有关,约化迁移率反映的是其固有属性,获得的离子迁移谱具有指纹谱特征,这些可用于离子迁移谱数据库建设,在可疑生物物质的快速筛查中发挥作用。在本研究的基础上,下一步拟将该装置发展为实用的现场快速检测设备,并开展混合物检测方法研究和创建生物大分子离子迁移谱数据库的工作。
1 Ellison H.HandbookofChemicalandBiologicalWarfareAgents, Translated by Institute of Chemical Defense, Beijing: YiWen Publishing Military,2009: 564-579
Ellison H. 化学与生物战剂手册, 防化研究院 译, 第二版, 军事谊文出版社: 564-579
2 JIANG Dan-Dan, PENG Li-Ying, ZHOU Qing-Hua, CHEN Chuang, LIU Ji-Wei, WANG Shuang, LI Hai-Yang.ChineseJ.Anal.Chem.,2016, 44(11): 1671-1678
蒋丹丹, 彭丽英, 周庆华, 陈 创, 刘骥巍, 王 爽, 李海洋. 分析化学,2016, 44(11): 1671-1678
3 Sferopoulos R.AReviewofChemicalWarfareAgentDetectorTechnologiesandCommercial-Off-The-ShelfItems, Translated by LIANG Chi-Yong, XIA Zhi-Qiang, WANG Man-Lin, LI Tie-Hu. Beijing: YiWen Publishing Military,2013: 25-44
Sferopoulos R. 化学毒剂检测器技术与装备评价. 梁赤勇, 夏志强, 王曼琳, 李铁虎 译. 北京: 军事谊文出版社,2013: 25-44
4 Wittmer D, Chen Y H, Luckenbill W K, Hill H H.Anal.Chem.,1994, 66: 2348-2355
5 Shvartsburg A A, Creese A J, Smith R D, Cooper H J.Anal.Chem.,2010, 82: 8327-8334
6 Isenberg S L, Armistead P M, Glish G L.J.Am.Soc.MassSpectrom.,2014, 25: 1592-1599
7 Young L M, Saunders J C, Mahood R A, Revill C H, Foster R J, Ashcroft A E, Radford S E.Methods,2016, 95: 62-69
8 Shvartsburg A A, Creese A J, Smith R D, Cooper H J.Anal.Chem.,2011, 83: 6918-6923
9 Jafari M T, Rezaei B, Javaheri M.FoodChem.,2011, 126: 1964-1970
10 Midey A J, Patel A, Moraff C, Krueger C A, Wu C.Talanta,2013, 116(22):77-83
11 Sheibani A, Tabrizchi M, Ghaziaskar H S.Talanta,2008, 75: 233-238
12 Hilton C K, Krueger C A, Midey A J, Osgood M, Wu J.Inter.J.MassSpectrom.,2010, 298(1) : 64-71
13 LIU Wen-Jie, LI Guo-Zhu, LUO Bi, MENG Qin-Yan, LU Ya-Ling, YIN Du-Ling.ChineseJ.Anal.Chem.,2015, 43(5): 788-793
刘文杰, 李国柱, 罗 碧, 孟庆艳, 卢亚玲, 尹笃林. 分析化学,2015, 43(5): 788-793
14 ZHANG Zhi-Gang, FANG En-Hua, HAO Yu-Lei, ZHU Jun.J.FoodSafetyQuality,2015, 6(6): 1-7
张志刚, 方恩华, 郝玉蕾, 朱 军. 食品安全质量检测学报,2015, 6(6): 1-7
15 CHEN Chuang, WANG Wei-Guo, LIANG Qian-Qian, ZHOU Qing-Hua, PENG Li-Ying, WEN Meng, JU Bang-Yu, ZHAO Kun, LIU Jun, LI Hai-Yang,ChineseJ.Chromatogr.,2013, 31(4): 386-391
陈 创, 王卫国, 梁茜茜, 周庆华, 彭丽英, 温 萌, 鞠帮玉, 赵 琨, 刘 军, 李海洋. 色谱,2013, 31(4): 386-391
16 LIN Fu-Sheng, ZHONG Ming-Nai, PEI Cheng-Xin, LUO Qing-Cong, ZHANG Shou-Lan, CHEN Chang-Ying, DU Xiu-Bao, LEI Guang-Qing, FAN Chong-Xu.J.HealthToxicol.,2001, 15(3): 5-8
林福生, 钟明鼐, 裴承新, 罗庆聪, 张守兰, 陈常英, 杜秀宝, 雷光清, 范崇旭. 卫生毒理学杂志,2001, 15(3): 5-8
17 Eiceman G A, Karpas Z.IonMobilitySpectrometry. Translated by GUO Cheng-Hai, CAO Shu-Ya, Beijing: National Defense Industry Press,2010: 238-250
Eiceman G A, Karpas Z. 离子迁移谱. 郭成海, 曹树亚 译. 北京:国防工业出版社,2010: 238-250
DetectionofAminoAcidsandPolypeptidesbyElectrosprayIonization-IonMobilitySpectrometry
KONG Jing-Lin*1, LIU Wei-Wei1, DING Jun-Jie1, ZHANG Lin1, LI Bao-Qiang1, QIN Mo-Lin1, CHEN Chuang2, LI Hai-Yang2
1(InstituteofChemicalDefense,Beijing102205,China)2(DalianInstituteofChemicalPhysicsChineseAcademyofSciences,Dalian116023,China)
The electrospray ionization-ion mobility spectrometric (ESI-IMS) technique has the potential as an analytical separation tool in analyzing polypeptides and amino acids for fast screening unknown samples in anti-chemical and biological terror attacks. A method for detecting several polypeptides and amino acids was developed based on ESI-IMS using air as drift gas at room temperature. The ion mobility of four amino acids and two polypeptides dissolved in methanol was determined on the system at elution rate of 2L/min. The spectra of these compounds had characteristics of finger-printing maps. The limit of detection of this instrument for Substance P could reach 855 ng/mL in 1 min. The results showed that a small, self-contained ESI-IMS instrument with reservoirs of air could be used to quickly detect and accurately identify polypeptides and amino acids.
Electrospray; Ion mobility spectrometry; Amino acid; Polypeptide; Reduced mobility
30 June 2017; accepted 8 September 2017)
10.11895/j.issn.0253-3820.171052
