间歇热处理对鲜切甘薯贮藏品质的影响
2017-11-03闫凯亚张洪翠蔡佳昂王静雯张敏
闫凯亚,张洪翠,蔡佳昂,王静雯,张敏*
1(西南大学 食品科学学院,重庆,400715) 2(农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆,400715) 3(重庆市特色食品工程技术研究中心,重庆,400715)
间歇热处理对鲜切甘薯贮藏品质的影响
闫凯亚1,2,3,张洪翠1,2,3,蔡佳昂1,2,3,王静雯1,2,3,张敏1,2,3*
1(西南大学 食品科学学院,重庆,400715) 2(农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆,400715) 3(重庆市特色食品工程技术研究中心,重庆,400715)
为研究间歇热处理对鲜切甘薯贮藏品质的影响,分别对鲜切甘薯进行间歇热处理(48 ℃/100 s+20 ℃/120 s+48 ℃/100 s+20 ℃/120 s+48 ℃/100 s+20 ℃/120 s)和连续热处理(48 ℃/5 min),室温下晾干水分后用聚乙烯包装袋包装,10片为一袋,包装后放入4 ℃、RH 90%~95%环境中贮藏,研究贮藏过程中甘薯的品质变化规律。结果表明,贮藏至第12天,与对照组相比,连续热处理组具有更小的色差、失重率和冷害指数,连续热处理组超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase,CAT)活性分别是对照组的1.35、1.22、1.23倍,差异显著(p<0.05),表明连续热处理组能够减轻冷害提高贮藏品质。间歇热处理组色差和丙二醛含量分别为连续热处理组的70.37%和66.37%,SOD、POD、CAT活性分别为连续热处理组的1.21、1.27、1.29倍,差异显著(p<0.05)。因此,间歇热处理对鲜切甘薯的保鲜效果优于连续热处理组。
鲜切甘薯;间歇热处理;贮藏品质;冷害;抗氧化酶活性
甘薯富含淀粉、膳食纤维、可溶性糖、维生素等,是一种营养均衡的食品,也是我国重要的粮食作物之一。鲜切甘薯具有清洁卫生、食用方便、品质新鲜等优点,然而,甘薯切割后呼吸消耗加剧,代谢反应增强,营养品质迅速下降,切割面易受微生物的侵害而腐败。低温冷藏能够控制鲜切甘薯的生理生化变化,提高贮藏品质,是极为有效的贮藏方法之一,但鲜切甘薯冷藏过程中容易发生冷害,主要表现为表面变暗、凹陷,呈水渍状软烂,造成鲜切甘薯品质劣变,失去商品价值[1]。因此,鲜切甘薯急需能够控制其冷害发生的保鲜技术。热处理作为一种安全有效的物理保鲜技术,能够减轻果蔬低温贮藏过程中的冷害。研究表明,热处理能提高猕猴桃的抗冷性[2],有效提升黄花梨的活性氧清除能力[3],诱导番茄抗氧化酶活性上升,减轻其冷害的发生[4]。杨虎清等[5]的研究表明,热处理能减少低温对甘薯细胞膜的伤害,抑制甘薯总抗氧化能力的下降,提高贮藏品质。
间歇热处理是热处理过程中多次用常温水回温,该过程可以使果蔬体内发生多次温度变化,有助于应激效应的产生和积累,也能中断热应力的积累,避免热损伤的发生。研究发现,间歇热处理能提高黄瓜[6]、血橙[7]等的抗氧化酶活性,具有更好的保鲜效果。间歇热处理诱导的更强烈的应激效应能否更加有效地提升冷藏条件下鲜切甘薯的抗氧化水平,提高抗冷性,取得更好的保鲜效果,目前为止还未见报道。本文以鲜切甘薯为试材,分别对其进行连续热处理和间歇热处理,研究鲜切甘薯在贮藏过程中的低温冷害和抗氧化酶活性变化。
1 材料与方法
1.1材料与试剂
供试甘薯:黄肉,购于重庆市北碚菜市场;包装材料:聚乙烯包装袋,20 cm×30 cm,双面厚60 μm,石家庄市长安区网诺包装材料;KI、聚乙烯吡咯烷酮、甲醇、邻苯二酚、EDTA:分析纯,成都市科龙化工试剂厂;苯丙氨酸、二硫苏糖醇、L-蛋氨酸、核黄素:生化试剂,成都市科龙化工试剂厂。
1.2仪器与设备
台式高速冷冻离心机(H1650R型),长沙湘仪离心机仪器有限公司;测色仪(UltraScan® PRO型),美国Hunter Lab 公司;紫外分光光度计(UV-2450PC型),日本岛津公司。
1.3实验方法
1.3.1 样品处理方法
选取大小一致,无病虫害、无机械损伤的甘薯块根作为实验材料,用清水洗净晾干,切成厚度约5 mm,直径50~60 mm的甘薯薄片,随机分为3组:CK组(室温清水浸泡5 min)、连续热处理组(48 ℃热水浸泡5 min)、间歇热处理组(48 ℃/100 s+20 ℃/120 s+48 ℃/100 s+20 ℃/120 s+48 ℃/100 s+20 ℃/120 s)。间歇热处理组48 ℃热水浸泡总有效时间为5 min,进行回温处理的时间是根据甘薯切片的中心温度达到20 ℃所需要的时间。将处理之后的鲜切甘薯片放于室温下冷却晾干后用聚乙烯包装袋进行包装,10片为一袋,包装后放入4 ℃、RH 90%~95%环境中贮藏12 d,每3 d测定相关指标变化,每次测量用3袋甘薯,取样重复3次。
1.3.2 色差测定
根据CIEL*a*b*颜色标准,采用UltraScan© PRO 色差仪于室温下测量甘薯切片的L*、a*、b*值,每片取3个部位测量,每次测量取10片。用ΔE表示甘薯的色差,色差采用式(1)进行计算:
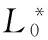
(1)

1.3.3 失重率测定
(2)
1.3.4 冷害指数
冷害的典型症状是鲜切甘薯表面出现水溃状斑点、凹陷,随后软化、腐烂。参考杨虎清等[5]的方法,按切片冷害发生面积大小将甘薯划分为5级:0 级,无冷害发生;1 级,冷害发生面积<25%;2级,冷害发生面积25%~50%;3 级,冷害发生面积51%~75%; 4级,冷害发生面积>75%。甘薯的冷害指数采用(3)式进行计算:
(3)
1.3.5 电导率的测定
参考曹建康的方法[8],用打孔器在甘薯切片横截面上取直径5 mm的圆片,取12片(重约1.0 g)清洗3次后置于100 mL的烧杯中,加蒸馏水 40 mL,25 ℃平衡3 h后,用 DDS-11A 型电导仪测定电导率P1,沸水浴10 min,冷却至室温后测定电导率P2。电导率采用式(4)进行计算:
(4)
1.3.6 MDA含量的测定
采用硫代巴比妥酸法[9]。取1.0 g甘薯组织样品,加入100 g/L 三氯乙酸5 mL,在冰浴中研磨成浆,于4 ℃、12 000 r/min离心20 min。取2 mL上清液,加入2 mL 0.67%硫代巴比妥酸,混匀后于沸水浴中煮沸20 min,取出快速冷却后再离心一次。测定上清液在450、532、600 nm处的吸光度值。MDA的含量根据式(5)、(6)进行计算
MDA浓度(c)/(μmol·L-1)=6.45×(OD532-OD600)-0.56×OD450
(5)
MDA含量/(μmol·g-1)=
(6)
1.3.7 SOD和CAT的提取及活性测定
酶液提取:取1.0 g鲜切甘薯组织于研砵中,加5 mL提取缓冲液(5 mmol/L DTT、5% PVP和pH 7.8 磷酸钠缓冲液),在冰浴中研磨成浆。于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提液。4℃低温保存备用。
选取我院2017年2月~2018年2月收治急性脑梗死合并心肌缺血患者60例,入组后利用随机分组的形式将其分为对照组与实验组。对照组30例,男16例,女14例,年龄62~74岁,平均(68.0±8.5)岁;实验组30例,男18例,女12例,年龄62~76岁,平均(69.0±8.7)岁。将两组患者研究资料纳入统计学软件中进行分析,差异无统计学意义(P>0.05)。
SOD活性测定:参考ZHANG 等[4]的方法。取5支试管,依次加入50 mmol/L pH 7.5磷酸缓冲液1.7 mL、130 mmol/L MET溶液0.3 mL、750 μmol/L NBT溶液0.3 mL、100 μmol/L EDTA-Na2溶液0.3 mL、20 μmol/L核黄素溶液0.1 mL和酶提取液0.1 mL(2支对照管中加入提取缓冲液)。混匀后将一支对照管置于暗处,其他各管置于30 W日光灯下反应15 min后立即置于暗处终止反应。以不照光管为空白参比,于560nm波长处分别测定其他各管的吸光度值。每克果蔬样品每分钟对光氧化还原的抑制50%为1个SOD活性单位。
CAT活性测定:参考BASSAL等[10]的方法。向试管中加入20 mmol/L H2O2溶液2.9 mL和酶提取液100 μL。以蒸馏水为参比空白,在波长240 nm处测吸光度值,以每克果蔬样品每分钟吸光度变化值减少 0.01为1个CAT酶活性单位。
1.3.8 POD的提取及活性测定
参考LEI等[11]的方法。取1.0 g鲜切甘薯组织于研砵中,加5 mL提取缓冲液(1 mmol PEG、4% PVPP 和1% Triton X-100),在冰浴中研磨成浆。于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提液。向试管中加入25 mmol/L愈创木酚溶液3.0 mL、酶提取液0.05 mL和0.02 mol/L H2O2溶液0.2 mL。以蒸馏水为参比,在波长420 nm处测吸光度值,以每克果蔬样品在470 nm处每秒钟吸光度变化值增加0.01为一个PPO活性单位。
1.4数据处理
采用SPSS 17.0软件对数据进行单因素方差分析及Duncan多重比较,显著性水平为0.05。利用Origin 7.5软件进行绘图分析。
2 结果与分析
2.1间歇热处理对鲜切甘薯色差的影响
色差反应甘薯色泽变化,是重要的感官品质指标。如图1所示,在贮藏过程中各处理组色差变化均呈上升趋势,这是因为鲜切甘薯中的多酚氧化酶将酚类物质氧化为褐色的醌类物质,使甘薯颜色变暗。在第12天,同对照组相比,间歇热处理组和连续热处理组的色差显著较低(p<0.05),说明间歇热处理与连续热处理均能显著减少鲜切甘薯的色差;而间歇热处理组色差显著(p<0.05)小于连续热处理组,说明间歇热处理相比于连续热处理能更好地保持鲜切甘薯的颜色。
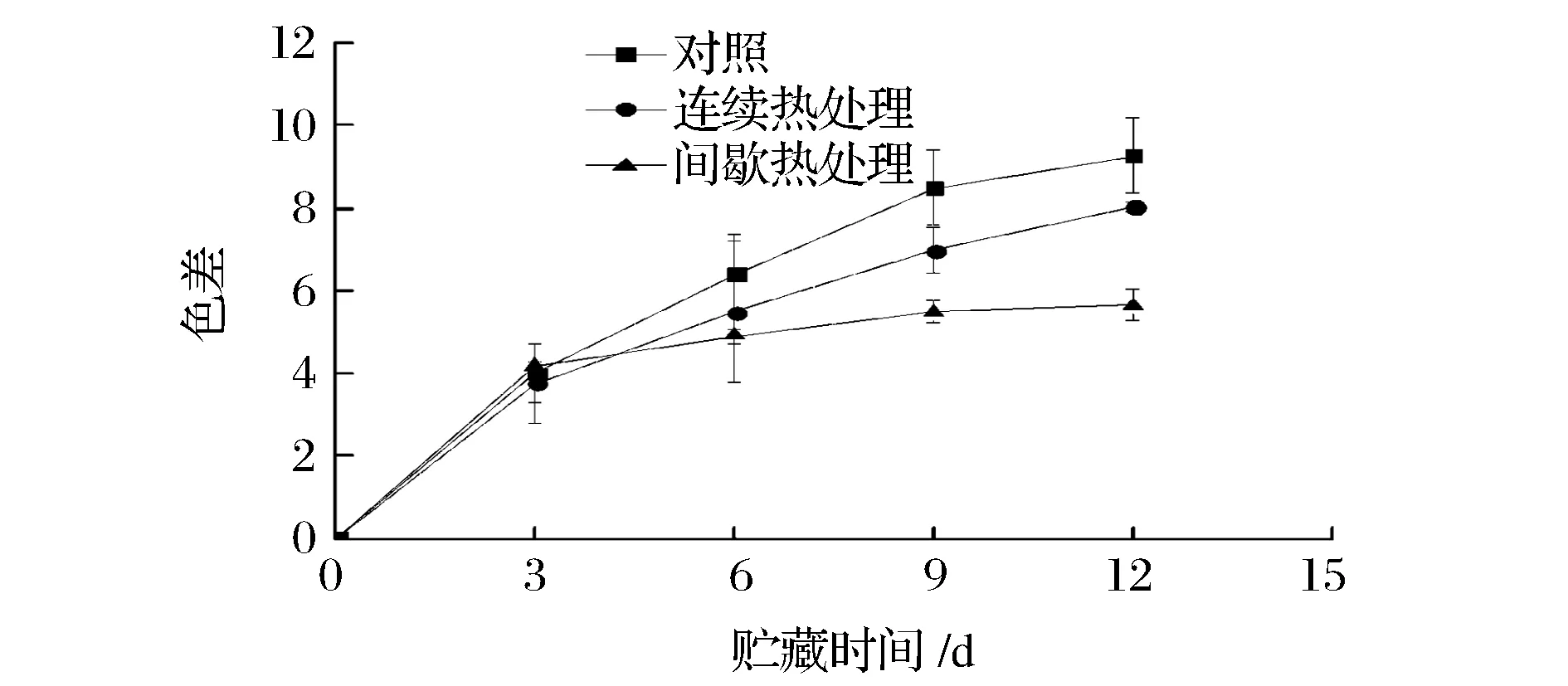
图1 间歇热处理对鲜切甘薯色差的影响Fig.1 Effect ofintermittent heat treatment on color difference of fresh-cut sweet potato
2.2间歇热处理对鲜切甘薯失重率的影响
失重率是鲜切甘薯贮藏过程中的品质指标,如图2所示,在贮藏过程中各处理组失重率均呈上升趋势。贮藏过程中的失重通常是由蒸腾作用和呼吸作用引起的,鲜切甘薯缺乏外周皮的保护,极易失水失重[12]。在整个贮藏过程中,间歇热处理和连续热处理均能有效减少(p<0.05)甘薯失重率,在第3天、第6天和第12天,间歇热处理组的失重率要显著(p<0.05)小于连续热处理组。贮藏至第12天,对照组、连续热处理组失重率分别为间歇热处理组的1.64和1.24倍。结果说明虽然连续热处理和间歇热处理都能显著降低鲜切甘薯的失重率,提高其商品品质,但间歇热处理比连续热处理效果更好。

图2 间歇热处理对鲜切甘薯失重率的影响Fig.2 Effect of intermittent heat treatment on weight loss of fresh-cut sweet potato
2.3间歇热处理对鲜切甘薯冷害指数的影响
如图3所示,对照组甘薯切片在第6天开始出现冷害症状,连续热处理于第9天开始出现冷害,且在第9天和第12天连续热处理组冷害指数显著(p<0.05)低于对照组。贮藏至第12天,间歇热处理组甘薯出现轻微冷害,但其冷害指数仅为连续热处理组甘薯22.22%,显著低于(p<0.05)连续热处理组,极显著地(p<0.01)低于对照组。连续热处理能有效减轻鲜切甘薯冷害症状,而间歇热处理能取得更好效果。

图3 间歇热处理对鲜切甘薯冷害指数的影响Fig.3 Effect of intermittent heat treatment on chilling injury index of fresh-cut sweet potato
2.4间歇热处理对鲜切甘薯相对电导率和丙二醛的影响
如图4所示,在贮藏过程中各处理组相对电导率均呈上升趋势。在整个贮藏过程中,连续热处理组鲜切甘薯的相对电导率均低于对照组,从第6天开始,这种差异达到显著水平(p<0.05)。在贮藏过程中,间歇热处理组鲜切甘薯的相对电导率均低于连续热处理组,在第6天和第9天,2组电导率差异达到显著水平(p<0.05)。
贮藏过程中各处理组丙二醛含量的变化趋势与相对电导率接近一致。从第6天开始,连续热处理组丙二醛含量显著(p<0.05)低于对照组,间歇热处理组丙二醛含量显著(p<0.05)低于连续热处理组。至第12天,间歇热处理组、连续热处理组和对照组丙二醛含量分别上升为自身初始值的为2.00、3.23、4.32倍,差异极显著(p<0.01)。
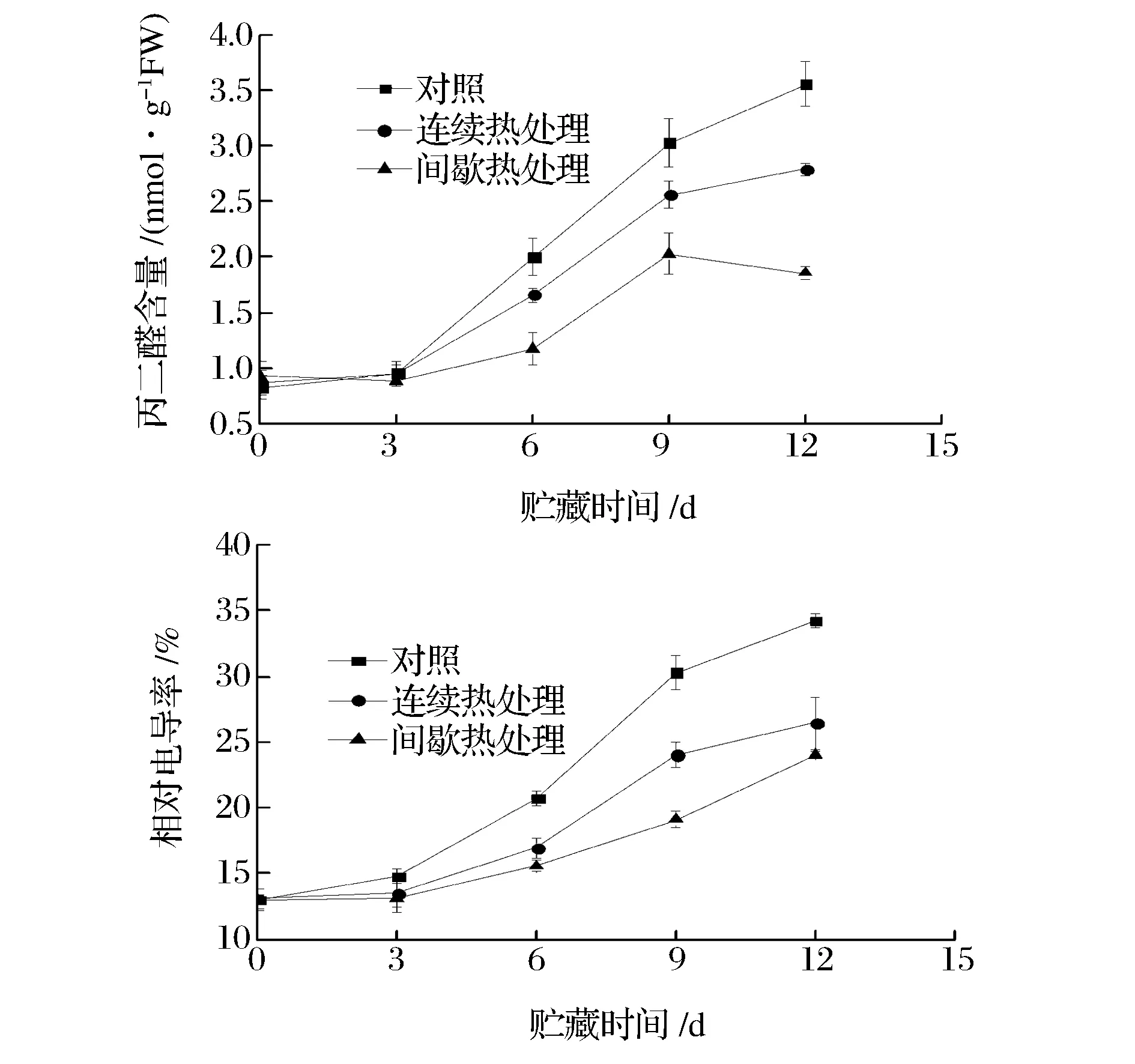
图4 间歇热处理对鲜切甘薯相对电导率和丙二醛含量的影响Fig.4 Effect of intermittent heat treatment on relative conductivity and malondialdehyde of fresh-cut sweet potato
2.5间歇热处理对鲜切甘薯SOD活性、POD活性和CAT活性的的影响
如图5,各处理组SOD活性呈先上升再下降的趋势,前6天贮藏期内各处理组无显著差异,在第9天和第12天,连续热处理组SOD活性显著(p<0.05)低于对照组。贮藏至第12天,间歇热处理组和连续热处理组酶活性分别5.61和4.65 U/g,差异极显著(p<0.01)。
在第3~12天,连续热处理组POD活性显著(p<0.05)高于对照组,间歇热处理组POD活性极显著(p<0.01)高于连续热处理组,3处理组均在第9 d达到各自POD活性的最大值,分别为83.04、59.18、48.00 U/g。
在第6天和第12天,连续热处理组CAT活性显著(p<0.05)高于对照组,间歇热处理组CAT活性显著(p<0.05)高于连续热处理组,贮藏至第12 d,间歇热处理组CAT活性分别为连续热处理组和对照组高1.29和1.59倍。

图5 间歇热处理对鲜切甘薯SOD、POD、CAT酶活性的影响Fig.5 Effect of intermittent heat treatment on SOD,POD and CAT activity of fresh-cut sweet potato
3 讨论

适度的热处理能诱导植物弱氧化应激反应,引起活性氧含量短暂而迅速地积累,这种活性氧信号在增强果蔬寒冷胁迫的耐受性中起关键作用[18]。王静等[19]的研究指出,热处理后的哈密瓜果实发生“氧化迸发”,活性氧信号分子诱发POD 和SOD 等活性氧清除酶活性升高,从而有效促进活性氧自由基降解,减轻冷害。本研究结果表明,连续热处理组鲜切甘薯的SOD、POD、 CAT等抗氧化酶活性增强,活性氧自由基的清除能力提高,冷害症状减轻。这与热处理能提高番木瓜[20]、茄子等果实的抗氧化酶活性,减轻冷害发生的结果一致。ZHANG等[21]认为,热处理使黄瓜内部组织产生的温度差异是黄瓜产生应激反应的根本原因,间歇热处理能诱导黄瓜SOD、POD、CAT活性的提高,取得更好的保鲜效果,可能是因为间歇热处理诱发产生了不断的短时叠加的应激反应,也可能是间歇热处理条件下果蔬内部组织能产生更大的温度梯度和更为剧烈的温度变化,促使更为强烈的应激反应。本试验中,间歇热处理比连续热处理更好地维持了鲜切甘薯的抗氧化酶活性,提高抗冷性,可能是因为间歇热处理不断的短时叠加的温度变化诱导了不断的短时叠加的“氧化迸发”效应或者较快的温度变化诱导了更为显著的“氧化迸发”效应,相关假设仍需进一步验证。这种“氧化迸发”效应促使更为强烈活性氧信号分子产生,诱发了甘薯组织内部更高的抗氧化酶活性,增强了抗冷性,减轻冷害的发生。
本试验表明,采用间歇热处理的方式处理鲜切甘薯,可以有效增强抗氧化活性,减轻冷害发生,使其冷害指数仅为连续热处理组的22.22%,对照组的10.53%,提高了鲜切甘薯的贮藏品质,该结论在对冷敏型果蔬低温贮藏方面具有较大的应用前景。
[1] 路茜玉,熊易强.甘薯贮藏期间的冷害研究[J].郑州粮食学院学报,1980(1):55-60.
[2] MA Q,SUO J,HUBER D ,et al.Effect of hot water treatments on chilling injury and expression of a new C-repeat binding factor (CBF) in 'Hongyang' kiwifruit during low temperature storage[J].Postharvest Biol Tec,2014,97:102-110.
[3] 千春录,何志平,林菊,等.热处理对黄花梨冷藏品质和活性氧代谢的影响[J].食品科学,2013,34(2):303-306.
[4] ZHANG X H,SHEN L,LI F J,et al.Arginase induction by heat treatment contributes to amelioration of chilling injury and activation of antioxidant enzymes in tomato fruit[J].Postharvest Biol Tec,2013,79:1-8.
[5] 杨虎清,赵晓飞,黄程前,等.不同处理方式对甘薯冷害和抗氧化代谢影响分析[J].核农学报,2014,28(8):1 407-1 412.
[6] 张娜,杨昭,陈爱强,等.间歇热处理抑制热伤害提高黄瓜贮藏品质[J].农业工程学报,2014,30(9):256-261.
[7] 程玉娇,秦文霞,赵霞,等.间歇热处理对血橙变温物流保鲜品质的影响[J].食品与发酵工业,2016,42(10):196-203.
[8] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:152-154.
[9] 潘显辉,杨永利,郭守军,等.丁香、艾叶提取物与长角豆胶复合涂膜保鲜剂对番荔枝的耐藏性影响[J].食品与发酵工业,2010,36(3):207-212.
[10] BASSAL M,EL-HAMAHMY M.Hot water dip and preconditioning treatments to reduce chilling injury and maintain postharvest quality of Navel and Valencia oranges during cold quarantine[J].Postharvest Biol Tec,2011,60(3):186-191.
[11] WANG L,JIN P,WANG J,et al.Hot air treatment induces resistance against blue mold decay caused by Penicillium expansum in sweet cherry (PrunuscerasusL.) fruit[J].Scientia Horticulturae,2015,189(3):74-80.
[12] 秦晓艺,王杰,李丹青,等.不同采收期与采后处理方法对杏鲍菇贮藏品质的影响[J].食品与发酵工业,2007,41(3):118-23.
[13] LYONS J M.CHILLING INJURY IN PLANTS[J].Annual Review of Plant Physiology and Plant Molecular Biology,1973,24:445-466.
[14] BOLWELL G P,WOJTASZEK P.Mechanisms for the generation of reactive oxygen species in plant defence-a broad perspective[J].Physiological and Molecular Plant Pathology,1997,51(6):347-366.
[15] PURVIS A C,SHEWFELT L.Does the alternative pathway ameliorate chilling injury in sensitive plant-tissues[J].Physiologia Plantarum,1993,88(4):712-718.
[16] PARKIN K L,MARANGONI A,JACKMAN R L,et al.Chilling injury-a review of possible mechanisms[J].Journal of Food Biochemistry,1989,13(2):127-153.
[17] 林婕,王则金,林震山,等.冷激处理对甘薯冷害及活性氧代谢的影响[J].粮食与饲料工业,2016(9):12-16.
[18] LI M H.Peroxidase and superoxide dismutase activities in fig leaves in response to ambient air pollution in a subtropical city[J].Archives of Environmental Contamination and Toxicology,2003,45(2):168-176.
[19] 王静,茅林春,李学文,等.热处理降低哈密瓜果实活性氧代谢减轻冷害[J].农业工程学报,2016,32(2):280-286.
[20] SHADMANI N,AHMAD S H,SAARI N,et al.Chilling injury incidence and antioxidant enzyme activities of Carica papaya L.'Frangi' as influenced by postharvest hot water treatment and storage temperature[J].Postharvest Biol Tec,2015,99:114-119.
[21] ZHANG N,YANG Z,CHEN A G,et al.Effects of intermittent heat treatment on sensory quality and antioxidant enzymes of cucumber[J].Scientia Horticulturae,2014,170(3):39-44.
Effectsofintermittentheattreatmentonthestoragequalityoffresh-cutsweetpotato
YAN Kai-ya1,2,3,ZHANG Hong-cui1,2,3,CAI Jia-ang1,2,3, WANG Jing-wen1,2,3,ZHANG Min1,2,3*
1(College of Food Science,Southwest University,Chongqing 400715,China) 2(Mimnistry of Agriculture,Chongqing Special Food Programme and Technology Research Center,Chongqing 400715,China) 3(Laboratory of Quality & Safety Risk Assessment for Argo-products on Storage and Preservation(Chongqing),Chongqing 400715,China)
Effects of intermittent heat treatment on the storage quality of fresh-cut sweet potato were investigated by treating fresh-cut sweet potatoes with continuous heat treatment (48 ℃/5 min)or intermittent heat treatment (48 ℃/100 s+20 ℃/120 s+48 ℃/100 s+20 ℃/120 s+48 ℃/100 s+20 ℃/120 s). After drying at room temperature and packaged with Polyethylene bags with 10 slices in each bag. The sweet potato was then stored at 4 ℃, RH 90%-95%. The quality of fresh-cut sweet potato was tested during storage. After 12 days of storage, compared with the contral group, the color difference, weight loss and chilling injury index of sweet potato with continuous heat treatment group were lower than those with intermittent heat treatment group. Superoxide Dismutase activity(SOD), POD activity(POD)and CAT activity(CAT)of sweet potato in continuous heat treatment group were 1.35, 1.22 and 1.23 times higher than those control group respectively. The differences are significant(p<0.05). The results show that continuous heat treatment can lighten chilling injury and keep storage quality. Compared with sweet potatoes in continuous heat treatment group, color differences and Malondialdehyde content of those in intermittent heat treatment group descend to 70.37% and 66.37%, respectively. SOD activity, POD activity and CAT activity of sweet potato in intermittent heat treatment group are 1.21, 1.27 and 1.29 times higher than those in continuous heat treatment group, respectively and the difference is significant(p<0.05). These results indicate that intermittent heat treatment is better than continuous heat treatment in improving preservation quality of fresh-cut sweet potato.
fresh-cut sweet potato; intermittent heat treatment; storage quality; chilling injury;antioxidant enzyme activity
本科生(张敏副教授为通讯作者,E-mail:zmqx123@163.com)。
重庆社会事业与民生保障科技创新专项(cstc2015shms-ztzx80010)
2017-02-21,改回日期:2017-04-10
10.13995/j.cnki.11-1802/ts.014097
