薏米贮藏过程中异味产生的机理
2017-11-03陈光静冉春霞夏季阚建全
陈光静,冉春霞,夏季,阚建全*
1(西南大学 食品科学学院,重庆,400715) 2(农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆,400715) 3(重庆三峡医药高等专科学校 医学技术系,重庆,404020)
薏米贮藏过程中异味产生的机理
陈光静1,2,冉春霞3,夏季1,阚建全1,2*
1(西南大学 食品科学学院,重庆,400715) 2(农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆,400715) 3(重庆三峡医药高等专科学校 医学技术系,重庆,404020)
以薏米为原料,研究了薏米贮藏过程中脂肪含量、脂肪酸值、脂肪酸组成、常见氧化指标(过氧化值、茴香胺值、总氧化值、丙二醛含量)和醛类化合物的变化情况,并分析了薏米的异味变化与上述指标的关系。研究结果表明:随着薏米贮藏时间的延长,薏米的脂肪含量和不饱和脂肪酸相对含量均显著降低,脂肪酸值、饱和脂肪酸相对含量、过氧化值、茴香胺值、总氧化值、丙二醛含量均显著增加,醛类的“相对内标含量”也显著增加。薏米贮藏过程中其总氧化值、丙二醛含量和挥发性醛类化合物含量与薏米的异味程度间呈显著正相关(p<0.01),不饱和脂肪酸含量与薏米异味程度间呈显著的负相关(p<0.01)。说明薏米贮藏过程中异味主要是由于薏米油脂氧化产生的,薏米油脂的二级氧化产物醛类化合物为薏米贮藏过程中产生异味的主要原因。
薏米;异味;机理;油脂氧化
薏米(Coixlachryma-jobiL. var. ma-yuen Stapf)又名薏仁、薏苡仁、六谷子等,是禾本科玉蜀黍族薏苡属植物薏苡的种仁,其营养价值丰富且兼具药理作用,具有抗氧化[1-2]、抗炎症[3]、抗癌[4]、抗肿瘤[5-6]、降血糖[7]和止痛[8]等功效,深受消费者喜爱。但长期以来,薏米作为小品种杂粮作物,并未得到充分的利用和开发。与我国传统主粮相比,薏米在贮藏过程中其品质易发生劣变,产生让人不愉快的异味,降低了薏米的食用品质和商品价值。因此,探究薏米异味产生的机理进而找到控制薏米产生异味物质的措施,对提高薏米的品质、促进薏米的利用和开发具有重要的现实意义。
本课题组在前期实验中采用顶空-固相微萃取-气相色谱-质谱联用结合嗅闻法(HS-SPME-GC-O-MS)对异味薏米中异味成分进行分析发现,薏米的异味主要是醛类化合物共同作用的结果。从现有的资料报道可知,食品原料贮藏过程中油脂的氧化会产生氢过氧化物,氢过氧化物再次分解会产生醛类化合物等次级氧化产物[9]。薏米属于脂肪含量较高的谷物,其脂肪含量高于大米、小麦、玉米、小米等谷物(分别为1.7%、1.8%、4.3%和3.5%)[9],使得薏米在贮藏过程中可能容易发生油脂氧化。张立庆等[10]在开发薏米饮品时发现薏仁米由于油脂氧化产生哈味,吴传茂等[11]在研制薏苡豆奶、李美玲等[12]在开发Viili薏仁米酸奶时有同样的发现。基于此,本研究推测薏米贮藏过程中产生的异味可能是由于薏米油脂的氧化产生。
为验证此推测,本实验拟研究薏米贮藏过程中脂肪含量、脂肪酸值、脂肪酸组成、过氧化值、茴香胺值、总氧化值、丙二醛含量、醛类化合物含量的变化情况,并分析脂肪氧化相关指标与薏米异味的相关程度,旨在初步探讨薏米贮藏过程中异味产生的机理。
1 材料与方法
1.1材料与试剂
新鲜薏米:购于北碚永辉超市,贮藏于40 ℃培养箱中,每2周取样1次对相关指标进行测定。取样时将薏米样品粉碎,过18目筛备用。
无水乙醚、无水乙醇、NaOH、正己烷、异丙醇、Na2SO4、冰乙酸、异辛烷、KI、Na2S2O3、淀粉、三氯乙酸、NaCl、苯、石油醚(分析纯),成都科龙化工试剂厂;p-茴香胺(分析纯),上海泰坦科技股份有限公司;2-硫代巴比妥酸(生化试剂),上海科丰实业有限公司;三氟化硼-甲醇(分析纯),德国CNW科技公司;正癸烷;(99.9%,内标),美国Sigma-Aldrich公司。
1.2仪器与设备
固相微萃取装置(配有50/30 μm DVB/CAR/PDMS萃取头),美国Supelco公司;萃取瓶,美国Perkinelmer公司;SQP电子天平,德国赛多利斯科学仪器有限公司;QP 2010型气相色谱-质谱联用仪(配有EI离子源及GC-MS solution 2.50工作站),日本岛津公司;SOX406脂肪测定仪,济南海能仪器股份有限公司;4K15冷冻离心机,美国Sigma公司;5810离心机,德国Eppendorf公司;NK200-1B可视氮吹仪,常州朗越仪器制造有限公司;T6紫外可见分光光度计,北京普析通用仪器有限责任公司;DK-8D三孔电热恒温水槽,上海齐欣科学仪器有限公司。
1.3实验方法
1.3.1 薏米贮藏过程中挥发性成分的测定
1.3.1.1 挥发性物质的提取
称取1.0 g不同贮藏时间薏米样品置于20 mL螺口顶空样品瓶中,加入等质量的水以加速挥发性成分的扩散。再向瓶内加入25 μL质量浓度为1 mg/mL的正癸烷标准品作为内标物,用聚四氟乙烯隔垫密封,将50/30 μm DVB/CAR/PDMS萃取头插入萃取瓶中,于60 ℃水浴中平衡4 min后开始萃取,顶空吸附40 min。然后在GC-MS进样口250 ℃解吸5 min,同时启动仪器采集数据。
1.3.1.2 GC-MS分析条件
色谱条件。色谱柱:DB-5MS毛细管柱(30 m×0.25 mm×0.25 μm);升温程序:柱温箱起始温度为40 ℃,保持2 min,先以8 ℃/min升温到70 ℃,保持4 min,4 ℃/min升温到80 ℃,保持2 min,再以4 ℃/min升温到145 ℃,最后以10 ℃/min升温到220 ℃,保持3 min;载气为高纯He,流速1 mL/min,压力49.3 kPa;进样口温度250 ℃;进样分流比为2∶1。
质谱条件:电子轰击(EI)离子源;检测器电压830 eV;离子源温度250 ℃;接口温度250 ℃;溶剂延迟时间2.5 min;ACQ方式:Scan;扫描速度666 u/s;质量扫描范围m/z 40~400。
1.3.1.3 挥发性成分的定性与定量分析
定性分析:用质谱和保留指数结合进行定性分析。质谱是通过计算机检索与仪器所配置的NIST08、NIST08s、PESTEI_3、PEST_EI标准谱库进行对照确定。保留指数定性是在与样品测定相同的色谱条件下,通过对C5~C25正构烷烃的色谱扫描,计算得到各物质的保留指数(kovats retention indice,RI)值,并与相应文献值对照。RI按以下公式进行计算:
(1)
式中:Rt(i)、Rt(n)、Rt(n+1)分别为待测未知物、含n及n+1个碳原子的正构烷烃保留时间。
定量分析:各挥发性组分的相对含量采用面积归一化法计算。根据ZHAO[13]的方法计算各组分的“相对内标含量”,用各物质峰面积与内标物质峰面积的比值表示。
1.3.2 薏米贮藏过程中粗脂肪含量的测定
参照GB/T 14772—2008进行测定[14]。
1.3.3 薏米贮藏过程中脂肪酸值的测定
参照GB/T 15684—2015进行测定[15]。
1.3.4 薏米贮藏过程中过氧化值的测定
薏米油脂的提取参照VANHAMEN等方法[16],油脂过氧化值的测定参照GB/T 5538—2005[17]。
1.3.5 薏米贮藏过程中茴香胺值的测定
薏米油脂的提取参照VANHAMEN等方法[16],油脂茴香胺值的测定参照GB/T 24304—2009[18]。
1.3.6 薏米贮藏过程中丙二醛含量的测定
参照孔祥刚[19]、张玉荣等[20]方法进行测定。
1.3.7 薏米总氧化值的测定
总氧化值为衡量薏米氧化的综合指标,总氧化值等于2倍的过氧化值与茴香胺值的和[21]。
1.3.8 薏米贮藏过程中脂肪酸组成的测定
1.3.8.1 薏米油脂的提取
参照1.3.2方法。
1.3.8.2 薏米脂肪酸的甲酯化
参照GB/T 17376—2008,采用三氟化硼法[22]。在油样中加入2 mL质量浓度为2 mg/mL的十九烷酸内标。
1.3.8.3 GC-MS检测薏米脂肪酸含量分析条件
气相色谱条件:色谱柱为DB-FFAP(30 m×0.25 mm×0.25 μm)毛细管柱,程序升温。柱温箱起始温度为160 ℃,先以6 ℃/min升温到200 ℃,保持2 min,再以10 ℃/min升温到230 ℃,保持1min;载气为高纯He,流速1 mL/min,压力96.0 kPa;进样口温度230 ℃;进样分流比1∶50;进样量1 μL。
质谱条件:电子轰击(EI)离子源;离子源温度230 ℃;接口温度为230 ℃;溶剂延迟时间2.5min;ACQ方式:Scan;扫描速度:833 u/s;质量扫描范围m/z 45~450。
1.3.8.4 薏米脂肪酸的定性与定量分析
定性分析:样品中各未知挥发性成分的定性由计算机检索与仪器所配置的NIST08、NIST08s、PESTEI_3、PEST_EI谱库匹配,采纳匹配度大于85的鉴定结果。
定量分析:各脂肪酸的相对含量采用峰面积归一化法计算。
1.3.9 薏米异味的感官评价方法
参照GB/T 16291.1—2012《感官分析 选拔、培训与管理评价员一般导则》选择感官评价员[23]。根据要求选取5名评价员,随机请入评价室,说明试验用意及步骤,不给无关提示以免误导评价员,试验采用评分检验法和简单描述检验法[24]。提前2 h将样品从冰箱中取出回复至室温,各取50 g放入100 mL烧杯中,尽量保证样品视觉特性均一,用3位随机数字对样品编号。将要评定的已编码的样品随机呈给评价员,评价员采用直接嗅觉法对样品进行气味评价[25],先以评分检验法进行鉴评,根据表1参考给分。同时以霉味、酸味、刺鼻味、哈败味、泥味、粪臭味、青草味等气味特性,以及无感觉、极弱、稍微、较强、极强5个等级进行简单描述检验法鉴评[26],试验员在一旁记录。每隔10 min在通风处放松休息,以免造成嗅觉混乱或迟钝,每次评定样品的数量控制在6个。

表1 薏米异味感官评分标准
1.4实验数据分析处理方法
采用Excel 2013、SPSS(Version 19.0)和OriginPro 2015(Version 9.2)软件对试验数据进行处理与分析。所有试验均进行3次平行测定,结果以3次测定结果的平均值表示。
2 结果与分析
2.1薏米贮藏过程中粗脂肪含量和脂肪酸值的变化
由表2可知,薏米的粗脂肪含量随着贮藏时间的延长呈下降趋势,其中0~4周、10~12周薏米粗脂肪含量下降速度较快。同时,薏米的脂肪酸值呈现逐渐上升的趋势,0~8周脂肪酸值略微上升,薏米贮藏10周后的脂肪酸值与第8周相比呈现出极显著的增加趋势(p<0.01),16周后薏米的脂肪含量和脂肪酸值均逐渐趋于稳定。
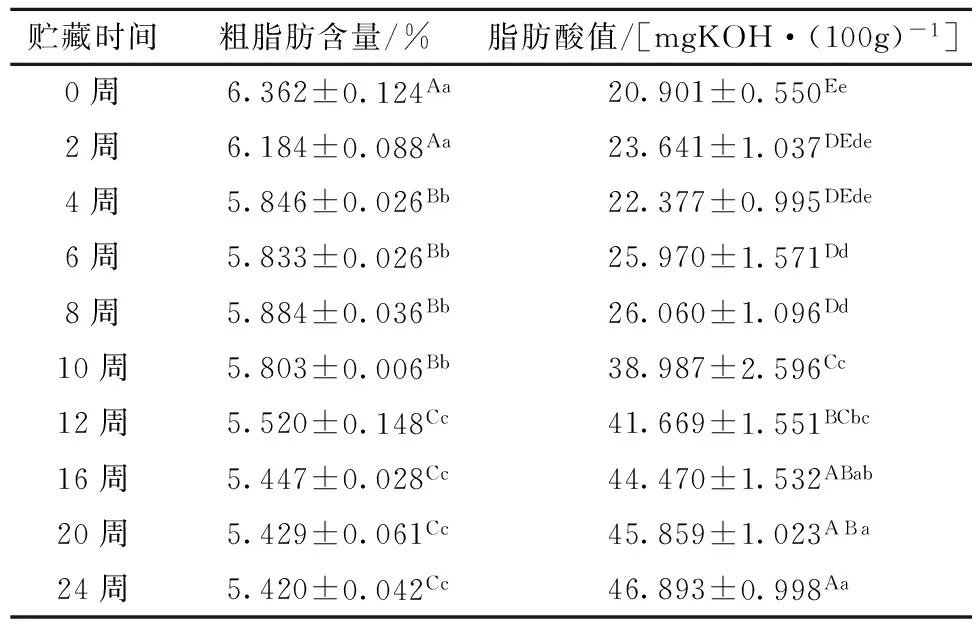
表2 薏米贮藏过程中粗脂肪含量和脂肪酸值的变化
注:表2中同一列数据的上标中,不同大写字母表示差异极显著(p<0.01),不同小写字母表示差异显著(p<0.05),表4同。
2.2薏米贮藏过程中油脂中脂肪酸组成的变化
图1为薏米的脂肪酸甲酯GC-MS图,通过GC-MS对不同贮藏时间薏米油脂的脂肪酸组成分析得到表3。由表3可以看出,随着贮藏时间的延长,薏米油脂中不饱和脂肪酸油酸(C18∶1)和亚油酸(C18∶2)的相对含量均逐渐降低,分别从原来的50.36%和32.54%降低到47.69%和27.73%,降低比例分别为原来的5.30%和14.78%。而饱和脂肪酸棕榈酸(C16∶0)和花生酸(C20∶0)的相对含量均逐渐升高,这是因为饱和脂肪酸较稳定,不易被氧化,油酸和亚油酸的相对含量降低,使得棕榈酸和花生酸的相对含量呈现出上升趋势。
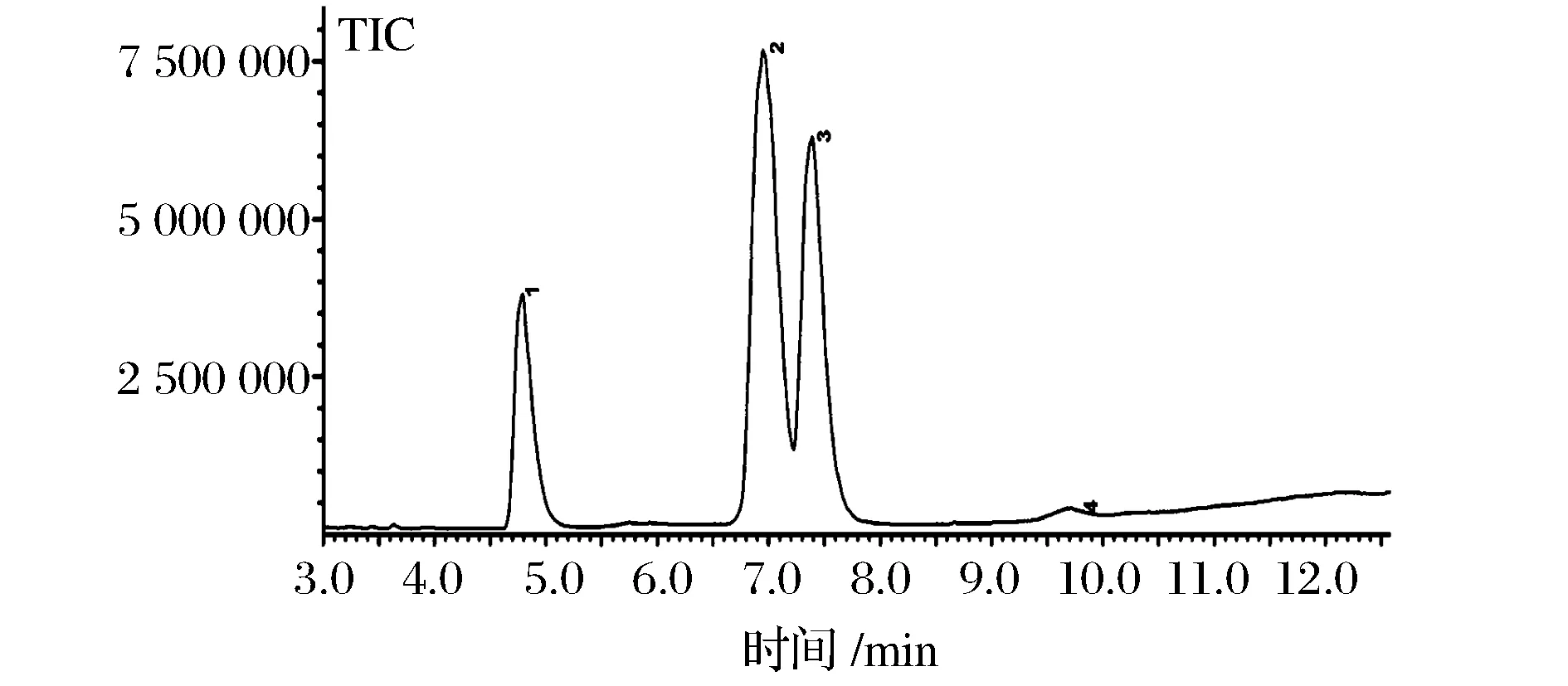
图1 薏米油脂的脂肪酸甲酯GC-MS总离子流图Fig.1 TIC of FAME of adlay seeds oil

贮藏时间棕榈酸/%油酸/%亚油酸/%花生酸/%其他/%饱和脂肪酸/%不饱和脂肪酸/%0周16.00±0.6650.36±1.0632.54±0.370.94±0.070.17±0.0316.94±0.6182.89±1.262周16.89±0.4550.20±0.7631.53±0.100.97±0.100.41±0.0417.86±0.5281.73±0.814周17.08±0.5850.06±1.0431.32±0.201.06±0.030.48±0.0318.14±0.6081.38±1.036周18.07±0.4949.86±0.5630.57±0.311.13±0.140.37±0.0319.20±0.4580.43±0.768周18.48±0.6549.47±0.8730.42±0.381.33±0.240.30±0.0419.81±0.6579.89±0.5310周19.50±0.5248.67±0.6629.59±0.721.41±0.410.83±0.0820.91±0.9178.26±0.7812周19.78±0.9348.42±0.1929.27±0.881.43±0.041.10±0.0721.21±0.9577.69±0.9116周20.24±0.9048.13±0.9628.85±1.031.67±0.231.11±0.0521.91±1.0576.98±1.8620周20.48±0.2847.89±0.9027.96±0.801.92±0.581.75±0.0922.40±0.4475.85±1.4724周20.76±0.7747.69±0.7727.73±0.712.08±0.181.74±0.1222.84±0.8275.42±1.48
2.3薏米贮藏过程中油脂氧化指标的变化
由表4可知,随着贮藏时间的延长,薏米油脂的过氧化值呈现逐渐增大的趋势,过氧化值从最初的1.26 meq/kg增加到8.47 meq/kg,表明薏米在贮藏过程中其油脂发生了剧烈的氧化反应,产生大量氢过氧化物。薏米油脂的过氧化值在其贮藏2~4周和10~12周的过程中增加极显著(p<0.01),12周之后增加速度变缓,过氧化值无显著性差异(p>0.05),说明从氢过氧化物生成速度的角度来看,薏米中的油脂在贮藏前2周内处于氧化诱导期,过程缓慢;2周后进入氧化期,氧化速度较大提高后保持较稳定速度;10周后过氧化值增加的速度增大。
由表4可以看出,随着贮藏时间的延长,薏米中油脂的茴香胺值逐渐增大,茴香胺值从新鲜薏米的0.36增加到贮藏24周时的5.34,增加极显著(p<0.01),茴香胺值的变化也反映出薏米在贮藏过程中发生了显著的氧化反应。此外,贮藏16周后薏米的茴香胺值与12周相比增加极显著(p<0.01),说明薏米贮藏12~16周期间,其油脂氧化产生的氢过氧化物发生了较强的分解反应,生成了较多不饱和醛。

表4 薏米贮藏过程中油脂的氧化指标测定结果
进一步分析总氧化值可以发现,薏米贮藏期间其油脂的总氧化值呈上升趋势(表4),从新鲜薏米的2.89增加到贮藏24周的22.27,增加极显著(p<0.01),其增加趋势与薏米油脂的过氧化值的变化趋势相近,表明薏米油脂的总氧化值受过氧化值影响较大。总氧化值不断增加,表明薏米在贮藏过程中,其油脂不断发生氧化反应。此外,总氧化值在2~4周、10~12周和12~16周期间增加极显著(p<0.01),说明这3段时间内,薏米油脂的氧化反应较剧烈。
由表4还可以看出,随着贮藏时间的延长,薏米丙二醛的含量逐渐增加,从新鲜薏米的0.99 μmol/g增加到第24周的1.46 μmol/g,增加极显著(p<0.01)。从相邻贮藏时间点丙二醛含量的变化来看,增加均不显著(p>0.05),说明相邻贮藏时间点薏米中多不饱和脂肪酸的氧化程度差异不显著,但氧化程度总体呈现上升趋势,其中贮藏16周的薏米丙二醛含量较第10周增加极显著(p<0.01),表明10~16周期间薏米中多不饱和脂肪酸的氧化相对强烈。
2.3薏米贮藏过程中挥发性成分中异味物质含量的变化
由图2为采用顶空固相微萃取法(HS-SPME)对贮藏24周薏米进行萃取后经GC-MS检测得到的总离子流色谱图,通过GC-MS对不同贮藏时间薏米挥发性醛类化合物的含量分析得到图3。由图3可知,随着贮藏时间的延长,薏米中挥发性醛类化合物的含量总体呈上升趋势,从新鲜薏米的2.28增加到第24周的36.44,虽然第10周较第8周略有下降,但从差异显著性分析来看,第10周薏米中醛类化合物的含量下降不显著(p>0.05),不具有统计学意义。贮藏4周的薏米与新鲜薏米相比,以及贮藏16周的薏米与12周相比,其挥发性醛类化合物的含量均增加极显著(p<0.01),说明在薏米贮藏0~4周和12~16周期间,薏米油脂氧化产生的氢过氧化物较大程度分解,导致薏米中产生了大量的醛类化合物。由于醛类物质的嗅觉阈值普遍较低[27],可推测贮藏0~4周及12~16周过程中,薏米气味可能变化较大。

图2 HS-SPME提取异味薏米挥发性成分的GC-MS总离子流图Fig.2 TIC of volatiles extracted by HS-SPME from smelly adlay seeds

图3 薏米贮藏过程中挥发性醛类化合物的含量Fig.3 The content of valotile aldehydes of adlay seeds during storage注:不同大写字母表示差异极显著(p<0.01),不同小写字母表示差异显著(p<0.05)
2.4薏米贮藏过程中异味感官评价结果
由表5可以看出,薏米贮藏过程中,其异味程度逐渐增大。通过异味评分增加值可以看到,异味变化最大的前3个时间段分别为2~4周、0~2周和12~16周,与2.3薏米中挥发性醛类化合物的含量变化相吻合。结合感官评定员对气味的描述可知,0~4周贮藏过程中,薏米的气味从无明显异味变为略有不愉快气味,薏米贮藏12周后强异味开始出现,这与2.3中对薏米气味变化的推测一致。
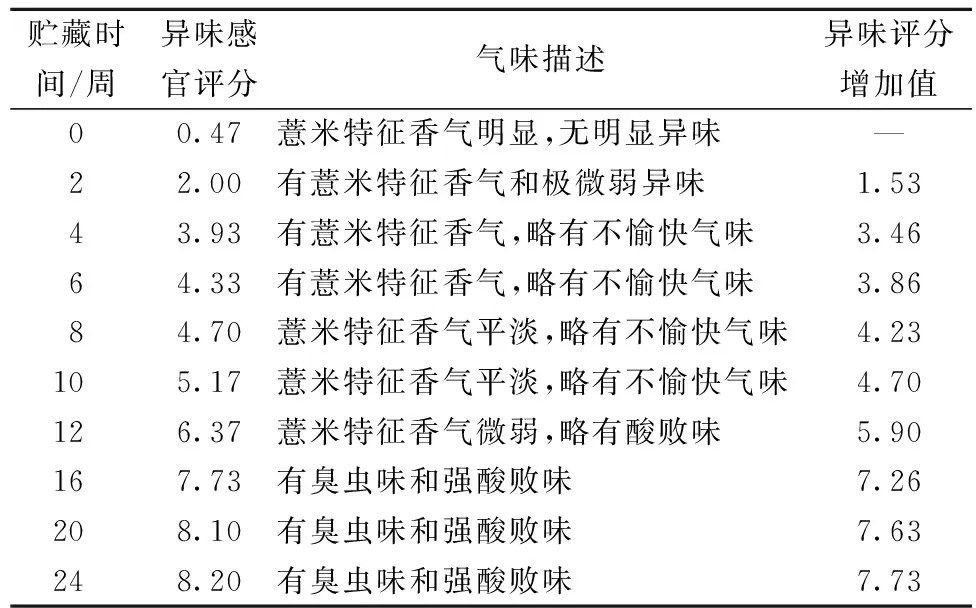
表5 不同贮藏时间薏米的感官评分结果
2.5薏米贮藏过程中异味产生的机理探讨
对薏米贮藏期间的异味评分与各指标间的相关性进行分析,见图4。

图4 薏米异味评分与相关指标的相关性分析Fig.4 Relativity analysis of sensory scores and related indexes of adlay seeds
由图4可知,薏米的总氧化值、丙二醛含量和挥发性醛类化合物含量与薏米的异味程度间呈显著正相关(R2分别为0.949、0.905和0.797,p<0.01),而不饱和脂肪酸含量间与薏米的异味程度间呈显著的负相关(R2为0.872,p<0.01)。油脂氧化导致不饱和脂肪酸含量降低、总氧化值升高、丙二醛含量升高、挥发性醛类化合物含量增多,这些指标的变化导致薏米异味程度的增加,由此可证实薏米贮藏过程中的异味主要是由于薏米中油脂氧化产生的。
综合本试验结果,可推测薏米贮藏过程中其油脂发生的变化。在贮藏过程中,薏米油脂发生氧化和水解反应,使得薏米中的粗脂肪含量下降,同时,游离脂肪酸增多,导致脂肪酸值上升。游离脂肪酸比甘油三酯更易氧化,两者的氧化使得不饱和脂肪酸的含量下降,氢过氧化物含量上升,即过氧化值增大。薏米贮藏12周后,氢过氧化物的分解加剧,产生大量挥发性醛类化合物,同时导致茴香胺值、丙二醛含量上升,大量挥发性醛类化合物导致薏米产生较强异味。
3 结论
随着薏米贮藏时间的延长,薏米的脂肪含量和不饱和脂肪酸相对含量均显著降低,脂肪酸值、饱和脂肪酸相对含量、过氧化值、茴香胺值、总氧化值、丙二醛含量均显著增加,油脂氧化的二级氧化产物醛类的“相对内标含量”也显著增加。这些指标的显著变化均表明薏米在贮藏过程中发生了强烈的氧化反应。薏米贮藏过程中其总氧化值、丙二醛含量和挥发性醛类化合物含量与薏米的异味程度间呈显著正相关,不饱和脂肪酸含量间与薏米的异味程度间呈显著的负相关。这说明薏米贮藏过程中异味主要是由于薏米中油脂氧化产生的,薏米油脂的二级氧化产物醛类化合物为薏米贮藏过程中产生异味的主要原因。
[1] ZHAOM M,ZHU D S,SUN-WATERHOUSE D X,et al.In vitro and in vivo studies on adlay-derived seed extracts:phenolic profiles,antioxidant activities,serum uric acid suppression,and xanthine oxidase inhibitory effects[J].Journal of Agriculture and Food Chemistry,2014,62(31):7 771-7 778.
[2] WANGL F,CHEN J Y,XIE H H,et al.Phytochemical profiles and antioxidant activity of adlay varieties[J].Journal of Agriculture and Food Chemistry,2013,61(21):5 103-5 113.
[3] CHOI G,HAN A,LEE J,et al.A Comparative study on hulled adlay and unhulled adlay through evaluation of their lps-induced anti-inflammatory effects,and isolation of pure compounds[J].Chemistry & Biodiversity,2015,12 (3):380-387.
[4] LUX Y,LIU W,WU J H,et al.A polysaccharide fraction of adlay seed (Coixlachryma-jobiL.) induces apoptosis in human non-small cell lung cancer A549 cells[J].Biochemical and Biophysical Research Communications,2013,430(2):846-851.
[5] CHENC,ZHANG Y Y,GAO Y L,et al.Identification and anti-tumour activities of phenolic compounds isolated from defatted adlay (Coixlachryiena-jobiL.var.ma-yuen Stapf) seed meal[J].Journal of Functional Foods,2016,26:394-405.
[6] HUANGD W,WU C H,SHIH C K,et al.Application of the solvent extraction technique to investigation of the anti-inflammatory activity of adlay bran[J].Food Chemistry,2014,145:445-453.
[7] WATANABE M,KATO M,AYUGASE J.Anti-diabetic effects of adlay protein in type 2 diabetic db/db mice[J].Food Science and Technology Research,2012,18(3):383-390.
[8] 阚建全.食品化学[M].第2版.北京:中国农业出版社,2008.
[9] 王颖.薏仁成分及薏仁醋的生产技术研究[D].重庆:西南大学,2013.
[10] 张立庆,蔡笑今.薏米饮品的开发与研制[J].食品科学,1995,16(2):31-36.
[11] 吴传茂,石勇,吴周和,等.薏苡豆奶的研制[J].粮食与饲料工业,1998(5):34-35.
[12] 李美龄,张景凯,罗成.Viili薏米酸奶的研究工艺[J].食品工业,2014,35(7):110-112.
[13] ZHAO D,JIAN T,DING X.Analysis of volatile components during potherb mustard (Brassicajuncea,Coss.) pickle fermentation using SPME-GC-MS[J].Lebensmittel-Wissenschaft und-Technologie,2007,40(3):439-447.
[14] 全国食品工业标准化技术委员会.GB/T 14772—2008,食品中粗脂肪的测定[S].北京:中国标准出版社,2008.
[15] 全国粮油标准化技术委员会.GB/T 15684—2015,谷物碾磨制品 脂肪酸值的测定[S].北京:中国标准出版社,2015.
[16] VANHANEN L P,SAVAGE G P.The use of peroxide value as a measure of quality for walnut flour stored at five different temperatures using three different types of packaging[J].Food Chemistry,2006,99(1):64-69.
[17] 国家粮食局.GB/T 5538—2005,动植物油脂 过氧化值测定[S].北京:中国标准出版社,2005.
[18] 国家粮食局.GB/T 24304—2009,动植物油脂 茴香胺值的测定[S].北京:中国标准出版社,2009.
[19] 张玉荣,周显青,王锋.粳稻新鲜度敏感指标的筛选及其验证[J].中国粮油学报,2008,23(4):9-13.
[20] 孔祥刚.糙米气调储藏稳定性研究[D].郑州:河南工业大学,2011.
[21] AMADO I R,FRANCO D,SANCHEZ M,et al.Optimisation of antioxidant extraction fromSolanumtuberosumpotato peel waste by surface response methodology[J].Food Chemistry,2014,165(20):290-299.
[22] 全国粮油标准化技术委员会.GB/T 17376—2008,谷物碾磨制品 脂肪酸甲酯准备[S].北京:中国标准出版社,2008.
[23] 中华人民共和国农业部.GB/T 16291.1—2012,感官分析 选拔、培训与管理评价员一般导则[S].北京:中国标准出版社,2012.
[24] 张水华,张君社,薛毅.食品感官鉴评[M].广州:华南理工大学出版社,2001:68-100.
[25] 中国标准化与信息分类编码研究所.GB/T 15549—1995,感官分析 方法学 检测和识别气味方面评价员的入门和培训[S].北京:中国标准出版社,1995.
[26] ANGEROSA F.Influence of volatile compounds on virgin olive oil quality evaluated by analytical approaches and sensor panels[J].European Journal of Lipid Science and Technology,2002,104(9/10):639-660.
[27] GEMERT L J V.Odour Thresholds[M].Oliemans Punter and Partner BV,2003.
Researchonmechanismofoff-flavorproducinginadlayseedsduringstorage
CHEN Guang-jing1,2,RAN Chun-xia3,XIA Ji1,KAN Jian-quan1,2*
1(College of Food Science,Southwest University,Chongqing 400715,China) 2(Laboratory of Quality & Safety Risk Assessment for Agro-products on Storage and Preservationg (Chongqing), Ministry of Agriculture,Chongqing 400715,China) 3(Department of Medical Technology,Chongqing Three Gorges Medical College,Chongqing 404020,China)
Fat content, fat acidicity, composition of fatty acid, common oxidation indexes (including peroxide value, anisidine value, total oxidation value and MDA content) and aldehydes content of adlay seeds during storage were all compared and investigated. Furthermore, respective correlations between the off-flavor of adlay seeds and unsaturated fatty acids content, total oxidation value, MDA content and volatile aldehydes content were analyzed. The results showed that after 24-week storage, the fat content of adlay seeds decreased from 6.362% to 5.420%; the relative content of unsaturated fatty acids reduced from 82.89% to 75.42%; fatty acid increased from 20.901 mg KOH/100g to 46.893 mg KOH/100g; the relative content of saturated fatty acids rose from 16.94% to 22.84%; peroxide value, anisidine value, total oxidation value and MDA content increased from 1.26 meq/kg, 0.36, 2.89, 0.99 μmol/g to 8.47 meq/kg, 5.34, 22.27, 1.46 μmol/g, respectively; the relative of the internal standard content of aldehydes raised from 2.28 to 36.44. All the indexes above showed that the fat in adlay seeds experienced strong oxidation during storage. Further study showed that the correlations between the off-flavor of adlay seeds and unsaturated fatty acids content, total oxidation value, MDA content and volatile aldehydes content were significant, the correlation coefficients were -0.934, 0.974, 0.952 and 0.893, respectively. The conclusion is that the off-flavor of adlay seeds during storage was mainly produced by lipid oxidation. The main reason for the appearance of off-flavor during storage is aldehydes, the secondary oxidation products caused by lipid oxidation in adlay seeds.
adlay; off-flavor; mechanism; oil oxidation
博士研究生(阚建全教授为通讯作者,E-mail:ganjq1965@163.com)。
中华人民共和国农业部财政专项项目(GJFP201501201)
2017-02-12,改回日期:2017-03-10
10.13995/j.cnki.11-1802/ts.014031
