蕨菜中原蕨苷含量的测定及加工过程对原蕨苷含量的影响
2017-11-03代娟田艳萍张小春袁亚
代娟,田艳萍,张小春,袁亚
(成都医学院 检验医学院,四川 成都,610500)
蕨菜中原蕨苷含量的测定及加工过程对原蕨苷含量的影响
代娟,田艳萍,张小春,袁亚*
(成都医学院 检验医学院,四川 成都,610500)
建立蕨菜及其制品中原蕨苷的HPLC检测方法,探讨加工工艺对蕨菜中原蕨苷含量的影响。蕨菜及其制品液氮研磨后,以体积分数30%甲醇作为提取溶剂,按固液比5∶ 40(g∶mL)室温下涡旋振荡提取30 min,提取液经聚酰胺6柱净化后,在碱性和酸性环境下将原蕨苷转化为稳定性较强的蕨素B,通过HPLC法检测蕨素B的含量来计算样品中原蕨苷含量,并以此方法考察热烫和热风干燥加工对蕨菜中原蕨苷含量的影响。在该色谱条件下线性范围为1~10 μg/mL,r=0.999,线性良好,对蕨素B的回收率为92.3%~102.4%,RSD均小于5.00%。蕨菜经热烫加工后原蕨苷含量显著降低,经热风干燥后原蕨苷含量却显著升高。该方法灵敏度高、定量准确、重现性好,可用于蕨菜及其制品中原蕨苷含量的检测,热烫加工可有效降低蕨菜中原蕨苷的含量。
蕨菜;原蕨苷; HPLC; 热烫;热风干燥
蕨菜,又叫拳头菜、猫爪、龙头菜、鹿蕨菜、是蕨的嫩芽。英文名Pteridiumaquilinum,属于凤尾蕨科,在我国各省区均有分布[1-2]。由于蕨菜营养价值丰富[3],具有软化血管、降低胆固醇等功效[4],近年来国内外对蕨菜及其深加工产品需求量急剧增加。在我国多个地区已将蕨菜作为特色农产品进行产业化发展,据保守估计每年的产值达数十亿元。
但在目前国内的蕨菜应用研究中,普遍忽视了蕨菜食用安全的问题。事实上在很多蕨类大量生长的地区也出现了家畜因食用蕨类而造成急慢性中毒症状的报道[5-7]。在随后的研究中发现,在蕨菜喂养的不同种试验动物如小鼠[8-11]、豚鼠[12]、蟾蜍[13]和大鼠[14-16]中均能产生多种肿瘤,并由此可以认定蕨菜的致癌性。研究发现蕨菜中的主要致癌物质是一种被称为原蕨苷(ptaquiloside ,PTA,CAS:87625-62-5)的化合物[17-18],该物质在体内外的研究表明与肿瘤的发生直接相关[19-22]。而流行病学研究也证明人群在蕨类生长密集的地区居住时间与患胃癌死亡的风险正相关[23-24]。目前,原蕨苷被世界癌症组织评级为2B类致癌物,而原蕨苷在蕨类植物的嫩芽中含量最高。目前,我国还没有针对蕨菜及其制品中PTA含量的检测方法和相关的食品安全标准,存在着潜在的食品安全风险。
PTA是一种结构不稳定的化合物,其标准品难以获取,且存在样品处理过程中易降解的问题。目前的研究尚无直接通过PTA标品以外标法来建立PTA的检测方法。但PTA经过碱性和酸性条件处理可以等摩尔比的转化为蕨素B(pterosine B, PTB, CAS:34175-96-7 )[25-27](见图1)。而PTB具有较好的稳定性,且PTB的标准品可通过商业途径获得。本研究通过优化PTB的色谱分离测试条件及PTA的提取、净化和转化为PTB的前处理方法,建立了通过HPLC检测样品中PTB的变化量来反映样品中PTA含量的检测方法,并对该方法进行了方法学评价。基于此方法对蕨菜加工前后PTA含量的变化进行了考察。
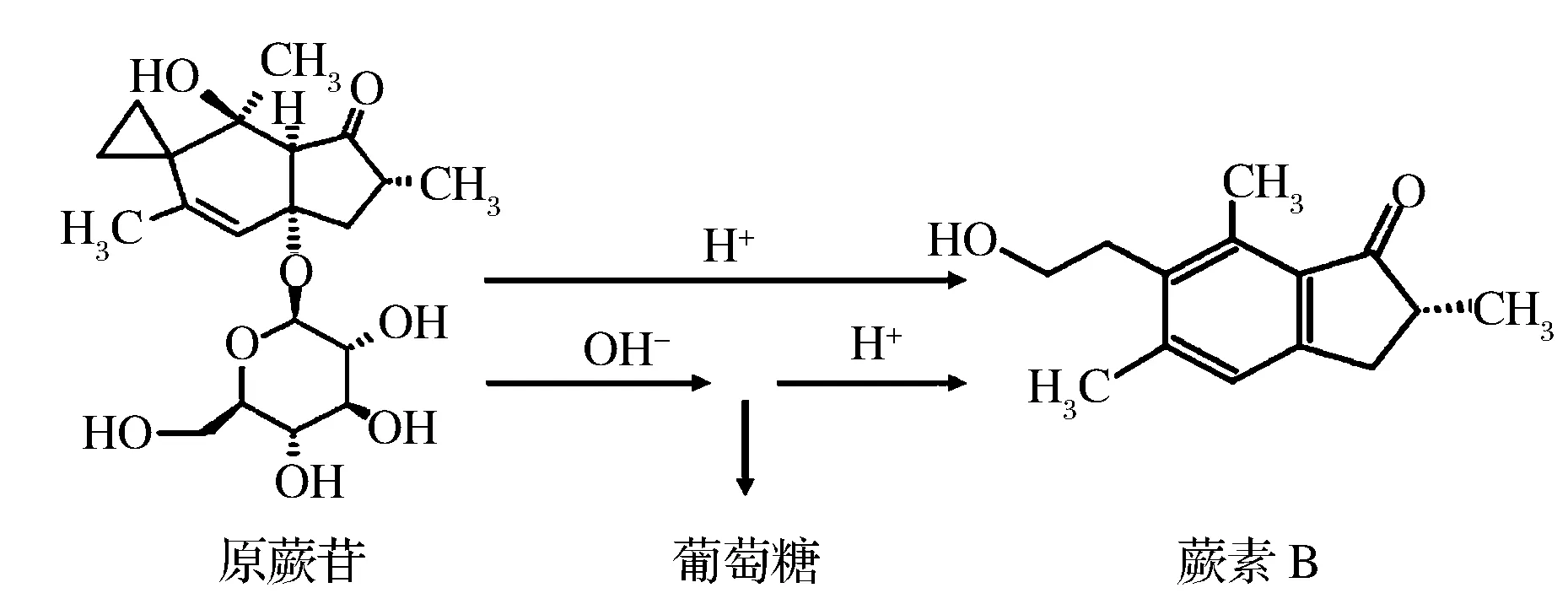
图1 PTA转化PTB结构示意图Fig.1 Structure of ptaquiloside and the transformation product pterosin B
1 材料与方法
1.1材料与试剂
新鲜蕨菜及其制品,市售;NaOH、HCl、聚酰胺6、甲醇(色谱纯),美国Tedia公司;PTB标准品(纯度>98%),上海瀚香生物科技有限公司。
1.2仪器与设备
TB-214电子天平型,北京赛多利斯仪器系统有限公司;LC20A液相色谱仪(配二极管阵列检测器),日本岛津公司;MS3涡旋混匀器,德国IKA公司;MTN2800氮吹仪,天津奥特赛恩斯仪器有限公司。
1.3PTA检测方法的条件优化与评价
1.3.1 色谱分离检测条件优化
通过PTB标准品的光谱图选择适合的检测波长,并在该波长下比较不同比例流动相、流速和柱温的对PTB分离效果,从而筛选出适合的色谱分离条件。
1.3.2 PTA提取条件的优化
为优化样品破碎方式,分别用匀浆机破碎和液氮研磨2种破碎方法对新鲜蕨菜进行处理,采用体积分数30%甲醇溶液提取、净化并转化后,比较PTA提取量,从而选择适合的样品破碎方式。
为优化提取溶剂种类,分别比较体积分数30%甲醇溶液和100%纯水提取新鲜蕨菜中的PTA的效果,样品经液氮研磨后,精密称取5.000 g,加入40 mL提取溶剂提取、净化并转化后,通过比较提取液中PTA的含量,从而选择适合的提取溶剂。
1.3.3 提取液净化验证与PTA转化条件优化
由于本方法是通过PTB的转化量来反映样品中PTA的含量,为保证检测方法的准确性,需对净化前后提取液中本底PTB的含量进行考察。通过检测不同pH值和转化时间下,PTB的生成量以及转化过程中PTB标品的稳定性,来优化对PTA的转化条件。
1.3.4 方法学评价
为评价仪器精密度,取同一样品重复进样5次,每次20 μL,计算PTB峰面积的RSD值。为评价该方法的重现性,取5份平行样品,根据样品处理和检测条件测定PTA的含量,计算其RSD值。
由于无法取得PTA标品,在准确度检验中只对PTB转化和检测过程的加标回收率进行计算,即分别取1 mL过聚酰胺6柱净化后的样品提取液,按高中低浓度,分别加入1、5、10 mg PTB标准品。按本研究所确定的PTB转化方法和检测条件,对每个加标浓度样品进行5次平行试验,计算其加标回收率和RSD值。
1.4样品的前处理方法
称取3~5 g新鲜蕨菜加入液氮研磨成粉状,再精密称取5.000 g置于50 mL离心管内加入40 mL 30%甲醇溶液,室温下涡旋振荡提取30 min后。于4 ℃ 6 000 r/min离心5 min,移取上清液,通过聚酰胺6柱(2 g聚酰胺6干法装柱)净化除去提取液中本底的PTB,收集过滤液待用。
1.5PTA转化为PTB的方法
从净化后的过滤液中移取1 mL,加入1 mol/L的NaOH溶液50 μL(使pH>11),于40 ℃水浴30 min,再加入5 mol/L的HCl 50 μL(使pH<2)酸化,以50%甲醇定容至2 mL,过滤待测。
1.6标准工作溶液的配制
精密称取PTB标准品10 mg(精确到0.01 mg),用体积分数50%甲醇稀释到10 mL,配制浓度约为1 000 mg/mL的标准储备液。以50%甲醇为溶剂,采用逐步稀释法,配制5个浓度在1~10 mg/mL范围的标准工作溶液。
1.7HPLC分析测试条件
色谱柱:Agilent XDB-C18柱(4.6 mm×250 mm,5 μm) ;以V(甲醇)∶V(水)=50∶50为流动相;柱温为50 ℃;流速1 mL/min;检测波长263 nm;进样量20 μL。
1.8样品中PTA含量的定量分析
以PTB的保留时间和目标峰光谱图定性。以外标法定量,分别以各标准溶液峰面积及对应浓度建立标准曲线及回归方程,再根据样品中PTB的峰面积,计算样品提取液中PTB的浓度,并按下式计算样品中PTA的含量(mg/kg):
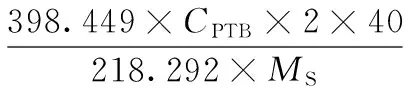
(1)
式中:CPTA,样品中PTA的含量,mg/kg;CPTB,转化后样品液中PTB的质量浓度,μg/mL;2,1 mL样品提取液转化后定容至2 mL, 被稀释了2倍;40,提取液体积,mL;Ms,取样量,g;398.449,PTA的摩尔质量;218.292,PTB的摩尔质量。
1.9不同加工方法对蕨菜中PTA含量的影响
为了解不同加工方法对PTA含量的影响,对市售蕨菜及其主要制品中PTA含量进行考察。为进一步了解热烫和热风干燥两种主要工艺对蕨菜中PTA含量的影响,分别对在沸水浴热烫和70 ℃热风干燥过程中蕨菜样品PTA含量的变化进行检测。
2 结果与讨论
2.1色谱分离检测条件优化
从PTB标准品经紫外可见光谱扫描可知(见图2-A),PTB在218、263、306 nm 处均有吸收峰,虽然在218 nm除吸收值最高,但是该波长处也有较高的杂质吸收,在样品检测时影响分离度。 而306 nm吸收值较低,影响检测的灵敏度。综合选择263 nm为最佳吸收波长。在该波长下比较不同比例流动相、流速和柱温的分离效果,经比较发现流动相:V(甲醇)∶V(水)=50∶50、柱温:50 ℃、流速:1 mL/min时,目标化合物的柱效(大于2 000)和分离度(大于2.5)较高,同是具有适宜的保留时间(24.55 min),对样品的分析时间在30 min完成(见图2-B,见图2-C)。

A-PTB标品光谱图;B-PTB标品色谱图;C-样品色谱图图2 PTB色谱分离检测条件优化Fig.2 Optimization of PTB chromatographic separation and detection conditions
分别取1、2.5、5、7.5、10 mg/mL的PTB标准液20 mL精密进样,根据峰面积之和与相应标准液浓度建立标准曲线(见图2),所得回归方程为:Y=62 797X-15 474,r=0.999。结果表明,PTB浓度在1~10 μg/mL,线性良好。据此确定该仪器对PTB的最小检出限(LOD)为 0.25 mg/mL。
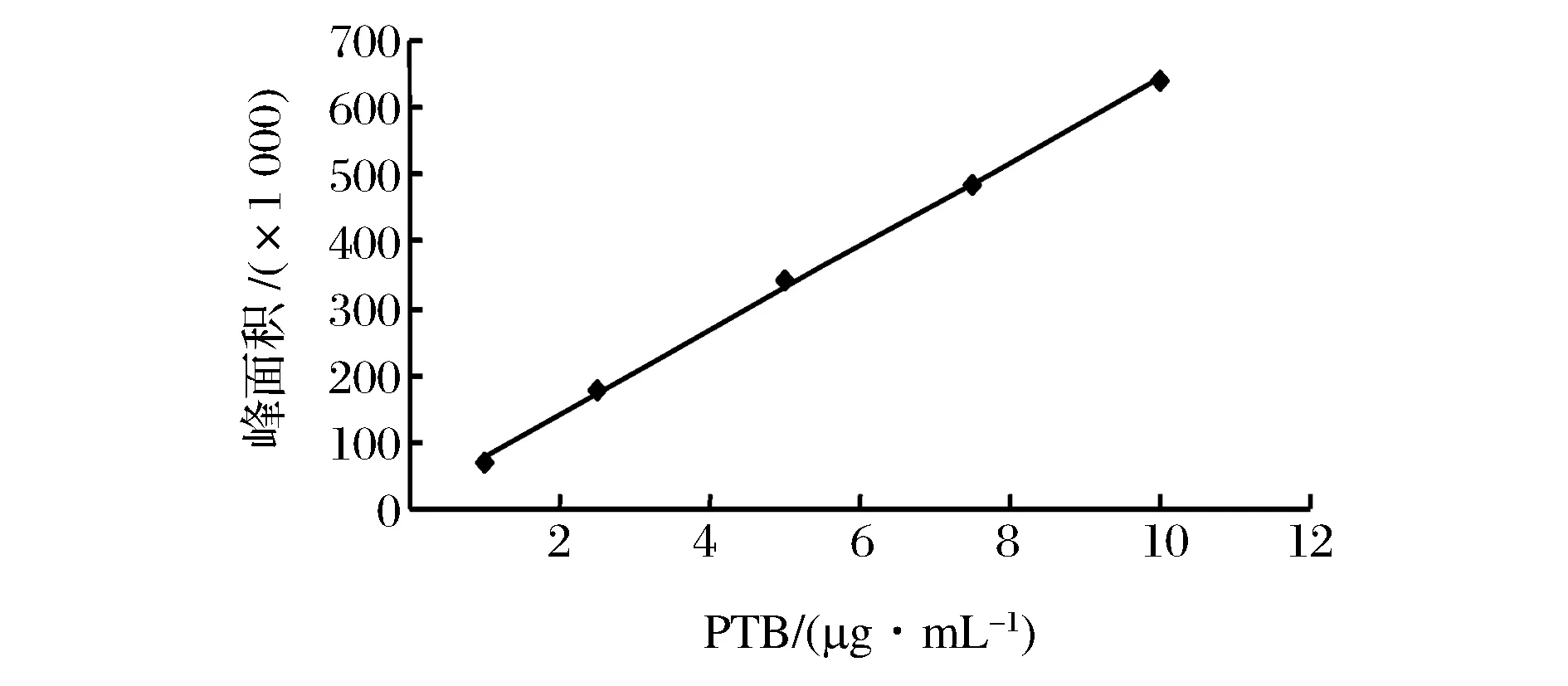
图3 PTB标准曲线Fig.3 Standard curve of PTB
2.2PTA提取条件的优化
在不同的破碎方法下样品中PTA提取量差异极大,采有匀浆机破碎的样品中PTA的提取量显著低于液氮研磨破碎(见图4-A)。这可能是由于PTA主要存在于蕨菜的表层,采用匀浆机很难将植物表皮充分破碎,而液氮研磨可将样品研磨成粉,不仅破碎充分还为提取提供了较大的比表面积。因此选用液氮研磨作为样品破碎方法。
采用不同的溶剂提取PTA的效果差异明显,30%甲醇溶液提取PTA的量显著高于纯水提取。在未净化提取液中,纯水中PTB的本底含量显著高于30%甲醇溶液(data no show),可能的原因是采用纯水提取的过程中PTA转化成了PTB,且纯水中溶解了样品中大量多糖类物质,增大了提取液黏度使得净化过柱过程十分缓慢(大于30 min)。此外随着提取时间的增加,提取液中PTA的含量液也增加,当提取时间达到30 min 后PTA含量趋于稳定(见图4-B)。因此确定固液比为1∶8的30%甲醇溶液,室温下涡旋振荡提取30 min为样品提取条件。
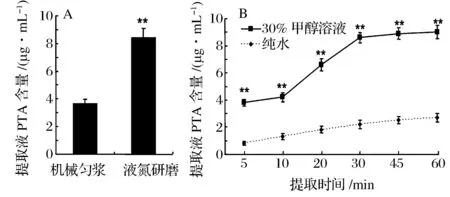
A-样品破碎方式优化;B-提取溶剂与时间优化图4 PTA提取条件优化Fig.4 Optimization of PTA extraction condition
2.3提取液净化验证与PTA转化条件优化
由于缺乏PTA的标准品或其他适合的内标物对转化过程进行矫正,为保证检测方法的准确性,对提取液的净化和PTA经过碱性和酸性条件转化为PTB的过程优化显得十分重要。通过PTB的转化量来准确反映样品中PTA的含量,需要保证提取液中本底的PTB经净化后被完全除去,提取液中PTA应完全转化为PTB,且生成的PTB在转化过程中不发生降解。由于PTA在碱性条件下脱去葡萄糖基的过程是整个转化过程的关键步骤。因此本研究对提取液的净化效果,不同pH和转化时间下,PTB的生成量以及转化过程中PTB标品的稳定性进行了考察。结果表明提取液经过柱净化后本底PTB被完全除去(见图5-A)。在pH值大于11的条件下40 ℃转化30 min 后,PTB的含量达到稳定并基本一致(见图5-B)。由于在1 mL提取液中加入1 mol/L的NaOH溶液 45 μL以上即可使反应体系的pH值大于11,为便于实验操作通过加入50 μL 1 mol/L的NaOH溶液作为碱性条件。而在此条件下转化时间大于40 min后,不论是提取液中转化所得的PTB还是PTB标品均出现了不同程度的降解(见图5-C)。因此综合考虑将转化时间确定为40 ℃下转化30 min。
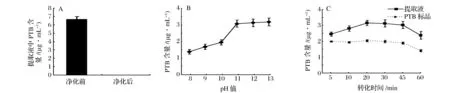
A-提取液净化效果;B-碱性转化条件优化;C-转化时间优化图5 提取液净化验证与PTA转化条件优化Fig.5 Purification verification of extraction solution and optimization of PTA transformation conditions
2.4方法学评价
该方法仪器精密度的RSD为1.63%,方法重现性的RSD为4.73%。方法的加标回收率和RSD值见表1。由于该检验方法对PTB的回收率为92.3%~102.4%,RSD均小于5%,再结合本方法针对蕨菜中PTA的提取、净化和PTB转化条件的优化结果,说明本方法具有良好的准确度和重现性,满足用于检测蕨菜及其制品中PTA含量的要求。
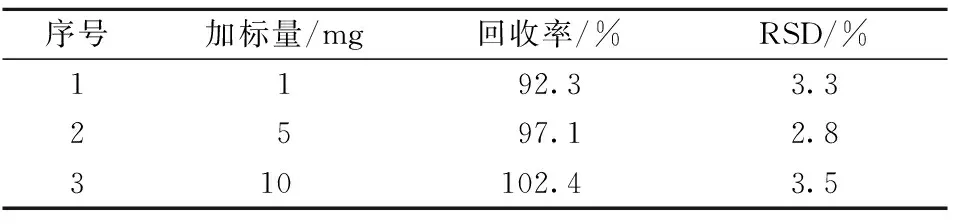
表1 回收率和RSD值表
2.5不同加工出方法对蕨菜中PTA含量的影响
目前在市场上销售的蕨菜加工产品主要包括蕨菜经泡渍或腌制后真空包装灭菌的预包装产品和直接烘干的蕨菜干。两类产品经检测后发现,与新鲜蕨菜相比经泡渍或腌制后的蕨菜制品中PTA的含量大大降低,而蕨菜干中PTA含量却大大高于新鲜蕨菜(见表2)。

表2 样品中PTA含量检测结果
在泡渍或腌制的蕨菜制品生产工艺中都需要热烫或蒸煮灭菌,而干蕨菜则需要自然晾晒或热风干燥。为进一步了解2种主要加工工艺对蕨菜中PTA含量的影响,本研究分别检测了在沸水浴热烫和70 ℃热风干燥过程中蕨菜样品PTA含量的变化。结果表明经过沸水浴热烫过程不仅起到灭酶和护色的作用,还使蕨菜中PTA含量显著降低,在5% NaHCO3的弱碱性溶液中进行热烫则可以进一步增强PTA的降解作用(见图6-A)。而在热风干燥过程中蕨菜中PTA并未减少且随着样品中水分含量的减少,使PTA的含量被进一步浓缩提高(见图6-B)。以上的实验结果提示了新鲜蕨素及其制品在食用前,如经过时间更长的水浴烹饪过程,将进一步促进蕨菜中PTA的降解,从而显著降低蕨菜类食品的潜在致癌风险。
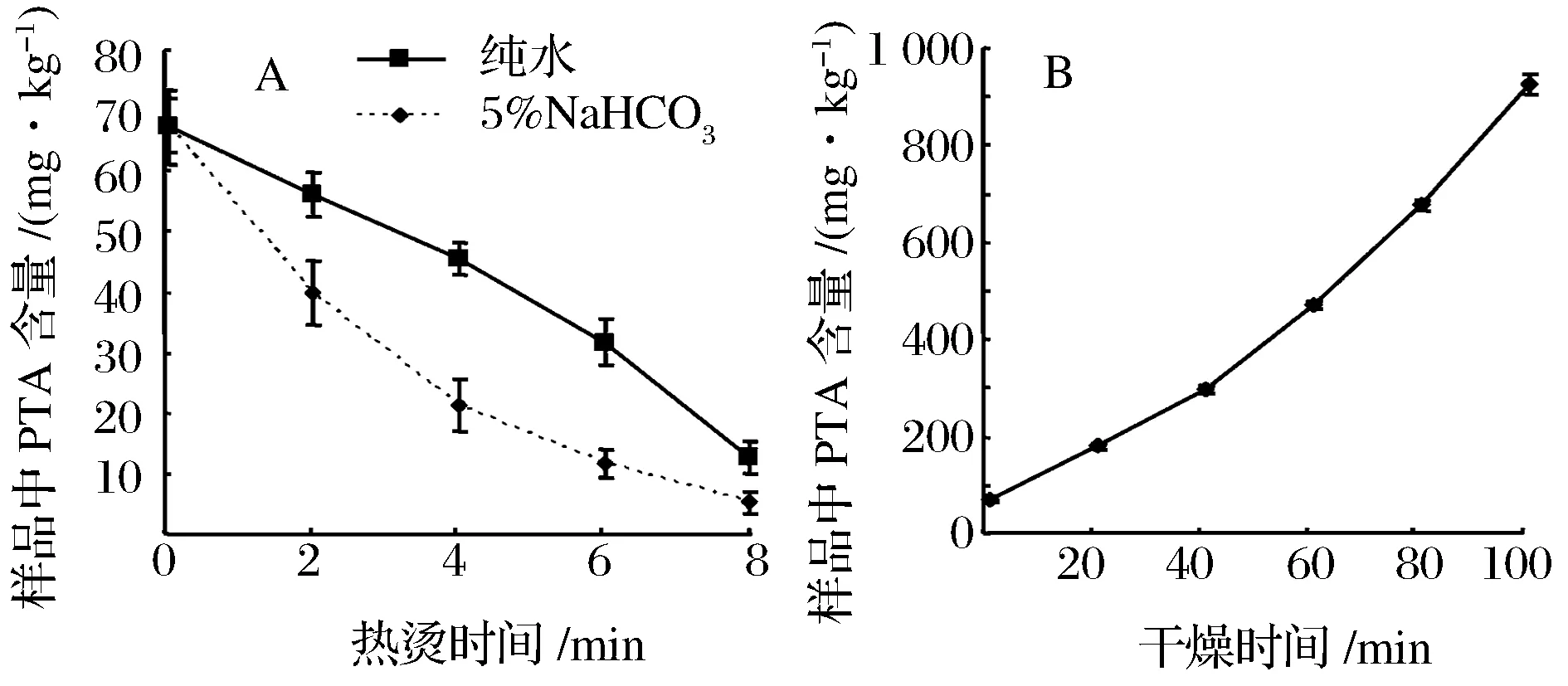
A-热烫对PTA含量的影响;B-热风干燥对PTA含量的影响图6 不同加工工艺对蕨菜中PTA含量的影响Fig.6 Effect of different processing technic on the content of PTA in bracken
3 结论
本研究采用30%甲醇溶液提取,聚酰胺6净化并将PTA转化为PTB后,经HPLC分析,建立了蕨菜及其制品中PTA含量的检测方法。利用该方法了解了目前蕨菜产品的加工工艺中,水浴热烫或蒸煮可以显著的降低样品中PTA的含量,而干燥工艺则不能降低样品中PTA含量,反而会因为水分含量降低而产品中PTA含量被浓缩。
[1] 何义发.经济蕨类植物紫萁的研究进展与展望[J].湖北农业科学,2002(6):101-103.
[2] 韩敬,赵莉.蕨类植物繁殖研究进展[J].安徽农业科学,2005,33(7): 1 261-1 263.
[3] 江萍,张倩.蕨菜多糖的提取及其对双歧杆菌生长的影响[J].山地农业生物学报,2001,20(3): 223-225.
[4] 马博,苏仕林,李荣峰.蕨菜化学成分及其生物活性研究进展[J].食品工业科技,2011 (3): 413-416.
[5] EVANS W C,EVANS E T R,HUGHES L E.Studies on bracken poisoning in cattle[J].Brit Vet J,1958,114:180.
[6] PEIXOTO P V,FRANÇA T N,BARROS C S L,et al.Histopathological aspects of bovine enzootic hematuria in Brazil[J].Pesquisa Veterinária Brasileira,2003,23(2): 65-81.
[7] DÖBEREINER J,TOKARNIA C H,CANELLA C F C.Ocorrência de hematúria enzoótica e de carcinomas epidermóides no trato digestivo superior em bovinos no Brasil[J].Pesq Agropec Bras,1967,2: 489-504.
[8] JARRETT W F,MCNEIL P E,GRIMSHAW W T,et al.High incidence area of cattle cancer with a possible interaction between an environmental carcinogen and a papilloma virus[J].Nature,1978,274(5668): 215-217.
[9] PAMUKCU A M,ERTÜRK E,PRICE J M,et al.Lymphatic leukemia and pulmonary tumors in female Swiss mice fed bracken fern (Pterisaquilina)[J].Cancer Research,1972,32(7): 1 442-1 445.
[10] FREITAS R N,O′CONNOR P J,PRAKASH A S,et al.Bracken (Pteridiumaquilinum)-induced DNA adducts in mouse tissues are different from the adduct induced by the activated form of the bracken carcinogen ptaquiloside[J].Biochemical and Biophysical Research Communications,2001,281(2): 589-594.
[11] YASUDA Y,KIHARA T,NISHIMURA H.Embryotoxic effects of feeding bracken fern (Pteridiumaquilinum) to pregnant mice[J].Toxicology and Applied Pharmacology,1974,28(2): 264-268.
[12] BRINGUIER P P,PIATON E,BERGER N,et al.Bracken fern-induced bladder tumors in guinea pigs.A model for human neoplasia[J].The American Journal of Pathology,1995,147(3): 858.
[13] EL-MOFTY M,SADEK I,SOLIMAN A,et al.α-Ecdysone,a new bracken fern factor responsible for neoplasm induction in the Egyptian toad (Buforegularis)[J].Nutrition & Cance,1987,9(2/3):103-107.
[14] PAMUKCU A M,YALÇINER,HATCHER J F,et al.Quercetin,a rat intestinal and bladder carcinogen present in bracken fern (Pteridiumaquilinum)[J].Cancer Research,1980,40(10): 3 468-3 472.
[15] PAMUKCU A M,PRICE J M.Induction of intestinal and urinary bladder cancer in rats by feeding bracken fern (Pterisaquilina)[J].Journal of the National Cancer Institute,1969,43(1): 275-281.
[16] PRICE J M,PAMUKCU A M.The induction of neoplasms of the urinary bladder of the cow and the small intestine of the rat by feeding bracken fern (Pterisaquilina)[J].Cancer Research,1968,28(11): 2 247-2 251.
[17] NIWA H,OJIKA M,WAKAMATSU K,et al.Ptaquiloside,a novel norsesquiterpene glucoside from bracken,Pteridiumaquilinum var.latiusculum[J].Tetrahedron Letters,1983,24(38): 4 117-4 120.
[18] VAN DER HOEVEN J C M,LAGERWEIJ W J,POSTHUMUS M A,et al.Aquilide A,a new mutagenic compound isolated from bracken fern (Pteridiumaquilinum(L.) Kuhn)[J].Carcinogenesis,1983,4(12): 1 587-1 590.
[19] GOMES J,MAGALHES A,MICHEL V,et al.Pteridiumaquilinumand its ptaquiloside toxin induce DNA damage response in gastric epithelial cells,a link with gastric carcinogenesis[J].Toxicological Sciences,2012,126(1): 60-71.
[20] SHAHIN M,SMITH B L,WORRAL S,et al.Bracken fern carcinogenesis: multiple intravenous doses of activated ptaquiloside induce DNA adducts,monocytosis,increased TNFα levels,and mammary gland carcinoma in rats[J].Biochemical and Biophysical Research Communications,1998,244(1): 192-197.
[21] FREITAS R N,BRASILEIRO-FILHO G,SILVA M E,et al.Bracken fern-induced malignant tumors in rats: absence of mutations in p53 ,H-ras and K-ras and no microsatellite instability[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2002,499(2): 189-196.
[22] MATSUOKA A,HIROSAWA A,NATORI S,et al.Mutagenicity of ptaquiloside,the carcinogen in bracken,and its related illudane-type sesquiterpenes: II.Chromosomal aberration tests with cultured mammalian cells[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,1989,215(2): 179-185.
[23] SMITH B L,SEAWRIGHT A A.Bracken fern (Pteridium spp.) carcinogenicity and human health—a brief review[J].Natural Toxins,1995,3(1): 1-5.
[24] GALPIN O P,WHITAKER C J,WHITAKER R H,et al.Gastric cancer in Gwynedd.Possible links with bracken[J].British Journal of Cancer,1990,61(5): 737.
[25] ALONSO-AMELOT M E,RODULFO-BAECHLER S,JAIMES-ESPINOZA R.Comparative dynamics of ptaquiloside and pterosin B in the two varieties (caudatum,and arachnoideum ) of neotropical Bracken Fern (Pteridiumaquilinum,L.Kuhn)[J].Biochemical Systematics & Ecology,1995,23(7/8):709-716.
[26] RASMUSSEN L H,KROGHSBO S,FRISVAD J C,et al.Occurrence of the carcinogenic Bracken constituent ptaquiloside in fronds,topsoils and organic soil layers in Denmark[J].Chemosphere,2003,51(2):117-127.
[27] AYALA-LUIS K B,HANSEN P B,RASMUSSEN L H,et al.Kinetics of ptaquiloside hydrolysis in aqueous solution[J].Environmental Toxicology & Chemistry,2006,25(10):2 623-2 629.
DeterminationofptaquilosideinPteridiumaquilinumbyHPLCandtheeffectofptaquilosideduringprocessing
DAI Juan, TIAN Yan-ping, ZHANG Xiao-chun, YUAN Ya*
(School of Laboratory Medicine, Chengdu Medical College, Chengdu 610500, China)
To establish a method for determination ptaquiloside inPteridiumaquilinumby HPLC, and evaluate the effect of ptaquiloside during processing. Method: Bracken and its products were grinded in liquid nitrogen and extracted 30 min at room temperature with 30% methanol with solid-liquid ratio of 5 g∶40 mL. The extract was purified by polyamide column, and was converted into pterosin B in alkaline and acidic environment; by detecting the content of pterosin B using HPLC, the content of ptaquiloside was calculated. The content of ptaquiloside was used in the comparison of two drying method: hot water bleaching and hot air drying. Result: The method can effectively extract and purify the ptaquiloside in bracken fern and can convert all the ptaquiloside into the pterosin B. The linear range was 1-10 μg/mL,r=0.999 9. The recovery rate of ptaquiloside was between 92.3% and 102.4% and RSD was less than 5.00%. The content of ptaquiloside in bracken fern significantly decreased by blanching processing, and significantly increased by hot air drying processing. Conclusion: This method has good sensitivity, accuracy, and repeatability. It can be used for the evaluation of the content of ptaquiloside in bracken fern. The content of ptaquiloside in bracken fern could be effectively reduced by blanching processing.
bracken fern; ptaquiloside; HPLC; blanching processing; hot air drying processing
硕士,讲师(袁亚硕士,讲师为通讯作者,E-mail:scuyaya@163.com)。
成都医学院校级“大学生创新实验计划”(CXJS201409);西华大学食品生物技术省级重点实验室开放研究基金资组项目SZJJ2014-010
2017-02-03,改回日期:2017-05-31
10.13995/j.cnki.11-1802/ts.013989
