原发性干燥综合征患者外周血OX40、OX40L、PD-1、PD-L1和SPD-1的表达及临床意义
2017-11-01袁一梦
郑 戈,袁一梦
原发性干燥综合征患者外周血OX40、OX40L、PD-1、PD-L1和SPD-1的表达及临床意义
郑 戈,袁一梦
目的研究原发性干燥综合征(primary sjogren's syndrome, PSS)患者外周血OX40、OX40L、PD-1、PD-L1和SPD-1的表达水平及临床意义。方法选择本院2012年3月—2015年3月收治的50例PSS患者(观察组),再根据疾病活动情况及病情程度分为活动期亚组(30例)、非活动期亚组(20例)和单系统亚组(29例)、多系统亚组(21例)。选择同期我院行体检健康者50例作为对照组。两组均行免疫荧光标记、流式细胞术检测外周静脉血OX40、OX40L、PD-1、PD-L1和SPD-1的表达情况;比较所有纳入研究者间OX40、OX40L、PD-1、PD-L1及SPD-1的表达情况,并记录观察组患者治疗前后上述指标的表达情况。结果观察组CD4+OX40+、CD14+OX40L+、CD19+OX40L+、CD4+PD-1+和CD4+PD-1+及SPD-1表达均高于对照组,CD14+PD-L1+表达低于对照组,差异均有统计学意义(P<0.01)。对观察组亚组进行分析,活动期亚组CD4+OX40+、CD14+OX40L+、CD19+OX40L+、CD4+PD-1+及SPD-1表达显著高于非活动期亚组(P<0.05或P<0.01);单系统亚组CD4+OX40+、CD14+OX40L+、CD19+OX40L+及SPD-1表达明显低于多系统亚组(P<0.05或P<0.01)。治疗前观察组CD4+OX40+、CD14+OX40L+、CD19+OX40L+和CD4+PD-1+表达显著高于治疗后(P<0.05);CD8+PD-1+、CD14+PD-L1+及SPD-1表达治疗前后比较差异无统计学意义(P>0.05)。结论PSS患者外周静脉血中OX40、OX40L、PD-1、PD-L1和SPD-1的异常表达,和疾病活动情况、组织损害情况有关联,可作为了解病情活动度和严重程度的检测指标。
干燥综合征;病情评估;OX40;OX40L;PD-1;PD-L1
原发性干燥综合征(primary sjogren's syndrome, PSS)是一种自身免疫性疾病,主要以外分泌腺体(泪腺、唾液腺)损伤为特征,眼泪和唾液分泌减少,导致患者出现眼干和口干,同时会累及肺脏、肾脏和神经系统[1-3]。T细胞、B细胞不正常激活和PSS的发生密切相关,共刺激信号在T细胞活化过程中起着直接作用。OX40、OX40配体(OX40L)是肿瘤坏死因子超家族成员,OX40表达于CD4+T细胞表层,OX40L表达于激活的B淋巴细胞、单核细胞和巨噬细胞,能使T细胞增加和提供刺激信号,阻止T细胞的生成;还可使Th2细胞生成细胞因子,B细胞成熟增殖分化为浆细胞,从而导致抗体生成[4-7]。程序性死亡受体1(PD-1)和程序性死亡受体-配体1(PD-L1)是人体重要的免疫抑制分子,是CD28家族的共刺激分子,主要表达于活化T细胞的表层;PD-1在CD28家族成员中表达较多,PD-L1大部分激发于抗原提呈细胞表层,主要以B细胞和单核细胞构成,能传递抑制信号,降低T细胞的增长[8]。研究表明,PD-1、PD-L1共刺激信号在人体许多免疫性疾病的发展过程中起着重要的作用[9]。研究表明,可溶程序性死亡受体1(SPD-1)具有完全的细胞外端,能够和PD-1相结合,在临床上被认为是PD-1和程序性死亡受体-配体的阻止剂[10-11]。本研究探讨PSS患者外周血OX40、OX40L、PD-1、PD-L1和SPD-1的表达水平和临床意义,以期为PSS患者病情评估寻找有意义的检测指标。
1 资料与方法
1.1纳入对象及分组 选择本院2012年3月—2015年3月收治的50例PSS作为观察组,均符合2002年国际卫生组织颁布的PSS诊断标准[12],其中男2例(4.0%),女48例(96.0%);年龄35~65(47.51±11.51)岁。其中10例为本次入院初诊者。同时选取我院体检健康且自愿参与本研究的志愿者50例为对照组,其中男3例(6.0%),女47例(94.0%);年龄34~67(47.61±12.21)岁。两组在性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
进一步将观察组按照不同病情程度进行亚组分组:①依据2009年欧洲风湿病联盟(EULAR)PSS活动指数评分标准将观察组再分为活动期亚组30例和非活动期亚组20例,该评分共9个类目(全身病症、关节病症、淋巴结、腺体、关节、肾脏病变、肺部、外周神经病变和骨骼肌情况)12个方面,每方面分为4个档次(不存在活动、轻微活动、中度活动和高度活动),测评分值≥2分为活动期,<2分为非活动期。②根据器官累及情况[13]将观察组再分为单纯累及外分泌腺体亚组(单系统亚组)29例和多系统累及外分泌腺体亚组(多系统亚组)21例。
1.2研究方法
1.2.1OX40、OX40L、PD-1和PD-L1检测:采集研究对象清晨空腹静脉血3 ml,应用CD004-1流式细胞仪,采用EDTA-K2钾盐抗凝法检测OX40、OX40L、PD-1和PD-L1的表达。试剂盒购自上海锐赛生物有限公司,严格按照试剂盒说明书操作。
1.2.2SPD-1检测:采集研究对象清晨空腹静脉血5 ml,1500~1800 r/min离心5 min,取上清,于-40℃的冰箱中保存。采用SPD-1 ELISA检验试剂盒(购于上海羽朵生物科技有限公司),严格按照试剂盒说明书操作。反应后采用酶标仪检测400~500 nm位置的吸光度值。
1.3观测指标 比较两组及各亚组外周静脉血OX40、OX40L、PD-1、PD-L1和SPD-1的表达情况;并比较观察组患者治疗前和治疗后2周时各项指标表达情况。
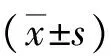
2 结果
2.1两组观测指标比较 观察组CD4+OX40+、CD14+OX40L+、CD19+OX40L+、CD4+PD-1+和CD8+PD-1+及SPD-1表达均高于对照组,CD14+PD-L1+表达明显低于对照组,差异均有统计学意义(P<0.01)。见表1。

表1 原发性干燥综合征与健康对照者OX40、OX40L、PD-1、PD-L1及SPD-1表达情况比较
注:观察组为原发性干燥综合征患者组,对照组为体检健康者组
2.2PSS活动期与非活动期患者观测指标比较 PSS活动期亚组CD4+OX40+、CD14+OX40L+、CD19+OX40L+、CD4+PD-1+及SPD-1表达显著高于非活动期亚组,差异有统计学意义(P<0.05或P<0.01)。见表2。

表2 原发性干燥综合征活动期和非活动期患者OX40、OX40L、PD-1、PD-L1及SPD-1表达比较
2.3PSS不同系统累及患者观测指标比较 PSS单系统亚组CD4+OX40+、CD14+OX40L+、CD19+OX40L+及SPD-1表达明显低于多系统亚组,差异有统计学意义(P<0.05或P<0.01)。见表3。

表3 原发性干燥综合征不同系统累及者OX40、OX40L、PD-1、PD-L1及SPD-1表达比较
2.4PSS患者治疗前后观测指标比较 观察组患者治疗前CD4+OX40+、CD14+OX40L+、CD19+OX40L+和CD4+PD-1+表达显著高于治疗后,比较差异有统计学意义(P<0.05);CD8+PD-1+、CD14+PD-L1+及SPD-1表达治疗前后比较差异无统计学意义(P>0.05)。见表4。
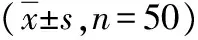
表4 原发性干燥综合征患者治疗前后OX40、OX40L、PD-1、PD-L1及SPD-1表达水平比较
3 讨论
PSS患者血清中出现抗体和异常γ-球蛋白血症的具体病理机制还未研究清楚,但相关研究认为与CD4+T细胞和B细胞不正常激活有密切的联系[14-16]。共刺激信号在T细胞的激发进程中发挥着重要的作用,负刺激信号强度的升高能阻止人体发生反应变化的T细胞激发和增长,阻止免疫性疾病的发生[17]。OX40、OX40L超家族属正共刺激分子,相关文献已经证明其能够促进T细胞的移动、增长、繁殖和分解,同时能记录T细胞的形成,阻止T细胞死亡,并且T细胞能够帮助B细胞的生长成熟和自身抗体的形成[18-19]。OX40和OX40L水平的明显升高和类风湿性关节炎(rheumatoid arthrtis, RA)、过敏性哮喘等自身免疫性疾病的存在和发展有着紧密的联系[19-20]。近年来相关研究表明,给胶原诱导关节炎模型小鼠注射OX40单克隆抗体时,能够阻止γ干扰素(IFN-γ)和IgG的分泌,甚至能对T细胞进行极化,对CIA小鼠模型的RA症状有缓解作用,提示OX40、OX40L和自身免疫性疾病有着紧密的联系[21]。
PD-1和PD-L1是一组负共刺激分子,PD-1主要表达于激发的抗原提呈细胞(APC)表面,能够阻止T细胞激发白细胞介素-2(IL-2)和IFN-γ的分泌,并且能引导T细胞的死亡[22]。PD-1和PD-L1信号出现异常时,和人体发生系统性红斑狼疮、RA、胰岛素依赖型糖尿病等自身免疫性疾病有着紧密的联系[23]。在PSS患者的唾液腺体标本中发现,淋巴细胞中存在高表达的PD-1分子,其导管与腺泡肌上皮细胞中PD-L1高表达,并经免疫组织化学染色证实,50%以上的患者唾液腺淋巴细胞中PD-1为高表达,60%以上的患者导管与腺泡肌上皮细胞中PD-L1存在高表达,进一步提示PD-1和PD-L1的信号异常与PSS的发生和发展密切相关[24-27]。
本研究观察PSS患者的外周静脉血T细胞、B细胞中的OX40、OX40L、PD-1和PD-L1共刺激分子的表达情况,同时依据患者的临床特征、疾病活动情况进行亚组分析。结果显示:①观察组CD4+OX40+、CD14+OX40L+、CD19+OX40L+、CD4+PD-1+和CD8+PD-1+及SPD-1表达均高于对照组,CD14+PD-L1+明显低于对照组,说明PSS患者T细胞中的OX40、PD-1明显上升,并且血清中的OX40L、PD-L1也显著上升,提示4种因子和PSS的发病有着密切的联系。②活动期亚组CD4+OX40+、CD14+OX40L+、CD19+OX40L+、CD4+PD-1+表达显著高于非活动期亚组,说明上述因子水平的高低与疾病的活动情况密切相关。③单系统亚组CD4+OX40+、CD14+OX40L+、CD19+OX40L+表达明显低于多系统亚组,说明上述因子水平的高低与PSS脏器损害情况密切相关。
本研究表示:观察组SPD-1表达均高于对照组,非活动期亚组患者SPD-1表达较活动期亚组患者明显降低,单系统亚组患者SPD-1表达明显低于多系统亚组患者,可推测PSS患者分泌的SPD-1和多余的PD-L1相组合,阻止了T细胞表层的PD-1和PD-L结合,从而使激发的T细胞“躲过”了PD-1和PD-L的控制信号,使T细胞一直激发和增长,人体免疫应答持续,从而加重了PSS的免疫病理损伤。针对PSS的治疗能使T细胞PD-1表达下降,使患者病情得到缓解,但SPD-1和治疗效果无相关性[28-29]。本研究PSS患者治疗后CD4+OX40+、CD14+OX40L+、CD19+OX40L+和CD4+PD-1+表达显著低于治疗前,说明治疗后能够减少患者自身反应,阻止了T细胞的激发和B细胞的分裂,自身抗体分泌情况减少,临床症状缓解。
综上,PSS患者外周静脉血单核细胞和淋巴细胞中OX40、OX40L、PD-1、PD-L1和SPD-1的异常表达,和疾病活动情况、组织损害情况有关联,提示可将OX40、OX40L、PD-1、PD-L1和SPD-1作为PSS的临床免疫指标,但其病理机制还需进一步深入研究。
[1] 江维,赵毅,林辉,等.艾拉莫德治疗原发性干燥综合征疗效观察[J].西部医学,2014,26(6):719-721,724.
[2] 杜雪梅,苏毅,王晓燕,等.小鼠来源的OX40融合蛋白的表达鉴定及优化表达[J].山东医药,2015,58(35):25-27,28.
[3] 刘鹏,汪茜,姜树军.原发性干燥综合征合并周围神经损害临床及病理特点分析[J].武警医学院学报,2012,21(7):536-538.
[4] 黄志芳,李新伦,李红霞,等.Th17细胞及白介素-17在系统性红斑狼疮发病中的作用[J].空军医学杂志,2014,29(1):28-30.
[5] 袁正洲,李作孝,马勋泰,等.来氟米特对实验性变态反应性脑脊髓炎小鼠T细胞亚群及Th1型细胞因子的影响[J].西部医学,2014,26(1):19-22.
[6] Awada A, Nicaise C, Ena S,etal. Potential involvement of the IL-33-ST2 axis in the pathogenesis of primary Sjogren's syndrome[J].Ann Rheum Dis, 2014,73(6):1259-1263.
[7] 姜德训,白云静,赵丽萍,等.艾拉莫德联合治疗原发性干燥综合征临床效果观察[J].临床误诊误治,2016,29(8):90-93.
[8] 陈雪雯,李桂珍,赵俊芳,等.外周血 OX40/OX40L 及抗 C1q 抗体水平对狼疮肾炎的诊断价值[J].山东医药,2015,58(13):31-32.
[9] 黄萍,刘芬,曾振国,等.微小RNA-146a调控肺泡巨噬细胞中白细胞介素-1受体相关激酶1和肿瘤坏死因子受体相关因子6的表达[J].中华危重病急救医学,2014,26(5):300-303.
[10] 蔡尚,田野,徐波,等.放射治疗联合阻断PD-1/PD-L1通路肿瘤免疫治疗的新进展[J].中华放射医学与防护杂志,2016,36(3):235-240.
[11] 王笑颜,邹伟华,吴泉,等.原发性干燥综合征患者IL-17测定及临床意义[J].中华全科医学,2014,12(4):620-621.
[12] Baldini C, Pepe P, Quartuccio L,etal. Primary Sjogren's syndrome as a multi-organ disease: impact of the serological profile on the clinical presentation of the disease in a large cohort of Italian patients[J].Rheumatology (Oxford), 2014,53(5):839-844.
[13] 赵俊山,王勤,温鹏强,等.白细胞介素35+调节性B淋巴细胞在川崎病免疫发病机制中的作用[J].中华实用儿科临床杂志,2015,30(9):662-666.
[14] Kyriakidis N C, Kapsogeorgou E K, Tzioufas A G. A comprehensive review of autoantibodies in primary Sjogren's syndrome: clinical phenotypes and regulatory mechanisms[J].J Autoimmun, 2014,51:67-74.
[15] 逯朝阳,严金川,伍超,等.OX40-OX40L相互作用对小鼠平滑肌细胞亲环素A表达的影响[J].中国动脉硬化杂志,2014,22(6):558-562.
[16] 苗同艳,宫晓飞,李春颖,等.热毒清口服液对老年肺炎大鼠血清中白细胞介素1β和肿瘤坏死因子α水平的影响[J].中华中医药杂志,2016,30(2):611-613.
[17] 马祥,刘洪,李群英,等.地塞米松对哮喘小鼠CD4+ CD25+调节性T细胞及IL-4 TGF-β水平的影响[J].西部医学,2016,28(6):768-771,777.
[18] Mavragani C P, Fragoulis G E, Rontogianni D,etal. Elevated IgG4 serum levels among primary Sjogren's syndrome patients: do they unmask underlying IgG4-related disease?[J].Arthritis Care Res (Hoboken), 2014,66(5):773-777.
[19] 马继慈.肿瘤坏死因子相关的凋亡诱导配体在前列腺癌治疗中的研究进展[J].中华男科学杂志,2015,21(10):941-944.
[20] 吴巧珍,汤颖,张剑峰,等.甘草酸对支气管哮喘小鼠气道炎症的影响机制[J].中华医学杂志,2014,94(42):3338-3344.
[21] Meiners P M, Vissink A, Kroese F G,etal. Abatacept treatment reduces disease activity in early primary Sjogren's syndrome (open-label proof of concept ASAP study)[J].Ann Rheum Dis, 2014,73(7):1393-1396.
[22] 谌双君,庞国进,张栋,等.OX40在免疫耐受中的调节作用[J].国际免疫学杂志,2015,38(4):362-364.
[23] Liang Y, Yang Z, Qin B,etal. Primary Sjogren's syndrome and malignancy risk: a systematic review and meta-analysis[J].Ann Rheum Dis, 2014,73(6):1151-1156.
[24] 崔金元,陶凯雄.生物标志物在阻断PD-1/PD-L1通路治疗肿瘤中的预测性作用[J].国际肿瘤学杂志,2016,43(6):452-454.
[25] Nezos A, Papageorgiou A, Fragoulis G,etal. B-cell activating factor genetic variants in lymphomagenesis associated with primary Sjogren's syndrome[J].J Autoimmun, 2014,51:89-98.
[26] 王丽娜,张薇.系统性红斑狼疮患者外周血CD4+T淋巴细胞中miRNAs表达谱分析[J].西部医学,2014,26(12):1637-1640.
[27] 孔冰,刘艳辉.PD-1/PD-L1在胶质瘤研究进展[J].中华神经外科疾病研究杂志,2016,15(3):284-285.
[28] 陈雪雯,李桂珍,赵俊芳,等.外周血 OX40/OX40L 及抗 C1q 抗体水平对狼疮肾炎的诊断价值[J].山东医药,2015,58(13):31-32.
[29] Yan J, Li Y, Wang Z,etal. Effects of OX40-OX40 ligand interaction on the levels of ROS and Cyclophilin A in C57BL/6J mice atherogenesis[J].Int J Cardiol, 2014,176(2):405-412.
ExpressionsandClinicalSignificancesofOX40,OX40L,PD-1,PD-L1andSPD-1inPeripheralBloodofPatientswithPrimarySjogren'sSyndrome
ZHENG Ge, YUAN Yi-meng
(Department of Blood Rheumatology, the First People's Hospital of Zigong City, Zigong, Sichuan 643000, China)
ObjectiveTo investigate expressions and clinical significances of OX40, OX40L, PD-1, PD-L1 and SPD-1 in peripheral blood of patients with primary Sjogren's syndrome (PSS).MethodsA total of 50 patients with PSS (observation group) admitted during March 2012 and March 2015 were divided into active period subgroup (n=30) and inactivity period subgroup (n=20) according to disease activity conditions, and single system subgroup (n=29) and multisystemic subgroup (n=21) according to active stages. Other 50 healthy people taking medical examinations at the same period were selected as control group. OX40, OX40L, PD-1, PD-L1 and SPD-1 expressions in peripheral venous blood were detected by immunofluorescence labeling and flow cytometry methods in two groups. OX40, OX40L, PD-1, PD-L1 and SPD-1 expressions were compared in groups and subgroups, and changes of the above indexes before and after treatment were recorded in observation group.ResultsIn observation group, CD4+OX40+, CD14+OX40L+, CD19+OX40L+, CD4+PD-1+and CD4+PD-1L+and SPD-1 expressions were significantly higher, while CD14+PD-L1+was significantly lower than those in control group (P<0.01). CD4+OX40+, CD14+OX40L+, CD19+OX40L+, CD4+PD-1+and SPD-1 expressions in active period subgroup were significantly higher than those in inactivity period subgroup (P<0.05 orP<0.01); CD4+OX40+, CD14+OX40L+, CD19+OX40L+and SPD-1 expressions in single system subgroup were significantly lower than those in multisystemic subgroup (P<0.05 orP<0.01). In 10 preliminary diagnosis patients in observation group, CD4+OX40+, CD14+OX40L+, CD19+OX40L+and CD4+PD-1+expressions before treatment were significantly higher than those after treatment (P<0.05); there were no significant differences in CD8+PD-1+, CD14+PD-L1+and SPD-1 expression between before and after treatment (P>0.05).ConclusionAbnormal expressions of OX40, OX40L, PD-1, PD-L1 and SPD-1 in peripheral venous blood of PSS patients relate to disease activity and tissue damage, and the expressions can be used as detection indexes for learning disease activity conditions and severe degree.
Sjogren's syndrome; Pathogenetic condition; OX40; OX40L; PD-1; PD-L1
四川省卫生厅科研课题资助(120003)
643000 四川 自贡,自贡市第一人民医院血液风湿科
R593.22
A
1002-3429(2017)10-0083-05
10.3969/j.issn.1002-3429.2017.10.028
2017-01-12 修回时间:2017-05-14)
