单药多西他赛与多西他赛联合顺铂治疗胸腺瘤合并重症肌无力的临床疗效研究
2017-11-01乞国艳顾珊珊杨红霞刘朝英张晓静
乞国艳,刘 鹏,顾珊珊,杨红霞,刘朝英,张晓静
·论著·
单药多西他赛与多西他赛联合顺铂治疗胸腺瘤合并重症肌无力的临床疗效研究
乞国艳*,刘 鹏,顾珊珊,杨红霞,刘朝英,张晓静
目的探讨单药多西他赛与多西他赛联合顺铂治疗胸腺瘤合并重症肌无力(MG)的临床疗效,以期为临床医生提供新的治疗思路。方法选取2008年1月—2015年12月就诊于石家庄市第一医院的明确诊断为胸腺瘤合并MG患者106例。2008年1月—2015年1月应用多西他赛联合顺铂治疗的胸腺瘤合并MG患者(DP组)66例,包括20例胸腺瘤术后出现转移胸腺瘤患者;2012年1月—2015年12月应用单药多西他赛治疗胸腺瘤合并MG患者(D组)40例,包括17例胸腺瘤术后出现转移胸腺瘤患者。两组分别给予相应药物治疗,比较两组患者治疗前后临床绝对评分、乙酰胆碱受体抗体(AchRAb)、MG临床疗效、毒副作用发生情况。结果两组治疗前临床绝对评分、AchRAb比较,差异无统计学意义(P>0.05)。两组治疗后临床绝对评分、AchRAb比较,差异无统计学意义(P>0.05)。两组治疗后临床绝对评分、AchRAb低于治疗前(P<0.05)。两组MG临床疗效比较,差异无统计学意义(P>0.05)。DP组患者毒副作用发生率高于D组(P<0.05)。结论单药多西他赛与多西他赛联合顺铂治疗胸腺瘤合并MG患者的疗效无差异,但单药多西他赛的毒副作用小。
胸腺肿瘤;重症肌无力;顺铂;治疗结果
乞国艳,刘鹏,顾珊珊,等.单药多西他赛与多西他赛联合顺铂治疗胸腺瘤合并重症肌无力的临床疗效研究[J].中国全科医学,2017,20(30):3753-3758.[www.chinagp.net]
QI G Y,LIU P,GU S S,et al.Clinical efficacy of docetaxel alone versus docetaxel combined with cisplatin in the treatment of thymoma with myasthenia gravis[J].Chinese General Practice,2017,20(30):3753-3758.
重症肌无力(MG)是累及神经肌肉接头、细胞免疫依赖、体液免疫介导、补体参与的一种获得性自身免疫疾病[1-2],其发病机制为体内产生的乙酰胆碱受体(AchR)抗体(AchRAb)在补体参与下与突触后膜的AchR产生应答,大量AchR被破坏,无法产生足够的终板电位,导致突触后膜传导障碍,从而发生肌无力。但是,引起MG免疫应答的始动环节仍不清楚。80%的MG患者同时有胸腺肥大、淋巴小结增生、生发中心增多,10%~20%的患者有胸腺瘤,而胸腺瘤患者中有40%合并MG[3]。胸腺切除后70%患者的临床症状改善或痊愈,因此认为胸腺瘤和MG的发生有着密切关系[4]。本课题组前期研究发现,多西他赛联合顺铂对胸腺瘤合并MG患者的MG缓解疗效显著,而对转移性胸腺瘤的疗效不明显[5]。且两药联合化疗的毒副作用较大,因此本研究采用单药多西他赛与多西他赛联合顺铂治疗胸腺瘤合并MG进行临床疗效比较,旨在探索一种新的内科治疗方法,既可降低患者经济负担、毒副作用发生率,又可改善MG症状。
1 资料与方法
1.1 诊断标准
1.1.1 MG诊断标准 (1) 临床表现:眼睑下垂、复视、斜视;四肢无力;吞咽咀嚼困难,呼吸困难等。(2)新斯的明试验阳性。(3)AchRAb阳性。(4)肌电图提示重频电刺激低频衰减,高频无递增[6]。符合其中2项即可诊断。
1.1.2 胸腺瘤诊断标准 (1)胸腺瘤切除术后病理检查明确胸腺瘤诊断,根据WHO胸腺肿瘤国际组织学分类标准进行病理分型[7],分为A、AB、B1、B2、B3 五型;(2)胸腺瘤分期术后病理分期参照Masaoka分期[8]。
1.2 纳入及排除标准 纳入标准:(1)MG诊断明确;(2)胸腺瘤术后病理明确;(3)年龄25~83岁。排除标准:合并肝肾功能不全等严重并发症。
1.3 一般资料 选取2008年1月—2015年12月就诊于石家庄市第一医院的明确诊断为胸腺瘤合并MG患者106例,其中男60例,女46例;年龄25~83岁,平均年龄(47.2±10.7)岁;平均病程(38.5±53.8)个月;A型胸腺瘤合并MG 2例,AB型胸腺瘤合并MG 4例,B1型胸腺瘤合并MG 24例,B2型胸腺瘤合并MG 43例,B3型胸腺瘤合并MG 11例,B1/B2型胸腺瘤合并MG 4例,B2/B3型胸腺瘤合并MG 18例。2008年1月—2015年1月应用多西他赛联合顺铂治疗胸腺瘤合并MG患者(DP组)66例,包括20例胸腺瘤术后出现转移胸腺瘤患者;2012年1月—2015年12月应用单药多西他赛治疗胸腺瘤合并MG患者(D组)40例,包括17例胸腺瘤术后出现转移胸腺瘤患者。两组胸腺瘤合并MG患者性别、年龄、病程、Masaoka分期、胸腺瘤分型比较,差异无统计学意义(P>0.05,见表1)。两组转移性胸腺瘤合并MG患者性别、年龄、病程、Masaoka分期、胸腺瘤分型比较,差异无统计学意义(P>0.05,见表2)。

表1 两组胸腺瘤合并MG患者一般资料比较
注:a为t值,b为Z值,余为χ2值
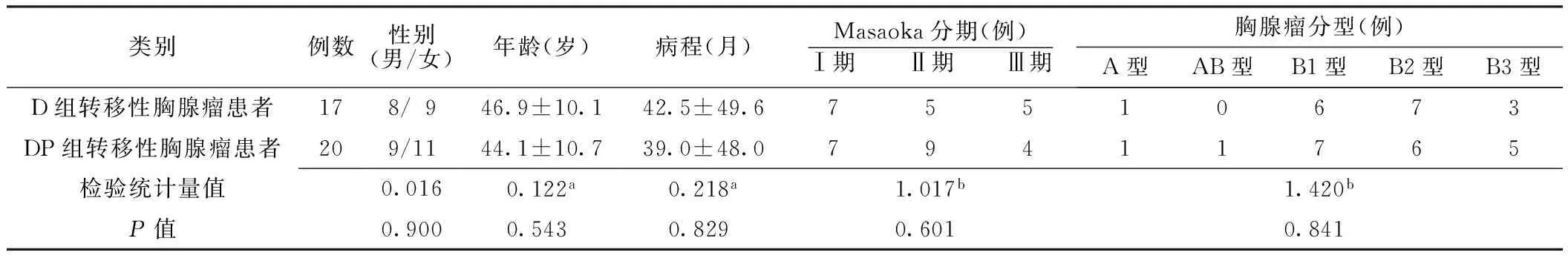
表2 两组中转移性胸腺瘤患者一般资料比较
注:a为t值,b为Z值,余为χ2值
1.4 治疗方法 DP组患者均给予多西他赛(江苏恒瑞医药股份有限公司)75 mg/m2+顺铂(江苏奥赛康药业股份有限公司)70 mg/m2方案治疗1次,21 d后重复治疗1次;D组患者均给予单药多西他赛75 mg/m2方案治疗1次,21 d后重复治疗1次。两组均治疗2个周期。
1.5 临床疗效评价
1.5.1 MG临床疗效评价 MG严重程度判定标准采用许贤豪临床绝对评分法[9],临床疗效判定标准采用临床相对评分法。临床相对评分=(治疗前绝对评分-治疗后绝对评分)/治疗前绝对评分×100%。临床相对评分≥95%为临床痊愈,80%~94%为基本痊愈,50%~79%为显效,25%~49%为好转,<25%为无效。两组治疗第2个周期结束后,随访3个月进行临床疗效评价。
1.5.2 胸腺瘤临床疗效评价 胸腺瘤临床疗效评价参照实体瘤疗效评价标准(RECIST)[10]。完全缓解(CR):治疗后原有可见肿瘤消失;部分缓解(PR):肿瘤最大直径与治疗前比较缩小>30%;疾病稳定(SD):肿瘤最大直径与治疗前比较缩小≤30%或增长≤20%;疾病进展(PD):肿瘤最大直径与治疗前比较增长>20%。临床疗效显效包括CR及PR,临床疗效不显效包括SD及PD。
1.6 AchRAb检测 方法:国际认可的放射免疫沉淀法进行检测[11]。
1.6.1 仪器和试剂 AchRAb放射免疫检测试剂盒(英国RSR有限公司)内容:125I-AchR、阴性对照、阳性对照、抗人IgG、正常人血清、洗液、缓冲液、促沉淀剂,25T/盒。所需其他物品:3.5 ml试管(应用促沉淀剂时推荐使用圆底试管)、试管架、移液器(5 μl、25 μl、50 μl、100 μl、1 ml)、离心机(1 500×g)、震动混匀器、吸引管、γ放射免疫计数器(科大创新股份有限公司中佳分公司)。
1.6.2 检测步骤 所有试剂室温20~25 ℃放置30 min后方可进行检测。阴性对照、阳性对照、待测患者血清(未稀释)5 μl加入2个检测管中(校准移液器可提高检测精度);每管内加入50 μl125I-AchR;震动混匀器充分混匀后,盖好管盖;室温孵育2 h,每管内加入50 μl 抗人IgG;震动混匀器充分混匀后,盖好管盖;2~8 ℃孵育2 h(如必要,可2~8 ℃孵育过夜);每管内加入25 μl促沉淀剂(此步骤可选择);每管内加入1 ml冷洗剂,震动混匀器充分混匀;2~8 ℃离心20 min,转速为1 500×g;吸出或倒掉上清液,每管内加入1 ml冷洗剂,震动混匀器充分混匀;2~8 ℃离心20 min,转速为1 500×g;吸出或倒掉上清液,γ放射免疫计数器检测,每管2 min。
1.6.3 结果分析[12]最终沉淀物的放射活性与待检测AchRAb结合的标记AchR的量成正比,可用下列公式表达:
上述公式中,A代表125I标记后到检测时的放射衰减因子;B代表计数仪效率;C代表待测样本加样量(μl);K代表125I标记AchR同时标记银环蛇毒素的特异放射活性(Ci/mmol)。每个试剂盒内均提供相应的A、C、K值。
1.6.4 检测结果校正[12]作为上述公式的补充校正值(英国RSR有限公司提供:0.25、1.40、8.00 nmol/L,见实际浓度质控表的标准曲线),每次检测的AchRAb均可通过校正曲线进行校正(不同批号的试剂盒校正浓度不同)。
检测结果线性度:在一定范围,检测的AchRAb与cpm成单一线性相关。为了克服这个问题,抗体阳性的血清可用正常人血清进行稀释后检测,因此,可在线性范围内计算AchRAb浓度。每位患者线性相关数值范围不同,但一般为0.5~5.0 nmol/L。阴性对照:<0.5 nmol/L;阳性对照:≥0.5 nmol/L。
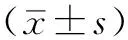
2 结果
2.1 两组治疗前后临床绝对评分比较 两组治疗前、治疗后临床绝对评分比较,差异无统计学意义(P>0.05);两组治疗后临床绝对评分低于治疗前,差异有统计学意义(P<0.05,见表3)。

Table3 Clinical absolute scores in group D and group DP assessed before and after treatment

组别例数治疗前治疗后t配对值P值D组4013.7±8.43.0±3.916.099<0.001DP组6614.5±7.03.4±4.36.750<0.001t值-0.310-0.453P值0.6810.652
2.2 两组MG临床疗效比较 两组MG临床疗效比较,差异无统计学意义(P>0.05,见表4)。
2.3 两组转移性胸腺瘤患者胸腺瘤临床疗效比较 D组17例转移胸腺瘤患者中CR 1例,PR 3例,SD 13例,显效率为23.5%(4/17);DP组20例转移胸腺瘤患者中CR 3例,PR 3例,SD 12例,PD 2例,显效率为30.0%(6/20)。两组转移胸腺瘤患者胸腺瘤临床疗效比较,差异无统计学意义(χ2=0.005,P=0.944)。

表4 两组患者MG临床疗效比较〔n(%)〕
2.4 两组治疗前后AchRAb比较 两组治疗前后AchRAb比较,差异无统计学意义(P>0.05);两组治疗后AchRAb低于治疗前,差异有统计学意义(P<0.05,见表5)。

Table5 AchRAb levels in group D and group DP measured before and after treatment

组别例数治疗前治疗后t配对值P值D组408.9±3.36.8±4.33.3800.002DP组668.4±3.36.2±3.43.3690.001t值0.6390.688P值0.5250.493
注:AchRAb=乙酰胆碱受体抗体
2.5 两组毒副作用发生率比较 D组10例(25.0%)发生毒副作用,其中8例出现Ⅲ度以上骨髓抑制,2例出现恶性呕吐症状。DP组47例(71.2%)发生毒副作用,其中19例出现Ⅲ度以上骨髓抑制,28例出现恶性呕吐症状。DP组毒副作用发生率高于D组,差异有统计学意义(χ2=32.290,P<0.001)。
3 讨论
MG是一种累及神经肌肉接头的自身免疫性疾病,80%以上的患者与胸腺有关,其中10%~20%患者合并胸腺瘤,而40%胸腺瘤患者合并MG[9]。70%以上MG患者体内AchRAb检测为阳性,20%左右存在其他自身免疫抗体[10]。胸腺瘤为来源于胸腺上皮的肿瘤,是最常伴发自身免疫疾病的肿瘤之一。胸腺瘤伴MG患者在切除胸腺瘤后,MG症状得到明显改善,因此,胸腺瘤可能是导致MG的因素,而MG是自身免疫性疾病,胸腺瘤可能引发自身免疫性疾病的机制在合并MG患者中得到了发现[13-15],因此MG与胸腺瘤之间存在着密切联系。WHO胸腺肿瘤国际组织学分类标准病理分型分为A、AB、B1~3、C型[7],其中合并MG的患者以B2、B1、AB型为主,A型及B3型的比例<10%[16-17]。本研究106例胸腺瘤合并MG患者,A型胸腺瘤合并MG 2例,AB型胸腺瘤合并MG 4例,B1型胸腺瘤合并MG 24例,B2型胸腺瘤合并MG 43例,B3型胸腺瘤合并MG 11例,B1/B2型胸腺瘤合并MG 4例,B2/B3型胸腺瘤合并MG 18例,符合上述研究的分类比例。
胸腺瘤合并MG发病机制尚未完全明确,目前推出了3种理论机制,包括免疫逃逸理论机制,遗传学理论机制和 AIRE理论机制[18-19],均与自身免疫息息相关。目前胸腺瘤临床治疗首选手术[20],对于不宜手术者考虑放疗及化疗[21]。胸腺瘤是对化疗敏感的肿瘤,其总有效率约为70%,完全缓解率约占1/3[22]。治疗胸腺瘤疗效肯定的药物有顺铂、依托泊苷、阿霉素、异环磷酰胺和皮质激素,应用含铂类的联合化疗具有较好效果[21]。但是化疗对胸腺瘤治疗的有效方案及剂量仍未达成共识。关于胸腺瘤合并MG患者的化疗,国内外尚未发现大宗病例报道。
紫杉醇作为一种抗癌药物其疗效已得到临床公认[23-24],作用机制是通过稳定细胞内微管系统而发挥抗肿瘤作用,因而可对多种细胞功能产生影响,特别是可对机体的免疫细胞产生影响。研究显示,紫杉醇具备一定的免疫抑制作用[25-26]。有动物实验研究表明紫杉醇可以预防治疗类风湿关节炎[27]和多发性硬化症[28]等自身免疫疾病,体外实验发现,经紫杉醇作用后,T淋巴细胞内干扰素γ(IFN-γ)明显下降,同时正常人和肿瘤患者T细胞的杀伤活性降低,抑制T淋巴细胞功能[29]。体外实验中还发现,紫杉醇可影响NK细胞在白介素2(IL-2)培养系中的生长,应用免疫荧光和电子显微镜观察紫杉醇作用后的淋巴细胞,发现紫杉醇并不直接对淋巴细胞产生毒副作用,也不改变淋巴细胞与靶细胞的结合力,而是降低了淋巴细胞溶解靶细胞的动力和淋巴细胞的再生能力[30]。因此紫杉醇有显著的免疫抑制作用,而顺铂对胸腺瘤有治疗作用,两者联合对胸腺瘤和MG均有治疗作用。
紫杉醇和多西他赛的相同点为均是紫杉类特征结构,4、5位均含氧四环结构[31-32]。不同点为多西他赛相应部位为烷氧基,而紫杉醇相应部位为苯甲酰苯基;多西他赛相应部位为羟基,而紫杉醇相应部位为乙酰基;多西他赛取代基团空间位阻小极性基团亲水性强,因此多西他赛与微管蛋白的亲和力是紫杉醇的2倍;过敏性休克较紫杉醇少。
本研究结果显示,胸腺瘤合并MG患者MG临床绝对评分和AchRAb在治疗前后有显著改善,而两组间MG疗效无统计学差异;两组转移胸腺瘤患者胸腺瘤临床疗效比较无差异。DP组毒副作用发生率高于D组。
因此,单药多西他赛治疗对胸腺瘤合并MG的毒副作用小,具有一定的免疫抑制作用,有可能为不能使用糖皮质激素的MG患者提供一种新的治疗方法,也为自身免疫性疾病的治疗提供新思路,但对转移胸腺瘤的疗效尚有待进一步研究。
作者贡献:乞国艳进行研究设计与实施、资料收集整理、撰写论文并对文章负责;顾珊珊、杨红霞、张晓静进行研究实施、评估、资料收集;刘朝英进行论文的修订、英文的修订;刘鹏进行质量控制及审校。
本文无利益冲突。
本文不足:
本研究中A型胸腺瘤患者只有2例,AB型胸腺瘤只有4例,样本量不足,对于A型和AB型胸腺瘤合并重症肌无力患者应用多西他赛治疗的临床疗效判定有一定缺陷。对于转移性胸腺瘤合并重症肌无力患者,单药多西他赛和多西他赛联合顺铂治疗疗效有待大样本研究。
[1]ARREDONDO-PROVECHO A B,GAREIA-HEDRERA F J,MARTINEZ-PIEROLA M M.Characteristics of patients with methicillin-resistant Staphylococcus aureus infection[J].Enferm Clin,2009,19(2):69-75.DOI:10.1016/j.enfcli.2008.10.009.
[2]JUNG C,STOECKLE C,WIESMÜLLER K H,et al.Complementary strategies to elucidate T helper cell epitopes in myasthenia gravis[J].J Neuroimmunol,2008,201/202:41-49.DOI:10.1016/j.jneuroim.2008.06.010.
[3]OKUMURA,M,FUJII Y,SHIONO H,et al.Immunological function of thymoma and pathogenesis of paraneoplastic myasthenia gravis[J].Gen Thorac Cardiovasc Surg,2008,56(4):143-150.DOI:10.1007/s11748-007-0185-8.
[4]MÜLLER-HERMELINK H K,MARX A.Thymoma[J].Curr Opin Oncol,2000,12(5):426-433.
[5]QI G Y,LIU P,DONG H M,et al.Therapeutic potential of docetaxel plus cisplatin chemotherapy for myasthenia gravis patients with metastatic thymoma[J].Tohoku J Exp Med,2017,241(4):281-286.DOI:10.1620/tjem.241.281.
[6]LI Z Y.China guidelines for the diagnosis and treatment of myasthenia gravis[J].Neuroimmunol and Neuroinfammation,2016,3(1):1-9.DOI:10.20517/2347-8659.2015.60.
[7]TRAVIS W D,BRAMBILLA E,BURKE A P,et al.WHO Classification of Tumours of the Lung,Pleura,Thymus and Heart[M].4th ed.Lyon:LARC Press,2015:187-204.
[8]MASAOKA A,MONDEN Y,NAKAHARA K,et al.Follow‐up study of thymomas with special reference to their clinical stages[J].Cancer,1981,48(11):2485-2492.
[9]许贤豪.肌无力——临床与基础[M].北京:中国协和医科大学出版社,2003:48-51.
XU X H.Weakness- Clinical and Basic[M].BeiJing:Peking Union Medical College Press,2003:48-51.
[10]ZHANG L M,ZHAO W,LIU G J,et al.Expressions of CEA and CA153 in the serum of breast cancer patients and their clinical significances[J].Journal of the Fourth Military Medical University,2007,28(4):307-309.
[11]GILHUS N E,VERSCHUUREN J J.Myasthenia gravis:subgroup classification and therapeutic strategies[J].Lancet Neurol,2015,14(10):1023-1036.DOI:10.1016/S1474-4422(15)00145-3.
[12] 乞国艳,刘鹏,顾珊珊,等.健脾益气补肝健肾中药治疗重症肌无力眼肌型患儿的AchR-Ab的临床研究[J].中华中医药学刊,2017,35(3):624-628.
[13]EVOLI A,LANCASTER E.Paraneoplastic disorders in thymoma patients[J].J Thoracic Oncol,2012,9(9 suppl 2):143-147.DOI:10.1097/JTO.0000000000000300.
[14]MARX A,WILLCOX N,LEITE M I,et al.Thymoma and paraneoplastic myasthenia gravis[J].Autoimmunity,2010,43(5/6):413-427.DOI:10.3109/08916930903555935.
[15]CHOI DECROOS E,HOBSON WEBB L D,JUEL V C,et al.Do acetylcholine receptor and striated muscle antibodies predict the presence of thymoma in patients with myasthenia gravis?[J].Muscle Nerve,2014,49(1):30-34.DOI:10.1002/mus.23882.
[16]MAGGI L,ANDREETTA F,ANTOZZI C,et al.Thymoma-associated myasthenia gravis:outcome,clinical and pathological corrections in 197 patients on a 20-year experience[J].J Neuroimmunol,2008,201/202:237-244.DOI:10.1016/j.jneuroim.2008.07.012.
[17]CHEN G,MAR X A,CHEN W H,et al.New WHO histologic classification predicts prognosis of thymic epithelial tumors:a clinicopathologic study of 200 thymoma cases from China[J].Cancer,2002,95(2):420-429.DOI:10.1002/cncr.10665.
[18]SHELLY S,AGMON-LEVIN N,ALTMAN A,et al.Thymoma and autoimmunity[J].Cell Mol Immunol,2011,8(3):199-202.DOI:10.1038/cmi.2010.74.
[19]KISAND K,LILIC D,CASANOVA J L,et al.Mucocutaneous candidiasis and autoimmunity against cytokines in APECED and thymoma patients:clinical and pathogenetic implications[J].Eur J Immunol,2011,41(6):1517-1527.DOI:10.1002/eji.201041253.
[20]WRIGHT C D.Management of thymomas[J].Crit Rev Oneol Henatol,2008,65(2):109-120.DOI:10.1016/j.critrevonc.2007.04.005.
[21]LOEHRER P J Sr.Current approaches to the treatment of thymoma[J].Ann Med,1999,31(Suppl 2):73-79.
[22]董志伟,谷铣之.临床肿瘤学[M].北京:人民卫生出版社,2002:823-824.
DONG Z W,GU X Z.Clinical Oncology[M].Beijing:People′s Medical Publishing House,2002:823-824.
[23]DEZUBEN B J.New therapies for the treatment of AIDS-related Kaposi sarcoma[J].Currn Opin Oncol,2000,12(5):445-449.
[24]FIGGITTN D P,WISEMAN L R.Docetaxel:an update of its use in advanced breast cancer[J].Drugs,2000,59(3):621-651.
[25]IESALNIEKS I,TANGE S,SCHERER M N,et al.Paclitaxel promotes liver graft survival in 5 rats and inhibits hepatocellular carcinoma growth in vitro and is a potentially useful drug for transplant patients with liver cancer[J].Transplant Proc,2002,34(6):2316-2317.
[26]TANGE S,SCHERER M N,GRAEB C,et al.The antineoplastic drug Paclitaxel has immunosuppressive properties that can effectively promote allograft survival in a rat heart transplant model[J].Transplantation,2002,73(2):216-223.
[27]PARRISH-NOVAK J,DILLON S R,NELSON A,et al.Interleukin 21 and its receptor are involved in NK cell expansion and regulation of lymphocyte function[J].Nature,2000,408(6808):57-63.DOI:10.1038/35040504.
[28]陈国兵,王净.060γc家族新成员:白细胞介素21[J].国外医学:免疫学分册,2003,26(4):183-186.DOI:10.3760/cma.j.issn.1673-4394.2003.04.005.
CHEN G B,WANG J.A new member of the gamma C family:Interleukin 21[J].Foreing Medical Sciences,2003,26(4):183-186.DOI:10.3760/cma.j.issn.1673-4394.2003.04.005.
[29]MULLINS D W,KOCI M D,BURGAR C J,et al.Interleakin-12 overcomes paclitaxel-mediated suppression of T cell proliferation[J].Immunopharmacol Immnotoxieol,1998,20(4):473-492.DOI:10.3109/08923979809031511.
[30]CHUANG L T,LOTZOVA E,HEATH J,et al.Alteration of lymphocyte mierotubule assembly,cytotoxicity and activation by the anticaner drug taxol[J].Cancer Res,1994,54(9):2523-2524.
[31]成莉,李琳,邢辉,等.促红细胞生成素对晚期卵巢癌经紫杉醇化疗所致神经毒性损伤的保护作用研究[J].中国全科医学,2014,17(29):3453-3456.DOI:10.3969/j.issn.1007-9572.2014.29.013.
CHENG L,LI L,XING H,et al.Protection role of EpO in neurovirulent damages caused by paclitaxel chemotherapy in patients with advanced ovarian cancers[J].Chinese General Practice,2014,17(29):3453-3456.DOI:10.3969/j.issn.1007-9572.2014.29.013.
[32]高琴,张丹丹,白帆,等.紫杉醇联合铂类方案治疗中晚期宫颈癌患者的临床疗效及对血清 CYFRA21-1、SCC-Ag 的影响[J].疑难病杂志,2015,14(1):53-56.DOI:10.3969/j.issn.1671-6450.2015.01.016.
GAO Q,ZHANG D D,BAI F,et al.Clinical efficacy of paclitaxel combined with platinum regimen on patients with advanced cervical cancer and the effect on serum CYFRA21-1,SCC-Ag[J].Chinese Journal of Difficult and Complicated Cases,2015,14(1):53-56.DOI:10.3969/j.issn.1671-6450.2015.01.016.
ClinicalEfficacyofDocetaxelAloneVersusDocetaxelCombinedwithCisplatinintheTreatmentofThymomawithMyastheniaGravis
QIGuo-yan*,LIUPeng,GUShan-shan,YANGHong-xia,LIUChao-ying,ZHANGXiao-jing
MyastheniaGravisTreatmentCenter,theFirstHospitalofShijiazhuang,Shijiazhuang050000,China
*Correspondingauthor:QIGuo-yan,Professor,Chiefphysician;E-mail:qiguoyan1106@sina.com
ObjectiveTo investigate the clinical efficacy of docetaxel alone versus docetaxel combined with cisplatin in the treatment of thymoma with myasthenia gravis(MG),with a view to providing new treatment ideas for clinicians.MethodsWe enrolled 106 patients who were diagnosed with thymoma and MG and
treatment in the First Hospital of Shijiazhuang from January 2008 to December 2015 and divided them into two groups,group DP(66 cases including 20 with metastatic thymoma after thymoma surgery ) receiving docetaxel combined with cisplatin between January 2008 and January 2015,and group D(40 cases including 17 with metastatic thymoma after thymoma surgery ) receiving docetaxel alone between January 2012 and December 2015.The clinical absolute score was assessed and acetylcholine receptor antibody(AchRAb) level was measured before and after treatment.The clinical efficacy of MG and toxic side effects were observed.ResultsBefore treatment,both groups showed similar clinical absolute scores and AchRAb levels(P>0.05);after treatment,they still presented similar clinical absolute scores and AchRAb levels(P>0.05).After treatment,the clinical absolute scores and AchRAb levels decreased significantly in group DP as well as group D(P<0.05).The effect of treatment for MG did not differ significantly between the groups(P>0.05).The incidence of toxic side effects in group DP was higher than that in group D(P<0.05).ConclusionFor thymoma with MG,docetaxel alone and docetaxel combined with cisplatin can achieve similar clinical efficacy,but docetaxel has less side effects.
Thymus neoplasms;Myasthenia gravis;Cisplatin;Treatment outcome
R 736.3
A
10.3969/j.issn.1007-9572.2017.00.076
2017-04-15;
2017-07-03)
(本文编辑:崔莎)
河北省自然科学基金资助项目(H2015106020);石家庄市科技局指导项目(131460613);河北省科技计划项目(14277758D);河北省中医药管理局项目(2014221)
050000 河北省石家庄市第一医院重症肌无力诊疗中心
*通信作者:乞国艳,教授,主任医师;E-mail:qiguoyan1106@sina.com
