非布司他与别嘌呤醇治疗原发性痛风的疗效及其对胰岛素抵抗的影响研究
2017-11-01袁晓旭路跃武
孟 娟,袁晓旭,路跃武
·论著·
非布司他与别嘌呤醇治疗原发性痛风的疗效及其对胰岛素抵抗的影响研究
孟 娟,袁晓旭,路跃武*
目的比较非布司他与别嘌呤醇治疗原发性痛风的疗效及其对胰岛素抵抗(IR)的影响。方法选取2013年11月—2015年5月首都医科大学附属北京朝阳医院门诊收治的符合纳入标准的原发性痛风患者52例为研究对象。使用SPSS 19.0软件将患者按1∶1的比例随机分为非布司他组(给予非布司他片)及别嘌呤醇组(给予别嘌呤醇片)。收集患者一般资料,分别检测患者治疗前和治疗24周末血清尿酸(UA)、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、肌酐(Cr)、空腹血糖(FBG)、空腹胰岛素(INS)水平,计算稳态模型评估胰岛素抵抗指数(HOMA-IR)。结果治疗前两组UA、AST、ALT、Cr、FBG、INS水平和HOMA-IR比较,差异无统计学意义(P>0.05);治疗后非布司他组UA、INS水平低于别嘌呤醇组(P<0.05);治疗后两组AST、ALT、Cr、FBG水平和HOMA-IR比较,差异无统计学意义(P>0.05)。别嘌呤醇组治疗后UA水平低于治疗前(P<0.05);非布司他组治疗后UA、INS水平和HOMA-IR低于治疗前(P<0.05)。结论非布司他比别嘌呤醇能更有效地控制原发性痛风患者血清UA水平,并能改善IR情况。
痛风;疗效比较研究;别嘌呤醇;胰岛素抵抗;非布司他
孟娟,袁晓旭,路跃武.非布司他与别嘌呤醇治疗原发性痛风的疗效及其对胰岛素抵抗的影响研究[J].中国全科医学,2017,20(30):3745-3748.[www.chinagp.net]
MENG J,YUAN X X,LU Y W.Efficacy of febuxostat versus allopurinol in the treatment of primary gout and their effects on insulin resistance[J].Chinese General Practice,2017,20(30):3745-3748.
痛风是嘌呤代谢障碍、血尿酸升高引起组织损伤的一组异质性疾病,典型的临床表现包括急/慢性痛风性关节炎、痛风石沉积、肾损害和肾结石等[1]。胰岛素抵抗(IR)是指胰岛素作用的靶器官对胰岛素作用的敏感性下降,即正常剂量的胰岛素产生低于正常生物学效应的一种状态[2-3]。目前研究认为,IR与动脉粥样硬化性疾病的发生、发展密切相关,是心血管疾病的危险因素[4]。痛风患者存在不同程度的IR,IR可以引起痛风患者血糖和血脂代谢紊乱,进而增加痛风患者心血管疾病风险[5-7]。2012年美国风湿病学会(ACR)痛风治疗指南[8]推荐别嘌呤醇或非布司他为治疗痛风的一线降尿酸(UA)药物,虽然别嘌呤醇的疗效肯定,但严重超敏反应综合征使其在临床使用受到限制[9]。非布司他是一种新型非嘌呤类选择性黄嘌呤氧化酶(XO)抑制剂[10],其降UA的疗效肯定,但对痛风患者IR影响的报道较少。本研究旨在通过检测非布司他、别嘌呤醇治疗前后原发性痛风患者血清UA、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、肌酐(Cr)、空腹血糖(FBG)、空腹胰岛素(INS)水平和稳态模型评估胰岛素抵抗指数(HOMA-IR)的变化,比较非布司他和别嘌呤醇治疗原发性痛风的疗效及其对IR的影响,以期为临床治疗提供借鉴。
1 对象与方法
1.1 纳入与排除标准 纳入标准:(1)签署知情同意书并能遵守研究方案要求;(2)年龄20~70岁;(3)既往有痛风发作史,符合ACR急性痛风关节炎的诊断标准[11];(4)血清UA≥480 μmol/L。排除标准:糖尿病、甲状腺疾病、肾脏病、心脑血管疾病,急/慢性炎症性疾病、严重肝肾功能不全、自身免疫性疾病、血液系统疾病、恶性肿瘤,使用过胰岛素、皮质醇激素、噻唑烷二酮类、血管紧张素转换酶抑制剂、双胍类、噻嗪类利尿剂等各种影响胰岛素敏感性的药物。
1.2 研究对象及分组 选取2013年11月—2015年5月首都医科大学附属北京朝阳医院门诊收治的符合纳入标准的原发性痛风患者52例为研究对象。其中男47例,女5例;年龄20~67岁,平均年龄(44.5±12.5)岁。使用SPSS 19.0软件将患者按1∶1的比例随机分为非布司他组及别嘌呤醇组。本研究经首都医科大学附属北京朝阳医院伦理委员会审批同意。
1.3 研究方法
1.3.1 一般资料收集 收集患者一般资料,包括性别、年龄、身高、体质量、血压〔收缩压(SBP)、舒张压(DBP)〕、病程,计算体质指数(BMI)。
1.3.2 治疗方法 非布司他组给予非布司他片,40 mg/片,1片·次-1·d-1;别嘌呤醇组给予别嘌呤醇片,300 mg/片,1片/次,3次/d。两组均治疗24周。
1.4 观察指标 分别于治疗前和治疗24周末采集患者清晨空腹静脉血5 ml,采用DXC800全自动生化分析仪(美国Beckman Coulter公司)检测血清UA、AST、ALT、Cr、FBG、INS水平,计算HOMA-IR,HOMA-IR=INS(mU/L)×FBG(mmol/L)/22.5[12-13],HOMA-IR>2.8定义为有IR。
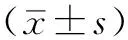
2 结果
2.1 两组一般资料比较 两组性别、年龄、BMI、SBP、DBP、病程比较,差异无统计学意义(P>0.05,见表1)。
2.2 两组治疗前后观察指标比较 治疗前两组UA、AST、ALT、Cr、FBG、INS水平和HOMA-IR比较,差异无统计学意义(P>0.05);治疗后非布司他组UA、INS水平低于别嘌呤醇组,差异有统计学意义(P<0.05);治疗后两组AST、ALT、Cr、FBG水平和HOMA-IR比较,差异无统计学意义(P>0.05)。别嘌呤醇组治疗后UA水平低于治疗前,差异有统计学意义(P<0.05);非布司他组治疗后UA、INS水平和HOMA-IR低于治疗前,差异有统计学意义(P<0.05,见表2)。

表1 两组一般资料比较
注:a为χ2值;BMI=体质指数,SBP=收缩压,DBP=舒张压,1 mm Hg=0.133 kPa

表2 两组治疗前后观察指标比较
注:UA=尿酸,AST=天冬氨酸氨基转移酶,ALT=丙氨酸氨基转移酶,Cr=肌酐,FBG=空腹血糖,INS=空腹胰岛素,HOMA-IR=稳态模型评估胰岛素抵抗指数;与本组治疗前比较,aP<0.05
3 讨论
高胰岛素血症、IR是心血管疾病的独立危险因素,IR使机体产生一系列神经、体液、内分泌代谢紊乱,在这些因素及尿酸盐结晶沉积于动脉壁损伤动脉内膜的共同作用下,动脉粥样硬化发生的危险极大增加[14-16]。当胰岛B细胞不能代偿性分泌高水平INS以适应糖代谢的需求时,血糖显著升高,进而发生糖尿病。研究发现,痛风患者存在IR,随着IR的加重,糖代谢异常发生概率明显增加[17]。CHOU等[18]对7 483例非糖尿病患者的研究发现,以INS水平和HOMA-IR为衡量胰岛素敏感性的指标,血清UA水平与IR程度呈正相关。因此了解降UA治疗对痛风患者IR的影响,将为临床用药提供一定的指导意见。
非布司他是一种新型降UA药物,是一种具有选择性的黄嘌呤氧化酶抑制剂,不影响嘌呤与嘧啶的正常代谢[19]。其由于较别嘌呤醇有更好的降UA效果而受到关注[20]。本研究结果显示,治疗前两组UA、AST、ALT、Cr、FBG、INS水平和HOMA-IR无差异,治疗后非布司他组UA、INS水平低于别嘌呤醇组,治疗后两组AST、ALT、Cr、FBG水平和HOMA-IR无差异;别嘌呤醇组治疗后UA水平低于治疗前,非布司他组治疗后UA、INS水平和HOMA-IR低于治疗前;说明非布司他组IR得到改善,而别嘌呤醇组IR改善不明显,且两者对肝肾功能无明显影响,提示非布司他在治疗原发性痛风中可能具有更好的应用价值。
研究发现,非布司他具有多向性效应[21-23]。动物实验研究发现,大量摄入果糖和高尿酸血症、代谢综合征、肾损害密切相关,非布司他可降低大鼠血压和UA、三酰甘油、胰岛素水平,改善胰岛素敏感性[24]。非布司他不仅具有降UA作用,还有抑制氧化应激状态、降低炎性反应、改善血管内皮细胞功能、抑制血小板聚集等作用。非布司他可以减少硝基-氧化应激促使的硝基酪氨酸形成,降低脂质过氧化反应,减少促进炎症发生和进展的各种炎性因子的过表达,同时能抑制黄嘌呤氧化酶循环,防止其通过葡糖氨基葡聚糖(GAGs)结合到内皮细胞表面,而该过程参与血管内皮损伤的发病机制[25-26]。因此笔者推测非布司他不仅能降低血清UA,而且可有效改善IR。
综上所述,非布司他比别嘌呤醇能更有效地控制原发性痛风患者血清UA水平,并能改善IR情况。但本研究样本量较少,尚需大样本、多中心研究进一步证实,且关于非布司他改善IR的具体机制尚需进一步探讨。
作者贡献:孟娟进行文章的构思与设计,文章可行性分析,文献/资料收集、整理,撰写论文;袁晓旭进行资料收集;路跃武进行论文的修订,英文的修订,文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。
[1]RODDY E,CHOI H.Epidemiology of gout[J].Rheum Dis Clin North Am,2014,40(2):155-175.DOI:10.1016/j.rdc.2014.01.001.
[2]LI C,HSIEH M C,CHANG S J.Metabolic syndrome,diabetes,and hyperuricemia[J].Curr Opin Rheumatol,2013,25(2):210-216.DOI:10.1097/BOR.0b013e32835d951e.
[3]PANENI F,COSTANTINO S,COSENTINO F.Insulin resistance,diabetes,and cardiovascular risk[J].Curr Atheroscler Rep,2014,16(7):419.DOI:10.1007/s11883-014-0419-z.
[4]REAVEN G M.Insulin resistance:from bit player to centre stage[J].CMAJ,2011,183(5):536-537.DOI:10.1503/cmaj.101430.
[5]VIAZZI F,LEONCINI G,PONTREMOLI R.Cardiovascular and renal effects of hyperuricaemia and gout[J].Reumatismo,2012,19,63(4):253-262.DOI:10.4081/reumatismo.2011.253.
[6]SHAH A,KEENAN R T.Gout,hyperuricemia,and the risk of cardiovascular disease:cause and effect?[J].Curr Rheumatol Rep,2010,12(2):118-124.DOI:10.1007/s11926-010-0084-3.
[7]PUIG J G,MARTNEZ M A.Hyperuricemia,gout and the metabolic syndrome[J].Curr Opin Rheumatol,2008,20(2):187-191.DOI:10.1097/BOR.0b013e3282f4b1ed.
[8]KHANNA D,KHANNA P P,FITZGERALD J D,et al.2012 American College of Rheumatology guidelines for management of gout.Part 2:therapy and antiinflammatory prophylaxis of acute gouty arthritis[J].Arthritis Care Res(Hoboken),2012,64(10):1447-1461.DOI:10.1002/acr.21773.
[9]ANDERSON B E,ADAMS D R.Allopurinol hypersensitivity syndrome[J].J Drugs Dermatol,2002,1(1):60-62.
[10]SHIRAKURA T,NOMURA J,MATSUI C,et al.Febuxostat,a novel xanthine oxidoreductase inhibitor,improves hypertension and endothelial dysfunction in spontaneously hypertensive rats[J].Naunyn Schmiedebergs Arch Pharmacol,2016,389(8):831-838.DOI:10.1007/s00210-016-1239-1.
[11]WALLACE S L,ROBINSON H,MASI A T,et al.Preliminary criteria for the classification of the acute arthritis of primary gout[J].Arthritis Rheum,1977,20(3):895-900.
[12]EMOTO M,NISHIZAWA Y,MAEKAWA K,et al.Homeostasis model assessment as a clinical index of insulin resistance in type 2 diabetic patients treated with sulfonylureas[J].Diabetes Care,1999,22(5):818-822.
[13]CERSOSIMO E,SOLIS-HERRERA C,TRAUTMANN M E,et al.Assessment of pancreatic β-cell function:review of methods and clinical applications[J].Curr Diabetes Rev,2014,10(1):2-42.
[14]PANENI F,COSTANTINO S,COSENTINO F.Insulin resistance,diabetes,and cardiovascular risk[J].Curr Atheroscler Rep,2014,16(7):419.DOI:10.1007/s11883-014-0419-z.
[15]LAAKSO M,KUUSISTO J.Insulin resistance and hyperglycaemia in cardiovascular disease development[J].Nat Rev Endocrinol,2014,10(5):293-302.DOI:10.1038/nrendo.2014.29.
[16]FRAMPTON J E.Febuxostat:a review of its use in the treatment of hyperuricaemia in patients with gout[J].Drugs,2015,75(4):427-438.DOI:10.1007/s40265-015-0360-7.
[17]GHEITA T A,EL-FISHAWY H S,NASRALLAH M M,et al.Insulin resistance and metabolic syndrome in primary gout:relation to punched-out erosions[J].Int J Rheum Dis,2012,15(6):521-525.DOI:10.1111/1756-185X.12007.
[18]CHOU P,LIN K C,LIN H Y,et al.Gender differences in the relationships of serum uric acid with fasting serum insulin and plasma glucose in patients without diabetes[J].J Rheumatol,2001,28(3):571-576.
[19]陶小军,金星,淘沙,等.不同剂量非布司他对痛风伴高尿酸血症的效果及对内皮素-1水平的影响[J].中国全科医学,2014,17(2):170-172.DOI:10.3969/j.issn.1007-9572.2014.05.015.
TAO X J,JIN X,TAO S,et al.Impact of different doses of febuxostat on uruc acid and endothelin-1 level in patients with gout and hyperuricemia[J].Chinese General Practice,2014,17(2):170-172.DOI:10.3969/j.issn.1007-9572.2014.05.015.
[20]MAYANS L.Metabolic syndrome:insulin resistance and prediabetes[J].FP Essent,2015,435:11-16.
[21]NOMURA J,BUSSO N,IVES A,et al.Xanthine oxidase inhibition by febuxostat attenuates experimental atherosclerosis in mice[J].Sci Rep,2014,4:4554.DOI:10.1038/srep04554.
[23]TSUDA H,KAWADA N,KAIMORI J Y,et al.Febuxostat suppressed renal ischemia-reperfusion injury via reduced oxidative stress[J].Biochem Biophys Res Commun,2012,427(2):266-272.DOI:10.1016/j.bbrc.2012.09.032.
[25]FUKUI T,MARUYAMA M,YAMAUCHI K,et al.Effects of febuxostat on oxidative stress[J].Clin Ther,2015,37(7):1396-1401.DOI:10.1016/j.clinthera.2015.03.026.
[26]BRIDGEMAN M B,CHAVEZ B.Febuxostat for the treatment of gout[J].Expert Opin Pharmacother,2015,16(3):395-398.DOI:10.1517/14656566.2015.985588.
(本文编辑:崔丽红)
EfficacyofFebuxostatversusAllopurinolintheTreatmentofPrimaryGoutandTheirEffectsonInsulinResistance
MENGJuan,YUANXiao-xu,LUYue-wu*
DepartmentofRheumatologyandImmunology,BeijingChao-YangHospital,CapitalMedicalUniversity,Beijing100020,China
*Correspondingauthor:LUYue-wu,Chiefphysician;E-mail:llyyww615@sina.com
ObjectiveTo investigate the efficacy of febuxostat versus allopurinol in the treatment of primary gout and their effects on insulin resistance.MethodsWe enrolled 52 primary gout patients who
outpatient treatment in Beijing Chao-Yang Hospital,Capital Medical University from November 2013 to May 2015 and met the inclusion criteria of this study.Using SPSS 19.0 software,they were randomized into febuxostat group receiving oral administration of febuxostat tablets and allopurinol group receiving oral administration of allopurinol tablets at a ratio of 1∶1.The baseline data of both groups were collected.The levels of serum uric acid(UA),aspartate aminotransferase(AST),alanine aminotransferase(ALT),creatinine(Cr),fasting blood glucose(FBG) and fasting insulin(INS) were detected,the homeostasis model assessment of insulin resistance(HOMA-IR) was calculated before treatment and at 24 weeks after treatment.ResultsThe levels of UA,AST,ALT,Cr,FBG and INS and HOMA-IR did not differ significantly between the two groups before treatment(P>0.05).After treatment,the levels of UA and INS in febuxostat group were lower than those in allopurinol group(P<0.05),but the levels of AST,ALT,Cr and FBG and HOMA-IR were still similar in both groups(P>0.05).The level of UA after treatment was significantly lower than that before treatment in allopurinol group(P<0.05).The levels of UA and INS and HOMA-IR after treatment were significantly lower than those before treatment in febuxostat group(P<0.05).ConclusionCompared with allopurinol,febuxostat can better control the serum UA level of patients with primary gout,and it can improve the level of IR.
Gout;Comparative effectiveness research;Allopurinol;Insulin resistance;Febuxostat
R 589.7
A
10.3969/j.issn.1007-9572.2017.00.068
2017-03-06;
2017-08-24)
100020 北京市,首都医科大学附属北京朝阳医院风湿免疫科
*通信作者:路跃武,主任医师;E-mail:llyyww615@sina.com
