雷公藤内酯醇对多发性骨髓瘤细胞凋亡及组蛋白H3K4甲基化的影响*
2017-11-01徐成波沈建箴付海英
徐成波, 廖 斌, 沈建箴, 付海英, 林 婷
(1. 福建省人民医院 福建中医药大学附属人民医院血液科, 福州 350004;2. 福建医科大学附属协和医院血液科 福建省血液病研究所, 福州 350001)
雷公藤内酯醇对多发性骨髓瘤细胞凋亡及组蛋白H3K4甲基化的影响*
徐成波1△, 廖 斌1, 沈建箴2, 付海英2, 林 婷1
(1. 福建省人民医院 福建中医药大学附属人民医院血液科, 福州 350004;2. 福建医科大学附属协和医院血液科 福建省血液病研究所, 福州 350001)
目的探讨雷公藤内酯醇(TPL)对多发性骨髓瘤RPMI8226细胞增殖、凋亡和组蛋白H3K4甲基化的影响。方法以人多发性骨髓瘤细胞株RPMI8226为研究对象,在不同浓度(10、20、40、80、160 nmol/L)TPL中共培养不同时间(24 h、48 h、72 h)后,采用噻唑蓝(MTT)法检测细胞增殖活性;流式细胞术检测细胞凋亡和细胞周期;Western blot法检测组蛋白H3K4me2、H3K4me3的甲基化状态,实时荧光定量RT-PCR分析组蛋白甲基化酶SMYD3和组蛋白去甲基化酶LSD1的表达水平。结果TPL对RPMI8226细胞有明显的增殖抑制作用,呈剂量和时间依赖性(P<0.05);TPL对RPMI8226细胞有明显诱导凋亡的作用,并且随着TPL作用浓度的增加,细胞凋亡比例逐渐增加(P<0.05);同时TPL还可以诱导RPMI8226细胞周期阻滞于G2/M期;TPL以浓度依赖性降低组蛋白H3K4me2、H3K4me3的甲基化水平(P<0.05,P<0.01),并抑制SMYD3和上调LSD1的表达(P<0.05)。结论TPL可抑制RPMI8226细胞增殖、引起细胞周期阻滞于G2/M期,并诱导其凋亡;通过抑制组蛋白甲基化酶SMYD3和增强组蛋白去甲基化酶LSD1的表达,降低组蛋白H3K4me3和H3K4me2的甲基化水平,这可能是TPL诱导多发性骨髓瘤细胞凋亡和抗肿瘤作用的机制之一。
雷公藤内酯醇;多发性骨髓瘤;凋亡;组蛋白;甲基化
雷公藤内酯醇(triptolide,TPL)又称雷公藤甲素,是从福建省泰宁县产的传统中药雷公藤根皮中分离出含环氧的二萜内酯化合物,临床研究发现其
具有显著的抗炎、抗肿瘤和免疫抑制的药理作用[1-3]。国内外研究证实,TPL可以通过调控核因子-κB(nuclear factor-kappa B,NF-κB)信号通路、Bcl-2基因家族以及热休克蛋白-70等途径,抑制多发性骨髓瘤(mutiple myeloma,MM)细胞的生长增殖,并诱导多发性骨髓瘤细胞凋亡[4]。组蛋白甲基化是表观遗传修饰的重要方式之一,广泛地参与了多发性骨髓瘤的发生与发展。最新研究表明,在多发性骨髓瘤细胞的增殖、分化过程中,组蛋白3第4位赖氨酸(trimethylation of histone H3 lysine 4,H3K4me3)和组蛋白3第27位赖氨酸(trimethylation of histone H3 lysine 27,H3K27me3)的三甲基化通过修饰抑癌基因的多梳蛋白抑制复合体-2(polycomb repressive complex-2,PRC-2),沉默靶基因的表达。其中Zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)能够编码PRC-2中甲基转移酶的成分,以催化H3K27三甲基化的方式导致肿瘤抑制因子表达受抑,促进多发性骨髓瘤细胞增殖及细胞转化。利用EZH2抑制剂,可以抑制多发性骨髓瘤细胞的异常增殖和克隆演变,并且组蛋白的甲基化水平与MM的预后密切相关[5]。本课题组前期研究[6-8]发现,TPL可明显抑制白血病细胞的增殖和诱导凋亡,其机制与逆转细胞中抑癌基因p15、p16及大肠腺癌息肉病(adenomatous polyposis coli,APC)基因的甲基化状态,恢复基因的转录与表达有关。同时还发现H3K4me3位点的甲基化水平在多发性骨髓瘤RPMI8226细胞中异常增高,是影响凋亡相关基因转录,导致多发性骨髓瘤细胞凋亡受阻,增殖加快的重要原因。因此,基于TPL能够逆转表观遗传修饰的作用,本研究以骨髓瘤细胞株RPMI8226细胞为研究对象,探讨TPL是否可以通过逆转组蛋白H3K4的甲基化模式并诱导MM细胞凋亡的作用机制,为TPL通过表观遗传调控途径靶向治疗多发性骨髓瘤的临床应用提供理论依据。
1 材料与方法
1.1 主要试剂
雷公藤内酯醇(美国sigma公司),胎牛血清(杭州四季青公司),MTT试剂(美国sigma公司),RPMI1640培养液(美国Gibco公司),Trizol试剂(美国Invitrogen公司),Annexin V FITC/PI凋亡检测试剂盒、细胞周期检测试剂盒(南京凯基生物公司),Prime Script RT Master Mix逆转录试剂盒、SYBR Advantage qPCR Premix(中国Takara公司),鼠抗人H3K4me3,H3K4me2单克隆抗体,鼠抗人β-actin单克隆抗体(美国CST公司),辣根过氧化物酶标记的抗鼠二抗(中杉金桥生物公司),ECL发光液(厦门鹭隆生物公司)。引物由上海Invitrogen公司合成。
1.2 主要仪器
超净工作台(苏州安泰空气技术有限公司),细胞培养箱(中国力康公司),倒置显微镜(日本NiKon公司),酶标仪(美国Awareness公司),FACScan型流式细胞仪(美国Becton Dickinson公司),荧光定量PCR仪(美国Thermo公司),核酸蛋白定量仪(美国Thermo公司),Western-blot电泳和转膜系统(美国Bio-Rad公司)
1.3 细胞培养
多发性骨髓瘤细胞系RPMI8226由福建省血液病研究所冻存,由我院中心实验室传代培养并保存。细胞常规复苏后,培养在10%胎牛血清的RPMI1640培养液中,置于含5%CO2、37℃、饱和湿度的培养箱中培养,细胞呈悬浮生长,间隔24~48 h细胞换液传代一次,取对数生长期的细胞用于实验。
1.4 MTT法检测细胞增殖及绘制增殖曲线
收集对数生长期的RPMI8226细胞,将细胞密度调整为2×105cells/ml并接种于96孔培养板中。分为空白对照组,TPL药物作用组,药物终浓度分别为10、20、40、80、160 nmol/L,每浓度组设3个复孔,药物作用24 h、48 h、72 h后,加入20 μl浓度为5 mg/ml的MTT试剂,继续培养4 h,再加入100 μl二甲基亚枫后在酶标仪上检测570 nm波长下各孔的吸光度值(A值),计算细胞的增殖抑制率。
细胞增殖抑制率(%)=(1-A药物组/A对照组)×100%
1.5 流式细胞术检测细胞的早期凋亡率
收集TPL终浓度分别为40、80、160 nmol/L,每浓度组设3个复孔,作用48 h后的RPMI8226细胞以及同期的空白对照组细胞,按Annexin V FITC/PI凋亡检测试剂盒操作步骤,离心细胞悬液,去上清后用1×binding buffer调整细胞浓度为(2~5)×105cells/ml。每份加入195 μl缓冲液及5 μl FIFC-Annexin V,避光孵育10 min,离心,去上清。再每份加入190 μl缓冲液及10 μl碘化丙啶,避光孵育10 min,1 h内流式细胞仪检测。
1.6 流式细胞术检测细胞周期百分率
收集TPL终浓度分别为40、80、160 nmol/L,每浓度组设3个复孔,作用48 h后的RPMI8226细胞以及同期的空白对照组细胞,按细胞周期检测试剂盒操作,离心细胞悬液,吸上清,调整细胞浓度为1×106cells/ml;加入预冷的70%乙醇1 ml固定,4℃孵育过夜。离心去除固定液,洗涤细胞后每份标加入100 μl RNase A,37℃水浴30 min,再加入400 μl碘化丙啶,混匀后预冷至4℃避光30 min后流式细胞仪检测,记录激发波长488 nm处红色荧光。
1.7Westernblot法检测组蛋白H3K4me2,H3K4me3的甲基化状态
收集TPL终浓度分别为40、80、160 nmol/L,每浓度组设3个复孔,作用48 h后的RPMI8226细胞以及同期的空白对照组细胞,将细胞裂解后提取细胞总蛋白。取30 μg上样总蛋白,行12% SDS聚丙烯酰胺凝胶电泳,电泳后电转膜1.5 h至醋酸纤维薄膜上,加5%的脱脂奶粉封闭2 h,分别与鼠抗人H3K4me2,H3K4me3单克隆抗体、鼠抗人β-actin单克隆抗体共孵育4℃过夜,洗膜后分别与辣根过氧化物酶标记的抗鼠二抗孵育1 h,加入化学发光法(ECL)发光试剂后在暗室曝光、显影、照相及结果分析。
1.8实时荧光定量RT-PCR(qRT-PCR)检测组蛋白甲基化酶SMYD3和组蛋白去甲基化酶LSD1的表达水平
收集TPL终浓度分别为40、80、160 nmol/L,每浓度组设3个复孔,作用48 h后的RPMI8226细胞以及同期的空白对照组细胞,Trizol试剂一步法提取细胞总RNA。采用逆转录试剂盒进行cDNA合成。应用SYBR Advantage qPCR Premix试剂盒进行PCR扩增。SMYD3上游引物:5’-CGGAGATGCAGGAAGT-TGGT-3’,下游引物:5’-GTATGGCTCCATGGTCCG-AGT-3’。LSD1上游引物:5’-CAGCCACCAGCCGTTC-AGT-3’,下游引物:5’-CAGCACGCCAACGAGACAC-3’,以3-磷酸甘油醛脱氢酶(GAPDH)为内参照。反应体系:SYBR Advantage qPCR Premix 12.5 μl,上下游引物(10 μmol/L)各0.5 μl,cDNA 2 μl,加水至25 μl。反应条件:95℃ 5 min,95℃10 s,60℃ 40 s,40个循环。采用2-ΔΔCt法计算基因的相对表达量。
1.9 统计学处理
2 结果
2.1 雷公藤内酯醇对RPMI8226细胞增殖的影响
MTT检测结果显示:不同药物浓度(10、20、40、80、160 nmol/L)的TPL作用RPMI8226细胞不同时间(24 h、48 h、72 h)后,RPMI8226细胞的生长增殖受到不同程度的抑制,且随着药物浓度的增加和作用时间的延长,TPL对RPMI8226细胞的增殖抑制作用逐渐增强。各药物作用组与空白对照组增殖抑制率比较,差异均有统计学意义(P<0.05,图1)。随着作用时间的延长,其IC50值也逐渐降低,分别是(100.10±1.05)nmol/L,(72.67±1.03)nmol/L,(45.26±1.06)nmol/L。


0: Blank group; 10: TPL 10 nmol/L group; 20: TPL 20 nmol/L group; 40: TPL 40 nmol/L group; 80: TPL 80 nmol/L group; 160: TPL 160 nmol/L group
2.2 雷公藤内酯醇对RPMI8226细胞凋亡的影响
流式细胞术检测结果显示:不同药物浓度(40、80、160 nmol/L)的TPL作用RPMI8226细胞48 h后,随着药物浓度的增高,各药物组细胞凋亡比例也逐渐增加,凋亡率分别是(13.43±1.86)、(30.63±1.86)、(41.60±3.31),而空白对照组为(5.93±1.33)。各药物作用组与空白对照组比较,差异均有统计学意义(P<0.05,图2)。

0: Blank group; 40: TPL 40 nmol/L group; 80: TPL 80 nmol/L group; 160: TPL 160 nmol/L group
*P<0.05vsblank group
2.3雷公藤内酯醇对RPMI8226细胞增殖周期的影响
流式细胞术检测结果显示:不同药物浓度(40、80、160 nmol/L)的TPL作用RPMI8226细胞48 h后,随着药物浓度的增高,各药物作用组G0/G1细胞比例略有减少,S期细胞比例逐渐减少,G2/M细胞比例逐渐增加,分别是(11.41±3.04)、(19.89±1.87)、(32.19±2.95),而空白对照组为(6.31±3.49),TPL浓度为80、160 nmol/L作用组与空白对照组比较,差异均有统计学意义(P<0.05,P<0.01,图3)。

0: Blank group; 40: TPL 40 nmol/L group; 80: TPL 80 nmol/L group; 160: TPL 160 nmol/L group
*P<0.05,**P<0.01vsblank group
2.4雷公藤内酯醇对RPMI8226细胞组蛋白H3K4me2、H3K4me3甲基化状态的影响
Western blot检测结果显示:不同药物浓度(40、80、160 nmol/L)的TPL作用RPMI8226细胞48 h后,随着药物浓度的增高,各药物组细胞组蛋白H3K4me3,H3K4me2的甲基化水平呈浓度依赖性下降。各药物作用组与空白对照组比较,差异均有统计学意义(P<0.05,P<0.01,图4)。
2.5雷公藤内酯醇对RPMI8226细胞SMYD3和LSD1mRNA表达水平的影响
实时荧光定量RT-PCR检测结果显示:不同药物浓度(40、80、160 nmol/L)的TPL作用RPMI8226细胞48 h后,随着药物浓度的增高,各药物组细胞SMYD3的mRNA表达水平呈浓度依赖性下降,与空白对照组比较,分别下降了0.53、0.61、0.79倍,差异均有统计学意义(P<0.05),而LSD1的mRNA表达水平逐渐升高,与空白对照组相比,分别升高了1.35、2.18、2.70倍,差异有统计学意义(P<0.05,图5)。

0: Blank group; 40: TPL 40 nmol/L group; 80: TPL 80 nmol/L group; 160: TPL 160 nmol/L group; H3K4me3: Trimethylation of histone H3 lysine 4
*P<0.05,**P<0.01vsblank group
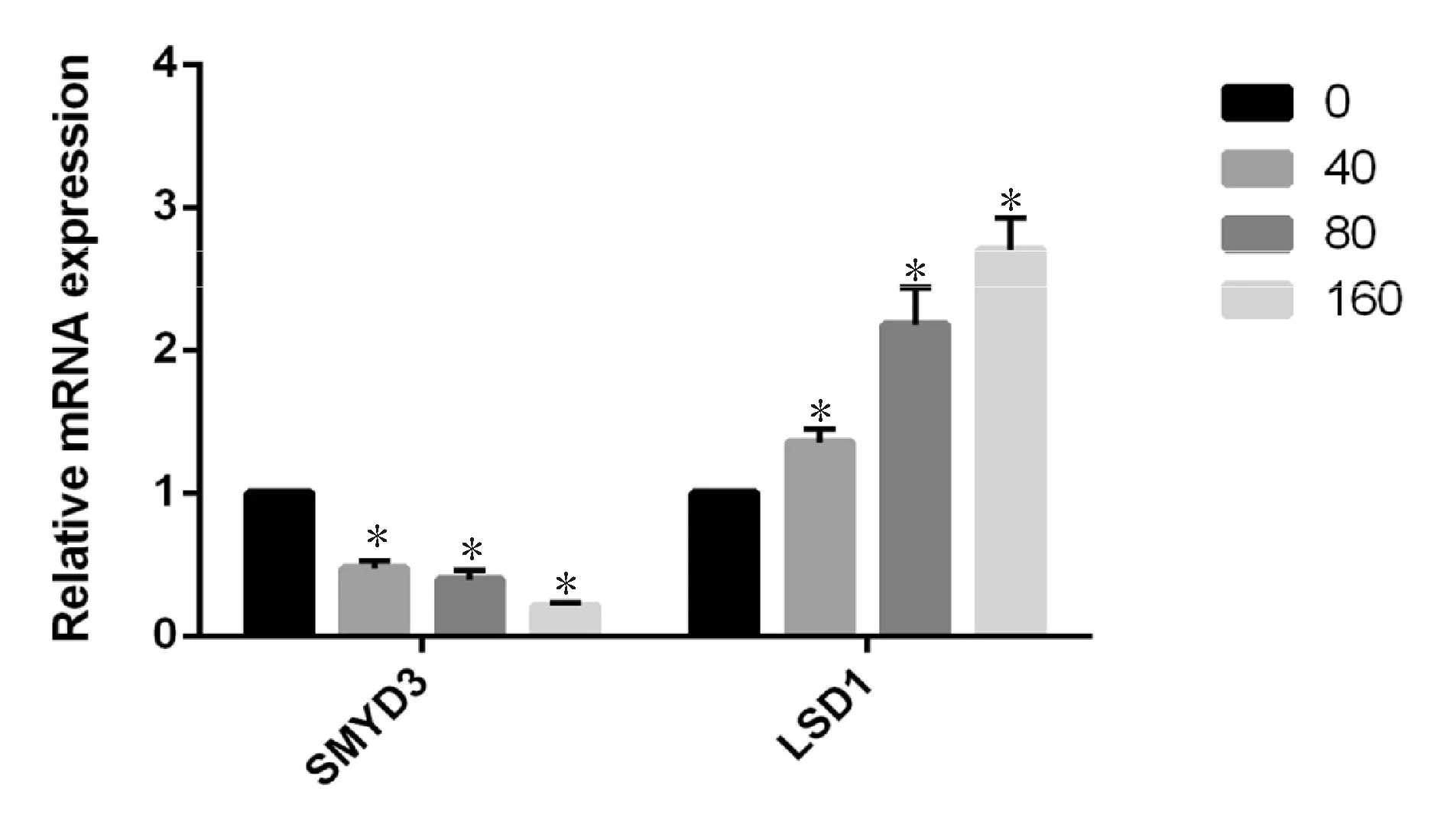
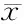
0: Blank group; 40: TPL 40 nmol/L group; 80: TPL 80 nmol/L group; 160: TPL 160 nmol/L group; SMYD3: SET and MYND domain containing 3; LSD1: Lysine specific demethylase 1
*P<0.05vsblank group
3 讨论
TPL是从卫矛科属木质藤本植物雷公藤的根皮中分离出的生物活性较强的有效成份,它作为一种传统中药,既往主要应用于自身免疫性疾病的治疗。国内外的研究发现,TPL还具有广谱的抗肿瘤的作用,尤其是对多种髓系及淋巴细胞白血病,B细胞淋巴瘤等血液肿瘤具有较好的抗癌活性[9]。TPL的抗肿瘤作用是通过直接抑制肿瘤细胞的增殖,以及激活Caspase家族通路,诱导p53基因表达,活化丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号和抑制NF-κB的表达等途径诱导肿瘤细胞凋亡,细胞周期阻滞和逆转肿瘤细胞耐药[10-12]。本研究采用MTT法分析发现TPL对多发性骨髓瘤细胞有明显的增殖抑制作用,随着TPL作用浓度的增加和作用时间的延长,对细胞的增殖抑制率逐渐升高,而IC50值逐渐降低。流式细胞术检测显示TPL呈剂量依赖性地诱导多发性骨髓瘤细胞凋亡,并且细胞周期阻滞于G2/M期,这与国内研究[13]的结果一致。
表观遗传学(epigenetics)是指不涉及DNA 碱基序列改变的可遗传的基因表达调控研究,包括DNA甲基化、组蛋白修饰、非编码RNA 等[14,15],这种调控途径被认为是一种极有前景的血液肿瘤治疗方法。目前,研究主要集中在DNA甲基化酶抑制剂逆转抑癌基因的过甲基化恢复基因表达和组蛋白去乙酰化酶抑制剂恢复组蛋白的乙酰化状态激活转录,如地西他滨治疗骨髓增生异常综合征(myelodysplastic syndromes,MDS)和老年急性髓系白血病(acute myelocytic leukemia,AML),西达本胺对复发难治的T细胞淋巴瘤均显示有良好的治疗效果,而选择性靶向干预组蛋白甲基化的研究较少。组蛋白甲基化修饰作为表观遗传调控的重要方式之一,主要是在组蛋白甲基化酶(histone methyltransferase,HMT)和组蛋白去甲基化酶(histone demethyltransferase,HDM)的共同作用下动态调节组蛋白的甲基化水平,从而影响细胞的增殖和分化,在细胞周期、凋亡等生命过程中发挥重要作用。H3K4me2和H3K4me3一般定位于基因启动子区域,主要功能为激活基因转录,而H3K27、H3K9等则与基因沉默有关。研究发现,H3K4me3通常在活化基因的转录起始区域高度聚集,通过识别转录激活效应分子来促进基因表达,此种修饰与癌基因转录效率之间存在密切关联,H3K4me3表达越高,肿瘤细胞的凋亡越慢。在部分多发性骨髓瘤患者中,由于t(4,14)染色体的易位,导致核受体结合SET结构域蛋白2(nuclear receptor-binding SET domain-protein 2,NSD2)基因过度表达,NSD2是HMT家族成员之一,主要功能为修饰组蛋白H3K36和H4K20的甲基化,影响基因转录,从而促进多发性骨髓瘤细胞增殖,与多发性骨髓瘤的形成和预后密切相关[16]。Zhao等[17]研究显示,TPL可以通过下调组蛋白甲基化酶EZH2和花斑3-9抑制因子同源物1(suppressor of variegation 3-9 Homolog l,SUV39H1),分别降低组蛋白H3K27me3和H3K9me3的甲基化水平,抑制多发性骨髓瘤细胞的增殖和诱导凋亡。我们的研究结果显示,TPL作用RPMI8226细胞48 h后,随着药物浓度的增高,细胞组蛋白H3K4me2、H3K4me3的甲基化水平呈浓度依赖性下降。
为进一步研究TPL影响H3K4me2、H3K4me3甲基化状态的机制,我们同时检测了组蛋白甲基化酶SET和MYND结构域含有蛋白3(SET and MYND domain containing 3,SMYD3)、赖氨酸特异性去甲基化酶1(lysine specific demethylase 1,LSD1)的表达。
SMYD3是一个含SET和MYND区域的蛋白,在肝细胞癌、结肠癌、乳腺癌、宫颈癌等肿瘤细胞中均出现异常的高表达。它可以接受S-腺苷甲硫氨酸提供的甲基,特异性地使组蛋白H3K4发生二甲基化和三甲基化,造成染色质空间结构的变化,从而影响转录复合物的接近和下游癌基因、凋亡基因的表达,促进细胞增殖,抑制凋亡[18]。在乳腺癌细胞中,SMYD3作为雌激素受体介导的辅助转录激活因子,SMYD3的表达下调可使靶基因启动子区域中雌激素反应元件的H3K4甲基化水平下降,使癌基因表达受抑,诱导肿瘤细胞凋亡[19]。此外,SMYD3的过度表达可导致基质金属蛋白酶-9(matrix metalloprotein,MMP-9)在纤维肉瘤细胞、乳腺癌、胃癌等肿瘤细胞中表达升高,对肿瘤的形成具有重要作用,而SMYD3表达沉默可以使MMP-9基因启动子区的H3K4甲基化水平降低,从而导致MMP-9基因表达减少[20]。本研究显示,在不同浓度的TPL作用下,多发性骨髓瘤细胞中H3K4me2和H3K4me3甲基化水平降低的同时,呈剂量依赖性的下调SMYD3的蛋白表达水平,因而我们推测TPL可能是通过下调SMYD3的表达来影响H3K4的甲基化状态,从而抑制细胞周期调控和凋亡相关基因的转录活性,诱导细胞周期阻滞和细胞凋亡。
LSD1是组蛋白H3K4的单甲基化(H3K4me)和双甲基化(H3K4me2)的特异性去甲基化酶。LSD1定位于细胞核内,调控着基因转录的激活和抑制,它的表达异常与多种肿瘤密切相关,往往聚集表达于癌基因的启动子区域,抑制癌基因的转录激活和肿瘤形成。Scoumanne A等[21]研究发现,LSD1能够抑制p53的生物学活性,抑制p53信号途径的传递,从而促进细胞凋亡,抑制肿瘤的发生。Kontaki 等[22]研究证实,当DNA受到损伤后,LSD1可以去甲基化修饰E2F转录因子1(E2F transcription factor 1,E2F1)的第185位赖氨酸,使其去甲基化,E2F1被激活后转录活性大大增强,并进一步乙酰化和磷酸化,同时参与细胞周期G1期到S期的转换,通过p53依赖和非p53依赖途径诱导下游凋亡蛋白的转录激活。本研究结果显示,经不同浓度的TPL作用后,随着H3K4me2甲基化水平的下降,LSD1蛋白表达水平逐渐增加。我们认为,TPL诱导LSD1的表达增高导致了H3K4me2去甲基化,使得肿瘤细胞中癌基因启动子区域甲基化缺失,癌基因转录激活受抑,肿瘤细胞的存活也被抑制。
总之,本研究显示TPL能够抑制多发性骨髓瘤细胞株RPMI8226细胞的生长增殖,引起G2/M期细胞周期阻滞,并诱导细胞凋亡。提示SMYD3和LSD1可能是TPL抗多发性骨髓瘤的作用靶点之一。该研究初步阐明了TPL通过调节组蛋白甲基化酶和去甲基化酶导致组蛋白表观遗传学修饰的改变,进而影响多发性骨髓瘤细胞的恶性生物学特征的分子机制,为进一步研究TPL的抗多发性骨髓瘤作用奠定了理论基础。
[1] Kiviharju TM, Lecane PS, Sellers RG,etal. Antiproliferative and proapoptotic activities of triptolide(PG490), a natural product entering clinical trials,on primary cultures of human prostatic epithelial cells[J].ClinCancerRes, 2002, 8(8): 2666-2674.
[2] Caspi O, Polak A. Traditional immunosuppression-Lei Gong Teng in modern medicine[J].Harefuah, 2013,152(7):404-409,433.
[3] Meng C, Zhu H, Song H,etal. Targets and molecular mechanisms of triptolide in cancer therapy[J].ChinJCancerRes, 2014, 26(5): 622-626.
[4] Zeng R, Zeng L, Chen Y,etal. Triptolide-induced apoptosis by inactivating nuclear factor-kappa B apoptotic pathway in multiple myeloma in vitro[J].JHuazhongUnivSciTechnologMedSci, 2011, 31(4): 446-451.
[5] Agarwal P, Alzrigat M, Párraga AA,etal. Genome-wide profiling of histone H3 lysine 27 and lysine 4 trimethylation in multiple myeloma reveals the importance of Polycomb gene targeting and highlights EZH2 as a potential therapeutic target[J].Oncotarget, 2016, 7(6): 6809-6823.
[6] 傅海英, 沈建箴. 雷公藤内酯醇对急性淋巴细胞白血病Molt4细胞系p15基因表达的影响[J]. 中华内科杂志, 2005, 44(4): 301-302.
[7] 吴雪梅, 沈建箴, 喻爱芳, 等. 雷公藤内酯醇逆转人恶性淋巴瘤细胞株CA46细胞P16基因甲基化的实验研究[J]. 中国医药导刊, 2008, 10(8): 1211-1212.
[8] 吴雪梅, 沈建箴, 沈松菲, 等. 雷公藤内酯醇逆转Jurkat细胞APC基因甲基化及其机制的初步研究[J]. 中国实验血液学杂志, 2010, 18(4): 866-872.
[9] Zhang C, Cui GH, Liu F,etal. Inhibitory effect of triptolide on lymph node metastasis in patients with non-Hodgkin lymphoma by regulating SDF-1/CXCR4 axis in vitro[J].ActapharmacolSin, 2006, 27(11): 1438-1446.
[10]Meng HT, Zhu L, Ni WM,etal. Triptolide inhibits the proliferation of cells from lymphocytic leukemic cell lines in association with downregulation of NF-κB activity and miR-16-1[J].ActaPharmacolSin, 2011, 32(4): 503-511.
[11]Catasus L, Gallardo A, Cuatrecasas M,etal. Concomitant PI3K-AKT and p53 alterations in endometrial carcinomas are associated with poor prognosis[J].ModPathol, 2009, 22(4): 522-529.
[12]梅 怡, 史永照, 冯 雯, 等. 雷公藤甲素对乳腺癌细胞P53、P73基因甲基化的影响以及对细胞增殖的抑制作用[J]. 第二军医大学学报, 2012, 33(4): 380-384.
[13]杨 洋, 董红娟, 高广勋, 等. 雷公藤内酯醇对硼替佐米诱导多发性骨髓瘤细胞凋亡的影响[J]. 中国实验血液学杂志, 2012, 20(2): 335-338.
[14]武 磊, 刘晓华, 王天辉, 等. 组蛋白去乙酰化酶抑制剂对大鼠应激性心肌损伤的保护作用[J]. 中国应用生理学杂志, 2015, 31(3): 193-196.
[15]吉海龙, 史鹏飞, 周 洁, 等. 脾源性酪氨酸激酶基因启动子甲基化与髓母细胞瘤细胞侵袭转移的关系[J]. 中国应用生理学杂志, 2016, 32(2): 132-136.
[16]Martinez-Garcia E, Popovic R, Min DJ,etal. The MMSET histone methyl transferase switches global histone methylation and alters gene expression in t(4;14) multiple myeloma cells[J].Blood, 2011, 117(1): 211 -220.
[17]Zhao F, Chen Y, Li R,etal. Triptolide alters histone H3K9 and H3K27 methylation state and induces G0/G1 arrest and caspase-dependent apoptosis in multiple myeloma in vitro[J].Toxicology, 2010, 267(1-3): 70-79.
[18]Hamamoto R, Furukawa Y, Morita M,etal. SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells[J].NatCellBiol, 2004, 6(8): 731-740.
[19]Kim H, Heo K, Kim JH,etal. Requirement of histone methyltransferase SMYD3 for estrogen receptor-mediated transcription[J].JBiolChem, 2009, 284(30): 19867-19877.
[20]Hervouet E, Cartron PF, Jouvenot M,etal. Epigenetic regulation of estrogen signaling in breast cancer[J].Epigenetics, 2013, 8(3): 237-245.
[21]Scoumanne A, Chen X. Protein methylation: a new mechanism of p53 tumor suppressor regulation[J].HistolHistopathol, 2008, 23(9): 1143-1149.
[22]Kontaki H,Talianidis I.Lysine methylation regulates E2F1-induced cell death[J].Molcell, 2010, 39(1): 152-160.
EffectsoftriptolideontheapoptosisandH3K4proteinmethylationinmultiplemyelomacells*
XU Cheng-bo1△, LIAO Bin1, SHEN Jian-zhen2, FU Hai-ying2, LIN Ting1
(1. Department of Hematology, The People’s Hospital Affiliated to Fujian University of Traditional Chinese Medicine, Fuzhou 350004;2. Department of Hematology, The Union Hospital Affiliated to Fujian Medical University, Fujian Institute of Hematology, Fuzhou 350001, China)
Objective: To investigate the effects of triptolide (Chinese Traditional Medicine)on the apoptosis and H3K4 protein methylation in multiple myeloma cells.MethodsThe RPMI8226 cells were cultured with different concentrations(10,20,40,80 and 160 nmol/L)of triptolide for different incubation time (24 h,48 h and 72 h). The inhibition of triptolide on RPMI8226 cell proliferation was detected by MTT assay. Apoptosis and cell cycle distribution were evaluated by flow cytometry.The expressions of H3K4me2 and trimethylation of histone H3 lysine 4(H3K4me3) in RPMI8226 cells were assayed by Western blot. The changes of expressions of histone methylase SET and MYND domain containing 3(SMYD3) and histone demethylase lysine specific demethylase 1(LSD1) in RPMI8226 cells were verified by qRT-PCR.ResultsTriptolide had obvious inhibitive effects on proliferation of RPMI8226 cells and showed a dose- and time-dependent manner(P<0.05). Triptolide induced apoptosis and G2/M cell cycle arrest in a dose-dependent manner(P<0.05). Triptolide decreased histone H3K4me2 and H3K4me3 expression in a dose-dependent manner(P<0.05,P<0.01). SMYD3 was significantly depressed at protein expression in a dose-dependent manner(P<0.05), but LSD1 was up-regulated (P<0.05).ConclusionTriptolide could inhibit RPMI8226 cell proliferation,induce the apoptosis and cause G2/M arrest,meanwhile,significantly inhibit the protein expressions of H3K4me2 and H3K4me2 with alter the expression of SMYD3 and LSD1.The effects is probably related to the antitumor mechanism of MM cells induced by triptolide.
triptolide; multiple myeloma; apoptosis; histone protein; methylation
*【收稿日期】2017-01-19 【修回日期】2017-05-15
R559
A
1000-6834(2017)05-450-06
10.12047/j.cjap.5483.2017.108
福建省自然科学基金项目(2015J01327);福建省卫计委青年科研基金(2016-1-77)
2016-08-02
2017-05-16
△
Tel: 13655038240; E-mail: albertsky@163.com
