小鼠原代肝星状细胞的分离、鉴定及生物学功能分析
2017-10-24韩聚强杜静华徐小洁刘文鹏梁吉光李佳睿叶棋浓
韩聚强,杜静华,徐小洁,刘文鹏,梁吉光,,李佳睿,叶棋浓
1.陆军总医院 肝病科,北京 100700;2.河北医科大学第三医院 a.中西医结合肝病科;b.感染科;河北 石家庄 050051;3.军事医学科学院 生物工程研究所,北京 100850;4.吉林大学第一医院 介入科,吉林 长春 130021
小鼠原代肝星状细胞的分离、鉴定及生物学功能分析
韩聚强1,3,杜静华2a,徐小洁3,刘文鹏2b,梁吉光4,3,李佳睿4,叶棋浓3
1.陆军总医院 肝病科,北京 100700;2.河北医科大学第三医院 a.中西医结合肝病科;b.感染科;河北 石家庄 050051;3.军事医学科学院 生物工程研究所,北京 100850;4.吉林大学第一医院 介入科,吉林 长春 130021
目的:探索C57.BL/6J小鼠肝星状细胞(HSCs)分离、纯化的可行方案,并评价该法所得HSCs的生物学特性。方法:经肝门静脉,先用不含钙镁离子的D-Hanks液充分灌注肝脏,再以适宜浓度的链霉蛋白酶和Ⅳ型胶原酶顺序灌注,随后Percoll非连续密度梯度离心分离、纯化HSCs,台盼蓝拒染法检测HSCs活性,光镜观察体外培养的HSCs的形态学变化,免疫细胞化学鉴定α-平滑肌肌动蛋白(α-SMA)和结蛋白的表达,Western印迹检测α-SMA和Ⅰ型胶原蛋白的表达。结果:纯化后每只小鼠获得HSCs约5.5×105个,纯度及存活率均大于95%;免疫细胞化学技术证实培养的HSCs分别表达α-SMA和结蛋白;Western印迹显示原代HSCs体外培养7 d时,α-SMA和Ⅰ型胶原蛋白的表达量达到峰值。结论:建立的分离、纯化方案可获得高纯度、高活率、功能正常的小鼠原代HSCs,为进一步研究肝纤维化的发病机制提供了技术保障。
肝星状细胞;原代培养;细胞分离;小鼠
肝星状细胞(hepatic stellate cells,HSCs)是引起肝纤维化的关键细胞,主要分布于肝脏窦周间隙(Disse间隙),是合成、分泌细胞外基质的重要来源[1-2]。肝炎病毒感染、酗酒、脂肪堆积、药物毒物损伤等各种因素均可导致HSCs激活并转化为肌成纤维样细胞,最后导致肝纤维化发生[3]。因此,HSCs激活是肝纤维化形成的关键环节。近年,随着原代细胞体外分离、培养技术的逐渐成熟,探索成熟稳定的HSCs分离与体外培养技术平台,对于明确肝纤维化的发病机制具有重要现实意义。基于此,我们在既往小鼠HSCs原代分离、培养的基础上进行适当改进,建立了稳定、简便、经济的小鼠HSCs分离方法,为进一步深入研究HSCs的生物学行为创造了条件。
1 材料和方法
1.1 材料
雄性C57.BL/6J小鼠,体重20~25 g,由军事医学科学院实验动物中心提供,普通饲料喂养,自由进食、进饮,实验前禁食12 h。
Ⅳ型胶原酶、DNA酶Ⅰ(DNaseⅠ)为Sigma公司产品;胰蛋白酶、D-Hank's液、DMEM培养液、胎牛血清(FBS)为Gibco公司产品;Percoll分离液为GE Healthcare公司产品;小鼠抗结蛋白(des⁃min)单克隆抗体、小鼠抗α-平滑肌动蛋白(α-SMA)单克隆抗体购自武汉博士德生物工程有限公司;荧光标记的羊抗小鼠单抗二抗为Invitrogen公司产品;倒置相差显微镜为Olympus公司产品;离心机为Beckman公司产品。
1.2 小鼠原代HSCs的分离
用5%水合氯醛(0.01 mL/g)腹腔麻醉小鼠,仰卧位固定,腹部打开暴露门静脉及下腔静脉,将9号输液针插入门静脉结扎固定,用D-Hank's液(含肝素25 U/mL)灌注肝脏,当肝脏充盈后反复打开、关闭下腔静脉,充分灌注3 min;更换链霉蛋白酶溶液(0.05%)继续灌注5 min,再换Ⅳ型胶原酶溶液(1%)灌注7 min;当肝脏表面呈龟背样变时,摘除肝脏置于无菌器皿中,剔除肝脏背膜,剪碎肝脏组织,加入含1%DNaseⅠ的链霉蛋白酶/胶原酶溶液 5 mL,37℃消化 25 min,用 70 μm孔径的细胞筛滤除未消化组织;将上清细胞悬液低温40 r/min离心3 min,继续低温580 r/min离心8 min,取细胞沉淀,加入8 mL无血清DMEM培养基重悬混匀;将2 mL细胞悬液按同等比例分别缓慢加到50%、25%Percoll分离液中,低温900 r/min离心20 min,小心吸取25%与50%Percoll之间的细胞层,加入无血清DMEM培养基,继续900 r/min离心10 min,最终将上清液加入含20%胎牛血清的DMEM培养基培养。
1.3 原代HSCs的培养
原代 HSCs以 2×105~5×105/mL 的浓度接种至培养瓶,在5%CO2、37℃条件下培养,36~48 h首次换液,之后每2 d更换1次培养液(含10%胎牛血清)。
1.4 原代HSCs的活率鉴定
用0.04%台盼蓝溶液鉴定细胞存活率,普通光镜下未着色者为活细胞。
1.5 原代HSCs的免疫组化鉴定
将分离的原代HSCs培养于放有盖玻片的6孔培养板中,分别于1、3、7 d收集细胞,用4%冷的多聚甲醛固定15 min,0.5%Triton X-100覆盖细胞10 min,前后分别用小鼠抗结蛋白抗体(1∶200)、小鼠抗α-SMA抗体(1∶200)于4℃避光过夜,用荧光标记的二抗室温避光孵育1 h,DAPI染核,封片,在荧光显微镜下观察。
1.6 HSCs标志分子免疫印迹鉴定
将体外培养的原代HSCs裂解后提取蛋白,随后行Western印迹,步骤大致如下:将细胞裂解物用PBS清洗后加入SDS蛋白上样缓冲液,煮沸10 min,离心后取上清进行SDS-PAGE,转膜,用5%脱脂奶粉于4℃封闭过夜,一抗室温作用1 h,辣根过氧化物酶偶联的羊抗鼠IgG二抗室温作用1 h,化学发光法显色5 min,曝光显影。
2 结果
2.1 HSCs的得率、存活率和纯度鉴定
每只C57.BL/6J雄性小鼠分离纯化所得HSCs约为5.5×105个,存活率和纯度均大于95%。
2.2 倒置显微镜细胞形态学观察
新分离的HSCs在倒置显微镜下呈球形,折光性强,悬浮于培养液中(图1A);4 h后大部分细胞已贴壁,呈扁圆型,内含光亮的脂滴,少量细胞已开始伸突;至48 h可见大量细胞伸展生长(图1B);培养7 d后,HSCs已充分展开,体积明显增大,细胞呈典型的星形或多边形,细胞内颗粒明显减少,细胞逐渐融合,增殖细胞形态较大,并呈局灶性生长,被完全激活(图1C);培养14 d,细胞由局灶性生长转为单层生长,铺满培养板孔,细胞呈典型的成纤维细胞形态(图1D)。

图1 体外分离、培养的HSCs在普通光镜下的形态学变化(×200)
2.3 免疫细胞化学染色监测
结蛋白和α-SMA为HSCs激活的分子标志。免疫细胞化学技术进一步证实,培养7 d时,结蛋白和α-SMA共定位与细胞质(图2)。

图2 体外培养7 d时HSCs表达α-SMA和结蛋白标志分子(×200)
2.4 Western印迹检测HSCs特异性标志蛋白
Ⅰ型胶原蛋白和α-SMA是HSCs成熟活化后分泌产生的标志分子。Western印迹证实,原代HSCs在体外培养7 d时,2种标志分子即可达到分泌峰值(图3)。
3 讨论
HSCs为肝脏主要非实质细胞之一,正常情况下位于Disse间隙,紧贴肝窦内皮细胞和肝细胞,形态上常伸出星状突起。静息状态下,HSCs内富含脂滴,主要发挥贮存维生素A、脂肪滴及合成和分泌胶原等胞外基质成分的作用;当肝脏受到损伤时,星状细胞逐渐激活,胞质中脂滴消失,α-SMA表达增多,细胞外基质分泌增加。目前认为,HSCs持续激活是肝纤维化发生、发展的关键环节[4-5],因此,研究HSCs各种生物学行为意义重大。由于HSCs在肝脏中比例较低,且小鼠体积较小,分离HSCs的操作难度较大鼠要大,因此以往有关分离、体外培养HSCs的研究相对集中于大鼠。但对于各种研究而言,操作小鼠的重复性及经济性要高很多,因此建立简便、经济、高效的小鼠HSCs分离、体外培养及鉴定技术,对探讨各种致病因素引起肝脏纤维化发生的分子机制具有重要的现实意义。
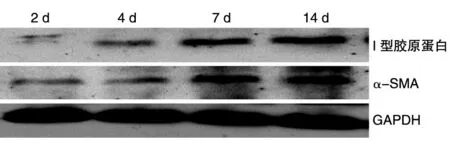
图3 Western印迹检测HSCs体外培养不同时间表达α-SMA和Ⅰ型胶原蛋白的规律
本研究采用在体原位肝脏灌注并结合非连续密度梯度离心技术,建立了分离、纯化与体外培养小鼠HSCs的方法。通过多次试验发现,影响HSCs分离及培养成功的主要因素包括:①门静脉插管灌流。门静脉插管要迅速、准确,进针切勿过深,灌流时应尽可能匀速,以保证肝脏每叶均能很好地灌注。我们采用的灌注速度为5 mL/min,无论是灌注D-Hank's液还是消化液,灌注时都应避免气泡进入门静脉在肝内血管中形成空气栓塞,导致灌注不充分。②链霉蛋白酶的应用。链霉蛋白酶可以选择性消化肝细胞[6],因此传统分离HSCs时都以链霉蛋白酶作为主要消化酶液,但如用量不当同样对HSCs有一定的损伤。我们经过多次摸索,在体灌注时先行用链霉蛋白酶灌注5 min破坏肝细胞,随后改为胶原酶继续灌注7 min,最后再用两者混合液继续消化,发现可以很好地保证HSCs的纯度和活力。③密度梯度分离介质。密度梯度分离介质的选择及密度梯度离心体系的建立,是纯化HSCs并提高获得率的重要步骤。与其他密度梯度介质相比,我们选用的Percoll分离介质具有价廉、梯度易制备及可直接观测等优点,同时易于从黏附的其他细胞上洗脱下来。④游离肝脏时应尽量去除肝脏包膜。肝组织机械分离时应尽量清除肝脏被膜,尽可能减少内皮细胞的污染。由于HSCs与Kuppfer细胞密度相近,特别容易造成污染,因此密度梯度离心后切忌贪多,禁止过度吸取界面下的细胞导致Kuppfer细胞污染[7]。⑤体外消化。酶液消化不充分可导致肝细胞与HSCs黏附在一起不易洗脱,最终降低了细胞纯度。如酶液消化过度,必然导致细胞损伤,进而引起分离后细胞体外存活能力下降。⑥小鼠的周龄和体重。小鼠周龄越小,细胞增殖力越好,但此时往往因体重较低不易操作;如周龄过大,分离操作确实容易,但由于细胞增殖能力较低,会影响后续实验进行。经过多次摸索,我们一般选择8~12周龄、体重22 g左右的小鼠作为实验对象。⑦细胞接种数量。HSCs分离后接种浓度和数量非常重要,接种浓度太低或数量太少,都会减弱细胞自分泌和旁分泌细胞因子的刺激作用,使细胞难以生长。我们的经验,一般接种浓度2×105/mL左右为宜。
目前,HSCs的鉴定尚无特异性指标,因此形态学观察显得尤其重要。新分离的HSCs胞浆中含有大量脂滴,在紫外光激发下可见蓝绿色荧光,该荧光观察虽简便快捷,但容易淬灭,不能长时间观察。随着生长贴壁,细胞进入活化阶段,此时HSCs具有肌成纤维细胞的一些特征,因此常用肌成纤维细胞特有的标志蛋白α-SMA和结蛋白进行鉴定[8]。本实验中,我们在体外培养7 d后分别对分离所得HSCs进行了免疫细胞化学染色,结果证实了HSCs同时表达α-SMA和结蛋白。业已证实,激活的HSCs分泌的细胞外基质主要成分为胶原蛋白。为了进一步验证分离所得细胞的生物学功能,我们分别对分离培养不同时间的HSCs进行蛋白印迹,发现常规培养7 d,HSCs分泌胶原蛋白及α-SMA的能力即达峰值,这为今后体外研究HSCs的活化时间及相应的分子、生物学功能等提供了有力的生物学依据。
[1]Senoon H,Yoshikawa K,Morii M,et al.Hepatic stel⁃late cell(vitamin A-storing cell)and its relative-past,present and future[J].Cell Bio Int,2010,34(12):1247-1272.
[2]Tang Y.Curcumin targets multiple pathways to halt hepatic stellate cell activation:updated mechanisms in vitro and in vivo[J].Dig Dis Sci,2015,60(6):1554-1564.
[3]Guo J,Friedman S L.Hepatic fibrogenesis[J].Semin Liver Dis,2007,27(4):413-426.
[4]Bansal R,Prakash J,de Ruijter M,et al.Peptide modified albumin carrier explored as a novel strategy for a cell-specific delivery of interferon-γ to treat liv⁃er fibrosis[J].Mol Pharm,2011,8(5):1899-1909.
[5]Tacke F,Trautwein C.Mechanisms of liver fibrosis resolution[J].J Hepatol,2015,63(4):1038-1039.
[6]Zhang Q,Qu Y,Li Z,et al.Isolation and culture of single cell types from rat liver[J].Cells Tissues Or⁃gans,2016,201(4):253-267.
[7]Mohar I,Brempelis K,Murray S,et al.Isolation of non-parenchymal cells from the mouse liver[J].Meth⁃ods Mol Biol,2015,325:3-17.
[8]Liu P,Wang M,Lu X,et al.Schistosoma japonicum egg antigen up-regulates fibrogenesis and inhibits pro⁃liferation in primary hepatic stellate cells in a concen⁃tration-dependent manner[J].World J Gastroenterol,2013,19(8):1230-1238.
Isolation,Identification and Evaluation of Hepatic Stellate Cells from C57.BL/6J Mouse
HAN Ju-Qiang1,3,DU Jing-Hua2a,XU Xiao-Jie3,LIU Wen-Peng2b,LIANG Ji-Guang4,3,LI Jia-Rui4*,YE Qi-Nong3*
1.Department of Liver Disease,PLA Army General Hospital,Beijing 100700;2.a.Department of Traditional and Western Medical Hepatology;b.Department of Infectious Disease;Third Hospital of Hebei Medical University,Shi⁃jiazhuang 050051;3.Beijing Institute of Biotechnology,Beijing 100850;4.Department of Interventional Radiogra⁃phy,First Hospital of Jilin University,Changchun 130021;China
Objective:To investigate and evaluate the feasible methods of isolating and purifying hepatic stellate cells(HSCs) from C57.BL/6J mousein vitro.Methods:Mouse's liver was infused with D-Hank fluids via portal veinin situ.Subsequently,HSCs were isolated by discontinuous Percoll gradient centrifugation after liver was di⁃gested with pronase E,Ⅳtype collgenase and DNase,the cell viability was determined by trypan blue exclusiontest.The morphological character of HSCs was observed by microscope.Both α-SMA and desmin were identified by immunocytochemistry staining.Both α-SMA andⅠtype collagen was detected by Western blot.Results:The yield amount of HSCs was about 5.5×105per mouse's liver.Both viability and purity were more than 95%.Immu⁃nocytochemistry staining demonstrated that α-SMA and desmin were positive in HSCs culturedin vitro.Western blot assay showed that α-SMA andⅠtype collagen were expressed extremely at 7thday.Conclusion:The estab⁃lished protocol is so successful in isolating and culturing the primary mouse HSCs that provides a technical sup⁃port for research of relevant liver fibrogenesis in the future.
hepatic stellate cell;primary culture;cell isolation;mouse
Q24
A
1009-0002(2017)05-0600-04
10.3969/j.issn.1009-
*Co-corresponding authors,YE Qi-Nong,E-mail:yeqn66@yahoo.com;LI Jia-Rui,E-mail:jiaruili1971@sina.com
2017-04-17
首都医学特色发展基金(z141107002514057)
韩聚强(1973- ),男,博士,主任医师,(Email)hanjuqiang2014@126.com;杜静华(1985- ),女,博士,主治医师;二者为共同第一作者
