肿瘤坏死因子α对大鼠骨髓间充质干细胞生物学特性的影响
2017-10-24杜春彦张欢杨静王晓晨冯泽国郭全义
杜春彦,张欢,杨静,王晓晨,冯泽国,郭全义
1.清华大学附属北京清华长庚医院 麻醉科,北京 102218;2.解放军总医院 麻醉手术中心,北京 100853;3.骨科再生医学北京市重点实验室,全军骨科战创伤重点实验室,北京 100853
肿瘤坏死因子α对大鼠骨髓间充质干细胞生物学特性的影响
杜春彦1,张欢1,杨静2,王晓晨2,冯泽国2,郭全义3
1.清华大学附属北京清华长庚医院 麻醉科,北京 102218;2.解放军总医院 麻醉手术中心,北京 100853;3.骨科再生医学北京市重点实验室,全军骨科战创伤重点实验室,北京 100853
目的:探讨不同浓度肿瘤坏死因子α(TNF-α)对大鼠骨髓间充质干细胞(BMSCs)生物学特性的影响。方法:采用全骨髓贴壁法分离培养大鼠BMSCs,倒置显微镜观察细胞形态学变化,流式细胞仪检测BMSCs表面标记物;分别以10、100、1000 ng/mL的TNF-α完全培养液预处理P3代BMSCs,并设置仅含培养基的空白对照组,24 h后采用ELISA试剂盒检测细胞培养上清液中IL-6、IL-10的表达水平;胰酶消化细胞,用PrestoBlue法检测10、100、1000 ng/mL TNF-α完全培养液预处理BMSCs后细胞增殖活性。结果:ELISA检测结果显示,与对照组相比,各浓度TNF-α干预组IL-6、IL-10均有不同程度升高,差异有统计学意义(P<0.05),且1000 ng/mL TNF-α干预组IL-10表达水平最高,其浓度为170.2±11.9 pg/mL,组间比较差异有统计学意义(P<0.05);100 ng/mL TNF-α干预组IL-6表达水平最高,其浓度为144.0±18.6 pg/mL,组间比较差异有统计学意义(P<0.05)。PrestoBlue检测结果显示,与对照组相比,10、100、1000 ng/mL TNF-α干预组荧光值均增高,差异有统计学意义(P<0.05),但组间荧光值比较差异无统计学意义(P>0.05)。结论:10~1000 ng/mL TNF-α可促进BMSCs的增殖,且随着TNF-α浓度的升高,BMSCs分泌促炎因子IL-6的能力降低,分泌抑炎因子IL-10的能力升高。
骨髓间充质干细胞;促炎因子;抑炎因子;肿瘤坏死因子α
骨髓间充质干细胞(bone marrow mesenchy⁃mal stem cells,BMSCs)是具有自我更新能力和多向分化潜能的多能干细胞,因具有低免疫性、易分离扩散、免疫调节及抗炎等特性,而成为组织工程和再生医学中的理想种子细胞[1-3]。作为细胞和基因治疗的载体,BMSCs目前已在多种疾病如帕金森病、中风、脑干损伤、心肌梗死、脊髓损伤、外周神经损伤中得到应用[4],但移植到损伤组织的细胞快速凋亡限制了BMSCs的广泛应用。近年有研究提出BMSCs所处的微环境是影响细胞生长和旁分泌功能的基本因素,干细胞移植微环境中炎性因子水平的高低不仅决定BMSCs的生存活性,还显著影响BMSCs功能的发挥[5]。Mi⁃ettinen等研究发现,急性组织损伤时,靶组织中急性升高的肿瘤坏死因子α(tumor necrosis factor α,TNF-α)水平对BMSCs的归巢定植及旁分泌功能均有促进作用[6]。Covey等研究发现,TNF-α是炎性反应过程中最早出现且最具有代表性的多功能炎性因子之一,微环境中TNF-α水平的高低不仅可促进白细胞介素IL-1β、IL-6等炎性因子的瀑布反应,还促使BMSCs在炎性环境下发生表型转换,影响BMSCs对疾病的调控作用[7]。因此,在本研究中,我们拟以大鼠来源的BMSCs为代表,通过添加不同浓度的TNF-α模拟BMSCs所处的炎性环境,探讨TNF-α完全培养液预处理对大鼠BMSCs活性及旁分泌作用的影响,为BMSCs在临床上的应用提供实验依据。
1 材料和方法
1.1 材料
健康清洁级雄性 SD 大鼠(60~80 g,4~6周龄)由解放军总医院动物研究中心提供;SD大鼠BMSCs基础培养基α-MEM、胎牛血清(FBS)、青链霉素双抗、谷氨酰胺等购自Gibco公司;0.25%胰酶购自康宁公司;CD29抗体、CD90抗体购自BD公司;CD34、CD45购自Abcam公司。
1.2 大鼠原代BMSCs的分离培养
选取4~6周龄SD大鼠6只,戊巴比妥钠50 mg/kg麻醉后处死,切开皮肤,暴露肌肉,取股骨、胫骨,于75%酒精中浸泡15 min后移入超净台,充分分离附着肌肉,显露骨髓腔,用α-MEM反复缓慢冲洗骨髓腔至骨发白,收集冲洗液移入离心管,1500 r/min离心5 min后弃上清,取α16培养液10 mL重悬,吹打均匀后以2×105/cm2的浓度接种于T25培养瓶中,于37℃、5%CO2培养箱内培养。用差异贴壁法分离纯化细胞,待细胞达到80%融合时传代培养。
1.3 大鼠BMSCs的流式细胞术鉴定
将融合率达到80%的P3代BMSCs常规消化成细胞悬液后,离心去上清,加入PBS重悬,细胞计数;再次离心去上清,PBS清洗2次,调整流式管中BSMCs密度至1×106/mL,每管依次加入抗大鼠 CD29-AF647(5 μL)、CD34-PECY7(20 μL)、CD45-PE(10 μL)、CD90-PE(10 μL)抗体和同型对照抗体,室温避光孵育30 min后去除未结合抗体,用300 μL PBS重悬,上机检测前加入700 μL PBS混匀,利用流式细胞仪对细胞表面分子标记物进行鉴定。
1.4 ELISΑ 法测定BMSCs分泌IL-6、IL-10的水平
取P3代BMSCs,常规消化细胞,离心计数,以1×105/孔接种于24孔培养板,培养过夜;次日弃去培养液,分别加入10、100、1000 ng/mL TNF-α完全培养液培养,设0 ng/mL为空白对照,每组均设3个复孔,置CO2培养箱内培养24 h后,吸取培养液上清,4℃、12 000 r/min离心20 min,取上清,用ELISA试剂盒于酶标仪上检测D450nm值,检测后用胰酶消化细胞,用于后续试验。
1.5 PrestoBlue试剂检测TNF-α预处理后BMSCs的增殖活性
取上述经 0、10、100、1000 ng/mL TNF-α 处理过的BMSCs,胰酶消化、计数,取96孔板,每孔加入 5×104BMSCs(100 μL),于 37℃、5%CO2培养箱中培养24 h后取出,将PrestoBlue试剂加入孔板,每孔10 μL,37℃孵育10 min,用酶联免疫检测仪(激发波长560 nm,发射波长590 nm)测定每孔荧光值(Fluorescence)。
2 结果
2.1 BMSCs形态观察
由骨髓分离的细胞体外培养2 d后,细胞呈悬浮样生长,细胞形态以圆形为主,镜下可见细胞呈梭形或多角形态,随着换液和继续培养,培养瓶中贴壁细胞数量逐渐增多,悬浮细胞数量减少。原代培养的细胞在接种1周后细胞集落达到80%融合(图1Α)。传代后的BMSCs分裂、增殖速度明显变慢,大部分贴壁细胞保持长梭形,培养2~3周后杂质细胞明显减少,细胞呈放射状排列,融合片状生长,形成典型漩涡状形态,细胞纯度较高(图1B)。

图1 原代培养BMSCs形态(×100)
2.2 BMSCs的流式鉴定结果
流式细胞分析技术显示CD29(99.59%)、CD90(83.95%)呈阳性表达,CD34(0.1%)、CD45(7%)呈阴性表达。表明分离培养的细胞在细胞表面标志物方面符合BMSCs的生物学特性且纯度较高,适合实验需要。
2.3 不同浓度TNF-α预处理后BMSCs分泌IL-6和IL-10的变化
ELISA结果显示,与对照组(13.469±3.717 pg/mL)相比,各浓度TNF-α干预组IL-6表达水平均有不同程度升高,差异有统计学意义(P<0.05)。其中100 ng/mL TNF-α干预组IL-6分泌最多,浓度为 143.980±18.639 pg/mL,与 10、1000 ng/mL TNF-α干预组相比差异有统计学意义(P<0.05)。与对照组(12.967±2.820 pg/mL)相比,各浓度TNF-α干预组IL-10表达水平均有不同程度升高,差异有统计学意义(P<0.05)。1000 ng/mL TNF-α干预组IL-10分泌最多,浓度为170.221±11.864 pg/mL,与10、100 ng/mL TNF-α干预组相比差异有统计学意义(P<0.05)
2.4 Prestoblue试剂检测TNF-α处理后BMSCs的生长活性变化
不同浓度TNF-α作用24 h后,BMSCs生长活性较对照组增高,其中10 ng/mL TNF-α干预组细胞生长活性最强,其荧光值为890.203±75.559,与空白组相比差异有统计学意义(P<0.005);100、1000 ng/mL TNF-α组与空白组相比,差异有统计学意义,但TNF-α各浓度组间比较无统计学差异(P>0.05)。
3 讨论
BMSCs常被移植到炎症环境中,并通过自分泌、旁分泌功能产生大量炎性因子,调节宿主的免疫反应。干细胞因这一特性,已在肺损伤、糖尿病、败血症、无菌模型角膜损伤和中风等动物模型中取得良好的治疗效果[8-9]。由于移植到损伤组织后的BMSCs仍处于炎性微环境中,炎性介质对BMSCs的生存及疾病调控作用有重要影响,因此,探索移植后微环境对BMSCs的生存及功能的影响具有重要意义。TNF-α是组织损伤后最先释放的细胞因子,被认为是炎症信号级联反应的启动因子,极低水平的TNF-α即可与BMSCs表面的Toll样受体(TLR)结合,促进干细胞合成和释放IL-6和IL-10等炎性因子[10-12]。本实验选用不同浓度的TNF-α模拟BMSCs在体内所处的微环境,采用PrestoBlue方法观察细胞活性,ELISA法测定BMSCs分泌炎性因子IL-6、IL-10的水平,探讨BMSCs在不同炎性环境下生长活性及旁分泌功能的变化,为临床研究打下了基础。

图2 流式细胞仪检测BMSCs表面分子标记物

图3 TNF-α刺激下BMSCs分泌IL-6、IL-10含量变化
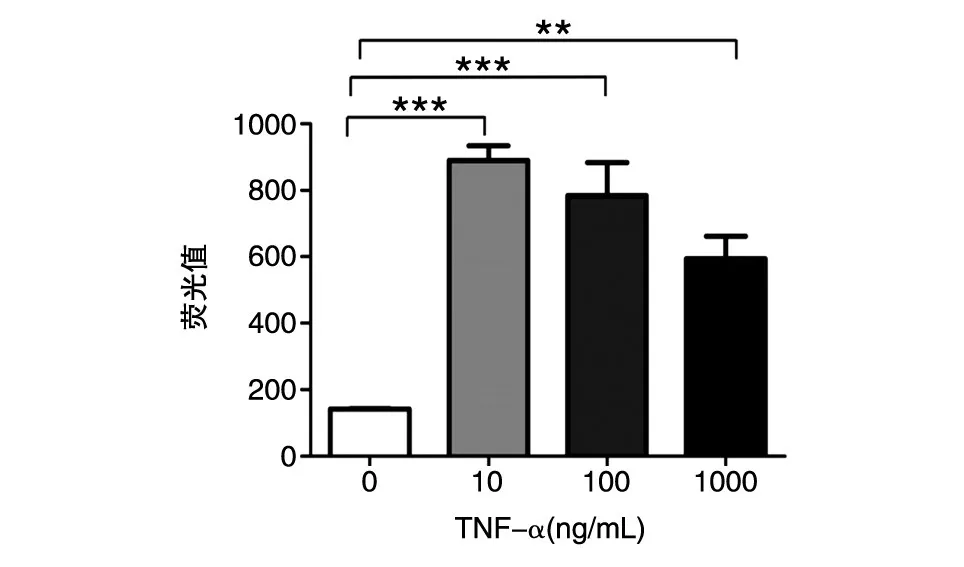
图4 TNF-α预处理后BMSCs的荧光值
PrestoBlue检测结果提示,10~1000 ng/mL的TNF-α促进BMSCs增殖,但随着TNF-α浓度的增加,BMSCs增殖幅度逐渐降低,提示高浓度的TNF-α可抑制BMSCs的增殖幅度。ELISA检测发现,随着TNF-α刺激浓度的升高,IL-6的增加幅度逐渐降低,BMSCs分泌促炎因子IL-6的能力逐渐下降;IL-10的增加幅度逐渐提高,BMSCs分泌抑炎因子IL-10的能力逐渐升高,提示BMSCs的旁分泌功能受炎性微环境环境的影响。LI等研究发现,在急性炎症反应期,低水平的促炎因子TNF-α、LPS、GM-CSF可诱导BMSCs向M1方向极化[13]。BMSCs分泌大量促炎因子,主要参与体内炎性反应,有促进炎症发展的作用[14],并分泌CX⁃CL9、CXCL10等趋化因子吸引BMSCs到达损伤部位[15]。在炎症反应晚期,高水平的的促炎因子TNF-α、IFN-γ可刺激BMSCs向M2型转化,抑制中性粒细胞的增殖、活化并阻止中性粒细胞迁移到损伤组织中,同时BMSCs可增强单核细胞和巨噬细胞中IL-10的产生[14,16]。国内学者在探讨TNF-α对小鼠BMSCs免疫抑制作用时发现,用25和50 ng/mL TNF-α干预BMSCs时,处理组上清液中的抑炎因子IL-10的表达和对照组相比并无明显增加,而在100 ng/mL TNF-α刺激时,上清液中的IL-10含量较对照组明显增加,与本实验结果相符[17]。Liu等研究发现,10 ng/mL TNF-α或100 ng/mL LPS处理BMSCs时,BMSCs上清液中的IL-6含量大幅度升高[18]。诸多研究表明炎性环境中IL-6的变化不仅和免疫炎症有关,其表达水平的高低可能与TNF-α逆转BMSCs的促炎表型相关[19-20]。
我们用 10~1000 ng/mL TNF-α 处理 BMSCs,从细胞上清IL-6的分泌量增加来看,经TNF-α刺激后的BMSCs已发生M1极化,TNF-α浓度进一步增加后IL-10表达水平增加,提示BMSCs可进一步发生M2极化偏移,M1型和M2型BMSCs的极化代表了细胞一个广泛的连续的功能状态。关于TNF-α是通过何种途径激活BMSCs的表型转化的,有文献报道M1向M2的转化取决于MSC表面的TLR,极化到M1的状态受TLR3的影响,而M2状态受TLR4的影响[13-14],低浓度促炎环境下,BMSCs表面的TLR3被激活,进一步促进MAPK激酶磷酸化,活化NF-κB,诱导IL-1β、IL-6的表达;NF-κB的激活可介导释放更多的促炎因子,激活BMSCs表面的TLR4,同时介导释放IL-10、IL-12等抗炎因子[21-22]。BMSCs对炎性因子的记忆作用使得越来越多的研究集中于干细胞的预处理,近年来,病毒转染、缺氧休克、高密度脂蛋白、脂多糖、TNF-α等在BMSCs的瞬时处理方面取得很大进展[18,21]。预处理可增强细胞存活,促使细胞迁移到靶器官,显著改善细胞在组织修复中的作用。但本该实验也存在不足,移植后BMSCs的生存微环境比体外情况下模拟的炎性环境复杂得多,并且BMSCs在不同的炎性环境下发生极化的方向也有可能不同,实验利用不同浓度的TNF-α来模拟炎性环境仍须改善。另外,用TNF-α预处理BMSCs后,移植到体内的BMSCs对疾病的有效性有待研究。
综上所述,TNF-α作为一种安全、简便、可靠、准确的预处理方式,可提高BMSCs的生物学功能及分泌炎性因子的能力,较高浓度的TNF-α可逆转BMSCs的促炎表型,促使BMSCs分泌更多的抑炎因子,进而更好地发挥治疗作用。目前针对BMSCs干预措施的研究仍在进行中,需要进一步明确BMSCs发挥治疗作用的机制及影响这一机制的炎性环境,这可优化BMSCs的治疗作用,为临床应用提供理论依据。
[1]Pittenger M F,Mackay A M,Beck S C,et al.Multi⁃lineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-147.
[2]Aggarwal S,Pittenger M F.Human mesenchymal stem cells modulate all ogeneic immune cellresponses[J].Blood,2005,105(4):1815-1822.
[3]王慧娜,杜丽欣,宋亚昆,等.人脐带间充质干细胞体内移植的安全性研究[J].生物技术通讯,2015,26(1):85-87.
[4]Lindvall O,Kokaia Z.Stem cells for the treatment of neurological disorders[J].Nature,2006,441(7097):1094-1096.
[5]De Becker A,Riet I V,et al.Homing and migration of mesenchymal stromal cells:How to improve the effi⁃cacy of cell therapy[J].World J Stem Cells,2016,8(3):73-87.
[6]Miettinen J A,Pietilä M,Salonen R J,et al.Tumor necrosis factor alpha promotes the expression of immu⁃nosuppressive proteins and enhances the cell growth in a human bone marrow-derived stem cell culture[J].Exp Cell Res,2010,317(6):791-801.
[7]Covey W C,Ignatowski T A,Knight P R,et al.Brain⁃derived TNFα:involvement in neuroplastic changes im⁃plicated in the conscious perception of persistent pain[J].Brain Res,2000,859(1):113-122.
[8]Prockop D J, Oh J Y. Mesenchymal stem/stromal cells(MSCs): role as guardians of inflammation[J]. Mol Ther, 2012,20(1):14-20.
[9]Choi H,Lee R H,Bazhanov N,et al.Anti-inflamma⁃tory protein TSG-6 secreted by activated MSCs attenu⁃ates zymosan-induced mouse peritonitis by decreasing TLR2/NF-κB signaling in resident macro phages[J].Blood,2011,118(2):330-338.
[10]English K,Barry F P,Fieldcorbett C,et al.IFN-gam⁃ma and TNF-alpha differentially regulate immunomodu⁃lation by murine mesenchymal stem cells[J].Immunol Lett,2007,110(2):91-100.
[11]Gnecchi M,Zhang Z,Ni A,et al.Paracrine mecha⁃nisms in adult stem cell signaling and therapy[J].Circ Res,2008,103(11):1204-1219.
[12]Vega-Letter A M,Kurte M,Fernández-O'Ryan C,et al.Differential TLR activation of murine mesenchymal stem cells generates distinct immunomodulatory effects in EAE[J].Stem Cell Res Ther,2016,7(1):150.
[13]Li W,Ren G,Huang Y,et al.Mesenchymal stem cells:a double-edged sword in regulating immune re⁃sponses[J].Cell Death Differ,2012,19(9):1505-1513.
[14]Gazdic M,Volarevic V,Arsenijevic N,et al.Mesen⁃chymal stem cells:a friend or foe in immune-mediat⁃ed diseases[J].Stem Cell Rev Rep,2015,11(2):280-287.
[15]Honczarenko M,Le Y,Swierkowski M,et al.Human bone marrow stromal cells express a distinct set of bi⁃ologically functional chemokine receptors[J]. Stem Cells,2006,24(4):1030-1041.
[16]Waterman R S,Tomchuck S L,Henkle S L,et al.A new mesenchymal stem cell(MSC)paradigm:polariza⁃tion into a pro-inflammatory MSC1 or an immunosup⁃pressive MSC2 phenotype[J].PLoS One,2010,5(4):e10088.
[17]亓俊华,吴梅,徐祥,等.TNF-α对小鼠骨髓间充质干细胞免疫抑制作用影响[J].青岛大学医学院学报,2015(2):169-171.
[18]Liu G Y,Liu Y,Lu Y,et al.Short-term memory of danger signals or environmental stimuli in mesenchy⁃mal stem cells:implications for therapeutic potential[J].Cell Mol Immunol,2016,13(3):369-378.
[19]Ranganath S H,Levy O,Inamdar M S,et al.Harness⁃ing the mesenchymal stem cell secretome for the treat⁃ment of cardiovascular disease[J].CellStem Cell,2012,10(3):244-258.
[20]Prockop D J.Concise review:two negative feedback loops place mesenchymal stem/stromal cells at the cen⁃ter of early regulators of inflammation[J].Stem Cells,2013,31(10):2042-2046.
[21]Choi H,Lee R H,Bazhanov N,et al.Anti-inflamma⁃tory protein TSG-6 secreted by activated MSCs attenu⁃ates zymosan-induced mouse peritonitis by decreasing TLR2/NF-κB signaling in resident macrophages[J].Blood,2011,118(2):330-338.
[22]Böcker W,Docheva D,Prall W C,et al.IKK-2 is re⁃quired for TNF-α-induced invasion and proliferation of human mesenchymal stem cells[J].J Mol Med,2008,
Effects of TNF-α on Biological Properties in Bone Marrow Mesenchymal Stem Cells
DU Chun-Yan1,ZHANG Huan1,YANG Jing2,WANG Xiao-Chen2,FENG Ze-Guo2*,GUO Quan-Yi3
1.Department of Anesthesiology,Beijing Tsinghua Changgung Hospital Tsinghua University,Beijing 102218;2.An⁃esthesia and Operation Center,General Hospital of PLA,Beijing 100853;3.Beijing Key Lab of Regenerative Medi⁃cine in Orthopaedics,Key Lab of Musculoskeletal Trauma&War Injuries,PLA,Beijing 100853;China
Objective:To investigate the effects of different concentrations of tumor necrosis factor-α(TNF-α)on the release of interleukin-6(IL-6) and interleukin-10(IL-10) from rat bone marrow mesenchymal stem cells(BMSCs).Methods:BMSCs were isolated and cultivated by whole bone marrow adherent culture method.Morpho⁃logical changes of BMSCs were observed by inverted phase contrast microscope,the surface markers of BMSCs were detected by flow cytometry.The BMSCs were treated with 10,100 and 1000 ng/mL TNF-α complete culturemedium respectively,the control group containing medium only,24 hours later,IL-6 and IL-10 in the cell cul⁃ture supernatants were detected by ELISA kit.Then the cells were treated with trypsin to detect the cell viability with PrestoBlue method.Results:The levels of IL-6 and IL-10 in the supernatants of TNF-α treated group were significantly higher than those in the control group(P<0.05).And IL-10(170.2±11.9 pg/mL) was the highest in 1000 ng/mL TNF-α intervention group,IL-6(144.0±18.6 pg/mL) was the highest in 100 ng/mL TNF-α interven⁃tion group,the difference was statistically significant among groups(P<0.05).PrestoBlue test showed that the fluo⁃rescence values of 10,100 and 1000 ng/mL TNF-α groups were all higher than those of the control group but there was no significant difference in fluorescence between groups(P>0.05).Conclusion:TNF-α may influence the proliferation of BMSCs and the secretion of IL-6 and IL-10.With the increase of TNF-α concentration,the BMSCs can increase the level of proinflammatory cytokine IL-6 and decrease anti-inflammatory cytokine IL-10.
bone marrow mesenchymal stem cells;proinflammatory cytokines;anti-inflammatory cytokines;tu⁃mor necrosis factor α
R329.28
A
1009-0002(2017)05-0584-06
10.3969/j.issn.1009-
*Corresponding author,E-mail:beijing_301@sina.com
2017-03-01
杜春彦(1991- ),女,硕士研究生,(E-mail)duchunyan1991@163.com
冯泽国,(E-mail)beijing_301@sina.com
