利用丙型肝炎病毒复制子模型检测重组人λ2干扰素的体外活性
2017-10-24张辉李亚东毕研伟宫悦李智华丁晨寸嫚
张辉,李亚东,毕研伟 ,宫悦,李智华,丁晨 ,寸嫚
1.中国医学科学院&北京协和医学院 医学生物学研究所,云南 昆明 650118;2.云南省重大传染病疫苗研发重点实验室,云南 昆明 650118
利用丙型肝炎病毒复制子模型检测重组人λ2干扰素的体外活性
张辉1,2,李亚东1,2,毕研伟1,2,宫悦1,2,李智华1,2,丁晨1,2,寸嫚1,2
1.中国医学科学院&北京协和医学院 医学生物学研究所,云南 昆明 650118;2.云南省重大传染病疫苗研发重点实验室,云南 昆明 650118
目的:利用丙型肝炎病毒(HCV)复制子细胞模型,体外研究重组人λ2干扰素(hIFNλ2)对HCV复制子的抑制作用。方法:构建重组质粒pcDNA3.1-hIFNλ2-HA,转染293T细胞,表达带有HA标签的hIFNλ2,表达后的上清通过Western印迹检测,然后稀释至不同浓度后作用于带有HCV复制子的Huh7.5细胞系,每隔24 h取样并更换培养液,通过报告基因检测hIFNλ2对HCV复制子的抑制作用。结果:构建了pcDNA3.1-hIFNλ2-HA真核表达重组体,并在293T细胞中表达出hIFNλ2,该蛋白能有效抑制HCV复制子的复制。结论:hIFNλ2对HCV复制子具有抑制作用。
重组人λ2干扰素;抑制;HCV复制子
丙型肝炎是一种主要经血液传播的疾病,是由丙型肝炎病毒(hepatitis C virus,HCV)感染引起的,已经给全世界带来了显著的医疗负担。由于HCV的自然清除率很低,大部分患者会发展为慢性感染,预计全世界有1.3~1.7亿人患有慢性丙型肝炎[1]。长期感染可能导致晚期肝纤维化、肝硬化甚至肝癌。目前尚无有效的疫苗可以预防HCV的感染,对于HCV感染患者,临床上采用的标准疗法是聚乙二醇-α干扰素(PEG-IFNα)联合病毒唑进行抗病毒治疗。自2011年起,新的治疗方法是在标准疗法的基础上增加特异性的HCV蛋白酶抑制剂,即采用PEG-IFNα、病毒唑及蛋白酶抑制剂(telaprevir或 boceprevir)三联疗法[2],最新的HCV药物研究还包括DAAs(direct-acting an⁃tiviral drugs)[3]、HTAs(host-targeting agents)[4]等 ,但高昂的治疗费用、可预期的耐药株,以及不能有效防治随后可能诱导发生的肝脏疾病限制了这种疗法的广泛运用。这就迫切需要我们进行新的抗病毒分子的研制。
干扰素(interferon,IFN)为体内主要的抗病毒细胞因子。自1957年Isaacs和Lindenmann[5]报道流感病毒感染的鸡胚胎细胞能够分泌一种可以抵抗流感病毒或其他病毒感染的蛋白质以来,有关IFN的研究不断深入。2003年,2个研究组[6-7]几乎同时报道了一个全新的Ⅲ型干扰素家族——人 IFNλs(hIFNλs)[4],包括 hIFNλ1、hIFNλ2、hIFNλ3(也可分别称作IL-29、IL-28A和IL-28B)以及最近发现的hIFNλ4[6-8]。IFNλs与受体结合能够激活细胞内的JAK/STAT信号转导通路,形成干扰素刺激调节因子3(IFN-stimulated regulatory factor 3,ISGF3),ISGF3进入细胞核后启动相应基因的表达。Ⅲ型干扰素的表达产物在体内和体外均具有抗病毒和抗肿瘤活性。目前用于抗病毒治疗的药物主要是Ⅰ型干扰素,但副作用较明显,所以Ⅲ型干扰素也许在干扰素替代性药物方面具有潜在的应用价值。
研究发现,IL28A(IFNλ2)具有抗病毒和抗肿瘤作用。另外,在IFNλ2转基因的体内实验中,IFNλ2可使小鼠脾细胞IFNγ增多,从而加强细胞毒性T细胞的活性和NK细胞的数量,促使IL-12诱导生成更多的IFNγ,抑制肿瘤生长。由此可见,IFN-λ2也可参与诱导抗肿瘤固有免疫和特异性免疫应答[9]。IFNλs的受体主要分布于肠、肝脏等部位,其中,IFNλ2通过IFNλR1受体起作用,因此与Ⅰ型干扰素相比,能够减少副作用。
我们将真核表达重组载体pcDNA3.1-hIFNλ 2-HA质粒瞬时转染293T细胞,表达hIFNλ2-HA,然后将表达的蛋白作用于带有HCV复制子的Huh7.5细胞,通过报告基因检测hIFNλ2对HCV复制子的抑制作用。
1 材料与方法
1.1 材料
带有2a型HCV JFH1复制子的Huh7.5细胞系、大肠杆菌DH5α感受态细胞由本科室保存;DMEM培养基购于Hyclone公司;胎牛血清(FBS)购于Gibco公司;XbaⅠ、NheⅠ和BamHⅠ限制性内切酶购于NEB公司;羊抗鼠-HRP二抗、化学发光底物试剂盒购于Thermo Fisher Scientific公司;HA单克隆抗体(HA-7)购于Sigma-Aldrich公司;质粒小提试剂盒、DNA纯化回收试剂盒购于天根生化科技(北京)有限公司;海肾萤光素酶报告基因检测试剂盒购于Promega公司;LipofectAMINE 2000、琼脂糖购于Invitrogen公司;6孔板和48孔板购于Costar公司;荧光化学发光分析仪(Fluoros⁃kan Ascent FL)购于Thermo Scientific公司。
1.2 重组表达质粒的构建
hIFNλ2基因由上海捷瑞生物工程有限公司合成,通过NheⅠ和BamHⅠ酶切位点将hIFNλ2基因插入表达载体pcDNA3.1-HA,转化大肠杆菌DH5α感受态细胞,获得重组表达质粒pcDNA3.1-hIFNλ2-HA。
2a型JFH1复制子各序列原件依次为T7启动子-JFH1A全长-丁型肝炎病毒核酶-T7终止子,将缺失信号肽的Gaussia萤光素酶报告基因(trun⁃cated Gluc)与部分P7和Ns2基因融合后插入JFH1A[10]。1a型H77C复制子各序列原件依次为T7启动子-H77C全长-丁型肝炎病毒核酸-T7终止子,同样将缺失信号肽的Gaussia萤光素酶报告基因与部分P7和Ns2基因融合后插入H77C。复制子中的萤光素酶报告基因(Gluc)用于检测复制子的复制情况,抗稻瘟菌素(blasticidin)抗性基因用于筛选带有复制子的细胞克隆。
1.3 带有1a型H77C复制子的Huh7.5细胞系的构建
将融合表达SEC14L2基因和EGFP报告基因、嘌呤霉素抗性基因的质粒(pCW499)与慢病毒包装质粒共转染293T细胞,48 h后收集含有慢病毒的培养基上清,20 000 r/min离心2 h对慢病毒进行浓缩,将浓缩后的慢病毒感染Huh7.5细胞,通过嘌呤霉素筛选获得能表达SEC14L2的Huh7.5稳定转染细胞系。
将带有1a型H77C复制子的质粒用XbaⅠ线性化,用T7 ribomax express large scale RNA pro⁃duction system试剂盒(Promega)体外转录为RNA,然后用TransMessenger Transfection Reagent试剂盒(Qiagen)将此RNA转染表达SEC14L2的Huh7.5稳定转染细胞系,通过抗稻瘟菌素筛选获得带有1a型H77C复制子的细胞系。
1.4 hIFNλ2的表达
用DMEM完全培养基(含10%胎牛血清)培养293T细胞,以4×105/孔的密度将细胞传至6孔板,37℃、5%CO2培养箱中培养约 16 h,采用 Lipo⁃fectAMINE 2000分别将pcDNA3.1-hIFNλ2-HA重组质粒(实验组)和pcDNA3.1空质粒(对照组)转染293T细胞,48 h后收集上清,通过Western印迹检测目的蛋白的表达,一抗为鼠单抗HA-tag(1∶1000),二抗为山羊抗鼠IgG-HRP(1∶5000)。
1.5 hIFNλ2对HCV复制子的抑制作用
JFH1复制子和1a型H77C型复制子均带有萤光素酶报告基因。将带有JFH1复制子和带有1a型H77C型复制子的Huh7.5细胞以5×104/孔的密度传至48孔板,12 h后将表达hIFNλ2的293T细胞的上清分别用DMEM培养基稀释至1/10、1/100、1/1000后等量加入带有2a型JFH1复制子和带有1a型H77C型复制子的Huh7.5细胞中,分别在0、24、48、72、96 h换液,同时加入含有相同剂量干扰素的DMEM培养基,上清于-20°保存用于检测萤光素酶活性。阴性对照组为不加干扰素的DMEM培养基,阳性对照组为含有活性单位为1000 U的α-干扰素的DMEM培养基,实验组的每个稀释度以及对照组均做3个复孔,将在每个时间段收集的样品的上清分别检测萤光素酶活性,评价HCV复制子的复制水平。
2 结果
2.1 重组表达质粒pcDNA3.1-hIFNλ2-HA的构建
通过NheⅠ和BamHⅠ双酶切获取hIFNλ2目的基因片段,1%琼脂糖凝胶电泳可见约681 bp的条带,与预期大小一致(图1A)。pcDNA3.1-HA载体同样经NheⅠ和BamHⅠ双酶切,1%琼脂糖凝胶电泳可见约5394 bp的目的条带,与预期大小一致(图1B)。对双酶切后的片段分别纯化回收,通过T4DNA连接酶连接,连接产物转化大肠杆菌DH5α感受态细胞,挑取阳性克隆,振荡培养后提取质粒,XhoⅠ酶切鉴定,获得约5863和288 bp的片段(图1C),与预期大小相符。
2.2 构建带有1a型H77C复制子并能稳定表达SEC14L2蛋白的Huh7.5的细胞系
SEC14L2蛋白能促进HCV复制子的复制[11],因此构建能稳定表达此蛋白的细胞系。为了检测方便,构建能融合表达SEC14L2和EGFP、嘌呤霉素抗性基因的质粒pCW499(图2A),与慢病毒包装质粒共转染293T细胞,收集含有慢病毒的细胞上清并浓缩,将浓缩后的慢病毒感染Huh7.5细胞,48 h后通过嘌呤霉素筛选,72 h后用荧光显微镜观察,可见细胞都有绿色荧光(图2B),表明已构建了能稳定表达SEC14L2的Huh7.5细胞系。

图1 重组表达质粒pcDNA3.1-hIFNλ2-HA构建的电泳图
将带有1a型H77C复制子的质粒经XbaⅠ线性化后,体外转录为RNA,转染已构建的能表达SEC14L2蛋白的Huh7.5稳定转染细胞系,经5 μg/mL抗稻瘟菌素筛选,3周后获得4个单克隆细胞,挑取单克隆扩大培养,收集48 h的细胞培养上清检测萤光素酶活性,结果显示2号细胞克隆的复制效率较高,选择2号单克隆细胞作为能稳定表达SEC14L2蛋白并带有1a型H77C复制子的细胞系(图3)。

图2 稳定表达SEC14L2蛋白的Huh7.5细胞系的建立

图3 挑取的4个单克隆细胞中复制子的复制效率
2.3 Western印迹检测hIFN-λ2蛋白的表达
将重组质粒pcDNA3.1-hIFNλ2转染293T细胞,48 h后收取上清,通过Western印迹检测hIFNλ2蛋白的表达,结果如图4,实验组可见明显目的条带,对照组则无,说明hIFNλ2蛋白得到了较好的表达。

图4 hIFNλ2蛋白表达的Western印迹
2.4 hIFNλ2蛋白对HCV复制子的抑制作用
由于2a型JFH1复制子和1a型H77C型复制子均带有萤光素酶报告基因,因此可通过检测萤光素酶活性来判断其复制水平。将表达hIFNλ2蛋白的293T细胞上清稀释至1/10、1/100、1/1000后,分别作用于带有2a型JFH1复制子和带有1a型H77C型复制子的Huh7.5细胞,阴性对照组只加入DMEM培养基,阳性对照组为含有1000 U α-干扰素的DMEM培养基,每隔24 h换液,分别收取0、24、48、72、96 h的上清,检测萤光素酶的活性(图5),可知hIFNλ2在48 h时已明显抑制了复制子的复制效率,即使稀释至1/1000仍有明显的抑制效果,且对2a型JFH1复制子和1a型H77C型复制子均有明显的抑制效果。
3 讨论
HCV目前仍在威胁着人类的健康,在相关疫苗研发出来之前,抗病毒药物对于HCV的治疗在现阶段仍是有效手段。干扰素是发现最早、研究最多、第一个克隆化和用于临床治疗的细胞因子,目前主要用于某些肿瘤和病毒性疾病的治疗,但对不同的肿瘤和病毒性疾病的疗效差异很大,且常出现一些不良反应。新发现的IFNλs的功能与Ⅰ型IFN有所相似,而且能选择性地作用于不同类型的靶细胞,它们可作为Ⅰ型(IFNα、IFNβ)或Ⅱ型(IFNγ)IFN的替代品或辅助品用于某些疾病的治疗,在肿瘤、器官移植、自身免疫性疾病及变态反应性疾病等防治方面具有潜在的应用价值。
干扰素一直以来都是抗病毒药物的首选,Ⅰ型干扰素是研究较多,应用也较广泛的抗病毒药物,但其副作用明显,病人用药后会出现体重、血清蛋白水平及白细胞、红细胞水平下降等症状,从而限制了Ⅰ型干扰素的应用范围。目前有关hIFNλs与病毒的作用机制正在深入研究中,已有报道显示,IFNλ2引导CD4+T淋巴细胞产生Th1细胞因子[12]。另外,IFNλ2特定的反硫代磷酸化核苷酸抑制ConA处理的小鼠肝脏的病理变化,IFNλ2是T细胞介导的肝细胞损伤的关键致病功能的调节因子,这一结果表明,IFNλ2可能成为治疗Th1介导的炎症疾病的新方法[13]。
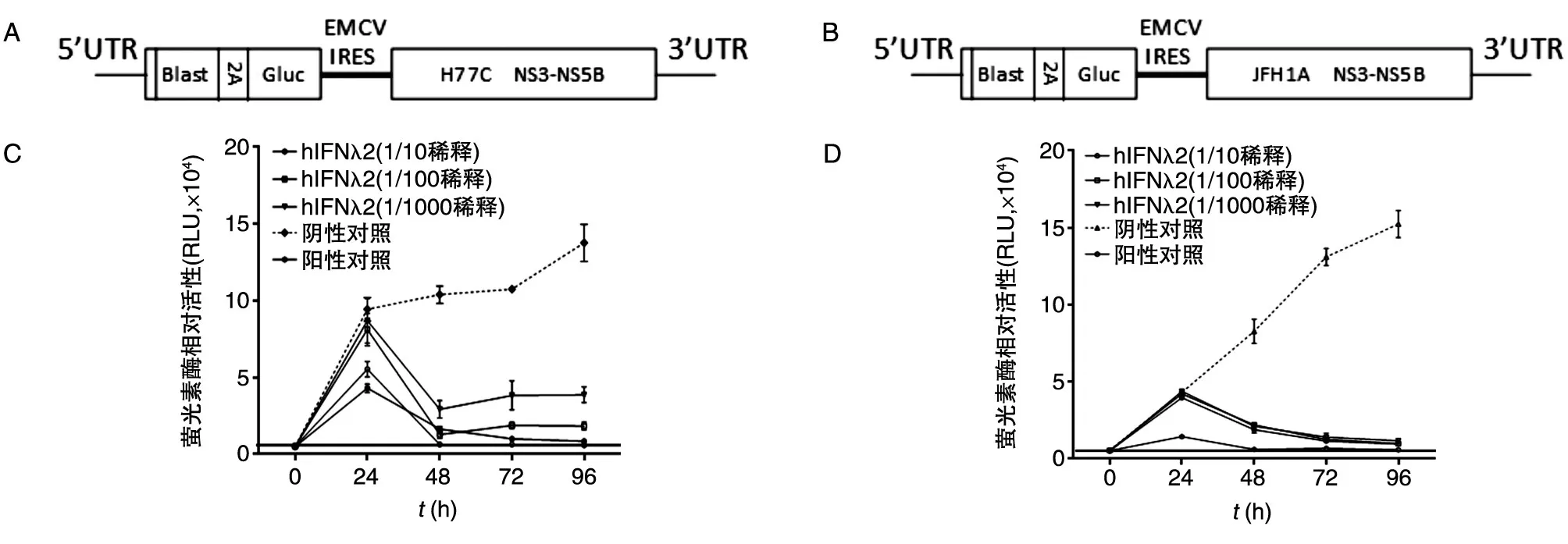
图5 不同剂量的hIFNλ2对HCV 1a型H77C复制子(B)和2a型JFH1复制子(D)的抑制作用结果
我们通过构建带有HCV复制子的细胞模型,体外研究hIFNλ2蛋白对HCV复制子的抑制作用。从实验结果可以看出,hIFNλ2蛋白对HCV的2a型JFH1复制子和1a型H77C复制子的复制均有明显的抑制作用,且具有一定的剂量相关性,作用24 h几乎没有抑制作用,作用48 h开始有明显的抑制作用,但作用96 h后复制子仍没有完全被清除,可能是由于作用时间不够长(96 h)或剂量不够高,也有可能是在hIFNλ2蛋白的作用下,HCV复制子产生了适应性的突变,留下了耐hIFNλ2蛋白的HCV复制子持续存在。目前尚未见有关hIFNλ2蛋白对HCV复制子抑制作用的研究报道。本研究将有助于进一步了解hIFNλ2蛋白的功能,为新药研发提供新思路。
[1]Lavanchy D.The global burden of hepatitis C[J].Liv⁃er Int,2009,29(Suppl 1):74-81.
[2]Ozaras R,Yemisen M,Balkan I I.Current and future therapies for hepatitis C virus infection[J].N Engl J Med,2013,369(7):679-680.
[3]Kiser J J,Flexner C.Direct-acting antiviral agents for hepatitisC virusinfection.[J].Annu RevPharmacol Toxicol,2013,53:427-449.
[4]Zeisel M B,Lupberger J,Fofana I,et al.Host-target⁃ing agents for prevention and treatment of chronic hep⁃atitis C-perspectives and challenges[J]. J Hepatol,2013,58(2):375-384.
[5]Isaacs A,Lindenmann J,Valentine R C.Pillars arti⁃cle:Virus interference.II.Some properties of interfer⁃on.Proc R Soc Lond B Biol Sci.1957.147:268-273[J].J Immunol,2015,195(5):1921-1926.
[6]Kotenko S V,Gallagher G,Baurin V V,et al.IFN-lambdas mediate antiviral protection through a distinct class II cytokine receptor complex[J].Nat Immunol,2003,4(1):69-77.
[7]Sheppard P,Kindsvogel W,Xu W,et al.IL-28,IL-29 and their class II cytokine receptor IL-28R[J].Nat Immunoly,2003,4(1):63-68.
[8]Prokunina-Olsson L,Muchmore B,Tang W,et al.A variant upstream of IFNL3(IL28B)creating a new inter⁃feron gene IFNL4 is associated with impaired clear⁃ance of hepatitis C virus[J].Nat Genet,2013,45(2):164-171.
[9]Numasaki M,Tagawa M,Iwata F,et al.IL-28 elicits antitumor responses against murine fibrosarcoma.[J].J Immunol,2007,178(8):5086-5098.
[10]徐婧雯,张雪梅,王晓辉,等.病毒基因组耦联报告基因用于筛选适宜丙型肝炎病毒培养的亚细胞克隆株[J].中华微生物学和免疫学杂志,2013,33(3):161-167.
[11]Saeed M,Andreo U,Chung H Y,et al.SEC14L2 en⁃ables pan-genotype HCV replication in cell culture[J].Nature,2015,524(7566):471-475.
[12]Siebler J,Wirtz S,Weigmann B,et al.IL-28A is a key regulator of T-cell-mediated liver injury via the T-box transcription factorT-bet[J].Gastroenterology,2007,132(132):358-371.
[13]李竞,齐义新,房桂英,等.IFN-λ真核表达载体的建立及其表达产物的生物学功能评估[J].军事医学,2015,39(11):816-820.
Detection of Interferon λ2 ActivityIn Vitroby HCV Repli⁃con Model
ZHANG Hui1,2,LI Ya-Dong1,2,BI Yan-Wei1,2,GONG Yue1,2,LI Zhi-Hua1,2,DING Chen1,2,CUN Wei1,2*
1.Institute of Medical Biology,Chinese Academy of Medical Sciences&Peking Union Medical College,Kunming 650118;2.Yunnan Key Laboratory of Vaccine Research and Development of Severe Infectious Disease,Kunming 650118;China
Objective:To study the inhibitory effect of recombinant human interferon λ2(hIFNλ2) on HCV repli⁃conin vitroby using cell culture system of HCV replicon.Methods:This study constructed recombinant plasmid pcDNA3.1-hIFNλ2-HA,and expressed the hIFNλ2 with HA tag in 293T cells,then detected the supernatant of the cell by Western blot,and then used supernatant diluted with different ratio to effect on Huh7.5 cell culture system with HCV replicon,samples were collected every 24 hours and replaced the medium,finally using the re⁃port gene to detect the inhibitory effect of the hIFNλ2 in HCV virus replicon.Results:The eukaryotic expression recombinant plasmid pcDNA3.1-hIFNλ2 was successfully contructed,and hIFNλ2 was expressed in 293T cells,and confirmed that the hIFNλ2 could inhibit the replication of HCV.Conclusion:The results proved that hIFNλ2 has a direct inhibitory effect on HCV replicon.
recombinant human interferon λ2;inhibition;HCV replicon
Q78;R392.1
A
1009-0002(2017)05-0595-05
10.3969/j.issn.1009-
*Corresponding author,E-mail:cunwei@foxmail.com
2017-03-06
云南省重点新产品开发计划(2015BC010)
张辉(1988- ),女,硕士研究生,(E-mail)1075941427@qq.com
寸韡,(E-mail)cunwei@foxmail.com
