酿酒废水产微生物絮凝剂菌株的筛选及发酵条件优化
2017-10-24彭翠珍宗绪岩沈小娟彭远松雷翔云张宿义
彭翠珍,宗绪岩,4,徐 勇,沈小娟,3,彭远松,3,雷翔云,3,张宿义,3,4*,李 建,陈 飞
(1.四川理工学院 生物工程学院,四川 自贡 643000;2.泸州老窖股份有限公司,四川 泸州 646000;3.国家固态酿造工程技术研究中心,四川 泸州 646000;4.酿酒生物技术及应用四川省重点实验室,四川 自贡 643000;5.重庆大学 生物工程学院,重庆 400030)
酿酒废水产微生物絮凝剂菌株的筛选及发酵条件优化
彭翠珍1,宗绪岩1,4,徐 勇2,沈小娟2,3,彭远松2,3,雷翔云2,3,张宿义2,3,4*,李 建1,陈 飞5
(1.四川理工学院 生物工程学院,四川 自贡 643000;2.泸州老窖股份有限公司,四川 泸州 646000;3.国家固态酿造工程技术研究中心,四川 泸州 646000;4.酿酒生物技术及应用四川省重点实验室,四川 自贡 643000;5.重庆大学 生物工程学院,重庆 400030)
该研究采用平板划线法、液体发酵筛选获得产絮凝剂菌株,命名为Y1,采用形态学观察、16S rDNA测序及系统进化树分析进行鉴定;并在单因素试验基础上,采用响应面试验设计方法优化菌株Y1的发酵条件。结果表明,菌株Y1为枯草芽孢杆菌(Bacillussubtilis),最佳发酵条件为初始pH7.4,转速147 r/min,温度35℃,接种量8%。在最佳发酵条件下,絮凝率为81.6%。
酿酒废水;菌种筛选;微生物絮凝剂;发酵条件;优化
微生物絮凝剂(microbial flocculants,MBF)是由糖类、蛋白质、纤维素和核酸组成的高分子化合物,利用微生物纯培养技术,经细菌、真菌、霉菌等微生物发酵、提纯获得[1]。传统无机化学絮凝剂及有机高分子合成絮凝剂难降解、絮凝活性不佳、易造成二次污染,对人体有害;MBF可降解性高、应用范围广、对环境无二次污染,与化学絮凝剂相比,具有一定的明显优势[2-3]。微生物发酵产絮凝剂因稳定性不强、适应性差、发酵周期较长、成本高等缺点,工业化应用较难[4-6]。
白酒废水属于高浓度有机废水,富含香味物质、淀粉、还原糖、有机酸、酯类、醇类等,有机物的降解是废水处理的关键[7-8]。目前,酿酒废水采用过滤、重力沉降、气浮、酸碱中和、微生物降解等方法进行处理,其中使用的化学絮凝剂有毒,并且易造成二次污染,微生物絮凝剂无毒、无污染,是其理想的替代产品[9-10]。该研究以筛选利用酿酒废水发酵产微生物絮凝剂的菌种、探索废水资源化利用途径为目的,采用平板划线和液体发酵从活性污泥中筛选到产絮凝剂的菌株;利用单因素和响应面法对其发酵条件进行优化,为该菌种利用废水培养基的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
活性污泥及酿酒废水采自某名优酒厂公司污水处理站,使用前调节pH 7.0。
氯化钠、葡萄糖、磷酸氢二钾、磷酸二氢钾、硫酸铵、尿素、七水硫酸镁、碘化钾、碘:成都市科龙化工试剂厂;牛肉膏、酵母膏、蛋白胨:北京奥博星生物科技有限公司;高岭土:天津市恒兴化学试剂制造有限公司。
种子液培养基:氯化钠0.5g/L、蛋白胨10g/L、酵母膏3g/L;
葡萄糖发酵培养基:葡萄糖20 g/L、酵母膏0.5 g/L、氯化钠0.5g/L、磷酸氢二钾5g/L、磷酸二氢钾2g/L、硫酸铵0.2g/L、尿素0.5 g/L、硫酸镁0.2 g/L,pH 7.5;
废水发酵培养基:废水化学需氧量(chemical oxygen demand,COD)10 000 mg/L 、氨氮78 mg/L、pH 4.79。
1.2 仪器与设备
UV-1600PC型紫外分光光度计:上海美谱达仪器有限公司;SW-CJ-2D型双人无菌工作台:苏州净化有限公司;YXQ-LS100A型立式压力蒸汽灭菌锅、BSD-YX320型智能精密摇床:上海博讯实业有限公司;DHG-9123A型电热鼓风干燥箱:上海一恒科学仪器有限公司;PS-3600A型电热恒温培养箱、DT1002A型电子天平:成都晟杰科技有限公司;ZHP-160型恒温振荡培养箱:上海鸿都科技有限公司。
1.3 实验方法
1.3.1 菌种的分离和筛选
称取10g样品溶于90mL无菌水,180r/min振荡20min。稀释10-5、10-6、10-7后,取1 mL菌液涂布于琼脂平板,37 ℃倒置培养48 h。采用平板划线法纯化菌株,重复实验直至获得纯菌落。接斜面,4℃保存。
初筛:挑斜面菌种接入装有100 mL牛肉膏蛋白胨液体培养基的250 mL三角瓶中,在37℃、150 r/min条件下培养24 h作种子液。10 mL种子液接种到90 mL发酵培养基中,30℃、150 r/min条件下发酵72 h。测定发酵液的絮凝率,选出絮凝率>60%的菌株。
复筛:10 mL种子液接种到90 mL酿酒废水中,30℃、150 r/min条件下发酵72 h,测定发酵液的絮凝率,选择絮凝率最大的菌株。
1.3.2 菌株的鉴定
(1)形态鉴定
观察菌株的琼脂平板菌落形态,并采用革兰氏染色法[11],在显微镜下观察菌体形态。
(2)分子生物学鉴定
DNA提取:按SK8255(细菌)试剂盒操作提取待测菌株的全基因组DNA并以其为模板。
16SrDNA序列扩增及测序:以细菌通用引物F27/R1492进行聚合酶链式反应(polymerase chain reaction,PCR)扩增16SrDNA。PCR反应体系:模板DNA0.5μL,10×Buffer2.5μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)1μL,Tap酶0.2μL,引物各0.5μL,加双蒸水至25μL。PCR循环条件:94℃预变性4 min,94℃退火45 s,55℃变性45 s,72℃延伸1 min,共30个循环,72℃修复10 min,4℃终止反应。PCR扩增产物经1%琼脂糖凝胶电泳检测后送上海生工测序。测序结果提交美国国家生物技术信息中心(national center of biotechnology information,NCBI)进行Blast同源序列比对分析,MEGA5.0邻接法构建系统发育树分析菌株种属关系[12]。
1.3.3 分析检测
絮凝率测定方法[13]:称取4 g高岭土溶于1 L蒸馏水中,充分搅拌即可。250 mL锥形瓶中加94 mL的高岭土悬液,4 mL 1%CaCl2溶液和2 mL发酵液,180 r/min振荡10 min,静置10 min后吸取上清液,测定OD550nm值,以蒸馏水作空白对照,重复3次。絮凝率计算公式如下:

式中:A为对照组上清液的OD550nm的值;B为实验组上清液的OD550nm值。
1.3.4 发酵条件优化单因素试验
生长曲线及最佳发酵时间:在上述最佳条件下,每隔一段时间(24h内间隔3h,60h内间隔6h,以后间隔12h)取样,按1.3.3方法测絮凝率,以液体培养基作空白测定OD600nm值,确定最佳发酵时间。
按初筛方法发酵,考察培养基不同初始pH(5、6、7、8、9)、培养温度(26℃、28℃、30℃、32℃、34℃、36℃、38℃、40℃)、转速(140 r/min、150 r/min、160 r/min、170 r/min、180 r/min)、接种量(6%、8%、10%、12%、14%)对发酵液絮凝率的影响,絮凝率测定方法按照1.3.3进行。
1.3.5 发酵条件优化响应面试验设计
以单因素试验结果基础为中心点,根据Box-Behnken中心组合实验原理[14],运用Design Expert 8.0软件以初始pH(X1)、转速(X2)、温度(X3)、接种量(X4)为评价因素,以絮凝率(Y)为响应值,设计4因素3水平的响应面试验,因素与水平见表1。

表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiments
2 结果与分析
2.1 菌株的分离筛选结果
采用平板划线法,从活性污泥中分离获得21株纯菌株,经初筛和复筛,筛选出5株利用酿酒废水产絮凝剂活性较强的菌株,分别命名为Y1、Y6、Y8、H5、H8。如图 1所示,各菌株的絮凝率>60%,Y1的絮凝活性最佳为65.8%,选择该菌株为后期实验研究对象。

图1 不同菌株的絮凝率Fig.1 Flocculation rate of different strains
2.1.1 菌株Y1形态特征
由图2A可知,菌株Y1的菌落接近圆形,直径3~6 mm,凸起,边缘浅裂,表面呈蜡质状、乳白色。由图2B可知,菌株的革兰氏染色呈阳性,菌体呈杆状。

图2 菌株Y1的菌落形态(A)与细胞形态(B)Fig.2 Colony morphology(A)and cell morphology(B)of strain Y1
2.1.2 菌株Y1的分子生物学鉴定
根据复筛结果,选菌株Y1进行16S rDNA序列鉴定,提取菌株Y1的基因组DNA为模板进行PCR扩增。扩增产物进行琼脂糖凝胶电泳检测,结果如图3所示。由图3可知,PCR扩增产物序列长度约为1 437 bp。

图3 菌株Y1 16S rDNA基因序列PCR扩增产物电泳图Fig.3 Electrophoresis of PCR amplification products of 16S rDNA gene sequence of strain Y1
将该序列提交GenBank,登录号为U73Y32KV016。将已测序列与GenBank数据库中的核酸数据进行同源性对比,采用MEGA5.0软件构建系统进化树,如图4所示。由图4可知,该序列与数据库中的Bacillus属的菌株有99%~100%高度相似序列,鉴定菌株Y1为枯草芽孢杆菌(Bacillus subtilis)。
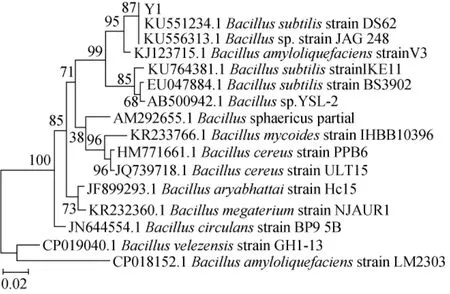
图4 菌株Y1的系统进化树Fig.4 Phylogenetic tree of strain Y1
2.2 发酵条件优化单因素试验
2.2.1 发酵时间的确定
菌株Y1的pH、菌体生长量和絮凝率随发酵时间变化情况如图5所示。由图5可知,菌株Y1的延滞期为6 h,6~24 h内为对数生长期,24 h进入稳定期。絮凝率变化不同于生长曲线,24 h内,絮凝率变化缓慢,24 h后变化速度加快,直至54 h,絮凝率最大为79.3%,此时菌体进入衰亡期,之后絮凝率有所降低。整个发酵过程中,发酵液的pH呈现下降趋势,发酵完成时发酵液呈微酸性。根据实验结果,确定菌株Y1的最佳发酵时间54 h。

图5 菌株Y1生长量、絮凝率、pH随培养时间变化曲线Fig.5 Change curves of the growth,flocculation rate and pH of strain Y1 with time
2.2.2 初始pH对发酵液絮凝率的影响
pH值是影响微生物生长和代谢的重要因素之一,pH偏高或偏低时会影响微生物的生长和代谢产物的形成[15]。由图6可知,菌株Y1在初始pH值为5~7范围内,絮凝率随pH值的增加而增加;在pH值为7时,絮凝率最大为69.9%;当pH>7,絮凝率随初始pH值的增加而下降。因此,最佳的培养基初始pH为7。
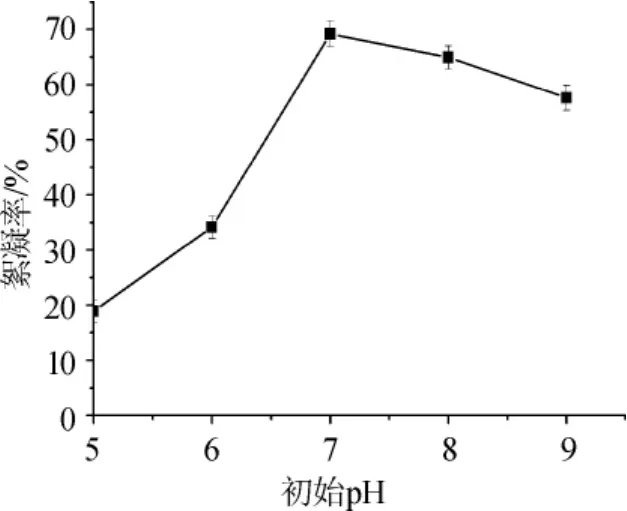
图6 培养基初始pH对絮凝率的影响Fig.6 Effect of medium initial pH on flocculation rate
2.2.3 温度对发酵液絮凝率的影响

图7 温度对絮凝率的影响Fig.7 Effect of temperature on flocculation rate
由图7可知,温度为26~36℃时,絮凝率均>60%;温度为36℃时,絮凝率最大,为78.4%;当温度>36℃时,絮凝率有下降。单因素试验发现34℃发酵产絮凝剂的絮凝率和36℃条件下几近相同,因此,最佳温度选择35℃[16]。
2.2.4 摇床转速对发酵液絮凝率的影响

图8 转速对絮凝率的影响Fig.8 Effect of rotate speed on flocculation rate
摇床转速影响发酵过程的溶氧,从而需要菌中的生长与代谢[17]。由图8可知,转速为140~180 r/min时,絮凝率先增加后降低;当转速为150 r/min时,絮凝率最大,为80.7%。因此,选择最佳转速为150 r/min。
2.2.5 接种量对发酵液絮凝率的影响

图9 接种量对絮凝率的影响Fig.9 Effect of inoculum on flocculation rate
由图9可知,接种量在4%~8%内,絮凝率呈上升趋势,按8%接种,最大絮凝率为79.6%,当接种量>10%,絮凝率有所降低。控制接种量,有益于微生物的生长,能够提高絮凝剂产量和絮凝活性[18],因此,选择最佳接种量为8%。
2.3 响应面试验结果与分析
运用Design Expert 8.0.6软件,以絮凝率(Y)为响应值,对初始pH、转速、温度及接种量这几个因素进行4因素3水平Box-Behnken试验,试验设计与结果见表4。

表4 Box-Behnken试验设计与结果Table 4 Design and results of Box-Behnken experiments

续表
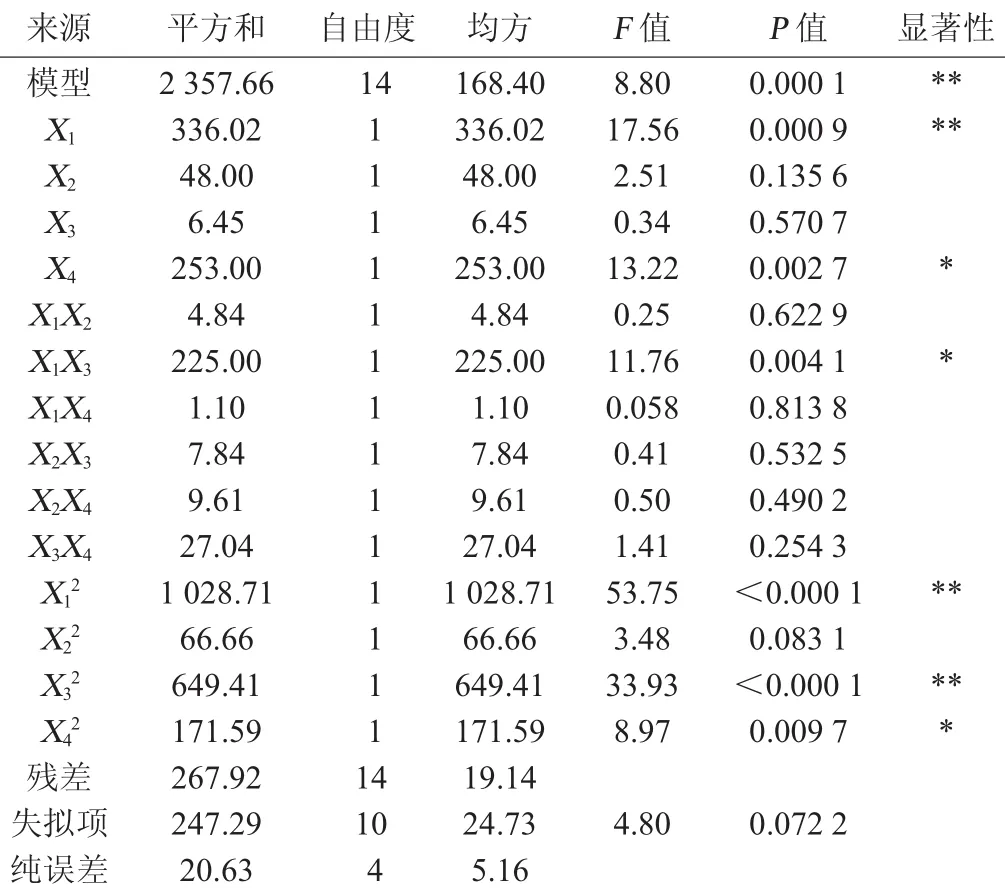
表5 回归方程方差分析Table 5 Variance analysis of regression equation
应用回归分析对方程和方程的各因子进行方差分析,结果如表5所示。由表5可知,以絮凝率为响应值,回归方程显著性检测P为0.000 1,表明该二次方程模型及显著,模型的决定系数R2=0.898 0;模型的调整确定系数R2Adj=0.795 9,表明回归方程和实际试验拟合较好,实验误差小,证明用响应面法优化絮凝率发酵条件可行。各因素对絮凝率的影响次序依次为:pH>接种量>转速>温度。回归拟合方程为:

Design Expert软件对各因素之间的交互作用进行响应面分析,结果见图10。等高线图直观反应2个变量间的交互作用的显著程度,圆形表示因素之间交互作用不显著,椭圆行表示交互作用显著[19]。由图10可知,pH与转速、pH与温度、转速与温度、转速与接种量、温度与接种量的交互作用对絮凝率的影响均显著(P<0.05);pH与接种量的交互作用不显著(P>0.05)。软件分析出优化发酵条件为:初始pH7.4,转速146.6 r/min,温度35℃,接种量7.8%,预测最大絮凝率为79.1%。为方便实际操作,修改最佳发酵条件为初始pH7.4,转速147 r/min,温度35℃,接种量8%,重复3次试验,絮凝率为81.6%,与预测值79.1%相差2.5%,说明该方程与实际情况拟合较好。

图10 初始pH、温度、转速、接种量交互作用对絮凝率影响的响应面及等高线Fig.10 Response surface plots and contour line of effects of interaction between initial pH,temperature,rotate speed and inoculum on flocculation rate
3 结论
从酿酒废水处理站的活性污泥中筛选出能利用酿酒废水发酵产絮凝剂的微生物,经形态学观察及16S rDNA鉴定为枯草芽孢杆菌(Bacillus subtilis)。单因素和响应面试验表明菌株产絮凝剂活性最强的发酵条件为初始pH值7.4,温度35℃,转速147 r/min,接种量 8%,发酵时间54 h。最佳发酵条件下,絮凝剂的絮凝率可达到81.6%。利用酿酒废水产微生物絮凝剂菌种的筛选,为利用廉价酿酒废水培养基发酵产微生物絮凝剂的研究及应用究奠定了理论基础。
[1]张 薇,马沁沁,袁向华,等.一株高效絮凝剂产生菌的分离鉴定与絮凝特性研究[J].安全与环境学报,2015,15(6):284-290.
[2]石 磊.微生物絮凝剂产生菌的分离与筛选[J].黑龙江环境通报,2014,38(3):44-47.
[3]马 放,段姝悦,孔祥震,等.微生物絮凝剂的研究现状及其发展趋势[J].中国给水排水,2012,28(2):14-17.
[4]WANG Q,YANG J F,ZHAO J H.Study of the applications flocculant on wastewater treatment[J].Guangzhou Chem Ind,2013,41(12):46-48.
[5]罗 平,杨林玉,卫宏毅.微生物絮凝剂产生菌的筛选及培养条件优化[J].工业用水与废水,2017,48(1):50-55.
[6]ALJUBOORI A H R,IDRIS A,ABDULLAH N,et al.Production and characterization of a bioflocculant produced byAspergillus flavus[J].Bioredour Technol,2013,127(1):489-493.
[7]梁艳玲,伍彦华,苏芬芬.大曲酒副产物黄水的综合利用[J].轻工科技,2016,33(10):1-2.
[8]李 丽,周 键,马 懿,等.基于高分子载体与活性炭对比处理白酒废水的研究[J].中国酿造,2011,30(2):110-112.
[9]陈 蕾,徐 涛.微生物絮凝剂的研究进展与发展趋势[J].环境研究与监测,2016,29(2):69-72.
[10]张晓菲,喻阳华.酱香型白酒酿造废水处理工艺设计[J].环保科技,2016,22(2):52-55.
[11]周德庆,徐德强.微生物学实验教程[M].北京:高等教育出版社,2013:3.
[12]虞凤慧,徐泽平,谢海涛.一株产壳聚糖酶芽孢杆菌的分离及鉴定[J].中国酿造,2015,34(1):65-67.
[13]ZHONG C,XU A,CHEN L,et al.Production of a bioflocculant from chromotropic acid waste water and its application in steroid estrogen[J].Colloid Surface B,2014,122:729-737.
[14]蒋 彪,王常高,杜 馨,等.响应面法优化芽孢杆菌CJPE209产角蛋白酶发酵培养基的研究[J].中国酿造,2017,36(5):76-80.
[14]赵 洁,苏君梅.微生物絮凝剂生产条件优化[J].工业用水与废水,2013,44(3):64-67.
[15]吴红萍,刘 勇,黄 辉,等.微生物絮凝剂产生菌的筛选及其絮凝特性初步研究[J].生物技术,2014(3):68-73.
[16]陶 然.微生物絮凝剂产生菌的筛选、鉴定及培养条件和工艺的优化研究[D].长沙:湖南大学,2006.
[17]黎 忠,张修玉.一株高效微生物絮凝剂产生菌的筛选鉴定和培养条件优化[J].环境工程学报,2010,49(11):2515-2518.
[18]陈 合,齐康儒,李轶超,等.响应面法优化两歧双歧杆菌益生元类冻干保护剂[J].中国酿造,2017,36(5):81-84.
[19]LI O,LU C,LIU A,et al.Optimization and characterization of polysaccharide-based bioflocculant produced byPaenibacillus elgiiB69 and its application in wastewater treatment[J].Bioresour Technol,2013,134(2):87-93.
Screening of bioflocculant-producing strains from liquor production wastewater and optimization of fermentation conditions
PENG Cuizhen1,ZONG Xuyan1,4,XU Yong2,SHEN Xiaojuan2,3,PENG Yuansong2,3,LEIXiangyun2,3,ZHANG Suyi2,3,4*,LIJian1,CHEN Fei5
(1.College of Bioengineering,Sichuan University of Science&Engineering,Zigong 643000,China;2.LuzhouLaojiao Co.,Ltd.,Luzhou 646000,China;3.National Engineering Research Center of Solid-state Brewing,Luzhou 646000,China;4.Liquor Making Bio-Technology&Application of Key Laboratory of Sichuan Province,Zigong 643000,China;5.Biotechnology College,Chongqing University,Chongqing 400030,China)
The bioflocculant-producing strain Y1 was screened and obtained by plate streak method and liquid fermentation,and was identified by morphological observation,16S rDNA sequence and phylogenetic tree analysis.On the basis of single factor experiments,the fermentation conditions of strain Y1 were optimized by response surface experiments.Results showed that strain Y1 was identified asBacillus subtilis.The optimum fermentation conditionswere initialpH7.4,rotate speed 147 r/min,temperature 35℃and inoculum8%.Under the optimumfermentation conditions,the flocculation rate was 81.6%.
liquor production wastewater;strain screening;bioflocculant;fermentation conditions;optimization
TS262.3
0254-5071(2017)09-0092-06
10.11882/j.issn.0254-5071.2017.09.020
2017-07-18
国家重点研发计划项目智能上甑机器人的研发与产业化(2016YFD0400501-05);固态酿造关键技术研究四川省院士(专家)工作站开放基金项目(GY2014-01);固态酿造关键技术研究四川省院士(专家)工作站开放基金项目(GY2016-04)
彭翠珍(1991-),女,硕士研究生,研究方向为酿酒生物技术及应用。
*通讯作者:张宿义(1971-),男,教授级高级工程师,博士,研究方向为酿酒生物技术及应用。
