无糖型外感风痧颗粒质量标准的研究
2017-10-23罗宇东陆施衡谭安蔷吴玉强陈洪涛
罗宇东++陆施衡+谭安蔷++吴玉强++陈洪涛

[摘要]目的 建立无糖型外感风痧颗粒质量控制的标准。方法 使用薄层色谱法(TLC),以石油醚(60~90℃)-乙酸乙酯-冰醋酸(16∶2∶1)为展开剂,10%硫酸乙醇溶液为显色剂,定性鉴别藤苦参;以甲苯-乙酸乙酯-冰醋酸(10∶3∶1)为展开剂,紫外光灯(365 nm)下观察,定性鉴别岗梅;采用高效液相色谱法(HPLC),色谱柱:岛津C18色谱柱(4.6 mm×150 mm,5 μm),流动相:乙腈-0.4%磷酸溶液(13∶87),流速0.5 ml/min,柱温25℃,检测波长327 nm,进样量10 μl,采樣时间60 min,对产品中的绿原酸进行含量测定。结果 按TLC法,供试品色谱中,在与对照药材藤苦参色谱相应的位置上,显一个或一个以上相同颜色的斑点,在与对照药材岗梅色谱中相应的位置上,显一个或一个以上相同颜色的亮斑,斑点清晰,专属性强,重现性好,阴性无干扰;绿原酸进样量在6.2968~201.5 μg范围内与峰面积线性关系良好(r=0.9991),平均回收率为100.11%,RSD=0.14%(n=6),测定10批无糖型外感风痧颗粒样品中绿原酸的平均含量为1.1069 mg/g(RSD=0.45%)。结论 所采用的质量控制方法具有方法灵敏、专属性强、重现性好、稳定性高的特点,可作为无糖型外感风痧颗粒的质量标准控制方法。
[关键词]无糖型外感风痧颗粒;质量标准;绿原酸;薄层色谱法;高效液相色谱法
[中图分类号] R286.0 [文献标识码] A [文章编号] 1674-4721(2017)09(a)-0125-05
Study on quality standard of sugarless Waiganfengsha Granules
LUO Yu-dong1,2,3 LU Shi-heng1 TAN An-qiang1 WU Yu-qiang1,3 CHEN Hong-tao1▲
1.Pharmaceutical Factory,Guangxi Traditional Chinese Medical University,Nan-ning 530023,China;2.Key Laboratory of Zhuang Medicine Prescriptions Basis and Application Research of Guangxi Colleges and Universities,Nanning 530001,China;3.Key Laboratory of Generic Technology Development of Chinese Medicine Preparation of Guangxi Colleges and Universities,Nanning 530001,China
[Abstract]Objective To set up the quality control standard of sugarless Waiganfengsha Granules.Methods Thin layer chromatography (TLC) was used,and petroleum ether (60-90℃)-ethyl acetate-glacial acetic acid (16∶2∶1) was the developing agent,and 10% sulfuric acid ethanol solution selected as the chromogenic agent to qualitatively identify Streptocaulon griffithii.Toluene-ethyl acetate-glacial acetic acid (10∶3∶1) was the developing agent,and it was observed under ultraviolet lamp (365 nm) to qualitatively identify Holly root.HPLC was used,chromatographic column:Shimadzu C18 chromatographic column (4.6 mm×150 mm,5 μm) was adopted,and mobile phase:acetonitrile-0.4% phosphoric acid solution (13∶87),current speed:0.5 ml/min,and column temperature:25℃,detection wavelength was 327 nm,sample size:10 μl,and sampling time was 60 min.The content of chlorogenic acid in the product was determined.Results According to TLC method,in test sample chromatography,in the corresponding position with Streptocaulon griffithii chromatogram of contrast medicinal material,1 or more than 1 spots in same color were displayed while in the corresponding position with Holly root chromatogram of contrast medicinal material 1 or more than 1 bright spots in same color were displayed,and the spots were clear,and the specificity was strong with good reproducibility,and it had no interference of negative.Chlorogenic acid had a good linear relationship with peak area in the range of 6.2968-201.5 μg (r=0.9991) of sample size,and the average recovery rate was 100.11%,and RSD was 0.14% (n=6).The average content of Chlorogenic acid was 1.1069 mg/g (RSD=0.45 %) among 10 batches of sample tablets.Conclusion The quality control method used has a characteristics of sensitive method,strong specificity,good reproducible and high stability,and it can be used as the quality standard control method of sugarless Waiganfengsha Granules.endprint
[Key words]Sugarless Waiganfengsha Granules;Quality standard;Chlorogenic acid;TLC;HPLC
外感风痧颗粒为国家颁布标准品种、广西传统特色优势壮药,其由苍耳草、藤苦参、岗梅、两面针等药材配方而成,具有祛风,清热的功效,用于风热感冒,咽喉肿痛等症疗效显著。药理研究表明外感风痧颗粒有明显抗菌、退热、镇痛、抗炎、增强、免疫、功能等作用。体内药理试验证实外感风痧片具有明显的抗菌、抗病毒作用及镇咳、祛痰作用。长期临床和药理试验证明外感风痧片按临床拟用的剂量、途径及疗程使用安全有效[1-4]。但外感风痧颗粒现有剂型含糖量偏高,辅料用量大,限制了一部分不宜摄入蔗糖的患者使用,另外,原品种质量控制方法有待进一步完善提高,如成品无特征成分药材的鉴别及有效成分的含测,因此,研制无糖型外感风痧颗粒产品,提高产品质量控制方法,对外感风痧颗粒进行二次开发,将具有良好的社会效益及经济效益。前期课题组对无糖型外感风痧颗粒进行了工艺研究[5-7],本文采用薄层色谱法(TLC)定性鉴别岗梅、藤苦参,并采用HPLC法测定产品中主药苍耳草所含绿原酸含量,以期为该产品的质量标准升级提供理论依据。
1 仪器与试剂
1.1仪器
岛津LC-10AT高效液相色谱仪,岛津SPD-10Avp紫外检测器,威玛龙用色谱数据工作站;XS105DM电子分析天平[梅特勒-托利多仪器(上海)有限公司];KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司),HH-S4数显恒温水浴锅(金坛市医疗仪器厂)。
1.2试剂
乙腈(色谱纯,美国Tedia 公司,批号:13025006),甲醇(色谱纯,美国Tedia 公司,批号:13025006);甲醇(分析纯,南京化学试剂有限公司,批号:09020310079),磷酸(分析纯,广东光华化学厂有限公司,批号:20071 101),水为纯水。
对照品:岗梅对照药材(批号:121152-201103)、绿原酸对照品(批号:11075-201314)均购自中国食品药品检定研究院。藤苦参、苍耳草、山芝麻、狗仔花购自南宁老百姓大药房,经广西中医药大学韦松基老教授鉴定。
1.3样品
外感风痧颗粒(无糖型)(批号:20140201、20140401、20140402、20140403、20140405、20140501、20140502、20140503、20140504、20140505)由广西中医药大学制药厂生产。
2方法与结果
2.1藤苦参薄層鉴别
取外感风痧颗粒(无糖型)45 g,研细,加无水乙醇100 ml,加热回流1 h,滤过,滤液蒸干,残渣加乙醇2 ml使溶解,作为供试品溶液;另取藤苦参对照药材6 g,加水煎煮2 h,滤过,滤液浓缩成干膏,同法制成对照药材溶液。取处方中除藤苦参以外的其他药材40 g,加水煎煮2 h,滤过,滤液浓缩成干膏,照上述供试品溶液制法制成外感风痧颗粒(无糖型)缺藤苦参阴性样品溶液。将供试品溶液、对照药材溶液、阴性样品液分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以石油醚(60~90℃)-乙酸乙酯-冰醋酸(16∶2∶1)为展开剂展开,取出,晾干,喷以10%硫酸乙醇溶液,105℃加热至斑点显色清晰。供试品色谱中,在与对照药材色谱相应的位置上,显一个或一个以上相同颜色的斑点,特征斑点Rf值为0.45,阴性无干扰(图1)。经多批重复试验,均能得到清晰明显的斑点,表明本法专属性强,重现性好,故质量标准中收入本法。
2.2岗梅薄层鉴别
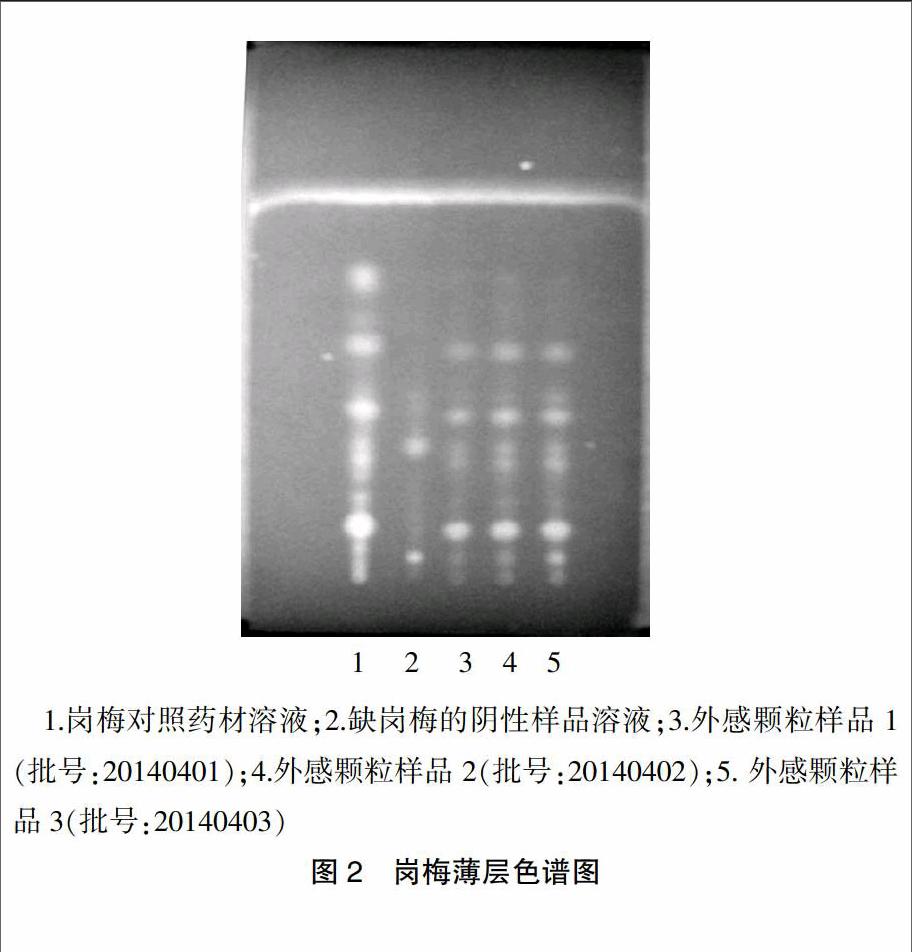
取外感风痧颗粒(无糖型)30 g,研细,加无水乙醇100 ml,加热回流30 min,滤过,滤液蒸干,残渣加水10 ml使溶解,滤过,滤液加乙醚20 ml,振摇提取,弃去水层,乙醚液加1 mol/L盐酸溶液10 ml振摇提取,弃去酸液,乙醚液用5%碳酸钠溶液振摇提取2次,每次10 ml,取乙醚液用10 ml水洗涤,乙醚液挥干,残渣加乙醇2 ml使溶解,作为供试品溶液;另取岗梅对照药材加水煎煮1 h,滤过,浓缩至10 ml,自“加乙醚20 ml”起,同上法制成对照药材溶液;另取处方中除岗梅以外的其他药材25 g,加水煎煮2 h,滤过,滤液浓缩成干膏。照上述供试品溶液制法制成外感风痧颗粒(无糖型)缺岗梅阴性样品溶液。吸取供试品溶液、对照药材溶液、缺岗梅阴性样品溶液各6 μl,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶G薄层板上,以甲苯-乙酸乙酯-冰醋酸(10∶3∶1)为展开剂,展开,取出,晾干,于紫外光灯(365 nm)下观察,供试品色谱中,在与对照药材色谱中相应的位置上,显一个或一个以上相同颜色的亮斑。斑点清晰,阴性无干扰(图2)。多批重复试验,结果相同,表明本法专属性强,重现性强,故质量标准中收入本法。
2.3绿原酸的含量测定
2.3.1对照品溶液的制备 精密称取绿原酸对照品10.41 mg,置25 ml棕色量瓶中,加50%甲醇制成储备液(0.403 mg/ml),精密量取绿原酸对照品储备液1 ml,置10 ml量瓶中,加50%甲醇定容,即得40.3 μg/ml的对照品溶液(10℃以下保存)。
2.3.2供试品及阴性对照品溶液的制备 供试品溶液的制备:按照《中国药典》附录HPLC试验,精密称定外感风痧颗粒(无糖型)5 g,置具塞锥形瓶中,精密加50%甲醇100 ml,称定重量,超声处理40 min,放冷,再称定重量,用50%甲醇补足重量,摇匀,0.45 μm滤膜滤过,精密量取续滤液5 ml,置10 ml棕色量瓶中,加50%甲醇至刻度,摇匀,作为供试品溶液。依法制备10批。
阴性样品溶液的制备:另取外感风痧颗粒(无糖型)一个处方量除苍耳草以外的其他药材,加水煎煮,第1次2 h,第2次1 h,合并煎液,滤过,滤液浓缩至稠膏状,干燥,粉碎成细粉,加糊精补足重量,制成颗粒,照上述供试品溶液制法制成外感风痧颗粒(无糖型)缺苍耳草阴性样品溶液。依法制备3批。endprint
2.3.3色谱条件 色谱柱:十八烷基硅烷键合硅胶为填充剂(4.6 mm×150 mm),流动相乙腈-0.4%磷酸溶液(13∶87),流速0.5 ml/min,柱温25℃,检测波长327 nm,进样量10 μl,采样时间60 min。在上述色谱条件下,绿原酸对照品、供试品、阴性对照的色谱图见图3。
2.3.4阴性干扰试验 照常规制备缺苍耳草的阴性对照品样品溶液,同法检测,在与绿原酸对照品色谱峰相应的位置上,供试品溶液有相同保留时间的色谱峰,而缺苍耳草的阴性对照品溶液在此位置上无色谱峰(图3)。
2.3.5线性关系考察 精密量取“2.3.1”项下对照品贮备液适量,分别加50%甲醇配制成6.2968、12.5936、25.1875、50.375、100.75、201.5 μg/ml 的溶液,作为对照品溶液。分别精密量取上述对照品溶液各10 μl 注入高效液相色谱仪,并记录色谱图。以浓度C为横坐标(X),峰面积 A 为纵坐标(Y),得绿原酸的线性回归方程:Y=42.56X+31.81,r2=0.999(n=6),结果表明,绿原酸在6.2968~201.5 μg范围内呈良好的线性关系。
2.3.6精密度 精密吸取对照品液 10 μl,重复进样6次,按“2.3.3”项下色谱条件测对照品峰面积,计算其RSD值为1.90%(n=6),结果表明仪器精密度良好。
2.3.7稳定性试验 精密吸取同一批外感风痧颗粒(无糖型)(批号:20140201)供试品溶液 10 μl,按“2.3.3”项下色谱条件试验,分别于0、2、4、8、12、24 h进样,测定其峰面积,计算RSD为2.38%(n=6),表明供试品溶液在24 h内稳定性良好。
2.3.8定量限和检出限 精密吸取绿原酸对照品贮备液,加50%甲醇稀释成一系列的浓度,过滤,精密量取10 μl 注入液相色谱仪中, 以 S/N=10为定量限,S/N=3为检出限,得出定量限和检出限分别为3.1484、1.0495 ng。
2.3.9重复性试验 取同一批外感风痧颗粒(无糖型)(批号:20140201)6份,按“2.3.2”项下方法制备供试品溶液,按“2.3.3”项下色譜条件测定其绿原酸含量,结果平均含量为1.0540 μg/mg,RSD=1.61%(n=6),结果表明本法重现性良好。
2.3.10回收率 精密称取同一批已知含量的外感风痧颗粒(无糖型)(批号:20140401,绿原酸含量为0.9920)6份各5 g,按样品中绿原酸含量的120%、100%、80%精密添入绿原酸对照品,按选定的色谱条件测定峰面积,计算回收率,结果见表1,绿原酸的平均回收率为100.11%,RSD=0.14%(n=6),表明该方法回收率较好。
2.3.11样品中绿原酸含量的测定 分别取10批外感风痧颗粒(无糖型),按色谱条件测定10批数据,每个批号重复测定3次,计算绿原酸含量,结果见表2,绿原酸平均值为1.1069 μg/mg(RSD=0.45%),最小值为0.9671 μg/mg,考虑到苍耳草来源的差异大,以最小包装为15 g/袋计算,拟将其含量定为“本品每袋含绿原酸(C16H18O9)计,不得少于12 mg”。
3讨论
本研究对无糖型外感风痧颗粒中藤苦参和岗梅进行了 TLC 定性鉴别,所确定的薄层鉴别方法专属性强,阴性对照无干扰,可以作为该制剂的鉴别方法。在藤苦参的TLC鉴别过程中,参照文献资料[8-11],曾分别试以三氯甲烷-甲醇-水(7∶2∶0.5)为展开剂展开,I2蒸汽显色;氯仿-甲醇(7∶2)为展开剂展开,在紫外下显色,得到的薄层色谱斑点均不明显,且分离效果均不理想。在岗梅的TLC鉴别试验中,参照文献方法[12-14],也曾以苯-乙酸乙酯-水(5∶2∶0.1)、苯-丙酮(9∶1)为展开剂,结果分离效果均不理想。笔者也对无糖型外感风痧颗粒中其他药材成份进行了TLC鉴别研究,试用了多种展开系统,但均未达到理想结果。
无糖型外感风痧颗粒由苍耳草、藤苦参、岗梅、两面针等药材组方而成,君药为苍耳草,绿原酸为苍耳草所含的专属性成分,因此选择功能性成分绿原酸作为含量测定的指标[15-19]。本文采用HPLC对无糖型外感风痧颗粒的绿原酸进行含量测定,绿原酸进样量在6.2968~201.5 μg范围内与峰面积线性关系良好(r=0.9991),平均回收率为100.11%,RSD=0.14%(n=6),本方法重现性好,结果准确,可作为无糖型外感风痧颗粒的质量评价方法。研究过程中,取绿原酸对照品溶液,在200~400 nm 波长范围扫描,测得绿原酸的最大吸收波长为327 nm,故将检测波长定为327 nm,另外,按既定条件测定供试品,理论板数按绿原酸峰计算≥1000,分离度>1.5,符合HPLC含量测定要求。
[参考文献]
[1]蒋林,李茂,黎明,等.外感风痧片对风热感冒的药效学研究[J].中国药师,2010,13(1):57-58.
[2]蒋林,李茂,黎明,等.外感风痧片体内抑菌、抗病毒作用的试验研究[J].世界中医药,2010,5(1):72-74.
[3]张玉军.外感风痧片对大鼠的长期毒性研究[J].中成药,2009,31(2):287-290.
[4]林启云,李爱媛,周芳,等.外感风痧颗粒(片)剂药理研究[J].广西中医学院学报,2001,4(4):88-90.
[5]覃学谦,刘源焕,陈洪涛.正交试验优选无糖外感风痧颗粒一步制粒工艺[J].广西中医药,2015,38(5):79-80.
[6]刘源焕,吴玉强,蒋林,等.正交试验优选无糖外感风痧颗粒的成型工艺[J].中国实验方剂学杂志,2011,17(3):11-13.
[7]谭珍媛,雷震鸣.正交试验法优选外感风痧颗粒制剂的提取工艺[J].广西中医学院学报,2007,10(3):76-78.
[8]张琳,王叶飞,徐丽珍.藤苦参化学成分研究[J].中国药学杂志,2007,42(6):24-26.
[9]彭霞,王志杰,林艳芳.傣药藤苦参质量标准研究[J].中国民族民间医药,2009,18(1):30-31.
[10]栾连军,王叶飞,张琳.藤苦参素的体外抗肿瘤活性及其对癌细胞凋亡的作用[J].药学学报,2007,42(1):104-107.
[11]朱华,刘安韬,廖月葵.古羊藤的显微鉴别研究[J].广西中医学院学报,2007,10(1):55-57.
[12]杜冰曌,杨鑫瑶,冯晓,等.岗梅的化学成分和药理作用研究进展[J].中国中药杂志,2017,42(1):20-27.
[13]郑夏生,袁玉贤,徐晖,等.岗梅药材的TLC鉴别和HPLC指纹图谱[J].中国实验方剂学杂志,2013,19(21):123-126.
[14]彭敏桦,张敏敏,沈雅婕,等.岗梅总皂苷含量测定方法建立及不同部位含量比较研究[J].中医药导报,2015,21(3):29-30.
[15]王美琴,徐圣秋,雷雨,等.HPLC法测定不同采收期苍耳草中绿原酸的含量[J].现代中药研究与实践,2011,25(6):83-85.
[16]王仕平,刘惠民,谢勇,等.苍耳草的质量标准研究[J].中国医院用药评价与分析,2014,14(3):220-222.
[17]仝俊太,徐圣秋,李伟东,等.高效液相色谱法测定苍耳草中绿原酸的含量[J].中国医院药学杂志,2011,31(20):1739-1740.
[18]尹靖先,邓晓鸿,车晓彦,等.苍耳子的薄层层析鉴别研究[J].华西药学杂志,2005,20(1):67-69.
[19]杨柳,吴金雄,许舜军,等.苍耳子中酚酸类化合物的鉴别及绿原酸的含量测定[J].中国实验方剂学杂志,2011, 17(19):85-88.
(收稿日期:2017-06-23 本文编辑:许俊琴)endprint
