恩诺沙星及其代谢物在西伯利亚鲟体内的药动学及消除规律
2017-10-23刘永涛李小义陈飞雄
赵 凤,周 洲*,刘永涛,李小义,孔 杰,陈飞雄
(1.贵州省水产研究所,贵州 贵阳 550025;2.中国水产科学研究院长江水产研究所,农业部淡水鱼类种质监督检验测试中心,湖北 武汉 430223)
恩诺沙星及其代谢物在西伯利亚鲟体内的药动学及消除规律
赵 凤1,周 洲1*,刘永涛2,李小义1,孔 杰1,陈飞雄1
(1.贵州省水产研究所,贵州 贵阳 550025;2.中国水产科学研究院长江水产研究所,农业部淡水鱼类种质监督检验测试中心,湖北 武汉 430223)
【目的】为探明西伯利亚鲟体内恩诺沙星及其代谢产物环丙沙星的代谢动力学与消除规律,同时为科学合理使用恩诺沙星防治鲟鱼细菌性疾病和水产品的安全提供理论依据。【方法】采用高效液相色谱法分析20 ℃条件下进行恩诺沙星10 mg/kg体重口灌给药后西伯利亚鲟血液、肌肉和肝脏组织中恩诺沙星及代谢产物环丙沙星的浓度,药物浓度时间数据采用药代动力学软件3p97进行分析。【结果】西伯利亚鲟血液、肝脏和肌肉中恩诺沙星药物代谢动力学房室模型符合二房室模型,达峰时间(Tmax)分别为0.5、0.9和1.23 h;峰浓度值(Cmax)分别为0.329、4.162和3.350 mg/L;表观分布容积(Vd)分别为26.219、6.320和2.835 L/kg,吸收半衰期﹝T(1/2)α﹞分别为4.643、45.623和11.308 h;消除半衰期[T(1/2)β]分别为32.046、354.987和252.194 h。恩诺沙星代谢物环丙沙星在西伯利亚鲟血液、肝脏和肌肉中药物代谢动力学房室模型符合二房室模型,Tmax分别为0.5、6.4和2 h;Cmax分别为0.164、0.918和1.450 mg/L;Vd分别为43.760、7.678和0.122 L/kg;T(1/2)α分别为4.643、8.503和14.464 h;T(1/2)β分别为32.046、148.4和219.904 h。【结论】恩诺沙星其代谢产物环丙沙星在西伯利亚鲟体内药物代谢动力学房室模型符合二房室模型,其吸收、消除较缓慢。
恩诺沙星;环丙沙星;西伯利亚鲟;药动学
鲟鱼(Acipenserbaeri)是一种珍贵的稀有鱼类,具有重要的经济价值和药用价值。近年来,随养殖规模的扩大,加之高密度养殖、投喂率增加、消毒剂和药物滥用以及不适当的管理方法等,使其养殖环境日益恶化,病害频繁发生且日趋严重,尤其是由气单胞菌属细菌引起的鲟鱼气单胞菌病危害最为严重,每年给养殖者造成极大的经济损失,严重阻碍了鲟鱼养殖业的健康发展。
恩诺沙星(enrofloxacin,EF)属于喹诺酮类抗菌药物,是动物专用的抗生素,目前在水产养殖过程中也广泛使用,主要用于细菌性传染病的前期预防和治疗[1],对鲟鱼气单胞菌有很好的治疗作用,但长期使用后,药物残留问题也越来越突出[2]。大量研究表明,在许多动物体内,恩诺沙星发生脱乙基反应,然后再代谢生成环丙沙星(ciproflocacin,CIP)[3],不同的种属代谢程度有明显差异[4]。所以,有必要研究代谢产物环丙沙星的代谢和消除。目前,虽有恩诺沙星在杂交鲟体内的药动学研究,但是未考虑其代谢产物环丙沙星的代谢情况。为探明西伯利亚鲟体内恩诺沙星与其代谢产物环丙沙星的代谢动力学及消除规律,同时为科学合理使用恩诺沙星防治鲟鱼细菌性疾病和水产品的安全提供理论依据,进行了西伯利亚鲟口灌给药恩诺沙星代谢试验。
1 材料与方法
1.1 试验材料
1.1.1 西伯利亚鲟 由贵州省水产研究所惠水基地提供,平均体重(40±10)g。试验前在室内水族箱(60 cm×80 cm×40 cm)内暂养1周,每个水族箱放养西伯利亚鲟10尾左右。自来水曝气48 h后使用,养殖过程中不断充氧,保持水中溶氧大于6.0 mg/L,温度为20 ℃。
1.1.2 试剂 乙腈、正己烷和质谱水,为色谱纯,购自美国CNW公司;无水硫酸钠、磷酸和三乙胺均为分析纯,购自国药集团化学有限公司;恩诺沙星标准品(纯度>99.0 %)和环丙沙星标准品(纯度>95.0 %),购自Dr.Ehrenstorfer GmbH;灌胃用恩诺沙星原粉(产品批号141031-2),购自浙江国邦药业有限公司。
1.1.3 仪器 高效液相色谱(Waters515泵,717自动进样器,2475多通道荧光检测器,配Empower色谱工作站,美国Waters公司),AE-240-METTLE-TOLEDO精密电子天平(梅特勒-托利多公司),20PR-520自动高速冷冻离心机(日本HITACH公司),Hei-VAP旋转蒸发仪(德国Heidolph公司),KD200氮吹仪(杭州奥盛仪器有限公司),HQ-60涡旋混合器(北方同正)。
1.2 采样
称取恩诺沙星原粉100 mg,用5 %冰醋酸溶解后定容至100 mL,恩诺沙星浓度为1 mg/mL,使用10 mg/kg剂量口灌给药。给药0 min、15 min、30 min、1 h、2 h、4 h、6 h、8 h、10 h、12 h、24 h、48 h、96 h、144 h、192 h和288 h后采集血液、肝脏和肌肉样品,每个时间点取5尾西伯利亚鲟作为平行样,于-20 ℃保存。
1.3 样品处理
准确称取肌肉、肝脏样品1.00 g和吸取血液1.00 mL,依次加入3 g无水硫酸钠和3 mL酸化乙腈,涡旋仪混匀,超声5~10 min,8000 r/min离心5 min,取上层清液到空离心管中。剩余残渣中继续加3 mL酸化乙腈,重复上述操作1次,合并上层清液,于55 ℃氮吹仪上吹干。用流动相1.0 mL充分溶解,涡旋并离心后,并经0.22 μm微孔过滤膜过滤后,供高效液相色谱仪测定。
1.4 标准溶液配制和标准曲线绘制
准确称取0.020 g恩诺沙星和环丙沙星,用乙腈稀释,并定容至100 mL,制成浓度为200 mg/L的标准储备液,低温避光储存,有效期为6个月。将恩诺沙星和环丙沙星标准储备液用流动相依次稀释,绘制恩诺沙星和环丙沙星浓度为5、10、20、50和100 ng/mL的低浓度标准曲线;绘制150 200、500、1000和2000 ng/mL的高浓度标准曲线。采用高效液相色谱荧光检测器分析测定。
1.5 回收率、精密度和检测限
往空白鲟鱼组织中加入配制好的定量恩诺沙星和环丙沙星标准溶液,室温放置30 min以上,每个样品同时做5个平行。按照上述方法处理样品后进样,通过峰面积分别计算组织中恩诺沙星和环丙沙星的含量。其中空白样品中添加的质量浓度分别为1、5、20和100 μg/kg。以引起3倍基线噪音的药剂质量浓度作为最低检测限。各组织中恩诺沙星和环丙沙星的回收率为85 %~90 %,日内精密度和日间精密度相对标准偏差小于5 %。各组织中恩诺沙星和环丙沙星的检测限分别为5.0和1.0 μg/kg。
1.6 色谱条件
色谱柱为反相色谱柱C18柱(250 mm×4.6 mm,5 μm),流动相为乙腈∶磷酸三乙胺=15∶85(V/V),流速为0.85 mL/min,激发波长为280 nm,发射波长为450 nm,柱温为40 ℃,进样量为10 μl。在该色谱条件下,恩诺沙星(20 ng/mL)和环丙沙星(30 ng/mL)的保留时间分别为14.00和10.11 min。
1.7 数据处理
药物浓度时间数据使用药动学软件3p97对药动学模型进行拟合并计算相关参数。试验数据采用Microsoft Excel 2016进行记录,分析药物浓度与时间的关系,并绘制药时曲线,初步确定药物在体内的代谢过程。
2 结果与分析
2.1 恩诺沙星和环丙沙星的线性方程
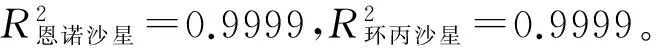
2.2 恩诺沙星在西伯利亚鲟体内的代谢吸收、分布及消除
口灌恩诺沙星10 mg/kg后,西伯利亚鲟血浆中恩诺沙星浓度有2个峰值,但总体呈下降趋势,在0.5 h达最高峰,峰浓度(Cmax)为0.329 mg/L,然后立即下降,48 h后下降速度变慢直至96 h后基本趋于平稳,Cmax保持在0.02 mg/L左右,到288 h在检测线以下(图1)。
口灌恩诺沙星后,西伯利亚鲟肌肉和肝脏中恩诺沙星浓度均迅速上升,肌肉在1 h即达最高,Cmax为3.350 mg/kg;肝脏在1.23 h达峰值,Cmax为4.162 mg/kg,之后立即下降,肌肉在6 h后下降速度变慢,肝脏在24 h后下降速度开始变慢。西伯利亚鲟肌肉中恩诺沙星的药物浓度时间曲线全部分布在肝脏的药物浓度时间曲线下面,表明口灌给药后,肌肉中恩诺沙星的浓度比肝脏低,其消除速度慢。
2.3 西伯利亚鲟体内环丙沙星的代谢吸收及消除
口灌恩诺沙星后,西伯利亚鲟血液、肝脏和肌肉中均有环丙沙星检出。从图2看出,3种组织中环丙沙星含量先低后高,然后下降,总体呈下降趋势,血液、肝脏、肌肉中环丙沙星的Cmax出现时间分别为0.5、6和2 h,Cmax分别为0.164 mg/L、0.918 mg/kg和1.450 mg/kg,远低于相应组织中恩诺沙星的浓度。
2.4 恩诺沙星在西伯利亚鲟体内的药动学特征
恩诺沙星在西伯利亚鲟肌肉、肝脏和血液中的药物代谢动力学模型符合二房室模型。从表中看出,药物在血液、肝脏和肌肉中Ka分别为0.149、19.030和4.862 L/h,T(1/2)α分别为4.643、45.623和11.308 h,说明西伯利亚鲟口灌恩诺沙星后在体内吸收比较缓慢;T(1/2)β分别为32.046、354.987和252.194 h,说明恩诺沙星进入鱼体后在各组织中消除较慢。Tmax分别为0.50、0.94和1.23 h;Cmax分别为0.329、4.162和3.350 mg/L;Vd分别为26.219、6.320和2.835 L/kg,表明恩诺沙星在西伯利亚鲟体内的消除需要较长时间。恩诺沙星在西伯利亚鲟血液、肝脏和肌肉中的 AUC 分别为21.131、542.312和111.077 mg/(L·h),表明西伯利亚鲟肝脏中恩诺沙星吸收量相对较多
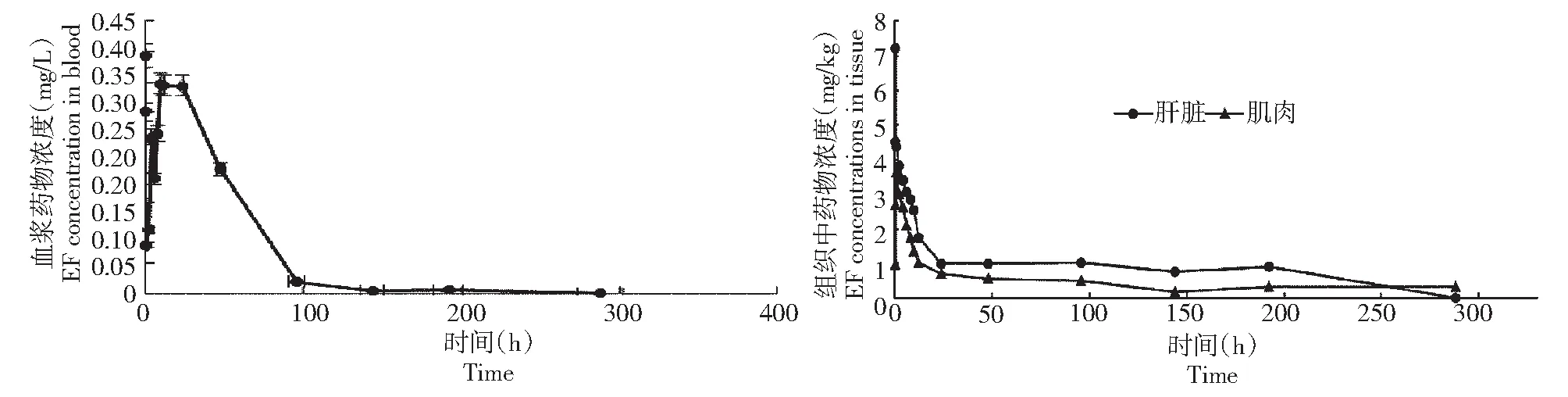
图1 口灌给药后不同时间血浆及组织中恩诺沙星的浓度Fig.1 Enrofloxacin concentration in blood and tissues of Acipenser baeri at different time after orally enrofloxacin
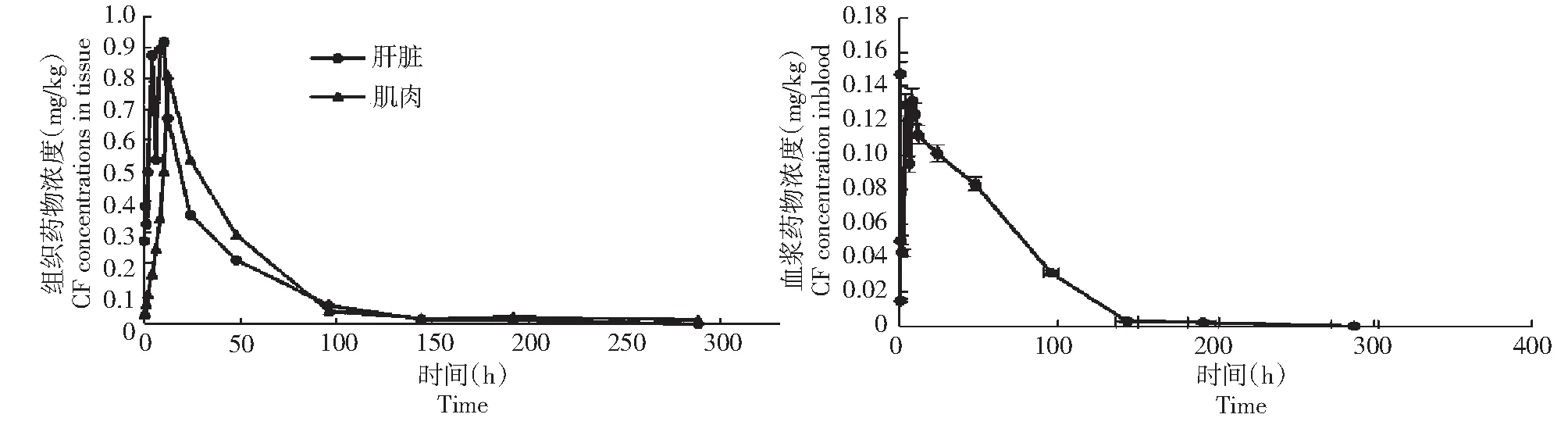
图2 口灌给药恩诺沙星后不同时间血浆及组织中环丙沙星的浓度Fig.2 Ciproflowerxacin concentration in blood and tissues of Acipenser baeri at different time after orally enrofloxacin
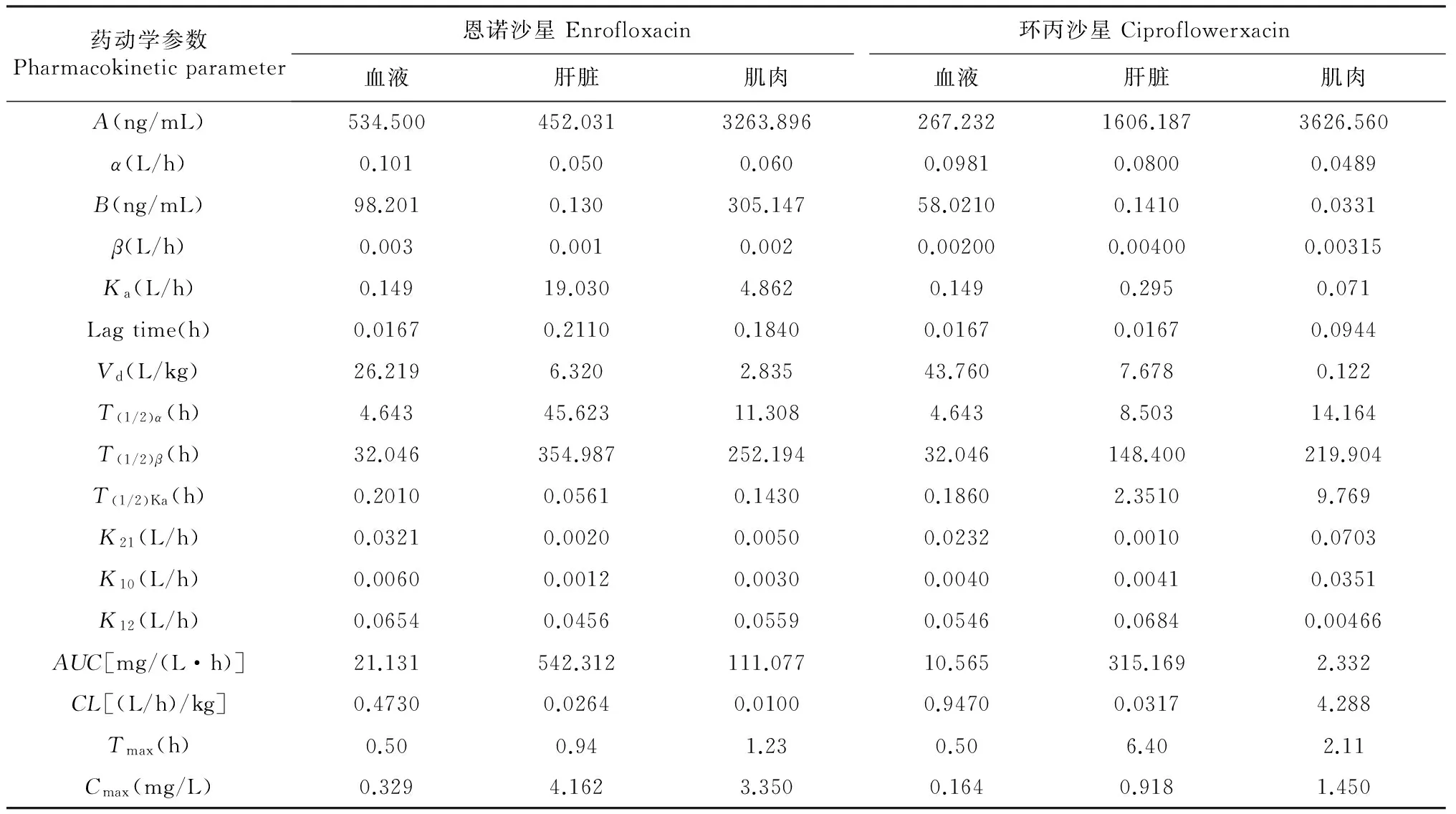
表1 恩诺沙星及代谢产物环丙沙星在西伯利亚鲟血液、肌肉和肝脏中的药物代谢动力学参数Table 1 Pharmacokinetic parameters of enrofloxacin and ciproflowerxacin in blood,muscle and liver of Acipenser baeri
注:A、B为药时曲线对数图上曲线在横轴和纵轴上的截距,CL为总体清除率,α、β分别为分布相和消除相的一级速率常数,Lag time为滞后时间,K21为周边室向中央室转运的一级速率常数,K12为中央室向周边室转运的一级速率常数,K10为中央室消除的一级速率常数,Vd为表观分布容积,Tmax为出现最高药物质量浓度的时间,AUC为药-时曲线下面积,Cmax为最高血药质量浓度,Ka为一级吸收速率常数,T(1/2)Ka为药物在中央室的吸收半衰期,T(1/2)α、T(1/2)β分别为总的吸收和消除半衰期。
2.5 代谢产物环丙沙星在西伯利亚鲟体内的药动学特征
在西伯利亚鲟血液、肝脏和肌肉中的环丙沙星药物代谢动力学模型符合二房室模型。从表中看出,环丙沙星在血液、肝脏、肌肉的Ka分别为0.149、0.295和0.071 L/h,T(1/2)α分别为4.643、8.503和14.164 h,T(1/2)β分别为32.046、148.400和219.904 h,表明环丙沙星在西伯利亚鲟肌肉中的吸收、消除比血液和肝脏中慢。血液、肌肉、肝脏中AUC分别为10.565、315.169和2.332 mg/(L·h)。
3 讨 论
不同水产动物体内恩诺沙星代谢为环丙沙星的能力有较大差异。INTONE L等[5]研究恩诺沙星在鲈鱼体内的代谢动力学表明,鲈鱼的肝脏、肌肉和血浆中都可以检测到代谢产物环丙沙星。李佳蔚等[6]在黑裙血液和肌肉中检测到少量环丙沙星,而且其消除时间比恩诺沙星的消除时间短。与之相反,ROCCA G等[7]在菱羊鲷各组织中没有检测到环丙沙星。西伯利亚鲟口灌给药恩诺沙星后,血液、肝脏和肌肉中的药物代谢动力学模型均符合二房室一级吸收模型,与恩诺沙星在中国对虾[8]和大西洋鲑[9]中的代谢房室模型类似。但是,恩诺沙星在西伯利亚鲟肝脏和肌肉中的吸收、消除较慢,尤其是T(1/2)β分别达354.987和252.194 h,比在吉富罗非鱼(15.61 h)[10]、黑裙(3.267 h)[6]中长,消除代谢较慢,与杂交鲟体内恩诺沙星药物代谢试验结果类似[11],可能与西伯利亚鲟生存的低温环境有关[12-13]。BREGANTE M A等[14]研究药物在虹鳟体内分布消除与给药方式的关系表明,在12 ℃水温条件下,以 5 mg/kg剂量静注和口灌虹鳟给药后,T(1/2)β分别为31.416和 23.675 h;如果K21 恩诺沙星的代谢途径较多,主要途径是在肝脏中脱去乙基,然后代谢成为环丙沙星,而且不同的种间差异很大。西伯利亚鲟口灌恩诺沙星后,其血液、肌肉和肝脏组织中都检测到环丙沙星,恩诺沙星和环丙沙星在血液中的Vd分别为26.219和43.760 L/kg,说明恩诺沙星及其代谢物主要分布在血液以外的组织,在肝脏中的环丙沙星含量最高。INTONE L等[5]在鲈鱼口服恩诺沙星药后,血浆和肝脏中都检测到恩诺沙星的代谢产物环丙沙星,而皮肤中没有检测到环丙沙星,但本试验在西伯利亚鲟肌肉中检测到少量的环丙沙星,这可能与种属差异有关。西伯利亚鲟口灌给药后,肝脏中环丙沙星每个时间点的残留量都高于肌肉和血液,与方星星等[8]对中国对虾的研究结果相似。说明恩诺沙星的主要代谢部位可能是肝脏,因为肝脏中有大量的酶,这些酶又与药物代谢有关,也有可能是肝脏对恩诺沙星药物有积聚作用,使环丙沙星在肝脏中Cmax值比血液中高。恩诺沙星在西伯利亚鲟血液、肌肉和肝脏中的消除比环丙沙星慢,与王洪艳等[16]对牙鲆的研究结果一致。 试验结果表明,西伯利亚鲟在20 ℃条件下进行恩诺沙星10 mg/kg体重口灌给药后,血液、肝脏和肌肉中恩诺沙星药物代谢动力学房室模型符合二房室模型,Tmax分别为0.50、0.94和1.23 h;Cmax分别为0.329、4.162和3.350 mg/L;Vd分别为26.219、6.320和2.835 L/kg,T(1/2)α分别为4.643、45.623和11.308 h;T(1/2)β分别为32.046、354.987和252.194 h。恩诺沙星代谢物环丙沙星在西伯利亚鲟血液、肝脏和肌肉中的药物代谢动力学符合二室模型,其中,T(1/2)α分别为4.643、8.503和14.464 h;T(1/2)β分别为32.046、148.4和219.904 h;Tmax分别为0.50、6.40和2.11 h;Cmax分别为0.164、0.918和1.450 mg/L;Vd分别为43.760、7.678和0.122 L/kg。 [1]刘开永,汪开毓.恩诺沙星在水产中的应用与研究[J].中国兽药杂志,2004,38(10):32-34. [2]宋红波,吴光红,沈美芳,等.恩诺沙星在水产品中残留的风险评估[J].渔业现代化,2008,35(5):39-42. [3]TYCZKOWSKA K,HEDEEN K M,AUCOIN D P,et al.High-performance liquid chromatographic method for the simultaneous determination of enrofloxacin and its primary metabolite ciprofloxacin in canine serum and prostatic tissue[J].Journal of Chromatograhpy,1989,493:337-346. [4]曾振灵,冯淇辉.恩诺沙星在猪体内的生物利用度及药物动力学研究[J].中国兽医学报,1996,16(6):605-612. [5]INTONE L,CECHINI S,BERTINI S,et al.Pharmacokinetics of enrofloxacin in the seabass[J].Aquaculture,2000,182:49-59. [6]李佳蔚,刘慧慧,于召强,等.恩诺沙星在黑裙体内的药物代谢动力学[J].中国渔业质量与标准,2012,2(1):52-57. [7]ROCCA G,DELLA A D,SALVO J,et al.The disposition of enrofloxacin in sea bream of after single intravenous injection of from medicated feed administration[J].Aquaculture,2004,32(7):53-62. [8]方星星,王 群,李 健.恩诺沙星及其代谢产物环丙沙星在中国对虾体内的代谢动力学[J].水产学报,2004,28(增刊):35-41. [9]STOFREGEN D A,WOOSTER G A,BUSTOS P S,et al.Multipl route and dose pharmacokinetics of enrofloxacin in juvenile Atlantic salmon[J].J Vet Pharmacol Ther,1997,20(2):111-123. [10]徐维海,林黎明,朱校斌,等.恩诺沙星及其代谢产物在吉富罗非鱼、中国对虾体内的残留规律研究[J].水产科学,2004,23(7):5-8. [11]郭娇娇,潘红艳,杨 虎,等.恩诺沙星在杂交鲟体内的药物代谢动力学[J].大连海洋大学学报,2011,26(4):362-366. [12]吴红光,张静波,孟 勇,等.不同水温下恩诺沙星在中华绒螯蟹体内药物代谢动力学[J].南京农业大学学报,2008,31(2):105-110. [13]BJORKLUND H V,BYLUND G.Temperature-related absorption and excretion of terramycin in rainbow trout[J].Aquaculture,1990,84(4):363-372. [14]BREGANTE M A,ABADIA A R,ARAMAYONA J,et al.Pharmacokinetics of enrofloxacin in rainbow trout after a single intravascular injection[J].J Vet Pharmacol Ther,1993,332(7):709-712. [15]钱云云,唐 俊,郑宗林,等.恩诺沙星在罗氏沼虾体内的药物代谢动力学[J].动物学杂志,2007,42(5):62-69. [16]王洪艳,李兆新,邢丽红,等.恩诺沙星及其代谢产物环丙沙星在牙鲆体内代谢消除规律[J].渔业科学进展,2014,35(3):44-49. PharmacokineticsandEliminationofEnrofloxacinandCiproflowerxacin(EnrofloxacinMetabolite)inAcipenserbaeri ZHAO Feng1,ZHOU Zhou1,LIU Yong-tao2,LI Xiao-yi1,KONG Jie1,CHEN Fei-xiong1 (1.Guizhou Fishery Institute,Guizhou Guiyang 550025,China; 2.Supervision and Inspection Center of Freshwater Fishes Germplasm,Ministry of Agriculture,Yangtze River Fisheries Research Institute,Chinese Academy of Fishery Sciences,Hubei Wuhan 430223,China) 【Metbod】The prent paper aims to discuss pharmacokinetics and elimination of Enrofloxacin and Ciproflowerxacin inAcipenserbaeriand provide the theoretical basis for scientific and rational utilization of Enrofloxacin against bacterial diseases of sturgeon and safety of aquatic products.【Objectiwe】The concentration of Enrofloxacin and Ciproflowerxacin in blood,muscle and liver ofAcipenserbaeriafter orally enrofloxacin with dose of 10 mg/kg was determined by HPLC at 20 ℃ and the time data of drug concentration was analyzed by pharmacokinetics software 3p97.【Result】 The Enrofloxacin pharmacokinetics compartment model in blood,liver and muscle ofAcipenserbaeriaccords with the two-compartment model and theTmax,Cmax,Vd,T(1/2)andT(1/2)βin blood,liver and muscle ofAcipenserbaeriare 0.5 h,0.329 mg/L,26.219 L/kg,4.643 and 32.046,0.9 h,4.162 mg/L,6.320 L/kg,45.623 h and 354.987 h,and 1.23 h,3.350 mg/L,2.835 L/kg,11.308 h and 252.194 h,respectively.The ciproflowerxacin pharmacokinetics compartment model in blood,liver and muscle ofAcipenserbaeriaccords with the two-compartment model also and theTmax,Cmax,Vd,T(1/2)andT(1/2)βin blood,liver and muscle ofAcipenserbaeriare 0.5 h,0.164 mg/L,43.760 L/kg,4.643 h and 32.046 h,6.4 h,0.918 mg/L,7.678 L/kg,8.503 h and 148.4 h,and 2 h,1.450 mg/L,0.122 L/kg,14.464 h and 219.904 h separately.【Conclusion】 The enrofloxacin and ciproflowerxacin pharmacokinetics compartment model in tissues ofAcipenserbaeriaccords with the two-compartment model and the absorption and elimination process in tissues ofAcipenserbaeriis slow. Enrofloxacin; Ciproflowerxacin;Acipenserbaeri; Pharmacokinetics 1001-4829(2017)4-0957-05 10.16213/j.cnki.scjas.2017.4.039 2016-07-26 贵州省科学技术基金项目“西伯利亚鲟气单胞菌性疾病模型的构建及药代动力学研究”[黔科合J字(2013)2190];贵州省农业攻关项目“鲟鱼精子超低温冷冻保存技术研究及应用”[黔科合NY(2015)3003-2];贵州省特色水产产业技术体系“疾病防控功能实验室”(GZCYTX2013-01102);贵州省农业科学院专项“贵州山区鲟鱼致病菌株的分离鉴定及药敏特性研究”[黔农科院院专项(2013)005] 赵 凤(1987-),女,研究实习员,从事水产品质量安全与渔业标准化研究,E-mail: f0328eng@126.com,*为通讯作者:周 洲(1985-),女,助理研究员,从事冷水鱼养殖及安全规范研究,E-mail: zz1126277@163.com。 S948 A (责任编辑 冯 卫)4 结 论
