基于高通量测序分析大花杓兰根际土壤细菌多样性
2017-10-23侯晓强付亚娟
张 剑,侯晓强,付亚娟*
(1.廊坊职业技术学院,河北 廊坊 065000;2.廊坊师范学院 生命科学学院,河北 廊坊 065000;3.河北省高校食药用菌应用技术研发中心,河北 廊坊 065000;4.廊坊市食用菌技术重点实验室,河北 廊坊 065000)
基于高通量测序分析大花杓兰根际土壤细菌多样性
张 剑1,侯晓强2,3,4,付亚娟2,3,4*
(1.廊坊职业技术学院,河北 廊坊 065000;2.廊坊师范学院 生命科学学院,河北 廊坊 065000;3.河北省高校食药用菌应用技术研发中心,河北 廊坊 065000;4.廊坊市食用菌技术重点实验室,河北 廊坊 065000)
【目的】从分子水平上对珍稀濒危药用植物大花杓兰根际土壤细菌群落多样性进行初步探讨。【方法】通过Illumina Miseq高通量测序技术对大花杓兰根际土壤细菌16S rRNA基因的V3~V4高变区片段进行测序,而后进行生物信息学分析。【结果】共得到166,847条16S rRNA基因序列。基于≥97 %的相似度水平,通过聚类共获得1549个可操作分类单元 (operational taxonomic units,OTUs)。大花杓兰根际土壤细菌在门、纲、目、科和属分类水平上的优势类群分别为变形菌门Proteobacteria (39.67 %)、α-变形菌纲α-Proteobacteria (24.72 %)、根瘤菌目Rhizobiales (11.11 %)、鞘脂单胞菌科Sphingomonadaceae (7.13 %)和鞘氨醇单胞菌属Sphingomonas(6.27 %)。【结论】首次揭示了大花杓兰根际土壤细菌群落的多样性,为进一步探究大花杓兰与其根际细菌的相互关系以及大花杓兰的迁地保育奠定了基础。
大花杓兰;根际细菌;细菌多样性;高通量测序
【研究意义】大花杓兰(CypripediummacranthumSw.)为兰科杓兰属多年生草本植物,主要分布于我国东北、内蒙古、北京、河北、山西和台湾等地,俄罗斯、日本和朝鲜半岛也有分布[1]。大花杓兰不仅是名贵的观赏花卉,还是我国濒危的药用植物,具有治疗全身浮肿、小便不利、风湿性腰腿痛、跌打损伤等作用[2]。旅游开发、栖息地的破坏及人为采挖,致使大花杓兰野生种群数量急剧减少,迫切需要开展其人工组培繁殖和保育等方面的研究。目前大花杓兰组培苗生长缓慢,出瓶后很难正常生长繁殖,制约其规模化人工繁殖。由于土壤微生物对植物根系的发育、植物的生长具有促进作用,其根际微生物的多样性、根际微生物的生态功能成为目前国内外的研究热点。【前人研究进展】兰科植物与菌根真菌关系十分密切,无论是兰科植物种子萌发、幼苗生长,还是植株形成都离不开菌根真菌。国内外学者对大花杓兰内生真菌群落多样性、以及利用菌根真菌来促种子萌发和幼苗促生长等方面进行了研究,大花杓兰种子的共生萌发、非共生萌发和快速繁殖技术已取得了一定进展[3-9],但由于原球茎诱导率低、褐化死亡率高、幼苗生长缓慢,目前仍处于少量微繁殖(Micropropagation)阶段。【本研究切入点】已有研究表明,多种兰科植物不同组织中存在细菌,并对兰科植物的生长发育有着重要的生物学功能,如促进兰科植物种子萌发[10]、加快植株生长[11]和增强抗逆性[12]。大花杓兰作为兰科濒危药用植物之一,其内生或根际土壤细菌的相关研究国内外尚未见报道。【拟解决的关键问题】以北京百花山地区的大花杓兰根际土壤为研究对象,采用Illumina Miseq高通量测序技术对其细菌16S rRNA基因的V3~V4区片段进行测序并进行生物信息学分析,从分子水平上揭示了大花杓兰根际土壤细菌群落的多样性,以期为将来深入研究大花杓兰根际土壤细菌的潜在的生态功能、大花杓兰人工组培繁殖和迁地保育研究提供一定的理论参考。
1 材料与方法
1.1 样品采集
2015年6月,在北京百花山国家自然保护区高山草甸采集大花杓兰根际土壤。采取五点采样法,将5个样点的根际土壤样品混匀,装入无菌自封袋中,当天带回实验室,置于-80 ℃冰箱中保存备用。
1.2 土壤基因组DNA的提取
采用土壤DNA提取试剂盒(FastDNA SPIN Kit for Soil,USA)分离土壤总DNA,其操作按照试剂盒说明书进行。0.7 %琼脂糖凝胶电泳对土壤DNA的完整性进行检测。
1.3 PCR扩增细菌16S rRNA基因V3~V4可变区
以提取的土壤基因组DNA为模板,338F 5′-ACTCCTACGGGAGGCAGCA-3′和806R 5′-GGACTACHVGGGTWTCTAAT-3′为引物,PCR扩增16S rRNA基因序列的V3~V4高变区。PCR反应体系:5×Q5 Reaction Buffer 10 μl,基因组DNA 40~60 ng,10 mM dNTP 1 μl,338F和806R引物(10 μM)各1.5 μl,Q5 High-Fidelity DNA Polymerase 0.5 μl,High GC Enhancer 10 μl,ddH2O补至总体系50 μl。PCR扩增程序:95 ℃ 5 min;95 ℃ 1 min,55 ℃ 1 min,72℃ 30 s,15 循环;72 ℃最后延伸7 min。PCR产物经1.8 %琼脂糖凝胶电泳检测后,委托北京百迈克生物科技有限公司对16S rRNA基因序列V3~V4区进行高通量测序(Illumina公司MiSeq测序仪)。
1.4 数据处理与生物信息学分析
采用FLASH[13]软件对原始测序数据进行拼接,Trimmomatic[14]软件对拼接序列进行质量过滤,而后用Mothur中UCHIME[15]程序去除嵌合体序列,获得高质量的Tags序列。在相似性≥97 %的水平上,对优质序列进行操作分类单元(operation taxonomic unit,OTU)聚类,并过滤OUT(0.005 %作为阈值);基于Silva119数据库,使用RDP Classifier[16]程序对OUT代表的序列进行物种分类。基于97 %的阈值确定稀释度,使用Mothur计算细菌群落物种的丰富度和多样性指数,包括Chao1指数、ACE指数、Shannon指数和Simpson指数。
2 结果与分析
2.1 大花杓兰根际土壤DNA的提取
应用土壤基因组提取试剂盒对大花杓兰根际土壤DNA进行抽提,0.7 %琼脂糖凝胶电泳检测结果如图1所示。从图1可以看出,所提取基因组的DNA条带清晰明亮,表明DNA基本没有降解,具有较好的完整性。采用NanoDrop 2000超微量分光光度计对土壤DNA的纯度进行检测,其A260/280比值为1.80,表明所提取的土壤DNA纯度较高,无RNA和蛋白质的污染,可满足后续实验的要求。
2.2 细菌16S rRNA (V3~V4)的PCR扩增结果
以大花杓兰根际土壤总DNA为模板,338F和806R为引物,PCR扩增16S rRNA基因序列的V3~V4可变区(图2)。与图2中泳道1阴性对照(以无菌Milli-Q水代替土壤DNA作为PCR反应的模板)相比,泳道2出现1条明亮的单一DNA条带,其大小约470 bp,与16S rRNA的V3~V4片段理论值基本相符,表明该DNA条带是来自土壤细菌16S rRNA基因V3~V4区域的特异性扩增。
M: DNA Marker; 泳道1:大花杓兰根际土壤基因组DNAM: DNA Marker; Lane 1: Genomic DNA of C.macranthum rhizosphric soil图1 大花杓兰根际土壤基因组DNA的琼脂糖凝胶电泳结果Fig.1 Agarose gel electrophoresis of genomic DNA isolated from C.macranthum rhizosphric soil
M: DNA Marker; 泳道1:阴性对照;泳道2:细菌16S rRNA V3~V4 PCR产物M: DNA Marker; Lane 1: Negative control; Lane 2: PCR product of bacterial 16S rRNA V3-V4 region 图2 细菌16S rRNA (V3~V4)PCR产物的琼脂糖凝胶电泳Fig.2 Agarose gel electrophoresis of PCR product of bacterial 16S rRNA V3-V4 region
2.3 测序结果分析
通过对细菌16S rRNA基因的V3~V4可变区进行高通量测序,共产生242 730条原始序列,质控后得到166 847条Clean tags。基于≥97 %的相似度水平,通过聚类分析共获得1549个有效OTUs(表1)。
通常用稀释性曲线(Rarefaction Curve)来说明样品的测序数据量是否合理,并间接反映样品中物种的丰富程度。以样品中随机抽取的测序条数为横坐标,并以基于该测序条数聚类得到的有效OTU数量为纵坐标,绘制了大花杓兰根际土壤样品高通量测序结果的稀释性曲线(图3)。由图3可知,土壤样品的稀释曲线逐渐趋于平坦,表明目前已获得的测序数据量足以覆盖了大多数细菌类群,基本能反映土壤样品细菌群落的组成和种类。
2.4 大花杓兰根际土壤细菌群落组成分析
对大花杓兰根际土壤进行高通量测序,共得到1549个OTUs,分属于14门31纲48目77科130属。从门分类水平来看,其优势细菌类群主要分在8个门,依次为变形菌门Proteobacteria(39.67 %)、放线菌门Actinobacteria(27.72 %)、酸杆菌门Acidobacteria(8.34 %)、芽单胞菌门Gemmatimonadetes(8 %)、绿弯菌门Chloroflexi(4.91 %)、拟杆菌门Bacteroidetes(4.72 %)、疣微菌门Verrucomicrobia(2.77 %)、浮霉菌门Planctomycetes(1.19 %)(图4a)。
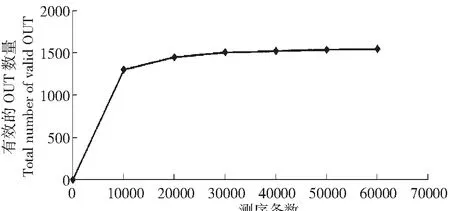
图3 大花杓兰根际土壤样品高通量测序结果的稀释性曲线Fig.3 Rarefaction curve of high throughput sequencing results of C.macranthum rhizosphric soil
从纲水平来看,相对丰度(>1 %)的11个纲所占比例总和达到88.57 %,依次为α-变形菌纲α-Proteobacteria(24.72 %)、放线菌纲Actinobacteria(15.94 %)、β-变形菌纲Betaproteobacteria(8.35 %)、芽单胞菌纲Gemmatimonadetes(8.0 %)、酸杆菌纲Acidobacteria(7.64 %)、嗜热油菌纲Thermoleophilia(5.66 %)、酸微菌纲Acidimicrobiia(5.47 %)、r-变形菌纲Gammaproteobacteria(4.84 %)、Sphingobacteriia纲(3.52 %)、Spartobacteria纲(2.60 %)和δ-变形菌纲Deltaproteobacteria(1.73 %)(图4b)。
从目水平来看,相对丰度(>1 %)的17个目所占比例总和达到75.1 %(图4c)。相对丰度最大的5个目,依次为根瘤菌目Rhizobiales(11.11 %)、鞘脂单胞菌目Sphingomonadales(8.58 %)、芽单胞菌目Gemmatimonadales(7.67 %)、伯克氏菌目Burkholderiales(6.40 %)、酸微菌目Acidimicrobiales(5.57 %)。
从科水平来看,相对丰度(>1 %)的15个科所占比例总和达到68 %(图2d)。丰度较高的优势菌科,依次为芽单胞菌科Gemmatimonadaceae(7.68 %)、鞘脂单胞菌科Sphingomonadaceae(7.13 %)、黄单胞菌科Xanthomonadaceae (3.42 %)、丛毛单胞菌科Comamonadaceae(3.25 %)、柄杆菌科Caulobacteraceae(3.18 %)、类诺卡氏菌科Nocardioidaceae(3.13 %)和慢生根瘤菌科Bradyrhizobiaceae(3.01 %)。
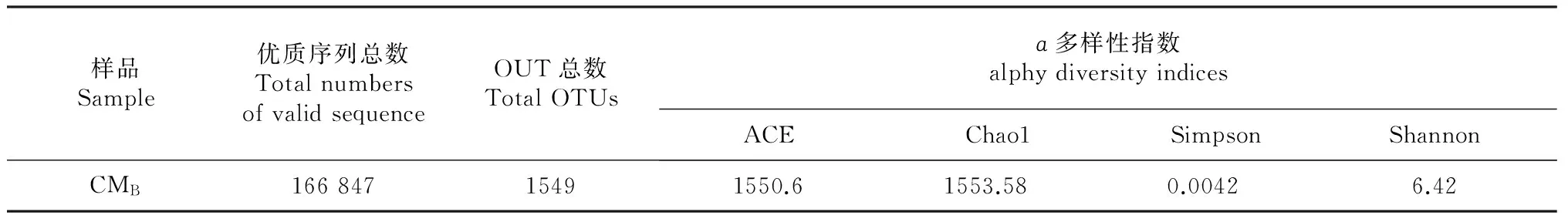
表1 大花杓兰根际土壤样品OUT丰度和ɑ多样性指数Table 1 OUT richness and alphy diversity indices of rhizosphric soil from C.macranthum
注:CMB代表采自北京百花山自然保护区的大花杓兰根际土壤。
Note: CMB represents rhizosphric soil ofC.macranthumcollected from Beijing Baihuashan National Nature Reserve.
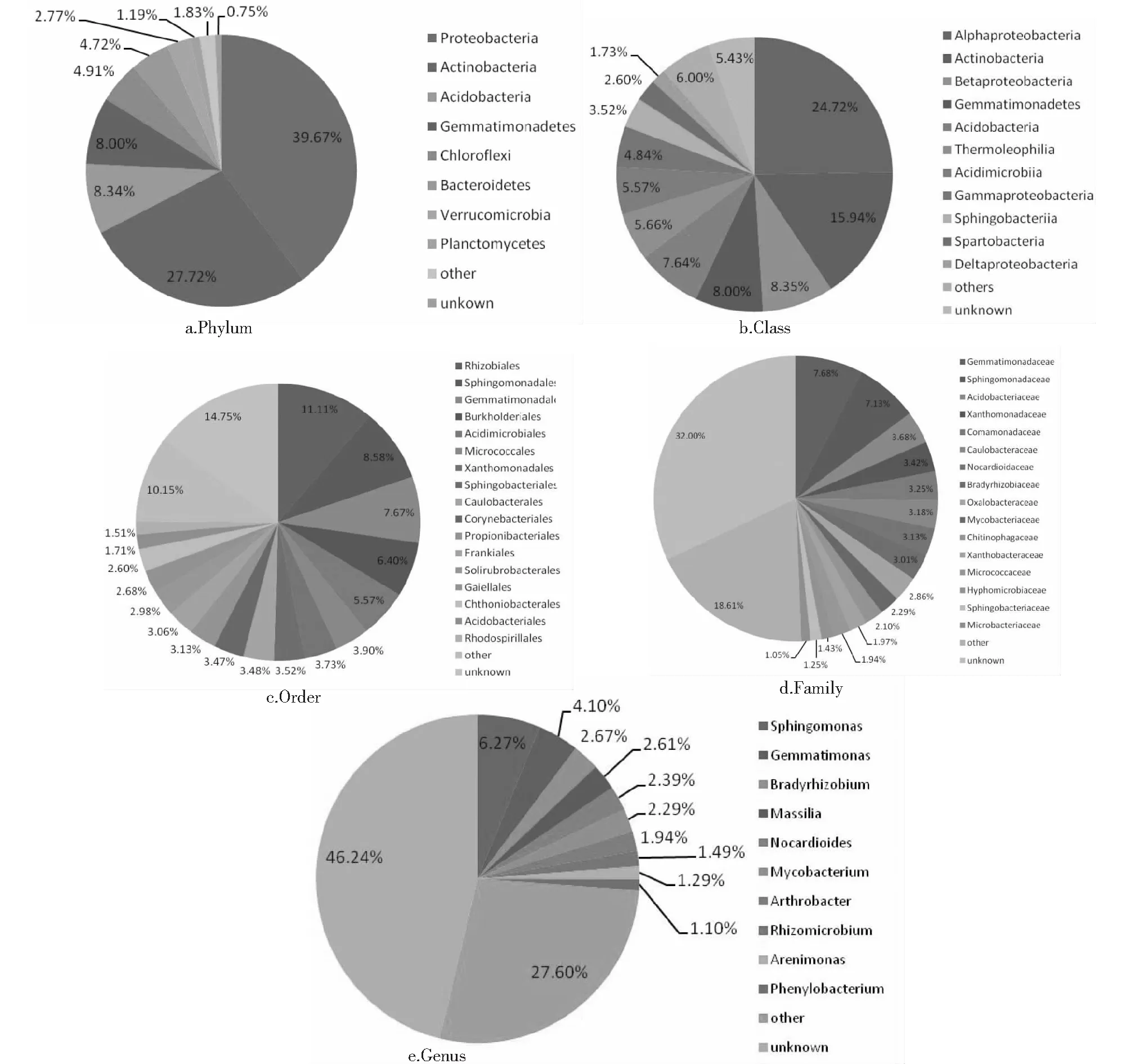
图4 采用高通量测序获得大花杓兰根际细菌群落丰度Fig.4 Relative abundance of C.macranthum rhizosphric bacteria analyzed by high throughput sequencing
从图4e可以看出,在属水平来上,相对丰度较大的6个属为鞘氨醇单胞菌属Sphingomonas(6.27 %)、芽单胞菌属Gemmatimonas(4.09 %)、慢生根瘤菌属Bradyrhizobium(2.67 %)、马赛菌属Massilia(2.61 %)、类诺卡氏属Nocardioides(2.39 %)和分枝杆菌属Mycobacterium(2.29 %)。
3 讨 论
本研究采用Illumina MiSeq高通量测序平台对大花杓兰根际土壤细菌群落多样性进行研究,初步获得其根际细菌在门、纲、目、科、属等不同分类水平上优势类群和相对丰度。研究结果发现,大花杓兰根际土壤细菌在门和纲水平上的分类信息较为明确;在目、科和属水平上尚未明确分类信息的类群所占比例较大,使得物种注释时的分辨度降低;基本不能将细菌注释到种的分类水平。可能是由于本研究选用了16S rRNA的V3~V4可变区进行高通量测序,而不是包含9个可变区总长约1540 bp的16S rRNA;高通量测序一般可以保证每个样品测定几万个序列数,提高了测序深度和覆盖度,但测序片段较短(约470 bp),在一定程度上降低了物种注释的分辨率。另外,16S rRNA基因的可变区的选择也会影响分类信息的精确性。
兰科植物根际微生物群落多样性研究较少,尤其是杓兰属濒危大花杓兰根际微生物多样性的探究目前尚未见报道。本研究以北京百花山自然保护区大花杓兰根际土壤为研究对象,采用高通量测序技术对其细菌群落组成进行初步分析。在97 %的相似度水平上,共获得1549个细菌OTUs。通过与Silva数据库进行比对,细菌可被分为变形菌门、放线菌门、酸杆菌门等14门,其中变形菌门为第一优势菌群,约占40 %。该研究结果与赵爱花等[17]的宝天曼国家级自然保护区落叶阔叶林土壤细菌、韩晶等[18]的新疆艾比湖湿地博乐河入口处土壤细菌、李新等[19]内蒙古河套灌区不同盐碱程度的土壤细菌、陈伟等[20]的纳帕海高原湿地土壤细菌和隋心等[21]的三江平原小叶章湿地土壤细菌进行对比分析发现,变形菌门通常是土壤中丰度最高的细菌类群,但在优势纲、科及属的层面上却存在着明显的差异。以上研究结果充分体现了土壤细菌存在丰富的多样性,不同类型的土壤中既存在各自独特的优势类群,也有相似的类群。
大花杓兰根际土壤细菌的优势属为鞘氨醇单胞菌属(Sphingomonas)、芽单胞菌属(Gemmatimonas)、慢生根瘤菌属(Bradyrhizobium)、马赛菌属(Massilia)、类诺卡氏菌属(Nocardioides)和分枝杆菌属(Mycobacterium)等。这与已报道的其他植物根际土壤细菌群落存在较大的差异。李鹏等[22]揭示小蓬竹根际土壤芽孢杆菌属占绝对优势;陆晓菊等[23]研究发现三七根际土壤的优势菌群为伯克氏菌属、节杆菌属、链霉菌属及芽孢杆菌属;谭渊等[24]采用PCR-DGGE技术对黄连根际土壤细菌多样性分析发现,已明确分类地位的优势菌群为嗜酸菌属,芽孢杆菌属,不动杆菌属、吕沃尔菌属和丛毛单胞菌属;翅碱蓬根系土壤盐单胞菌属占最大比例,其次是海杆菌属[25]。芽孢杆菌属、伯克氏菌属、链霉菌属、嗜酸菌属和节杆菌属等在本研究中也被检测到,但不作为优势菌群,而盐单胞菌属、海杆菌属未发现。笔者认为造成不同植物根际微生物种类及丰度差异显著的原因,除了与检测方法(传统培养方法、PCR-DGGE和高通量测序技术等)、土壤类型、营养及所处环境有关以外,植物根系分泌物可能是影响根际微生物群落组成最为重要的因素。
已有研究表明,鞘氨醇单胞菌属(Sphingomonas)和分枝杆菌属(Mycobacterium)对杓唇石斛种子具有促萌发作用,并对四季豆根段有促生长作用[10]。本研究从大花杓兰根际土壤中也检测到了相对丰度较高的鞘氨醇菌属和分枝菌属,推测其可能对大花杓兰种子萌发及幼苗生长也有促进作用。慢生根瘤菌属(Bradyrhizobium)是具有固氮作用,能在寄主植物的根部膨大生成根瘤的一类细菌。慢生根瘤菌属在大花杓兰根际土壤中具有相对较高的丰度,其可能为大花杓兰生长发育提供N素营养。鞘氨醇单胞菌属、分枝杆菌属和慢生根瘤菌属(Bradyrhizobium)是否具有上述的生物学功能,还需要将来从大花杓兰根系环境中分离到相关菌株,并通过实验深入探究其与宿主的相互关系。另外,濒危物种大花杓兰根际土壤中未被确定分类地位的细菌占有很大的比重,这说明在大花杓兰根际土壤存在着广泛的菌种资源,有待人们充分挖掘和深入研究。本研究只是首次采用高通量测序技术对其根际细菌群落多样性进行了分析,而根中内生细菌多样性还需进一步研究。鉴于兰科植物内生细菌与其生长、健康密切,下一步将要开展的工作是从大花杓兰根及根际土壤中分离筛选菌根辅助细菌和促生细菌,以期为珍稀濒危大花杓兰的保育及规模化人工组培繁殖奠定基础。
4 结 论
本研究采用Illumina Miseq高通量测序技术对濒危药用植物大花杓兰根际土壤细菌群落多样性进行初步探讨,研究结果表明大花杓兰根际土壤细菌具有较高的物种多样性,其在门、纲、目、科和属分类水平上的优势类群分别为变形菌门(Proteobacteria)、α-变形菌纲(α-Proteobacteria)、根瘤菌目(Rhizobiales)、鞘脂单胞菌科(Sphingomonadaceae)和鞘氨醇单胞菌属(Sphingomonas)。
[1]郎楷永,陈心启,罗毅波,等.中国植物志[M].第17卷.北京: 科学出版社,1997: 34-35.
[2]郭晓莉,赵建成,彭献军.河北珍稀濒危药用植物资源研究[J].干旱区资源与环境,2010,24(4): 144-149.
[3]侯晓强,付亚娟,袁建平,等.大花杓兰内生真菌多样性研究[J].湖北农业科学,2015,54(6): 1357-1360.
[4]张亚平.中国北方三种杓兰内生真菌多样性及其对原球茎生长的效应[D].四川农业大学,2013.
[5]张 毓,赵世伟.一种促进大花杓兰种子共生萌发的真菌及其应用[P].中国,CN201110402377.6,2011-11-06.
[6]Shimura H,Mai S,Matsuura M,et al.Characterization of mycorrhizal fungi isolated from the threatenedCypripediummacranthos,in a northern island of Japan: two phylogenetically distinct fungi associated with the orchid[J].Mycorrhiza,2009,19(8): 525-534.
[7]Shimura H,Koda Y.Enhanced symbiotic seed germination ofCypripediummacranthosvar.rebunensefollowing inoculation after cold treatment[J].Physiologia Plantarum,2005,123(3): 281-287.
[8]Taniguchi H,Katsumi M Y Y,Tatsumi Y,et al.In vitro proliferation and genetic diversity ofCypripediummacranthosvar.rebunense[J].Plant Biotechnology,2008,25(4): 341-346.
[9]Zhang Y,Lee Y I,Deng L,et al.Asymbiotic germination of immature seeds and the seedling development ofCypripediummacranthosSw.,an endangered lady′s slipper orchid[J].Scientia Horticulturae,2013,164: 130-136.
[10]Tsavkelova E A,Cherdyntseva T A,Klimova S Y,et al.Orchid-associated bacteria produce indole-3-acetic acid,promote seed germination,and increase their microbial yield in response to exogenous auxin[J].Archives of Microbiology,2007,188(6):655-664.
[11]童文君,张 礼,薛庆云,等.不同产地美化石斛内生细菌分离及促生潜力比较[J].植物资源与环境学报,2014,23(1): 16-23.
[12]程 萍,郑燕玲,黎永坚,等.石斛兰镰刀菌叶斑病的生物防治研究[J].中国农学通报,2008,24(9): 357-361.
[14]Bolger A M,Lohse M,Usadel B.Trimmomatic: a flexible trimmer for Illumina sequence data[J].Bioinformatics,2014,30(15): 2114-2120.
[15]Edgar R C,Haas B J,Clemente J C,et al.UCHIME: improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16): 2194-2200.
[16]Wang Q,Garrity G M,Tiedje J M,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Applied and Environmental Microbiology,2007,73(16):5261-5267.
[17]赵爱花,杜晓军,臧 婧,等.宝天曼落叶阔叶林土壤细菌多样性[J].生物多样性,2015,23(5): 649-657.
[18]韩 晶,胡文革,王艳萍,等.新疆艾比湖湿地博乐河入口处土壤细菌多样性分析[J].微生物学通报,2014,41(11): 2244-2253.
[19]李 新,焦 燕,代 钢,等.内蒙古河套灌区不同盐碱程度的土壤细菌群落多样性[J].中国环境科学,2016,36(1): 249-260.
[20]陈 伟,季秀玲,孙 策,等.纳帕海高原湿地土壤细菌群落多样性初步研究[J].中国微生态学杂志,2015,27(10): 1117-1120.
[21]隋 心,张荣涛,钟海秀,等.利用高通量测序对三江平原小叶章湿地土壤细菌多样性的研究[J].土壤,2015,47(5): 919-925.
[22]李 鹏,刘济明,文爱华,等.小蓬竹根际土壤可培养细菌多样性[J].江苏农业科学,2016,44(7): 223-227.
[23]陆晓菊,官会林,张正芸,等.三七连作根际土壤微生物区系的16S rRNA系统遗传多样性[J].微生物学报,2015,55(2): 205-213.
[24]谭 渊,陈 强,刘汉军,等.不同种植年限黄连根系土壤细菌PCR-DGGE分析[J].中国中药杂志,2015,40(16): 3147-3151.
[25]田 锐,于子超,李作扬,等.辽宁盘锦三角洲翅碱蓬根系及内生细菌群落多样性[J].微生物学通报,2016,43(7): 1462-1472.
RhizosphericBacteriaDiversityofCypripediummacranthumEstimatedviaHighThroughputSequencing
ZHANG Jian1,HOU Xiao-qiang2,3,4,FU Ya-juan2,3,4*
(1.Langfang Polytechnic Institute,Hebei Langfang 065000,China; 2.College of Life Science,Langfang Normal University,Hebei Langfang 065000,China; 3.Edible and Medicinal Fungi Research and Development Center of Hebei Universities,Hebei Langfang 065000,China; 4.Langfang Key Laboratory of Edible Fungi Technology,Hebei Langfang 065000,China)
【Objective】Rhizospheric bacteria diversity of medicinal plantsCypripediummacranthumendangered was preliminary explored at the molecular level.【Method】V3-V4 variable regions of 16S rRNA gene inC.macranthumrhizospheric soil were sequenced with the Illumina Miseq high throughput sequencing platform,and bioinformatics analysis of these sequences were then performed.【Result】A total of 166,847 partial 16S rRNA gene sequences were obtained.At the 97 % sequence similarity levels,1549 operational taxonomic units (OTUs) were identified based on UCLUST algorithm.At the classification level of phylum,class,order,family and genera,the dominant groups ofC.macranthumrhizospheric bacteria were Proteobacteria (39.67 %),α-Proteobacteria (24.72 %),Rhizobiales (11.11 %),Sphingomonadaceae (7.13 %),Sphingomonas(6.27 %),respectively.【Conclusion】The research revealed for the first time bacteria diversity inC.macranthumrhizospheric soil.The result of the study would be beneficial for further exploring the interaction betweenC.macranthumand its rhizospheric bacteria and other related scientific questions.
Cypripediummacranthum; Rhizospheric bacteria; Bacterial diversity; High throughput sequencing
1001-4829(2017)4-0811-06
10.16213/j.cnki.scjas.2017.4.017
2016-10-21
河北省教育厅青年拔尖人才项目(BJ2016045);廊坊师范学院博士基金项目(LSLB201405);廊坊师范人才引进科研启动项目(0140102001);廊坊师范学院微生物学重点学科项目(2015001)
张 剑(1981-),男,硕士,讲师,研究方向:微生物学;E-mial: zhangjian810916@163.com,*为通讯作者:付亚娟(1981-),女,博士,研究方向:分子微生物学;E-mial: fuyajuan501@163.com
Q938.1
A
(责任编辑 李 洁)
