不同种小鼠乙型肝炎模型的建立及其感染状况研究*
2017-10-19唐宗生杨东亮宋景娇
周 云,李 盛,唐宗生,杨东亮,宋景娇
不同种小鼠乙型肝炎模型的建立及其感染状况研究*
周 云,李 盛,唐宗生,杨东亮,宋景娇
目的探讨建立急性或慢性乙型肝炎病毒(HBV)感染小鼠模型的方法。方法采用高压尾静脉注射pAAV/HBV1.2表达质粒,建立急性或慢性HBV感染小鼠模型,采用ELISA法检测HBV抗原,采用RT-PCR法检测免疫相关分子基因,使用FACS检测肝内淋巴细胞活化情况,采用酶联免疫斑点实验(ELISPOT)法检测脾脏相关免疫细胞特征。结果成功建立急性和慢性高压尾静脉注射HBV感染小鼠模型;在急性BALB/c小鼠模型,血清HBsAg持续时间分别为(3.25±1.04) w,显著短于慢性 C57BL/6 小鼠组【(10.0±3.74)w,P<0.05)】;在 BALB/c小鼠模型,注射2.5 μg病毒质粒小鼠血清HBsAg持续时间为(3.67±1.03)w,显著长于注射50 μg组【(2.33±0.52)w,(P<0.05)】;在高压尾静脉注射后第10 d,BALB/c小鼠脾脏出现了HBcAg特异性T淋巴细胞。结论成功建立高压尾静脉注射HBV感染小鼠模型,发现宿主遗传背景、免疫应答状态和病毒剂量影响HBV感染小鼠模型的建立。
乙型肝炎;pAAV/HBV1.2表达质粒;高压尾静脉注射;小鼠
作者单位:430022武汉市 华中科技大学同济医学院附属协和医院感染性疾病科(周云,李盛,唐宗生,杨东亮);附属同济医院实验医学中心(宋景娇);河南大学医学院(周云)
乙型肝炎病毒(Hepatitis B virus,HBV)感染呈全球范围广泛流行,慢性感染者达3.5亿人。因此,HBV感染是全球一大公共卫生问题[1,2]。HBV感染可引起急性和慢性肝炎,并与肝硬化和肝癌的发生密切相关。成人感染HBV后通常表现为急性自限性肝炎,仅有5%会发展为慢性感染,而新生儿感染后约90%发展为慢性感染。然而,HBV慢性感染的机制尚不明确[3]。为了研究HBV感染的免疫病理发生机制,迫切需要建立合适的动物模型。小鼠为目前应用最广泛的实验动物之一,遗传背景清晰,其免疫学特征已被广泛研究。HBV转基因小鼠模型已成为广泛应用的小鼠模型。但是,小鼠属于免疫耐受模型,不适合研究HBV清除机制[4]。因此,我们建立一种简便、快捷、经济实用的高压尾静脉注射感染HBV小鼠模型,可用于急慢性HBV感染的致病机制研究。
1 材料与方法
1.1 动物与试剂 SPF级雄性BALB/c和C57BL/6小鼠,6~8周龄,体质量为18~22 g,购自北京华阜康生物科技股份有限公司,饲养于华中科技大学同济医学院实验动物中心。所有动物实验均符合本校动物实验伦理学委员会的规定。pAAV和pAAV/HBV1.2质粒由台湾大学陈培哲教授惠赠。检测HBsAg试剂盒购自上海科华生物工程股份有限公司;Endo-free Plasmid Maxi Kit购自美国OMEGA公司;ONE Step SYBR PrimerScript RT-PCR Kit购自日本TAKAR公司;动物组织总RNA提取试剂盒购自北京天根生化科技有限公司;酶联免疫斑点检测试剂盒(ELISPOT)购自深圳达科为生物技术有限公司。重组HBcAg和HBsAg购自以色列ProSpec公司。PE标记抗鼠CD69抗体及同型对照购自美国Ebioscience公司。本实验所用引物均购自德国QIAGEN公司。
1.2 HBV感染小鼠模型的建立 将10 μg重组质粒pAAV/HBV1.2溶于相当于小鼠体质量10%的生理盐水,混匀后转移至注射器备用。用75%酒精消毒小鼠尾部,再用远红外理疗仪照射2~3 min,致小鼠尾静脉充盈并清晰可见,在尾静脉末端1/3处注入HBV重组质粒,在5~8 s内完成注射。在高压尾静脉注射后定期采血,连续采血12 w。采血方法为,给予1%戊巴比妥钠150 μl腹腔注射,麻醉后用灭菌毛细管从小鼠眼眶内侧采血约300 μl,离心分离小鼠血清,冻存于-80℃。在高压尾静脉注射后第10、20、30 d处死小鼠,取肝组织,部分肝组织用10%中性福尔马林固定,用于石蜡切片,另一部分肝组织置液氮冻存后保存于-80℃冰箱。
1.3 血清HBsAg检测 采用双抗夹心ELISA法检测,将小鼠血清与1×PBS按照1:10比例稀释,充分混匀后加入96孔板,每孔加稀释血清50 μl,同时设立阳性对照、阴性对照和空白对照,再加等体积的酶结合物,轻轻混匀,37℃孵育1 h,洗板5次,加显色剂A液和B液各50 μl,37℃孵育30 min,加终止液50 μl,在酶标仪读取450 nm吸光度值。
1.4 肝组织免疫相关分子mRNA检测 取肝组织20 mg,加裂解液RL 300 μl,用研磨棒研磨组织,然后加入去离子水590 μl和蛋白酶K 10 μl,混匀后56℃水浴20 min。离心后取上清,缓慢加入0.5倍无水乙醇,转入吸附柱中,离心后弃废液,再加入去蛋白液350 μl,离心后弃液,再向柱中加入DNaseⅠ,离心后弃液,再加入漂洗液 500 μl,最后加去离子水50 μl,洗脱。以总RNA为模板,采用RT-PCR法检测细胞因子和CD分子mRNA水平,按照 One Step SYBR PrimeScript RT-PCR Kit说明配制反应体系,PCR反应条件为95℃ 5 s,60℃20 s,共40个循环。以β-actin为内参,采用Pfaffl法计算目的基因水平。
1.5 小鼠脾细胞抗原刺激反应检测 在高压尾静脉注射pAAV/HBV1.2后20 d,给予1%戊巴比妥200 μl腹腔注射,麻醉小鼠,摘眼球采血,断颈处死小鼠,无菌分离小鼠脾脏,用玻璃注射器活塞研磨脾脏,使用小鼠淋巴细胞分离液分离淋巴细胞,调整细胞密度至4×106个细胞/毫升。接种脾淋巴细胞于96孔ELISPOT包被板,加抗原刺激物HBcAg、HBsAg、CMV 和 ConA,终浓度为 0.5 μg/ml,在37℃,5%CO2培养箱无菌培养30~36 h,在培养过程中不移动培养板。待斑点显色反应,扣出孔内培养基,加入冰冷的去离子水200 μl,4℃静置10 min,细胞处于低渗而裂解,用1×Washing Buffer洗板5次,加生物素标记抗体100 μl,37℃孵育1 h,洗板5次,再加酶联亲和素100 μl,37℃孵育1 h,洗板,加AEC显色工作液100 μl,室温避光静置15~45 min,自来水冲洗板子正反面3~5次,终止显色,采用ELISPOT斑点计数仪计数细胞。
1.6 肝内淋巴细胞活化检测 在高压尾静脉注射pAAV/HBV1.2后第10 d、20 d和30 d,给予小鼠1%戊巴比妥200 μl腹腔内注射,采血后断颈,处死小鼠,放置于75%酒精中浸泡3 min,切开皮肤和腹膜,暴露肝脏,将PBS10 ml缓慢通过肝门静脉灌洗肝脏,将肝脏放置于70 μm滤网中研磨,加胶原酶Ⅱ裂解肝组织,用lympholyte-M液分离肝内淋巴细胞。加荧光抗体表面染色,每孔肝内淋巴细胞加PBS 100 μl,洗涤1次,加入抗PE-CD69抗体或同型对照(1:100),每孔 50 μl,4℃避光,抗原抗体结合反应30 min,再用PBS洗涤1次,在流式细胞仪Calibur检测,观察肝内T淋巴细胞活化情况。
1.7 统计分析 应用GraphPad Prism软件作图,应用SPSS 17.0统计软件对实验数据进行分析,计量资料以(±s)表示,采用两独立样本 t检验,对血清HBsAg阳性持续率采用Kaplan-Meier分析,P<0.05为差异具有统计学意义。
2 结果
2.1 不同小鼠血清HBsAg水平变化比较 在注射相同剂量的pAAV/HBV1.2情况下,BALB/c小鼠血清HBsAg持续时间为(3.25±1.04)w,显著低于C57BL/6 组【(10.0±3.74)w,P<0.01)】;自高压尾静脉注射后第1 d~注射后第12 w,经Kaplan-Meier分析,C57BL/6小鼠HBsAg持续阳性率显著高于BALB/c小鼠(P<0.05,图 1),说明我们成功建立了高压尾静脉注射HBV感染小鼠模型,但是小鼠遗传背景影响了HBsAg阳性持续时间。
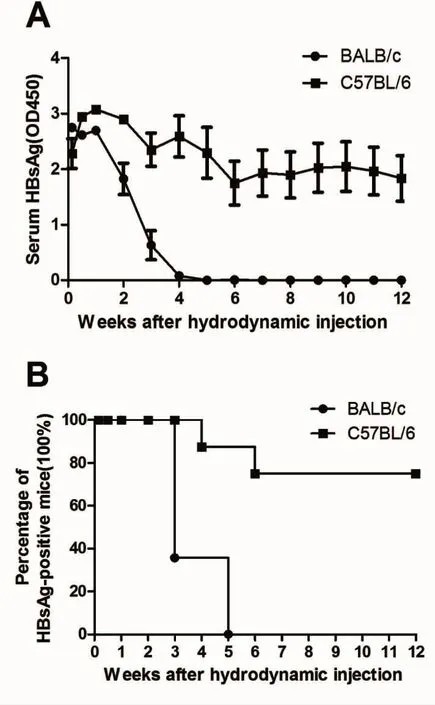
图1 不同遗传背景小鼠血清HBsAg阳性水平和持续时间比较A:C57BL/6小鼠血清HBsAg阳性水平显著高于BALB/c小鼠;B:C57BL/6小鼠血清HBsAg阳性持续时间显著长于BALB/c 小鼠(n=8~14)
2.2 注射病毒剂量影响HBV持续时间 在BALB/c小鼠模型,注射 pAAV/HBV1.2 2.5 μg,血清HBsAg阳性持续时间为(3.67±1.03)w,显著长于50 μg 剂量组【(2.33±0.52) w,P<0.05,图 2A】;经Kaplan-Meier分析,注射2.5 μg剂量组小鼠血清HBsAg阳性率显著高于50 μg剂量组(P<0.05,图2B)。我们发现,在一定注射剂量范围内,注射病毒质粒质量越多,血清HBsAg清除速度越快。
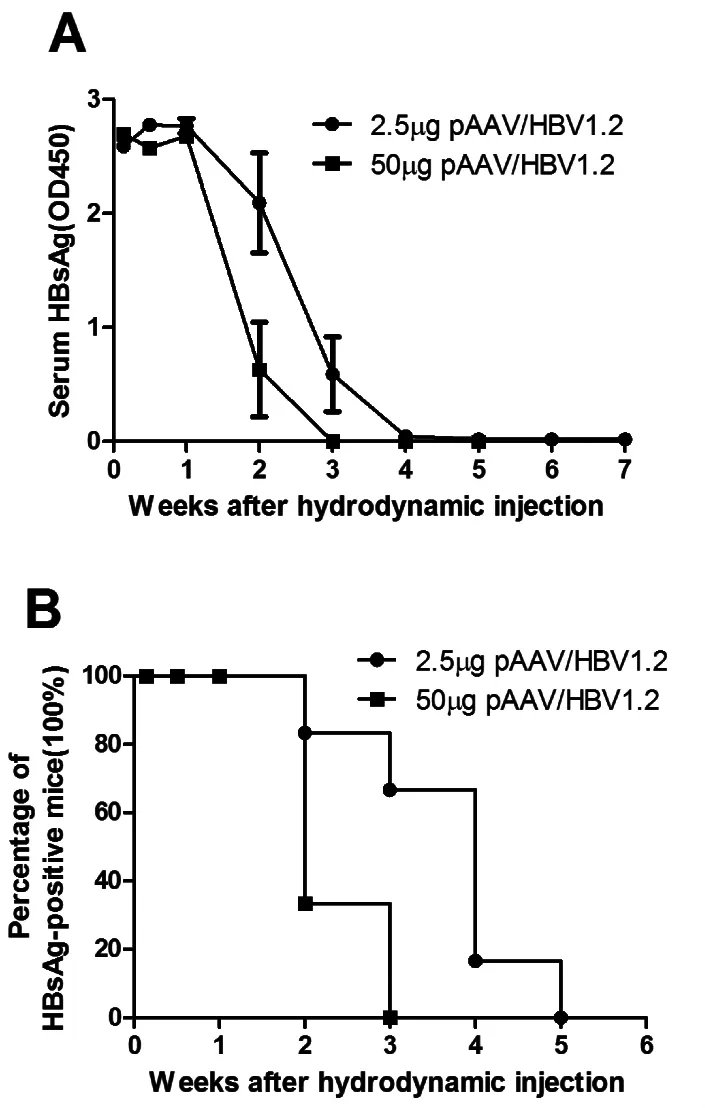
图2 注射不同剂量pAAV/HBV1.2质粒BALB/c小鼠血清HBsAg阳性水平和持续时间比较A:在BALB/c小鼠模型,经高压尾静脉注射不同剂量pAAV/HBV1.2后,发现注射小剂量组(2.5 μg)小鼠HBsAg阳性水平显著高于大剂量组(50 μg)小鼠;B:注射不同剂量pAAV/HBV1.2小鼠,血清HBsAg阳性持续时间比较,经Kaplan-Meier分析,发现大剂量组小鼠血清HBsAg持续时间反而显著短于小剂量组小鼠(n=6)
2.3 不同遗传背景小鼠肝组织免疫相关分子水平比较 在高压尾静脉注射pAAV/HBV1.2后第4 d,BALB/c小鼠和 C57BL/6小鼠肝组织 IFN-γ、IL-10、TGF-β和PDL-1 mRNA水平差异无统计学意义,但C57BL/6小鼠肝组织IL-6和FOXP3 mRNA 水平显著高于 BALB/c小鼠(P<0.05,图 3),暗示C57BL/6小鼠血清HBsAg持续阳性可能与肝内免疫负调控分子FOXP3表达升高有关。
2.4 肝内T淋巴细胞活化动态变化 给予BALB/c小鼠高压尾静脉注射pAAV空载体对照质粒或pAAV/HBV1.2各10 μg,在注射后第10 d,注射pAAV/HBV1.2组小鼠肝内CD69+/CD8+T淋巴细胞活化比例显著升高,在第20 d和30 d下降(P<0.05,图4)。

图3 不同遗传背景小鼠肝组织免疫相关分子mRNA水平比较 在高压尾静脉注射pAAV/HBV1.2后第4 d,发现C57BL/6小鼠肝组织IL-6和FOXP3 mRNA水平显著高于BALB/c小鼠

图4 肝内CD8+T淋巴细胞CD69分子动态变化 在BALB/c小鼠模型,在注射pAAV/HBV1.2后第10 d,肝内 CD8+T淋巴细胞被活化,而在第20 d和30 d,却不再见到T淋巴细胞被活化
2.5 HBsAg和HBcAg特异性T淋巴细胞数量的比较 BALB/c小鼠在高压尾静脉注射pAAV或pAAV/HBV1.2 10 μg后第20 d,以分泌IFN-γ为特征,未发现HBsAg特异性T细胞,而HBcAg特异性T细胞数量显著增加(P<0.05,图5),说明HBcAg能致敏淋巴细胞,可能在清除HBV感染过程中发挥作用。
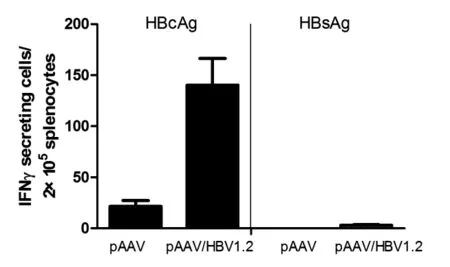
图5 HBsAg和HBcAg特异性T细胞数量变化 在BALB/c小鼠模型,经高压尾静脉注射pAAV/HBV1.2后第20 d,未见HBsAg特异性T细胞,而HBcAg特异性T细胞数量显著增加(P<0.05)
3 讨论
HBV感染宿主范围狭窄,目前仅人类和黑猩猩可感染HBV。由于伦理及经费等问题,应用黑猩猩进行科学研究受到了限制。HBV转基因小鼠属于免疫耐受模型,无法用于HBV自限性清除的研究[3,5]。本实验将pAAV/HBV1.2质粒经高压尾静脉注射BALB/c小鼠体内,产生急性HBV复制过程,模拟人类急性自限性感染过程[4,6,7]。该模型既探讨了HBV清除机制,又为HBV感染小鼠模型的建立提供技术上的支持。
HBV清除与动物遗传背景和年龄相关。我们的实验结果证明HBV在C57BL/6小鼠体内清除速度慢于BALB/c小鼠,与BALB/c小鼠对HBsAg所产生的特异性免疫应答强于C57BL/6小鼠有关[8]。宿主年龄越大,清除HBV速率越快,免疫功能健全的成人感染后常为自限性感染,而婴幼儿感染多为持续性慢病毒感染[9,10]。
注射的病毒剂量影响HBV感染的持续时间[11,12]。具有正常免疫功能的小鼠,在给予小剂量的HBV腺病毒载体后,可以导致HBV感染持续存在,而大剂量HBV注射将导致病毒被快速清除[13]。
适应性免疫通常被认为在清除HBV方面发挥重要的作用[14,15]。病毒特异性细胞毒性T淋巴细胞(CTL)直接与感染的肝细胞接触,并杀伤清除肝细胞。然而,这并不是最有效的清除方式[16]。特异性CTL分泌IFN-γ,通过抑制病毒复制及衣壳体组装而呈非溶解性清除病毒[17,18]。在急性自限性感染时,HBV DNA在病毒复制高峰后2~3周下降90%,肝脏不出现明显的病理性损伤,说明CD8+T细胞分泌的 IFN-γ 等细胞因子能非溶解性清除 HBV[14,19,20]。我们在急性HBV感染小鼠模型检测到HBcAg特异性分泌IFN-γ的T淋巴细胞,因而认为HBcAg或其形成的核衣壳在清除HBV感染过程中起一定的作用。
[1]Burns GS,Thompson AJ.Viral hepatitis B:clinical and epidemiological characteristics.Cold Spring Harb Perspect Med,2014,4(12):a024935.
[2]Liaw YF Chu CM.Hepatitis B virus infection.Lancet,2009,373(9663):582-592.
[3]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2015年版).实用肝脏病杂志,2016,19(3):Ⅴ-ⅩⅩⅢ.
[4]Huang LR,Wu HL,Chen PJ,et al.An immunocompetent mouse model for the tolerance of human chronic hepatitis B virus infection. Proc Natl Acad Sci U S A,2006,103 (47):17862-17867.
[5]Thomas E,Liang TJ.Experimental models of hepatitis B and C-new insights and progress.Nat Rev Gastroenterol Hepatol,2016,13(6):362-374.
[6]Yang PL,Althage A,Chung J,et al.Hydrodynamic injection of viral DNA:a mouse model of acute hepatitis B virus infection.Proc Natl Acad Sci U S A,2002,99(21):13825-13830.
[7]Lin YJ,Wu HL,Chen DS,et al.Hepatitis B virus nucleocapsid but not free core antigen controls viral clearance in mice.J Virol,2012,86(17):9266-9273.
[8]Milich DR,Chisari FV.Genetic regulation of the immune response to hepatitis B surface antigen (HBsAg).I.H-2 restriction of the murine humoral immune response to the a and d determinants of HBsAg.J Immunol,1982,129(1):320-325.
[9]Chou HH,Chien WH,Wu LL,etal.Age-related immune clearance of hepatitis B virus infection requires the establishment of gut microbiota.Proc Natl Acad Sci U S A,2015,112(7):2175-2180.
[10]Guidotti LG,Chisari FV.Immunobiology and pathogenesis of viral hepatitis.Annu Rev Pathol,2006,1:23-61.
[11]Tian Y,Chen WL,Kuo CF,et al.Viral-load-dependent effects of liver injury and regeneration on hepatitis B virus replication in mice.J Virol,2012,86(18):9599-9605.
[12]Asabe S,Wieland SF,Chattopadhyay PK,et al.The size of the viral inoculum contributes to the outcome of hepatitis B virus infection.J Virol,2009,83(19):9652-9662.
[13]Huang LR,Gabel YA,Graf S,et al.Transfer of HBV genomes using low doses ofadenovirus vectors leads to persistent infection in immune competent mice.Gastroenterology,2012,142(7):1447-1503.
[14]Guidotti LG,Rochford R,Chung J,et al.Viral clearance without destruction ofinfected cells during acute HBV infection.Science,1999,284(5415):825-829.
[15]Guidotti LG,Chisari FV.Noncytolytic control of viral infections by the innate and adaptive immune response.Annu Rev Immunol,2001,19:65-91.
[16]Chisari FV,Isogawa M,Wieland SF.Pathogenesis of hepatitis B virus infection.Pathol Biol,2010,58(4):258-266.
[17]Guidotti LG,Isogawa M,Chisari FV.Host-virus interactions in hepatitis B virus infection.Curr Opin Immunol,2015,36:61-66.
[18]Tan A,Koh S,Bertoletti A.Immune response in hepatitis B virus infection.Cold Spring Harb Perspect Med,2015,5(8):a021428.
[19]Wieland S,Thimme R,Purcell RH,et al.Genomic analysis of the host response to hepatitis B virus infection.Proc Natl Acad Sci USA,2004,101(17):6669-6674.
[20]Thimme R,Wieland S,Steiger C,et al.CD8(+) T cells mediate viral clearance and disease pathogenesis during acute hepatitis B virus infection.J Virol,2003,77(1):68-76.
(收稿:2016-10-26)
(本文编辑:陈从新)
Establishment of hepatitis B virus infection model in different mice by hydrodynamic injection of pAAV/HBV1.2 plasmid
Zhou Yun,Li Sheng,Tang Zongsheng,et al.Department of Infectious Disease,Union Hospital,Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430022,China
Hepatitis B;pAAV/HBV1.2 plasmid;Hydrodynamic injection;Mice
10.3969/j.issn.1672-5069.2017.05.007
国家传染病防治科技重大专项项目(编号:2008ZX10002-011)
周云,男,36岁,医学博士。主要从事感染与免疫研究。E-mail:zyky120@126.com
宋景娇,E-mail:jjsong@tjh.timu.edu.cn
【Abstrat】Objective To establish the acute or chronic HBV-infection mouse model.Methods Acute or chronic HBV-infection mouse model was established by hydrodynamic injection of pAAV/HBV1.2 plasmid.Serum HBsAg were detected by ELISA.The immune-related molecule mRNA were detected by real-time PCR.The activated lymphocytes in the livers were detected by FACS and ELISPOT was used to detect the HBV-specific cellular immune response.Results We successfully established the acute and chronic HBV-infection mouse model by hydrodynamic injection of pAAV/HBV1.2 plasmid;The duration of serum HBsAg secretion in acute HBV-infected BALB/c mice was (3.25±1.04) weeks,significantly shorter than that in chronic HBV-infected C57BL/6 mice[(10.0±3.74) weeks,P<0.05];The duration of serum HBsAg secretion in BALB/c mice injected with low dose (2.5μg) of pAAV/HBV1.2 plasmid was(3.67±1.03) weeks,significantly longer than that in high dose(50μg) group[(2.33 ±0.52) weeks,P <0.05];On the tenth day after hydrodynamic injection,HBcAg special T lymphocytes appeared in the spleen of BALB/c mice.Conclusion HBV-infection mouse model is successfully established by hydrodynamic injection of pAAV/HBV1.2 plasmid and we find that mouse genetic background,immune response and viral doses will impact the establishment of this kind of HBV-infection mouse model.