基于红荧烯纳米材料构建电致化学发光免疫传感器用于灵敏检测β淀粉样蛋白的研究
2017-10-19刘佳莉汤雨衡柴雅琴
刘佳莉,汤雨衡,卓 颖,柴雅琴,袁 若
(重庆市现代分析化学重点实验室,西南大学化学化工学院,重庆400715)
基于红荧烯纳米材料构建电致化学发光免疫传感器用于灵敏检测β淀粉样蛋白的研究
刘佳莉,汤雨衡,卓 颖*,柴雅琴,袁 若*
(重庆市现代分析化学重点实验室,西南大学化学化工学院,重庆400715)
该实验合成了一种以红荧烯为发光体的纳米棒(SDS-Rub),并基于此构建了高灵敏的信号减小型电致化学发光(ECL)免疫传感器用于β淀粉样蛋白的检测。该实验以二氧化硅(SiO2)为模版制备了二茂铁纳米微球(PAA/PEI-Fc),极大限度地提高了二茂铁的固载量,更加灵敏地猝灭ECL信号。首先,将红荧烯纳米材料修饰到玻碳电极表面,将制得的银纳米线滴涂到修饰了的电极上,用于固载一抗。利用牛血清白蛋白(BSA)封闭多余的活性位点后,将抗原(Ag)孵育到电极上。此时,该传感器检测到高的ECL信号。利用抗原抗体特异性结合,将二茂铁二抗复合物(Fc-Ab2)孵育到电极上,由于二茂铁的猝灭作用,ECL信号降低。基于ECL信号的变化值与β淀粉样蛋白浓度的关系,实现定量检测。实验结果表明,在β淀粉样蛋白抗体浓度范围10 fg/mL~100 ng/mL,该传感器的检测限为3.2 fg/mL。
电致化学发光(ECL);免疫传感器;红荧烯;β淀粉样蛋白(Aβ)
Abstract:In this study,the rubrene nanomaterials were synthesized as a luminophor to construct the sensitive electrochemiluminescence(ECL)immunosensor for the detection of β-amyloid protein.The ferrocene nanoparticles(PAA/PEI-Fc)were prepared by using silica as template,which greatly improved the load capacity of the(PAA/PEIFc)to quench the ECL signal more sensitively.Firstly,the RubNRs was decorated on the polished GCE,then,the silver nanowires were dropped on the electrode to immobilize the capture antibody(Ab1).After immobilizing with the BSA to block the active site,the Aβ antigen(Ag)was incubated.Finally,the secondary antibody bioconjugate(Fc-Ab2)was connected to the surface of the electrode because of the specific binding of antibody to antigen,which obtained a declining ECL signal.The results showed that there was a good linear relationship of the concentration of β-amyloid protein at the concentration range of 10 fg/mL~100 ng/mL,with the detection limit of 3.2 fg/mL.This work can also provide a new approach for ultrasensitive detection of Aβ.
Key words:electrochemiluminescence(ECL);immunosensor;rubrene;amyloid-β protein(Aβ)
0 引言
β淀粉样蛋白 (Aβ),由39-43个氨基酸组成,是大脑皮质老年斑的主要成分,可以有效消弱突触结构和功能。这种二聚体是最小的突触毒性物质,是引起阿尔茨海默病的主要物质[1]。近年来,生物传感器发展迅速,已逐渐应用于工业、食品、临床医学和环境监测等领域。免疫传感器作为一种新兴的生物传感器,因其鉴定物质的灵敏度、稳定性及高度特异性受到青睐。免疫传感器的问世使得传统的免疫分析方法发生了很大的改变,它将传统的免疫测试和生物传感技术融为一体,集两者的诸多优点于一身,不仅提高了灵敏度和检测精度、减少了分析时间,也使得测定过程变得简单,易于实现自动化,有着广阔的应用前景。免疫传感器的原理为:基于抗原-抗体特异性反应进行分子识别,然后通过物理或化学变化实现信号转化,最后通过监测可测信号的变化进行定量分析。抗原和抗体结合即发生免疫反应,其特异性极高,具有极高的选择性和灵敏度。免疫传感器可以分为直接型和间接型。直接法是将抗体固定在电极上后,通过抗原抗体间的特异性结合孵育被测抗原,从而实现信号的转换对抗原进行测定。间接型免疫传感器的原理是将捕获抗体(capture antibody,Ab1)固定在电极上后通过特异性结合将抗原 (antigen,Ag)孵育在电极之上,最后再将标记抗体(secondary antibody,Ab2)孵育在电极之上,形成夹心免疫模式进行检测。间接法相对于直接法有更好的灵敏度,且干扰也相对小于直接法,对于该实验检测的β淀粉样蛋白来说更具有优势[2]。
电致化学发光(ECL)技术是电化学与化学发光相结合的检测技术,它具有选择性高、易于实现自动化、灵敏度高、仪器设备简单、重现性好、操作方便、抗干扰能力强、分析速度快和线性响应范围宽等特点[3]。ECL的基本原理是通过发光体与共反应试剂在电极表面发生氧化还原反应产生ECL信号。首先,对电极施加一定的电压,电化学发光物质在电极表面发生电子传递反应而产生电化学发光物质的激发态,当激发态跃迁回基态时辐射出光子发光,最后用光电倍增管捕获和测量发光强度,进而实现对物质痕量分析[4]。常见的电致化学发光体系有:聚芳香族碳氢化合物(PAH);酰肼类化合物,其代表物是鲁米诺;无机金属配合物或螯合物,其代表物是联吡啶钌Ru(bpy)32+。目前,电致化学发光的分析主要应用于药物及生化分析,免疫分析,有机分析,无机分析,核酸杂交分析等领域[5]。
红荧烯 (Rubrene),5,6,11,12-四苯基四苯,红色至浅棕色结晶或结晶性粉末,属于多环芳烃簇(PHA)化合物,是一种重要的小分子有机半导体材料[6]。红荧烯是用于实现红色有机发光二级管和白色有机发光二级管的材料。它作为一种高效的荧光材料,能通过从未占据态到占据态电子的跃迁而发出可见黄光,将它掺杂到空穴转移层中,能够提高有机发光二极管的效率和稳定性;红荧烯与其他所有的多环芳烃簇化合物一样有着非定域π-电子,使得分子的稳定性加强并使分子具有相对较小的能带宽度,红荧烯分子的这些特性决定了它的光学和电学性质[7]并为有机电子和光电子装置的研究和应用提供了较理想的条件。研究表明,红荧烯晶体存在三种晶系:三斜晶系、正交晶系和单斜晶系,这三种晶系可通过不同的生长条件得到。其中红荧烯正交晶系中能使四并苯环更为平面化并使分子更容易堆积在一起,沿着红荧烯分子堆积方向存在的π-π堆积,是红荧烯晶体有着很高的电子迁移率的根本原因[8-9]。
纳米材料是指在三维空间中至少有一维处于纳米尺寸(0.1~100 nm)或由它们作为基本单元构成的材料,这大约相当于10~100个原子紧密排列在一起的尺度。纳米材料的应用范围极其广泛,如天然纳米材料、纳米磁性材料、纳米陶瓷材料、纳米传感器、纳米倾斜功能材料、纳米半导体材料、纳米催化材料、碳纳米管等。纳米材料大致可分为纳米粉末、纳米纤维、纳米膜、纳米块体等四类。其中纳米粉末开发时间最长、技术最为成熟,是生产其他三类产品的基础[10]。纳米技术作为一种最具有市场应用潜力的新兴科学技术,其潜在的重要性毋庸置疑,一些发达国家已投入大量的资金进行研究工作。在国内,许多科研院所、高等院校也组织科研力量,开展纳米技术的研究工作,并取得了一定的研究成果。近年来,将纳米材料应用到传感器中已成为一大研究热点。
该实验以红荧烯纳米材料(SDS-Rub)为发光体,二茂铁纳米微球为猝灭剂,采用免疫夹心模式构建了高灵敏的信号减小型ECL免疫传感器。首先将红荧烯纳米材料(SDS-Rub)修饰到玻碳电极作为发光体,然后将银纳米线固载在电极上用于固载捕获抗体(Ab1),通过Ag-N键将Ab1孵育到电极表面。用牛血清蛋白(BSA)封闭其非特异性位点后孵育不同浓度的抗原(Ag)。此时,该传感器检测到高的ECL信号。最后通过抗原抗体的特异性结合,将二茂铁二抗复合物(Fc-Ab2)结合到电极上制备生物传感器。由于二茂铁的猝灭作用,ECL信号降低。该实验基于夹心免疫模式,通过测定ECL信号的变化值与β淀粉样蛋白浓度的关系,实现了对Aβ的超灵敏检测。
1 实验部分
1.1 仪器与试剂
MPI-A型ECL分析仪 (西安瑞迈电子科学技术有限公司);CHI660C电化学工作站(上海辰华仪器有限公司);三电极体系:玻碳电极(GCE,Φ=4 mm)及其修饰电极为工作电极,饱和甘汞电极为参比电极,铂丝为对电极;Ag/AgCl参比电极;TGL-20M高速台式冷冻离心机 (长沙湘仪离心机仪器有限公司);移液枪(成都方舟科技开发公司);SCZL-2数显智能控温磁力搅拌器;AB204-S电子天平(瑞士Metter Toledo公司);溶解洗涤等使用BRANSONIC200超声清洗仪 (德国 BRANSON ULTRASCHALL 公司);DZF-6050真空干燥箱(上海齐欣科学仪器有限公司)。
十二烷基硫酸钠(SDS);红荧烯(Rub);四氢呋喃(THF);三乙胺(TEA),氯化铁(FeCl3);乙二醇 (EG);聚乙烯吡咯烷酮 (PVP);硝酸银(AgNO3);乙醇(Ethanol);聚乙烯亚胺(PEI);羧基化二茂铁(Fc-COOH);聚丙烯酸(PAA);氢氟酸(HF);1-(3-二甲基丙基)-3-乙基碳二亚胺盐酸盐(EDC);N-羟基琥珀酰亚胺(NHS);β 淀粉样蛋白(Aβ)及其抗体;牛血清白蛋白(BSA 0.25%)购于 Sigma公司(美国);磷 酸 缓 冲 溶 液 (PBS,0.1 mol/L,pH7.4) 是由 0.1 mol/L Na2HPO4,0.1 mol/L KH2PO4和0.1 mol/L KCl混合配制而成;实验所用其它试剂均为分析纯或优级纯,实验用水均为二次去离子水。
1.2 红荧烯纳米材料(SDS-Rub)的制备
首先将50 mL的烧杯及搅拌子用铬酸洗液充分浸泡后,用蒸馏水超声洗涤干净后晾干,称取0.0216 g十二烷基硫酸钠(SDS)溶解到10 mL蒸馏水中。另取一清洁干燥的10 mL烧杯,称取5 mg红荧烯 (Rub),充分溶于5 mL四氢呋喃(THF)后逐滴加入到10 mL十二烷基硫酸钠(SDS)溶液中,搅拌 30 min,超声 12 min后离心洗涤,加蒸馏水稀释避光保存。
1.3 羧基化二茂铁-二抗复合物(Fc-Ab2)的制备
取5 mmol/L羧基化二茂铁溶于乙醇中,加入40 mmol/L 1-(3-二甲基丙基)-3-乙基碳二亚胺盐酸盐(EDC),10mmol/L N-羟基琥珀酰亚胺(NHS)配成的溶液在4℃下不断搅拌2 h活化。然后加入1%聚乙烯亚胺(PEI)溶液,室温下搅拌过夜使其与二茂铁上的羧基形成酰胺键,得到PEI-Fc-COOH。
称取1 mg SiO2纳米颗粒均匀分散到10 mL乙醇中,加入100 μL已经制备的PEI-Fc-COOH溶液不断搅拌1 h,以SiO2纳米颗粒为核,PEIFc-COOH包裹在外。反应完成后,离心(8000 r/min,2 min)得到 SiO2@PEI-Fc-COOH,用乙醇离心洗涤两次,洗去多余的PEI-Fc-COOH。将1%聚丙烯酸(PAA)加入到上述材料中搅拌1 h,离心洗涤除去多余的PAA后,依次加入PEI-Fc-COOH,PAA和PEI-Fc-COOH进行层层自组装包裹,然后离心洗涤得到核壳结构的SiO2@PAA/PEI-Fc。将氢氟酸溶液逐滴加入到所得的核壳型纳米材料中,当溶液逐渐变为透明时停止滴加,离心洗涤后分散到去离子水中,得到二茂铁纳米微球(PAA/PEI-Fc)。最后将层层包裹的纳米颗粒在40 mmol/L 1-(3-二甲基丙基)-3-乙基碳二亚胺盐酸盐 (EDC)10 mmol/L N-羟基琥珀酰亚胺(NHS)配成的溶液中4℃下与二抗进行交联,最后离心(8000 r/min,5 min)得到二茂铁二抗复合物(Fc-Ab2)放入4℃下储存备用。
1.4 银纳米线(AgNWs)的制备
称取0.0016 g氯化铁 (FeCl3)溶解到10 mL乙二醇 (EG)中,剧烈搅拌下加入0.15 mol/L(0.162 g)聚乙烯吡咯烷酮(PVP),之后逐滴加入10 mL 的 0.1 mol/L(0.17 g)硝酸银(AgNO3)乙二醇(EG)溶液。搅拌均匀后,将溶液转移到50 mL的反应釜中,在160℃的条件下真空干燥箱反应2.5 h。反应结束后取出反应釜冷却至室温后离心洗涤,最后加水稀释备用。
1.5 电极的组装过程
首先,将玻碳电极用三氧化铝粉末在电极板上打磨光滑,然后在水和乙醇的混合溶液中超声清洗3次,室温下晾干备用。用移液枪吸取10 μL分散均匀的红荧烯纳米材料(SDS-Rub)滴涂于预处理后的玻碳电极表面,在常温避光条件下晾干成膜。然后用移液枪吸取5 μL分散均匀的银纳米线溶液滴涂于电极上,室温避光条件下成膜。取10 μL Ab1滴涂于电极上,在4℃条件下孵育12 h。将孵育了Ab1的电极取出用蒸馏水淌洗,在室温条件下滴涂5 μL牛血清白蛋白(BSA 0.25%),孵育40 min,用以封闭非特异性结合位点。用蒸馏水淌洗之后室温下孵育10 μL不同浓度的β淀粉样蛋白(Aβ)1.5 h,最后用蒸馏水淌洗后室温下孵育10 μL二茂铁二抗复合物 (Fc-Ab2)1.5 h。电极组装过程如图1所示。
1.6 检测方法
该实验测量采用三电极体系:
a)经修饰的玻碳电极(Φ=4 mm)作为工作电极,Ag/AgCl(饱和 KCl溶液)作为参比电极,铂丝为对电极。在2 mL PBS(pH=7.4)溶液中加入10 μL三乙胺(TEA)作为共反应试剂,采用MPIA型电致化学发光分析系统对所修饰电极的电致化学发光行为进行研究。电位扫描范围为0 V~1.2 V,以100 mV/s的电位扫描速度进行扫描。

图1 电级组装过程示意图Fig.1 Schematic diagram of the ECL sensor preparation process
b)经修饰的玻碳电极(Φ=4 mm)作为工作电极,饱和甘汞电极作为参比电极,铂丝为对电极。在5 mmol/L K3[Fe(CN)6]溶液中利用循环伏安法(CV)和电化学交流阻抗技术(EIS)对电极的制备过程进行表征。电位区间为-0.2 V~0.6 V,扫描速率为50 mV/s。

图2 红荧烯纳米材料和银纳米线的SEM表征Fig.2 SEM images of(A)SDS-Rub and(B)Ag nano wires
2 结果与讨论
2.1 红荧烯纳米材料(SDS-Rub)和银纳米线的SEM表征
红荧烯纳米材料和银纳米线的扫描电子显微镜(SEM)表征如图2所示,通过该图可以看出红荧烯纳米材料和银纳米线的形貌特征。红荧烯为长度5 μm,截面直径为1 μm的圆柱体形状,银纳米线为长度500 nm,截面直径为50 nm的线状,说明该纳米材料制备成功。
2.2 传感器制备过程CV表征
制备过程中,修饰每一步电极后将其置于5 mmol/L K3[Fe(CN)6]溶液中,在-0.2~0.6V的电位范围内进行循环伏安的电化学表征,由图3可观察到,裸电极在底液中有一对可逆的Fe(CN)64-/Fe(CN)63-的可逆氧化还原峰(曲线a)。当红荧烯纳米材料固载到电极表面后,由于红荧烯纳米材料阻碍电子传递使得电流信号减弱(曲线b)。电极经银纳米线修饰后,由于银纳米线加快电子传递,所以电流值增高(曲线c)。因为蛋白质对电子传递的阻碍作用,当分别修饰Ab1,BSA及Aβ 之后,电流强度依次降低(曲线 d、e、f)。 最后电极经Fc-Ab2修饰之后,电流值增高(曲线g)。
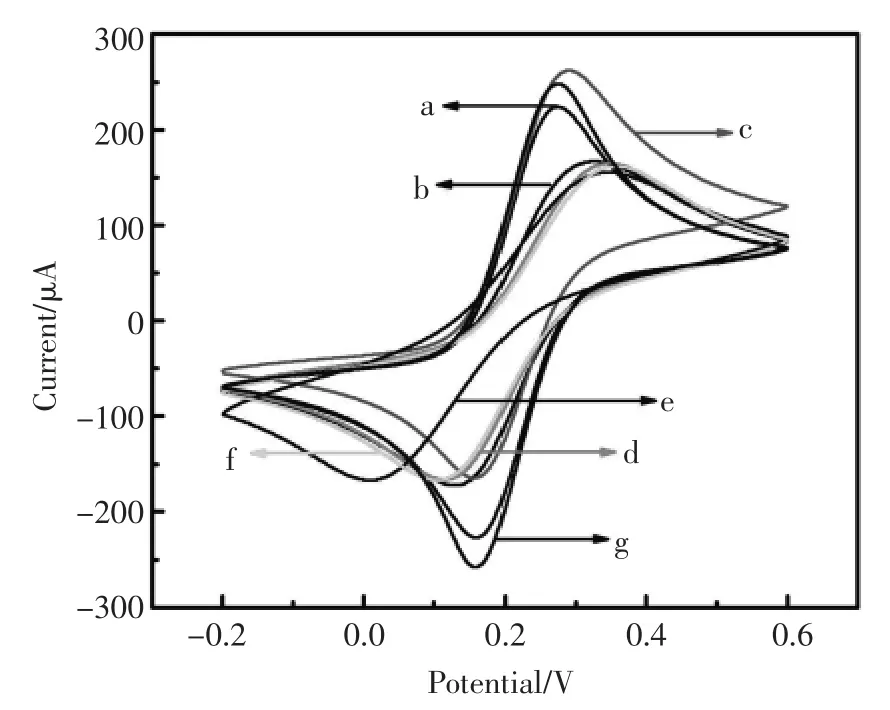
图3 CV表征(a.裸电极,b.SDS-Rub/裸电极,c.AgNWs/SDS-Rub/裸电极,d.Ab1/AgNWs/SDS-Rub/裸电极,e.BSA/Ab1/AgNWs/SDS-Rub/裸电极,f.Aβ/BSA/Ab1/AgNWs/SDS-Rub/裸电极,g.Fc-Ab2/Aβ/BSA/Ab1/AgNWs/SDS-Rub/裸电极)Fig.3 The CV characterization(a.bare GCE,b.SDS-Rub/GCE,c.AgNWs/SDS-Rub/GCE,d.BSA/AgNWs/SDS-Rub/GCE,e.Ab1/BSA/AgNWs/SDS-Rub/GCE,f.Aβ/Ab1/BSA/AgNWs/SDS-Rub/GCE,g.Fc-Ab2/Aβ/Ab1/BSA/AgNWs/SDS-Rub/GCE)
2.3 传感器制备过程ECL表征
电极制备过程中通过ECL信号的变化表征传感器的修饰过程 (如图4)。在2.0 mL三乙胺(TEA)溶液中,裸电极几乎没有信号(曲线a),当电极修饰了红荧烯纳米材料后,ECL信号明显增强(曲线b),因为电极修饰了发光体红荧烯。由于银纳米线对电子传递的促进作用,因此ECL信号持续增强(曲线c)。当分别修饰上捕获抗体、牛血清白蛋白、β淀粉样蛋白、二茂铁二抗复合物后,信号均降低(曲线 d、e、f、g),这是由于蛋白质电子传递的阻碍作用。

图 4 ECL 表征(a.裸电极,b.SDS-Rub/裸电极,c.AgNWs/SDS-Rub/裸电极,d.Ab1/AgNWs/SDS-Rub/裸电极,e.BSA/Ab1/AgNWs/SDS-Rub/裸电极,f.Aβ/BSA/Ab1/AgNWs/SDS-Rub/裸电极,g.Fc-Ab2/Aβ/BSA/Ab1/AgNWs/SDS-Rub/裸电极)Fig.4 The ECL characterization(a.bare GCE,b.SDSRub/GCE,c.AgNWs/SDS-Rub/GCE,d.Ab1/AgNWs/SDSRub/GCE,e.BSA/Ab1/AgNWs/SDS-Rub/GCE,f.Aβ/BSA/Ab1/AgNWs/SDS-Rub/GCE,g.Fc-Ab2/Aβ/BSA/Ab1/AgNWs/SDS-Rub/GCE)
2.4 传感器制备过程EIS表征
该实验还采用了电化学阻抗方法(EIS)来进一步表征传感器的制备过程。如图5所示,不同修饰电极在含有0.1 mol/L KCl的[Fe(CN)6]3-/4-(5 mmol/L)溶液中扫描得到不同的电化学阻抗曲线。首先,裸电极具有比较小的阻抗值(曲线a),当电极经过红荧烯纳米材料修饰之后,阻抗值增大(曲线b),这是由于红荧烯纳米材料对电子的阻碍作用。将银纳米线固载到电极表面后,由于银纳米线加快电子传递,电化学阻抗值减小(曲线c)。由于蛋白质的阻碍作用,连续孵育捕获抗体、牛血清白蛋白、β淀粉样蛋白后,阻抗值逐步增大(曲线d、e、f)。最后电极修饰上二茂铁二抗复合物,电极阻抗值减小(曲线g)。
2.5 传感器的ECL信号响应特性

图 5 ECL 表征(a.裸电极,b.SDS-Rub/裸电极,c.AgNWs/SDS-Rub/裸电极,d.Ab1/AgNWs/SDS-Rub/裸电极,e.BSA/Ab1/AgNWs/SDS-Rub/裸电极,f.Aβ/BSA/Ab1/AgNWs/SDS-Rub/裸电极,g.Fc-Ab2/Aβ/BSA/Ab1/AgNWs/SDS-Rub/裸电极)Fig.5 The ECL characterization(a.bare GCE,b.SDSRub/GCE,c.AgNWs/SDS-Rub/GCE,d.BSA/AgNWs/SDS-Rub/GCE,e.Ab1/BSA/AgNWs/SDS-Rub/GCE,f.Aβ/Ab1/BSA/AgNWs/SDS-Rub/GCE,g.Fc-Ab2/Aβ/Ab1/BSA/AgNWs/SDS-Rub/GCE)
该实验研究了制备的免疫传感器在孵育了不同浓度的抗原之后,其ECL信号与不同浓度抗原的关系,结果如图6所示。从图6A可以看出传感器的发光强度随孵育的抗原浓度的增大而减小。并且传感器的发光强度与抗体的浓度成线性关系,如图6B所示:线性方程为I=1372.81 lgc+8108.71(I为电致化学发光强度,c为β淀粉样蛋白的浓度),相关系数为r=0.998。所以此结果能很好地说明实验所制备的传感器有很好的灵敏度。
2.6 ECL传感器选择性
为了探究传感器对β淀粉样蛋白的选择性,将β淀粉样蛋白分别用100 ng/mL的AFP、CEA及其混合物替代10 ng/mL进行试验,然后将分别孵育了上述物质的传感器的电致化学发光响应同孵育了10 ng/mL的β淀粉样蛋白的信号进行比较。结果如图7所示,由于该传感器为信号减小型,所以由图7可以看出孵育β淀粉样蛋白的传感器ECL信号明显小于其他对比蛋白。因此可以表明传感器对β淀粉样蛋白有很好的选择性。
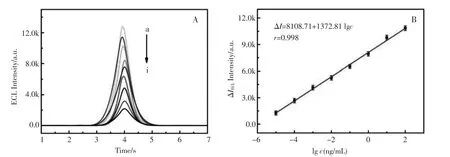
图6 (A)不同浓度β淀粉样蛋白的ECL响应信号和(B)不同浓度β淀粉样蛋白的线性曲线Fig.6 (A)The ECL profiles of the prepared biosensor in the presence of different concentrations of Aβ:a.blank,b.10 fg/mL, c.100 fg/mL,d.1 pg/mL,e.10 pg/mL,f.100 pg/mL,g.1 ng/mL,h.10 ng/mL,i.100 ng/mL and(B)The corresponding calibration plot of the ECL intensity vs.the logarithm of Aβ concentration
2.7 ECL传感器的稳定性
稳定性是检测传感器性能的一个重要指标。为测定该实验所制作的传感器的稳定性,在β淀粉样蛋白浓度为100 ng/mL的条件下用电致化学发光仪在检测液中连续循环扫描一段时间,所得出的ECL信号结果如图8。由图可以看出该传感器的ECL信号非常稳定,传感器具有良好的性能。

图7 传感器的选择性Fig.7 The selectivity of sensor:a.blank,b.AFP(100 ng/mL),c.CEA(100 ng/mL),d.Aβ (10 ng/mL),e.the mixture

图8 传感器的ECL信号稳定性图Fig.8 The ECL signal stability of the biosensor towards 1×10-4ng/mL Aβ
2.8 各种检测方法的对比

检测方法间接法酶联免疫吸附法双抗体夹心酶联免疫吸附法竞争法酶联免疫吸附法该实验所研究的免疫传感器优点及不足仅在患者脑脊液(CSF)中检测β淀粉样蛋白,检测方法比较局限但是具有较高的灵敏度能检测Aβ 1-42的水平,对其他种类Aβ检测效果不理想无法获得两种以上单一性抗体的抗原检出限低灵敏度好,再生性良好,成本低操作简便检出限3.62 μg/L 2.02 μg/L 3.61 μg/L 3.2 fg/mL
3 结论
该实验以红荧烯纳米材料/三乙胺为发光体系,基于抗原抗体特异性结合采用夹心免疫模式构建高灵敏的信号减小型ECL免疫传感器。实验结果表明,在β淀粉样蛋白浓度范围10 fg/mL~100 ng/mL之间,表现出良好的线性关系。该ECL生物传感器制备方法简单,能够对β淀粉样蛋白实现高灵敏度,高选择性的检测,并且重现性和稳定性好,能够更方便更快速地检测低浓度的β淀粉样蛋白,有望在医疗等方面中具有一定的应用价值。
[1]赵谨,王心.β淀粉样蛋白 [J].日本医学介绍,2003,9:026.
[2]屠一锋,郭文英,黄炳强.影响鲁米诺体系电致化学发光因素的研究[J].光谱实验室,2001,18(2):185-188.
[3]邓金祥,康成龙,杨冰.真空蒸镀红荧烯薄膜及其形貌分析[J].真空科学与技术学报,2012,32(8):678-681.
[4]Podzorov V,Pudalov V M,Gershenson M E.Field-effect transistors on rubrene single crystals with parylene gate insulator[J].Applied physics letters,2003,82:1739-1741.
[5]涂荣波,董军.β淀粉样蛋白在老年痴呆症发生发展中的作用及其机制[J].第四军医大学学报,2007,28(1):91-93.
[6]da Silva Filho D A,Kim E G,Brédas J L.Transport properties in the rubrene crystal:electronic coupling and vibrational reorganization energy [J]. Advanced Materials,2005,17:1072-1076.
[7]温志立,汪世平,沈国励.免疫传感器的发展概述[J].生物医学工程学杂志,2001,18(4):642-646.
[8]霍群.电化学免疫传感器[J].临床检验杂志,2003,21(3):181-182.
[9]Unterholzner L,Keating S E,Baran M,et al.IFI16 is an innate immune sensor for intracellular DNA[J].Nature immunology,2010,11:997-1004.
[10]Fabriek B O,van Bruggen R,Deng D M,et al.The macrophage scavenger receptor CD163 functions as an innate immune sensor for bacteria[J].Blood,2009,113:887-892.
The electrochemiluminescence immunosensor based on the rubrene nanomaterials for sensitive detection of amyloid-β protein
Liu Jia-li,Tang Yu-heng,Zhuo Ying*,Chai Ya-qin,Yuan Ruo*
(College of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
国家自然科学面上基金项目(21575116,21675129,21675130);中央高校基本科研业务费专项资金资助(XDJK2015A002)
*通信联系人,E-mail:yingzhuo@swu.edu.cn;yuanruo@swu.edu.cn,Tel.:Fax:023-68253172(卓颖,袁若)
