电化学分析法应用于黄曲霉毒素检测的进展研究
2017-10-19苏会岚岑耀颖
杨 谦,苏会岚,罗 欢,王 琴,岑耀颖
(成都医学院公共卫生系,四川成都610500)
电化学分析法应用于黄曲霉毒素检测的进展研究
杨 谦,苏会岚*,罗 欢,王 琴,岑耀颖
(成都医学院公共卫生系,四川成都610500)
黄曲霉毒素是一类化学结构相似的化合物,是黄曲霉和寄生曲霉的次级代谢产物,具有剧毒性和严重的致癌性、致畸性和致突变性。摄入被黄曲霉毒素污染的农作物和食品会对人类和动物的健康造成严重危害,快速准确的检测黄曲霉毒素具有重要的现实意义。近年来电化学分析方法用于黄曲霉毒素的研究表明,构建电化学传感器检测黄曲霉的方法相比于传统的黄曲霉毒素检测方法,具有检测时间短、操作简便、成本低、便于微型化等诸多优势,有望在快速、在线、高灵敏准确检测食品中的黄曲霉毒素方法上获得突破。
黄曲霉毒素;电化学;免疫传感器;适体传感器
Abstract:Aflatoxins are a series of compounds with similar chemical structure.Aflatoxins exist widely in nature,which is secondary metabolite of Aspergillus flavus and Aspergillus parasiticus,with highly toxic and serious carcinogenic,teratogenic and mutagenic.When ingested crops and food contaminated aflatoxin,it is serious harm to human and animal health.Therefore,the rapid and accurate detection of aflatoxin has important practical significance.Nearly research report shows that electrochemical analytical methods have been widely utilized to detect aflatoxin for its high efficiency,high sensitivity,simple operation,low cost,easy miniaturization.It is predictable that the obviously breakthrough in this research field could be expected in the future.
Key words:aflatoxin; electrochemical; immunosensor; aptasensor
0 引言
黄曲霉毒素是由黄曲霉菌和寄生曲霉产生的一类结构与性质相似的真菌次生代谢物,具有强毒性、高稳定性、致畸性、致癌性、并且能抑制机体的免疫过程。在已发现的400多种黄曲霉毒素中,常见的黄曲霉毒素主要有B1.B2.M1.M2.G1.G2等几种亚型,其中AFB1是最危险的致癌物(毒性相当于砒霜的68倍)[1]。黄曲霉毒素广泛存在于粮食作物中,特别是对高温高湿地区的玉米、花生、大米、坚果的污染尤其严重。1993年,世界卫生组织癌症研究机构将AFB1确定为I类致癌物[2]。建立快速检测食品中的黄曲霉毒素含量的方法对于食品安全和保障人民健康具有重要意义。目前,黄曲霉毒素的检测方法主要有薄层色谱法 (TLC)、胶体金试纸条法、酶联免疫法(ELISA)、荧光光度法 、高效液相色谱法(HPLC)等[3-11]。近年来,随着现代科学技术的不断发展,使用电化学分析法检测黄曲霉毒素越来越受关注。电化学分析方法具有检测快速、成本低、不受样品颜色与浊度的影响、仪器设备相对简单、体积小、快速、灵敏、选择性高、操作简便等特点,在黄曲霉毒素检测快速方法的发展中具有非常重要的意义。
1 电化学免疫传感器在黄曲霉毒素检测中的应用
电化学免疫传感器是利用抗原抗体的特异性亲和作用,通过检测特异性识别作用前后的电流、电位、电阻等电信号的变化来实现对目标分子检测。近年来的主要研究热点集中在抗原抗体的固定和电信号放大技术的研究上[12-17]。
黄曲霉毒素(AF)作为半抗原,通常需要和牛血清蛋白 (BSA)结合形成BSA-AF复合物才能与相应的抗体有效结合。电化学免疫传感器是通过anti-AF对BSA-AF的特异性识别作用实现对AF的检测。在生物分子固载方面,Owino等[18]用聚苯胺和聚苯乙烯磺酸修饰的铂电极固定AFB1抗体,用牛血清白蛋白(BSA)封闭,识别AFB1后的免疫复合物可阻碍电子传输,阻抗分析表明,该传感器的检测限为0.1 mg/L。Raquel等[19]利用G蛋白定向固载作用,将G蛋白和IgG功能化的碳纳米管用于检测污染大米中的黄曲霉,检测限为10 μg/g。王瑞鑫等[20]用壳聚糖-金溶胶复合膜修饰玻碳电极,AFB1抗体通过静电作用吸附在电极表面制备出一种电化学免疫传感器用于AFB1的检测,具有更低的检测限,其检测限为0.05 ng/g,线性范围为 0.1~1.1 ng/g。
为了增强检测灵敏度,研究者将纳米材料和新型导电材料等应用到黄曲霉毒素免疫传感器的构建中,增大电极比表面积,增强电极表面的导电性能,提高检测的灵敏度。碳纳米材料因碳纳米管和石墨烯的发展而广泛应用于科学研究。Chandan等[21]将anti-AFB1抗体固载到羧基化多壁碳纳米管上,并进一步修饰到铟锡氧化物(ITO)玻片上,采用电化学循环伏安法检测AFB1。周琳婷等[22]首先将氧化石墨烯、2,5二(2-噻吩)卜对苯甲酸吡咯和氯金酸依次电沉积到金电极表面形成导电高分子膜,再将AFB1抗体与之共价结合,采用循环伏安法和交流阻抗法检测AFB1。结果显示,该导电高分子膜可有效增强检测灵敏度,检出限为11×10-15mol/L,线性范围2×10-15~3.2×10-13mol/L。 随着各种导电性能良好的新材料(如离子液体、导电聚合膜等)的出现,给电化学传感器敏感界面的构建提供了新思路。Li等[23]制备出一种硅胶-离子液体生物相容性膜固定anti-AFB1抗体,通过阻抗分析,与不含离子液的比对电极相比,结果表明离子液体能够增大玻碳电极表面的导电性,减小电子转移阻抗。同时,纳米技术的更新使功能化的纳米材料的协同效应备受关注,Zhou等[24]将纳米技术结合离子液体的优良性能用于黄曲霉毒素的检测(图1)。首先在电极上固定一层石墨烯/导电聚合物/金纳米粒子/离子液体复合膜,然后将anti-AFB1抗体共价固定在膜上。石墨烯和金纳米粒子可加快电子转移,且离子液体能为抗体提供优良的微环境,使该传感器呈现出灵敏度较高的特点,显示出优良的响应性能。

图1 基于石墨烯/导电聚合物/金纳米粒子/离子液体复合膜的黄曲霉毒素电化学传感器示意图Fig.1 Procedure for fabrication of the sensor based on GN/DPB/Au/IL membrane[24]
为进一步放大响应信号,酶催化技术、纳米技术和生物放大技术常被联合用于黄曲霉毒素电化学免疫传感器中[25-30]。有研究者提出加入碱性磷酸酯酶(ALP)、辣根过氧化物酶(HRP)等用于标记抗体或抗原。Ammida等[31]在丝网印刷电极表面固定BSA-AFB1,与待测液中的游离AFB1竞争结合anti-AFB1抗体,ALP标记二抗放大响应信号,通过ALP催化底液中1-萘基磷酸盐产生的增强的电流,用差分脉冲伏安法检测电流改变以实现对目标物的检测。Tan等[32]构建电流型免疫传感器,利用酶催化银沉淀的信号放大方法检测大米中的AFB1,游离的AFB1与固定在巯基乙胺修饰的金电极表面的BSA-AFB1竞争性结合固定数量的anti-AFB1抗体,二抗标记物碱性磷酸酶(ALP)催化底液中的抗坏血酸2-磷酸酯生成抗坏血酸,银离子被还原成金属银沉积在电极表面,通过电流信号的改变检测AFB1。Paniel等[33]将磁性纳米颗粒结合酶标记技术用于AFM1的检测中,将anti-AFM1抗体包被在磁性纳米颗粒表面,通过外加磁场将anti-AFM1抗体固定在丝网印刷电极表面,用辣根过氧化物酶(HRP)作为竞争性免疫标记物,用计时电流法和循环伏安法检测电流信号,实现信号放大,检测限为0.01 μg/L,线性范围为 0.01~0.1 μg/L。 Tang 等[34]也利用磁CoFe2O4纳米粒子为核和普鲁士蓝纳米粒子掺杂的二氧化硅为壳制备一种多功能磁性微珠(MMB),该磁性微珠用于固定AFB1–BSA,HRP标记的anti-AFB1抗体和金纳米颗粒结合,免疫反应后在外加磁场的作用下,纳米生物复合物附着在铟锡氧化物(ITO)电极表面,实现对该体系电信号的检测,检测限为6.0 pg/mL,线性范围为0.05~12 ng/mL。磁性纳米材料具有修饰灵活性强、易收集、灵敏度高等优点,在黄曲霉毒素的快速检测方法的构建中具有广泛的应用前景。
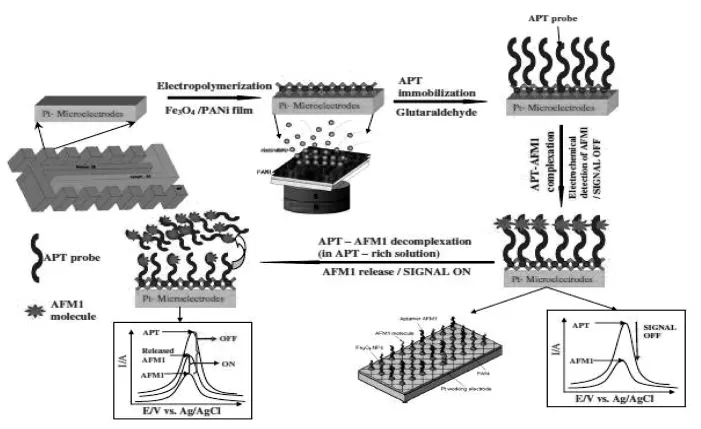
图2 基于磁性纳米粒子的信号增强性适体传感器用于黄曲霉毒素检测示意图Fig.2 Principle of label-free detection of AFM1with magneto-electrochemical Fe3O4/PANi based aptasensor[40]
2 电化学适体传感器在黄曲霉毒素检测中的应用
电化学适体传感器是以核酸为分子识别元件,根据适体与配体结合前后电化学信号的改变而建立的一种分析方法。核酸适体作为一种新型的分子识别原件,相比抗体有高亲和性、高特异性、无免疫原性、靶分子种类多、易于合成与修饰等优点,被广泛的应用于生物传感、临床诊断等领域[35-38]。目前,电化学适体传感器用于黄曲霉毒素的检测方法研究也逐渐成为热点[39-43]。Dinqkaya等[39]制备出一种基于DNA探针的阻抗型适体传感器。该传感器用硫醇修饰的单链DNA(SS-HSDNA)探针,通过与金纳米颗粒共价交联而固定在金电极上,AFM1分子能够被ss-HSDNA特异性识别,从而增大电子转移阻抗, 通过识别前后的电阻变化实现对AFM1的检测。Nguyen等[40]制备一种适体传感器检测AFM1(图2)。将Fe3O4/PANI固定在铂微电极表面,APT探针固定在电极表面识别AFM1,磁性纳米粒子作为信号放大元件,通过循环方波伏安法检测电化学信号变化,线性范围为6~60 ng/L,检出限为1.98 ng/L。适体传感器用于检测黄曲霉毒素时,不要求BSA与待测物先结合,简化了操作步骤。同时适体的黄曲霉毒素见的亲和力高,其检测的灵敏度和特异性都有明显优势。
3 其他的电化学方法在黄曲霉毒素检测中的应用
目前,绝大多数电化学方法都是基于黄曲霉毒素和生物分子之间的亲和作用力而实现分析的,然而有研究者发现,黄曲霉毒素可以吸附在悬汞电极表面并进行不可逆还原反应,Hajian等[44]使用悬汞电极作为工作电极,吸附溶出伏安法测定AFB1和AFB2,采用伏安扫描,使AFB1和AFB2从阴极溶出,根据溶出电流峰测定其含量。 此外,Rejeb[45]利用黄曲霉毒素抑制乙酰胆碱酯酶的活性的特点,将胆碱氧化酶交联在用普鲁士蓝修饰的丝网印刷电极表面。(图3)乙酰胆碱酯酶(AChE)催化乙酰胆碱水解为乙酸和胆碱,再由胆碱氧化酶(ChOx)氧化胆碱为H2O2,普鲁士蓝还原H2O2,以此来检测黄曲霉毒素。这些方法是建立在黄曲霉毒素自身的生化性质上实现检测的,为丰富黄曲霉毒素的检测手段提供了新思路,但这类方法受待测物质自身的生化性质限制,较难推广到其它分子的检测中。

图3 酶催化增强的黄曲霉毒素检测方法示意图Fig.3 Schematic representation of enzyme labeled system for AFB1determination[45]
4 展望
黄曲霉毒素广泛存在于土壤、动植物中,很容易对花生、玉米、小麦、大豆等粮油产品造成污染,是霉菌毒素中毒性最大、对人类健康危害非常大的一类霉菌毒素。目前,随着传感技术、材料科学、生物技术等现代科学技术的发展,构建电化学传感器检测黄曲霉毒素也逐渐成为研究的热点。与其他较传统的分析方法相比,电化学分析法具有操作简单、成本低、设备便于微型化、易于实现移动检测等诸多优势。在黄曲霉毒素的检测过程中,纳米技术、生物放大技术、催化放大技术的使用对提高检测的灵敏度和准确性有着重要意义。构建更快速、更简便、更灵敏的电化学检测方法以适应实际卫生检测的需要,还有着极大的发展进步空间。
[1]马海华,张元,甄彤,等.电化学生物传感器在黄曲霉毒素检测中的研究进展[J].中国粮油学报,2016,31(2):132-140.
[2]张艺兵,鲍蕾,褚庆华.农产品中真菌毒素的检测分析[M].北京:化学工业出版社,2006.5-7.
[3]Fallah A A.Aflatoxin M-1 contamination in dairy products marketed in Iran during winter and summer[J].Food Control,2010,21(11):1478-1481.
[4]Zhang D, Li P,Yang Y,et al.A high selective immunochromatographic assay for rapid detection of aflatoxin B-1[J].Talanta,201l,85(1):736-742.
[5]Zheng N,Sun P,Wang J Q,et al.Occurrence of aflatoxin M1 in UHT milk and pasteurized milk in China market[J].Food Control,2013,29(1):198-201.
[6]Hussain I,Anwar J.A study on contamination of aflatoxin M-1 in raw milk in the Punjab province of Pakistan[J].Food Control,2008,19(4):393-395.
[7]Wang Y T,Liu X B,Xiao C X,et al.HPLC determination of aflatoxin M-1 in liquid milk and milk powder using solid phase extraction on OASIS HLB[J].Food Control,2012,28(1):131-134.
[8]Xiong J L,Wang S P,Ma M R,et al.Seasonal variation of aflatoxin M-1 in raw milk from the Yangtze River Delta region of China[J].Food Control,2013,34(2):703-706.
[9]Campone L,Piccinelli A L,Celano R,et al.Application of dispersive liquid-liquid microextraction for the determination of allatoxins B1,B2,G1 and G2 in cereal products[J].Journal of Chromatography A,2011,1218(42):48-54.
[10]Khan M R,Alothman Z A,Ghfar A A,et al.Analysis of aflatoxins in nonalcoholic beer using liquid-liquid extraction and ultraperformance LC-MS/MS[J].Journal of Separation Science,2013, 36(3):572-577.
[11]Zaldivar J,Nielsen J,Olsson L.Fuel ethanol production fromlignocellulose:a challenge for metabolic engineering and processintegration[J].Appl Microb Biotech,2001,56:21-31.
[12]Faridah S,lbtisam E T.Detection of Salmonella typhimurium using an Electrochemical lmmunosensor[J].Biosensors and Bioelectmnics,2009,24(8):2630-2636.
[13]Bond L, Juan C V, Duato P,et al.Ochzatuxin A nanostructured electrochemical immunosensors based on polyclonal antibodies and gold nanoparticles coupled to the antigen[J].Analyticel Methods,2010,2:335-341.
[14]Kamal M,Kadir A,Ibtizam E,et al.Development of an electrochemical immunosensor for fumonisins detection in foods[J].Toxins,2010,2:382-398.
[15]刘继超,姜铁民,陈历俊,等.电化学免疫传感器在食品安全检测中的研究进展[J].中国食品添加剂,2011,1:216-222.
[16]Sharma A,Matharu Z,Sumana G,et al.Antibody immobilized cysteamine functionalized-gold nanoparticles for ariatoxin detection[J].Thin Solid Films,2010,3:1213-1218.
[17]Bacher G,Pal S,Kanungo L,et al.A label-free silver wire based impedimetric immunosensor for detection of aflatoxin Ml in milk[J].Sensors and Actuators B:Chemical,2012,168(1):223-230.
[18]Owino J H 0,Ignaszak A, Ahmed A,et al.Modelling of the impedimetric responses of an aflatoxin Bl immunosensor prepared on an electrosynthetic polyaniline platform[J].Analytical and Bioanalytical Chemistry,2007, 388(5):1069-1074.
[19]Raquel A,Villamizar Alicia,Maroto F,et al.Rapid detection of Aspergillus flavus in rice using biofunctionalized carbon nanotube field effect transistors[J].Anal Bioanal che,2011,399(1):119-126.
[20]王瑞鑫,李书国.基于纳米材料构建免疫传感器快速测定粮油食品中的黄曲霉毒素B1[J].中国粮油学报,2016, 29(1): 62-66.
[21]Chandan S,Saurabh S.Carboxylated multiwalled carbon nanotubes based biosensor for aflatoxin detection[J].Sensors and Actuators B:Chemical,2013,185:258-264.
[22]周琳婷,李在均,方银军.石墨烯/导电高分子/离子液体修饰的黄曲霉毒素B1免疫传感器的制备与应用[J].分析化学,2012,11:1635-1641.
[23]Li Z J,Wang Z Y,Sun X L,et al.A sensitive and highly stable electrochemical impedance immunosensor based on theformation of silica gel—ionic liquid biocompatible film onthe glassy carbon electrode for the determination of aflatoxin B1 in bee pollen[J].Talanta,2010,80(5):1632-1637.
[24]Zhou L T,Li R Y,Li Z J, et al.An immunosensor for ultra-graphene/conducting polymer/gold nanoparticles/the ionic liquid composite film on modified gold electrod with electrodeposition[J].Sensors and Actuators B:Chemical,2012,174(1):359-365.
[25]冯甜,张弦,杨弦弦,等.电化学免疫传感器检测样品中黄曲霉毒素B1的误差分析[J].国际检验医学杂志,2014,8:947-951.
[26]Vig A,Radoi A,Mufioz-Berbel X,et al.Impedimetric aflatoxin M1 immunosensor based on colloidal gold and silver electrodeposition[J].Sensors and Actuators B:Chemical,2009,138(1):214-220.
[27]Rameil S,Schubert P,Grundmann P,et a1.Use of 3-(4-hydroxyphenyl)propionic acid as electron donating compound in a potentiometric aflatoxin Ml immunosensor[J].Analytica Chimica Acta,2010,661(2):122-127.
[28]Ah c S,Park C W,Yang J H,et a1.Detection of uncharged or feebly charged small molecules by field—effect transistor biosensors[J].Biosensom and Bioelectronics, 2012, 33(1):233-240.
[29]Piermarini S,Micheli L,Ammida N H S,et al.Electrochemical immunosensor array using a 96-well screenprinted microplate for aflatoxin B1 detection[J].Biosensors and Bioelectronics,2007,22:1434-1440.
[30]张松柏,胡霞,沈广宇,等.电化学适体传感器研究进展[J].化学传感器,2014,34(3):13-21.
[31]Ammida N H S, Micheli L, Piermarini S, et al.Detection of allatoxin Bl in barley:comparative study of immunosensor and HPLC[J].Analytical Letters, 2006, 39(8):1559-1572.
[32]Tan Y, Chu X, Shen G L, et al.A signal-amplified electrochemical mmunosensor for aflatoxin BI determination in rice[J].Analytical Biochemistry, 2009,1:82-86.
[33]Paniel N,Radoi A,Marty J L.Development of an electrochemical biosensor for the detection of aflatoxin M1 in milk[J].Sensors,2010,10(10):9439-9448.
[34]Tang D P, Zhong Z Y,Niessner R.et al.Muhffunctional magnetic bead—based electrochemical immunoassay for the detection of aflatoxin Bl in food[J].Analyst,2009,1349(8):1554-1560.
[35]Song S,Wang L,Li J,et al.Aptamer-based biosensors[J].TrAC Trends in Analytical Chemistry,2008,2:108-117.
[36]Iliuk A B,Hu L H,Tao W A.Aptamer in bioanalytical applications[J].Anal.Chem.,2011,83:4440-4452.
[37]Du Y,Li B L,Wei H,et al.Multifuntional label-free electrochemical biosensors based on an integrated aptamer[J].Anal.Chem.,2008,80:5110-5117.
[38]Lu Y,Li X C,Zhang L M,et al.Aptamer-based electrochemical sensors with aptamer-complementary DNAoligonucleotides as probe[J].Anal.Chem.,2008,80:1883-1890.
[39]Dinekaya E,Kmlk 0,Sezgintiirk M K,et al.Development of an impedimetric aflatoxin Ml biosensor based on a DNA probe and gold nanoparticles[J].Biosensom and Bioelec-tmnics, 2011, 26(9):3806-381l.
[40]Nguyen B H,Yran L D, Do Q P,et al.Label-free detection of aflatoxin M1 with electrochemical Fe3O4/polyaniline-based aptasensor[J].Materials Science and Engineering C,2013.33(4):2229-2234.
[41]Shim W B, Mun H,Joung H A,et al.Chemiluminescence competitive aptamer assay for the detection of aflatoxin B1 in corn samples[J].Food Control,2014,36(1):30-35.
[42]Guo X D,Wen F,Zheng N,et al.Development of an ultrasensitive aptasensor for the detection of aflatoxin Bl[J].Biosensors and Bioelectronics,2014.56:340-344.
[43]Noelia S,Covadonga V,Jéssica G,et al.Specific detection and quantification of Aspergillus flavus and Aspergillus parasiticus inwheat flour by SYBR®Green quantitative PCR[J].International Journal of Food Microbiology,2011,145:121-125.
[44]Hajian R,Ensall A A.Determination of aflatoxins B1 and B2 by adsorptive cathodic stripping vohammetry in groundnut[J].Food Chemistry,2009,115(3): 1034-1037.
[45]Rejeb I B,Arduini F,Arvinte A,et al.Development of a bio-electrochemical assay for AFBl detection in olive oil[J].Biosensors and Bioelectronies, 2009, 24(7): 1962-1968.
The application of electrochemical analytical methods in detection of aflatoxin
Yang Qian,Su Hui-lan*,Luo Huan,Wang Qin,Cen Yao-ying
(The department of public health,ChengDu Medical College,Chengdu 610500,China)
国家自然科学基金(81401757),发育与再生四川省重点实验室项目(SYS16-004),成都医学院科研创新团队(CYTD16-03)
* 通信联系人,共同第一作者,Tel:028-62739576, E-mail:suhuilan1986@163.com
