外源接种黄曲霉污染普洱茶安全性研究
2017-10-19李亚莉邢倩倩涂青周红杰
李亚莉,邢倩倩,涂青,周红杰
云南农业大学普洱茶学院,云南 昆明 650201
外源接种黄曲霉污染普洱茶安全性研究
李亚莉,邢倩倩,涂青,周红杰*
云南农业大学普洱茶学院,云南 昆明 650201
以云南普洱茶为实验材料,外源接种黄曲霉(Aspergillus flavus)菌株于普洱茶原料及成品中,设未接种菌株普洱茶为对照,分别置于室温,湿度80%、温度30℃,湿度90%、温度30℃的恒温恒湿箱条件下存放,在第7天、14天、21天、28天分别取样以LC-MS/MS检测法进行黄曲霉毒素检测。检测结果表明,所有受试茶样中均未检测到黄曲霉毒素B1、B2、G1、G2,检出率为0。说明无论是室温还是在高温高湿条件下,被黄曲霉污染的普洱茶,经存放后,不会产黄曲霉毒素,就这一点而言普洱茶具有较高的饮用安全性。
普洱茶;黄曲霉;黄曲霉毒素;安全性
曲霉毒素(Aflatoxins, AFT)属真菌毒素,是某些黄曲霉菌和寄生曲霉菌所产生的一类次生代谢产物[1],含有一个双呋喃环和氧杂萘邻酮(香豆素),前者为基本毒性结构,后者可能与致癌有关[2-3]。黄曲霉毒素是一种毒性很强的肝毒素,可引起肝脏的急性或慢性损害,除损害机体的肝脏以外,黄曲霉毒素对肾脏等其他多种组织器官也能造成严重损害,更为严重的是,黄曲霉毒素已被证实具有致癌、致畸、致细胞突变的作用[4],被联合国粮农组织和世界卫生组织认定为Ⅰ类致癌物质,严重危害人、畜、禽类健康[5]。
普洱茶是以地理标志保护范围内的云南大叶种晒青茶为原料,并在地理标志保护范围内采用特定的加工工艺制成,具有独特品质特征的茶叶[6]。仓储陈化是普洱茶重要的生产环节,普洱茶“越陈越香”主要是由茶的本质特征、储藏的环境、存放的年限等多种因素决定的。由于普洱茶的发酵和仓储环境存在高温、高湿的特殊性,而黄曲霉毒素的污染主要是由于储存条件不当造成的,如仓储温度高、湿度大、通风透气条件不良等,因此人们对普洱茶是否会受到黄曲霉污染并产生致癌物质存有疑虑。针对这一问题,前人进行了相关研究。
2003年,台湾的孙璐西[7]将黄曲霉接种于云南晒青毛茶,进行模拟普洱茶渥堆试验。试验发现,接种黄曲霉的毛茶中只有灭过菌的A组检出黄曲霉毒素(1.05 μg·kg-1),且其量低于标准,其余B及C组皆未检出黄曲霉毒素。2014年,李亚莉等[8]进行了接种产毒黄曲霉进行模拟普洱茶发酵试验,结果表明,在普洱茶发酵过程中,接种的黄曲霉能在茶叶中生长繁殖,但在发酵终止时,未在茶样中检测出黄曲霉毒素。2011年,徐丹等[9-10]研究了黑曲霉对黄曲霉生长、产毒的抑制作用,发现黑曲霉既能抑制黄曲霉生长、产毒,又能降解AFTB1。陈建玲等[11]抽取了70份湿仓储存普洱茶样本,检测黄曲霉毒素B1、伏马毒素(Fumonisin B1, FB1)、呕吐毒素(脱氧雪腐镰刀菌烯醇, deoxynivalenol, DON)和T-2毒素的浓度,结果表明,湿仓储存普洱茶存在真菌毒素 AFB1及 DON不同程度的污染。
普洱茶质量安全问题已成为普洱茶生产、消费和管理领域的严峻挑战。为了更全面系统地研究普洱茶在仓储过程中是否产生黄曲霉毒素,本文模拟高温高湿的仓储环境,以人工致霉变的普洱茶样和产毒黄曲霉菌株污染的普洱茶茶样为实验对象,分析普洱茶在受黄曲霉污染的情况下是否产毒,为普洱茶生产安全、质量安全及饮用安全提供理论依据。
1 材料与方法
1.1 材料
实验茶样:普洱生茶(紧压茶)、普洱熟茶(紧压茶)、晒青毛茶、普洱熟茶(散茶),来源于云南南涧凤凰沱茶厂。
实验菌株:黄曲霉(A. flavus)菌株,引自云南省微生物研究所。YM 31880,来源于ATCC(美国菌种保藏中心);YM 31882,来源于AS(中国科学院微生物研究所)。两株菌均能产黄曲霉毒素B1、B2、G1、G2。
1.2 试剂及仪器
黄曲霉毒素标准品(纯度 99%,美国Sigma公司),乙腈、甲醇(色谱纯,美国Fisher公司),盐酸(分析纯),MycoSep 228 AflaPat多功能净化柱(配 10 mL样品净化试管,美国Romer公司),0.22 μm有机相微孔滤膜(德国MEMBRANA公司),18.2 MΩ·cm超纯水由赛多利斯超纯水机生产。
洁净工作台(苏州集团苏州安泰空气技术有限公司)、恒温恒湿箱(上海一恒科学仪器有限公司)、架盘药物天平(北京医用天平厂)、LC/MS/MS高效液相色谱串联质谱仪(美国AB公司)、液相色谱仪(日本岛津)、AS系列超声波清洗机(天津奥特赛恩斯仪器有限公司)、高速冷却离心机(上海安亭科学仪器厂)、氮吹仪(美国Organomation公司)、电子天平(德国Sartorius公司)。
1.3 实验方法
1.3.1 菌株活化
将黄曲霉菌株YM 31880、YM 31882接种到PDA培养基斜面上,28℃活化培养5~7 d备用。
1.3.2 孢子悬液的制备与接种
根据两株黄曲霉菌种在PDA斜面上的生长状况,挑选出生长力比较旺盛的菌种进行孢子悬浮液的制备与接种。实验显示YM 31882生长力较YM 31880更强,所以之后的接种便选取YM 31882。取PDA斜面活化的菌种数支,加入适量0.85%的生理盐水,使孢子悬浮于生理盐水中,并用无菌移液管转移至无菌三角瓶中(200 mL),再以血球计数板计数,调整孢子浓度达到106cfu·mL-1,备用。
晒青毛茶、普洱散茶(熟):分别取 40 g晒青毛茶、普洱散茶(熟)放入无菌玻璃瓶中。按5%的接种量接入茶样中,混匀,用三层纱布封口,培养24 h摇瓶1次。YM 31882孢悬液黄曲霉菌数为3.326×107cfu·mL-1,茶样接种YM 31882的量为1.66×105cfu·g-1。
普洱紧压茶(生、熟):紧压茶 100 g小饼,按5%的接种量均匀喷雾接种于茶饼表面,用棉纸包好。YM 31882孢悬液黄曲霉菌数为3.326×107cfu·mL-1,茶样接种YM 31882的量为1.66×105cfu·g-1。
1.3.3 茶样处理
为更系统地研究普洱茶是否产毒,实验模拟黄曲霉适宜的生长环境:(1)湿度80%、温度30℃;(2)湿度90%、温度30℃;(3)室温、常湿。将接种黄曲霉菌株YM 31882的茶样置于相应的恒温恒湿箱中,设未接种普洱茶为对照。第7天、第14天、第21天和第28天取样,检测黄曲霉毒素。试验各处理见表1,每个处理重复3次。
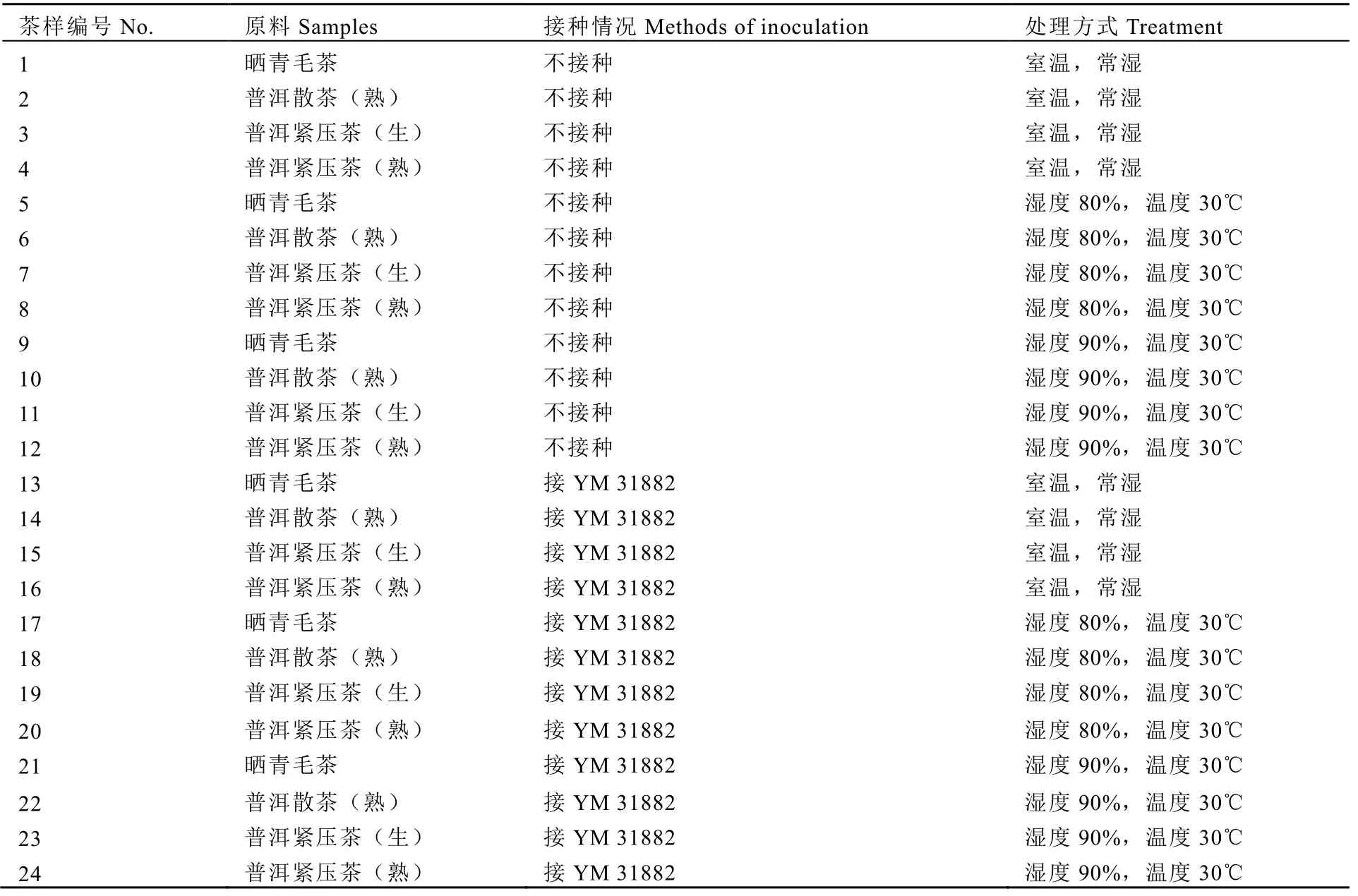
表1 试验处理Table 1 Experimental treatment
1.3.4 黄曲霉毒素检测——LC-MS/MS检测法
(1)提取
取2.0 g混合均匀并捣碎的茶叶末于25 mL具塞比色管中,加入1%盐酸溶液/乙腈(3∶7)提取液15 mL,旋涡混匀后超声30 min,过滤,取滤液备用。
(2)净化
取滤液10 mL于多功能净化柱配套的试管内,缓慢压下多功能净化柱,保持1 mL·min-1的速度,完全压至试管底部,取净化后的提取液5 mL于10 mL的比色管中,在40℃的温度下氮吹至尽干,用1 mL水/甲醇(2∶8)溶液洗涤残渣,振荡混匀,用0.22 μm滤膜针头滤器过滤,滤液待测。
(3)测定
色谱条件:色谱柱为美国 Waters公司Acquity UPLC BEH C18柱(100 mm×2.1 mm,1.7 μm)。流动相A为水,流动相B为甲醇。流动相梯度洗脱条件见表2,进样量为5 μL,柱温40℃。
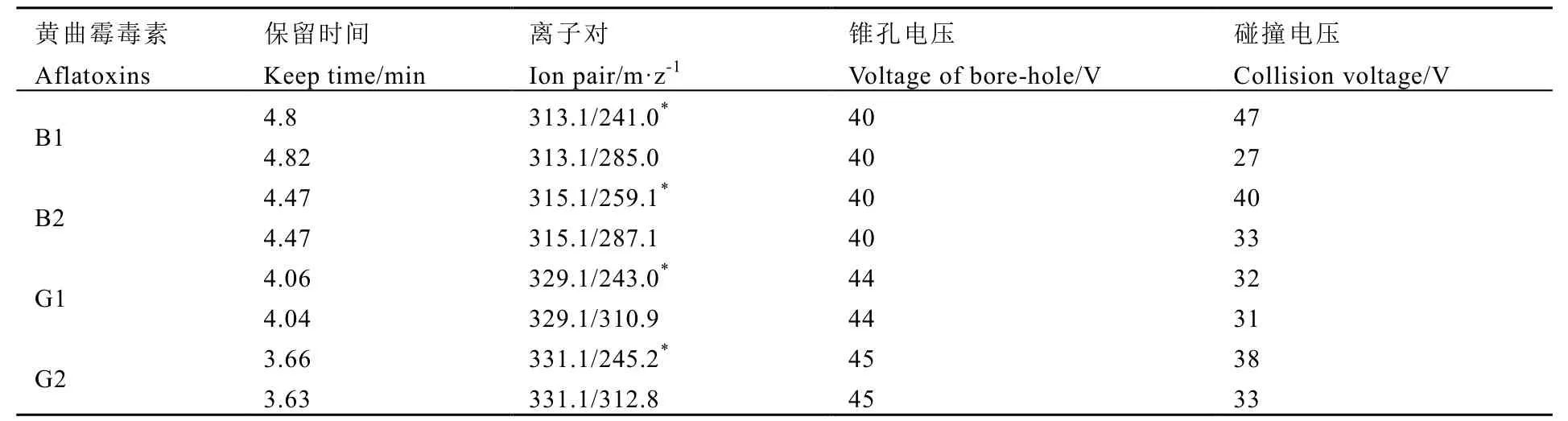
表3 4种黄曲霉毒素的保留时间、定性定量离子对及锥孔电压和碰撞电压Table 3 Test conditions of multiple reactions of 4 kinds of aflatoxins
质谱条件:扫描方式:电喷雾正离子模式(ESI+);检测方式:多反应监测(MRM);喷雾电压:5 500 V;气帘气:30 kPa;碰撞气:55 kPa;脱溶剂温度:600℃;雾化气:10 kPa;辅助气:60 kPa。多反应检测条件见表3。
计算方法:试样中的黄曲霉毒素含量按以下公式进行计算:

式中:X为试样中待测组分含量(μg·kg-1);C为从标准曲线获得的样液中待测组分的质量浓度(ng·mL-1);V为样液最终定容体积(mL);m为称取样品的质量(g)。
检出限与精密度:本方法黄曲霉毒素(G1、G2、B1、B2)测定最低限均为 0.5 μg·kg-1。在重复条件下获得的两次独立测定结果的绝对差值不得超过算术平均值的10%。
2 结果与分析
2.1 两株黄曲霉菌种在PDA斜面上的生长情况
将产毒黄曲霉菌种 YM 31880和 YM 31882接至PDA斜面上,28℃±1℃恒温培养,观察其生长情况,图 1、图 2是菌种在 PDA斜面上生长6 d后的情况。
如图1与图2所示,2株菌株培养6 d后,PDA斜面上,YM 31880菌种生长出的气生菌丝稀少,黑色菌核比较多,菌落呈橘红色,孢子呈黄绿色。YM 31882菌种的气生菌丝生长旺盛,有黑色菌核,菌落呈黄绿色,孢子呈黄绿色。所以,为了使实验更具说服力,在接下来的实验中选取YM 31882菌种。
2.2 未接种与接种后不同阶段茶样中微生物的变化

图1 YM 31882生长6 d斜面Fig. 1 Growth results of YM 31882 fungi on the 6th day

图2 YM 31880生长6 d斜面Fig. 2 Growth results of YM 31880 fungi on the 6th day
将接种黄曲霉菌茶样和未接种茶样按试验设计置于 30℃、相对湿度 80%,30℃、相对湿度90%和室温条件3种环境下存放。其中1~12号茶样未接种黄曲霉菌株,13~24号茶样接种了黄曲霉菌株YM 31882,接种量1.66× 105cfu·g-1,观察不同阶段茶样中微生物数量的变化。
2.2.1 茶样存放7 d菌落计数
接种和未接种茶样存放第 7天的微生物检测结果(表4)表明,1~12号茶样均未检测到黄曲霉。13~24号茶样中均检测到黄曲霉,14、16、23号茶样中黄曲霉数量比接种的黄曲霉略多,其他茶样中黄曲霉的数量较接种的黄曲霉数量略少。
在进行微生物检测实验时,部分茶样中还检测出黑曲霉和青霉,1~12茶样中,1、2、5、6、10号茶样检测出黑曲霉,熟茶(2、6、10号)中检测出的黑曲霉在数量上比晒青毛茶(1号和5号)多。13~24号茶样中,13、14、18、24号茶样中检测出黑曲霉,仅在17号茶样中检测到青霉。
2.2.2 茶样存放14 d菌落计数
茶样存放第14天的微生物检测结果(表4)表明,1~12号茶样中,均未检测出黄曲霉。13~24号茶样中,22、23、24号茶样中未检测到黄曲霉,其他茶样均检测到黄曲霉;在室温(13~16号茶样)条件下,茶样中黄曲霉的数量与第7天相差不大,在相对湿度80%、90%(17~24号茶样)条件下,茶样中黄曲霉数量较第7天茶样中的黄曲霉数量增多。
1~12号茶样中,2、4、5、9、10、11、 12号茶样检测出黑曲霉。室温条件下,存放7 d、14 d茶样中黑曲霉数量变化不大;相对湿度 80%、90%条件下,存放 14 d茶样中黑曲霉在数量上比存放7 d的茶样有所增加。13~24号茶样中,13、14、17、18、21、22、23号茶样中检测出黑曲霉,其余茶样均未检测出黑曲霉。室温条件下,存放7 d与14 d的茶样中黑曲霉数量变化不大;相对湿度80%、90%条件下,存放14 d茶样中黑曲霉数量比存放7 d的茶样有所增加。茶样中青霉比较少。
2.2.3 茶样存放21 d菌落计数
茶样存放第21天的微生物检测结果(表4)表明,1~12号茶样中,5号茶样检测到黄曲霉。13~24茶样中,仅14号和24号茶样中未检测到黄曲霉,其他茶样均检测到黄曲霉;在室温(13~16号)条件下,茶样中黄曲霉的数量相差不大,在相对湿度80%、90%(17~24号)条件下,茶样中黄曲霉数量较第7天、第14天增加,且普洱熟茶(18、20、22、24号)中黄曲霉数量比普洱生茶(19、23)、晒青毛茶(17、21)少。
除18号茶样中未检测到黑曲霉,其他23个茶样中均检测到黑曲霉。
2.2.4 茶样存放28 d菌落计数
茶样存放第28天的微生物检测结果(表4)表明,1~12号茶样中,5、6、10号茶样中检测出黄曲霉;5号茶样中第 28天的黄曲霉数量比 21天有所增加。13~24号茶样中,除18、20、22号茶样中未检测到黄曲霉,其他茶样中均检测到黄曲霉。存放 28 d的部分茶样中黄曲霉数量较存放21 d的茶样有所下降。
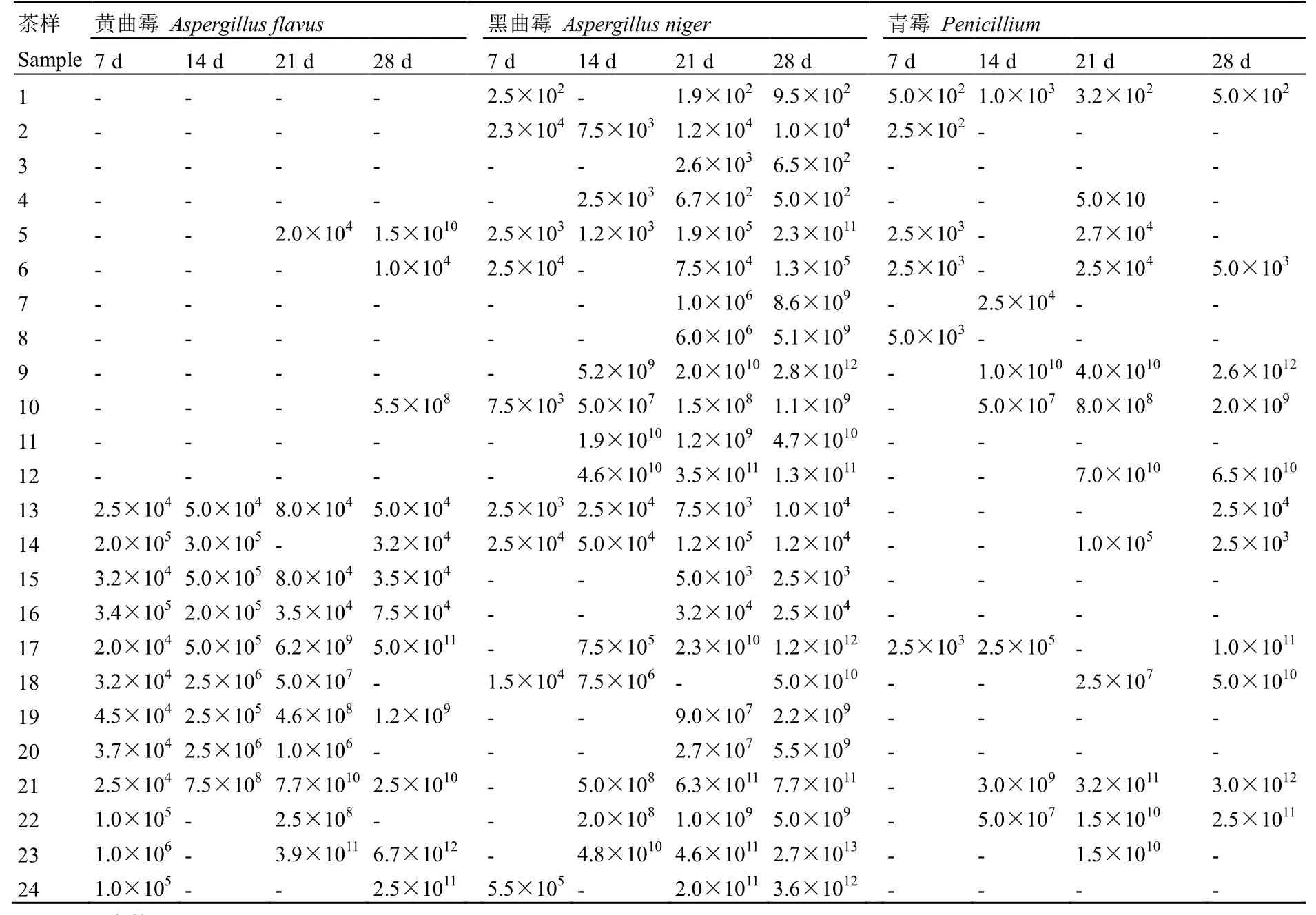
表4 茶样中微生物在不同阶段的数量变化Table 4 The time course changes of microorganisms in tea samples cfu·g-1
2.2.5 存放过程中茶样菌落数量的变化
在存放过程中(7~28 d),茶样中黄曲霉的长势在相对湿度为80%、90%的环境中要比室温条件下好。在室温环境下,茶样中的黄曲霉数量变化波动不大,且室温条件下存放28 d的茶样中黄曲霉数量少于接种的黄曲霉数量,说明室温环境不适合黄曲霉生长,但在相对湿度为80%、90%环境下,从第14天开始茶样中黄曲霉的数量就多于接种量。
在进行微生物检测实验时,部分茶样中还检测出黑曲霉和青霉,1~12号茶样中均检测到黑曲霉。室温(1~4号)条件下,存放7、14、21、28 d的茶样中黑曲霉在数量上变化不大;相对湿度80%、90%(5~12号)条件下,茶样中的黑曲霉数量在存放过程中呈上升趋势。13~24号茶样中均检测到黑曲霉。室温(13~16号茶样)条件下,存放过程中茶样中黑曲霉数量变化不大;相对湿度 80%、90%(17~24号)条件下,存放过程中茶样中黑曲霉数量呈上升趋势。存放28 d时,供试茶样中大部分茶样的黑曲霉数量超过黄曲霉的数量。
茶样中青霉比较少,只有部分茶样检测到青霉,室温条件下,茶样中青霉数量在存放过程中变化不大;相对湿度80%、90%条件下,茶样中青霉数量在存放过程中大致呈上升趋势。
2.3 恒温恒湿箱存放茶样中黄曲霉毒素检测
接种黄曲霉菌株YM 31882的茶样,在室温,相对湿度80%、温度30℃,相对湿度90%、温度30℃的恒温恒湿箱中存放7 d、14 d、21 d、28 d时,均已生长黄曲霉孢子,未接种黄曲霉菌株的茶样也已经霉变。存放7 d时,接种黄曲霉菌株YM 31882的茶样上可看到黄曲霉有所增长,未接种的茶样开始出现霉变。存放14 d时,接种黄曲霉菌株YM 31882的茶样上可看到黄曲霉有所增长,未接种黄曲霉菌株的茶样其霉变程度也较存放7 d时略有增长但总体变化不大。第21天时,接种黄曲霉菌株YM 31882的茶样上可看到黄曲霉布满茶样,未接种黄曲霉菌株的茶样也已经霉变。总体来说,室温条件下第7天和第14天黄曲霉生产情况差异不大;在相对湿度80%、90%(17~24号)条件下,茶样中黄曲霉数量与第 7天、第 14天相比呈上升趋势。存放 28 d时,接种黄曲霉菌株YM 31882的茶样上可以看到黄曲霉孳生布满茶样,未接种黄曲霉菌株的茶样也已经霉变,并且在 28 d左右黄曲霉开始衰老。分别对这几个时间点取茶样进行黄曲霉毒素B1、B2、G1、G2检测,检测结果表明,无论是存放7 d、14 d的茶样,还是21 d、28 d的茶样中均未检测到黄曲霉毒素B1、B2、G1、G2,检出率为0。说明被黄曲霉污染的普洱茶也不会产毒。
2.3.1 存放第7天茶样中黄曲霉毒素检测
黄曲霉产毒高峰在第 5~7天[12],取第 7天茶样采用 LC-MS/MS法进行黄曲霉毒素检测。图3为黄曲霉毒素B1、B2、G1、G2标准溶液色谱图,11、12、23、24号茶样的检测图谱如图4。
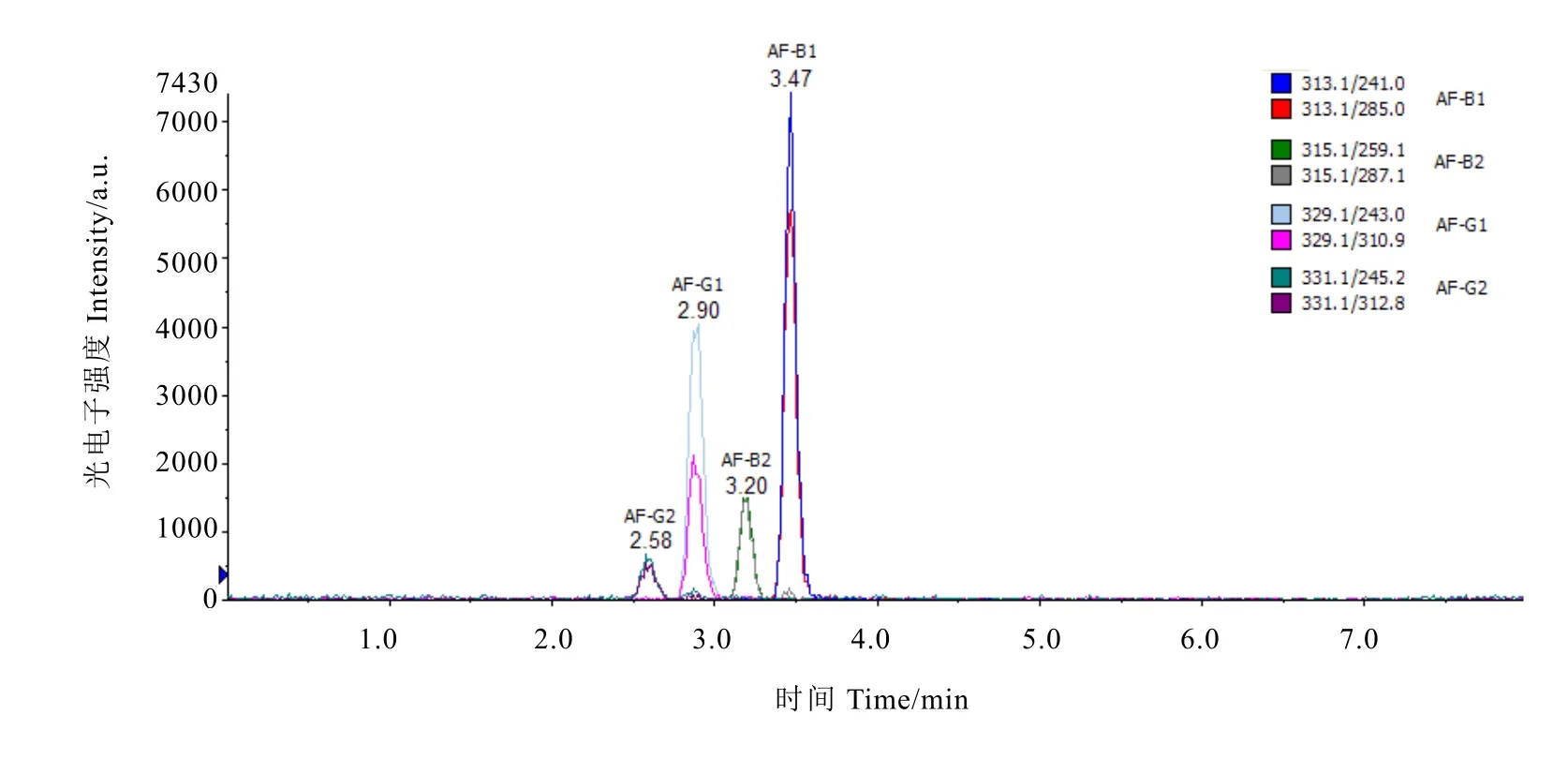
图3 黄曲霉毒素B1、B2、G1、G2标准溶液色谱图Fig. 3 Standard solution chromatograms of aflatoxin B1, B2, G1, G2
由图4与图3对比可以看出,样品在B1、B2、G1、G2对应的出峰时间并未有峰值出现,表明存放7 d的茶样中均未检测到黄曲霉毒素B1、B2、G1、G2,检出率为 0。结果说明,普洱茶被黄曲霉污染并且存放于适合黄曲霉生长产毒的环境中也不会产黄曲霉毒素,普洱茶具有较高的安全性。
2.3.2 存放第28天茶样中黄曲霉毒素检测
实验中观察到存放14 d和21 d时茶样中黄曲霉虽然有增长,但变化不大。而第28天时,黄曲霉开始衰老,第 28天的茶样以LC-MS/MS法进行黄曲霉毒素检测,检测图谱如图5。
由图5与图3对比可以看出,样品在B1、 B2、G1、G2对应的出峰时间并没有峰值出现,表明存放 28 d的茶样中也未检测到黄曲霉毒素B1、B2、G1、G2,检出率为0。上述结果表明,若普洱茶被黄曲霉污染并且存放于适合黄曲霉产毒的高温高湿环境中,黄曲霉虽然能在普洱茶中生长,但随着存放时间的延长,黄曲霉生长呈下降趋势,同时,可能由于普洱茶的抑菌作用,即便霉变和被黄曲霉污染的普洱茶也不会产生对人体有害的黄曲霉毒素。

图4 存放7 d普洱茶样中黄曲霉毒素B1、B2、G1、G2检测图谱Fig. 4 LC-MS/MS analysis of aflatoxin B1, B2, G1, G2 in Pu-erh tea after storaging for 7 d

图5 存放28 d普洱茶样中黄曲霉毒素B1、B2、G1、G2检测图谱Fig. 5 LC-MS/MS analysis of aflatoxin B1, B2, G1, G2 in Pu-erh tea after storaging for 28 d
3 讨论
本实验在普洱茶的仓储过程中添加外源黄曲霉,并置于适宜黄曲霉生长的环境中进行仓储存放,研究普洱茶的安全性,结果显示在各阶段均未检测到黄曲霉毒素。综合分析,可能的原因是在高温高湿的仓储条件下,虽然黄曲霉大量生长,但同时黄曲霉的生长受到了原料茶中微生物(尤其是优势菌种)的竞争抑制作用。有研究表明,黑曲霉是普洱茶发酵过程中的优势菌种[13]。而在普洱茶发酵过程中,黄曲霉和黑曲霉的生长都呈现先迅速增长而后逐渐下降的趋势。黄曲霉在发酵初期的生长态势优于黑曲霉,但到发酵后期,黑曲霉作为优势菌种,其生长强于黄曲霉,说明两者之间存在竞争抑制作用[8]。除此之外,云南大叶种茶中的某些(种)成分对黄曲霉毒素的生物合成具有抑制作用。近年来研究发现,普洱茶具有抗菌抑菌作用,还有研究发现普洱茶中的没食子酸和槲皮素均能抑制黄曲霉菌产生AFB1[14];吴清华[15]、李浩[16]研究发现,红茶、绿茶、普洱生茶、普洱熟茶和花茶的水提物均对黄曲霉产毒有不同程度的抑制作用,但对黄曲霉的生长没有明显的抑制作用。或许茶叶中的某些(种)物质抑制了合成黄曲霉毒素的关键酶,但具体是什么物质目前尚不清楚,有待进一步研究阐明。
普洱茶的仓储陈化是形成其品质的重要环节,但仓储需要适宜的环境条件(温度25℃±3℃,相对湿度≤75%),如温湿度控制不当,如高温高湿条件有利于微生物生长繁殖,有害微生物产生真菌毒素导致茶叶出现霉变现象,因而存在真菌毒素污染的可能。本实验在高温高湿环境下进行,添加外源黄曲霉菌,实验结果并未检测到黄曲霉毒素,说明普洱茶具有较高的安全性。但实验只检测了黄曲霉毒素,对高温高湿条件下是否有其他有毒物质产生还有待进一步研究和验证。
实践经验证明,普洱茶与其他茶相比,特别耐贮藏。它的这种特性表现在经过一定时间贮藏的普洱茶品质会得到提高(后熟作用),随着品质的提高,价值也就得到提升。好的普洱茶具有饮用和收藏的双重功能,即普洱茶除了具有饮料的属性外,它还有收藏的价值。受“普洱茶越陈越香”的影响,众多喜爱普洱茶的人收藏普洱茶,并希望通过仓储提升品质,作为商品可以升值,作为个人消费可以享受陈年普洱的独特陈韵。由此可见,控制仓储条件对形成优质普洱茶尤其重要。
4 结论
(1)接种黄曲霉菌株YM 31882及未接种菌株的晒青毛茶、普洱散茶(熟)、普洱紧压茶(生、熟),分别置于室温,相对湿度80%、温度30℃,相对湿度90%、温度30℃ 3种条件下进行仓储,接种黄曲霉菌株YM 31882的茶样均已生长黄曲霉孢子,未接种黄曲霉菌株的茶样也已经霉变。说明高温高湿条件下仓储普洱茶,会导致普洱茶霉变。
(2)存放第7、14、21、28天的茶样取样进行黄曲霉毒素检测,结果未检测到黄曲霉毒素B1、B2、G1、G2,检出率为0。说明普洱茶即使在室温或者高温高湿仓储条件发生霉变,但也不会产生具有致癌毒性的黄曲霉毒素,在这一点上普洱茶具有较高的饮用安全性。但实验只检测了黄曲霉毒素,对高温高湿条件下是否有其他有毒物质产生还有待进一步研究和验证。
[1]Piekkola S, Tumer P C, Aadel-Hamid M, et al. Characterisation of aflatoxin and deoxynivalenol exposure among pregnant Egyptian women [J]. Food Additives & Contaminants: Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment, 2012, 29(6): 962-971.
[2]孙建和, 陆苹, 顾红香, 等. 真菌毒素的微生物脱毒技术[J]. 微生物学通报, 2003, 30(1): 60-63.
[3]孟昭赫, 张国柱, 宋圃菊, 等. 真菌毒素研究进展[M]. 北京: 人民卫生出版社, 1979: 14-18.
[4]Calvo A M, Wilson R A, Bok J W, et al. Relationship between secondary metabolism and fungal development [J]. Microbiology and Molecular Biology Reviews, 2002, 66(3): 447-459.
[5]刘畅. 益生菌对黄曲霉毒素 B1的吸附作用的研究[D]. 北京: 中国农业科学院, 2010: 13-15.
[6]蔡新, 张理珉,杨善禧, 等. GB/T 22111—2008 地理标志产品 普洱茶[S]. 北京: 中国标准出版社, 2008: 2.
[7]孙璐西. 普洱茶模拟渥堆试验接种黄曲菌之研究[A]. 中国茶叶学会第三届海峡两岸茶叶学术研讨会论文集. 杭州: 中国茶叶学会, 2003: 352-357.
[8]李亚莉, 康冠宏, 杨丽源, 等. 普洱茶发酵过程中外源接种黄曲霉产毒研究[J]. 茶叶科学, 2014, 34(5): 435-441.
[9]徐丹, 石伟力, 宋宏新, 等. 茶多酚对黄曲霉生长及产毒能力的影响[J]. 食品与发酵工业, 2014, 40(12): 20-24.
[10]徐丹, 孙秀兰, 李永仙, 等. 黑曲霉对黄曲霉生长、产毒及黄曲霉毒素 B1的影响[J]. 中国微生态学杂志, 2011, 23(6): 490-494.
[11]陈建玲, 李文学, 杨光宇, 等. 广州某茶叶市场普洱茶中多种生物毒素污染现状调查[J]. 癌变·畸变·突变, 2011, 23(1): 68-71.
[12]许艳丽. 产黄曲霉毒素菌株的检测方法及产毒条件的研究[D]. 青岛: 中国海洋大学, 2008: 19-26.
[13]李浩, 谭英智, 陈柱涛, 等. 云南大叶种晒青毛茶提取物对产毒黄曲霉生长及产毒的影响[J]. 现代食品科技, 2015, 31(11): 101-106.
[14]龚加顺, 周红杰. 云南普洱茶化学[M]. 昆明: 云南科技出版社, 2010: 49.
[15]卢添林, 黄梦姣, 程悦, 等. 普洱茶水提物体外抑菌效果研究[J]. 现代预防医学, 2015, 42(2): 313-315.
[16]吴清华. 茶叶中抑制黄曲霉毒素产生的组分及相关特性研究[D]. 杨凌: 西北农林科技大学, 2013: 19.
[17]李浩. 云南大叶种晒青毛茶提取物对产毒黄曲霉生长及产毒的影响[J]. 现代食品科技, 2015, 3(11): 101-106.
Study on the Safety of Pu-erh Tea Contaminated by Exogenous Aspergillus flavus
LI Yali, XING Qianqian, TU Qing, ZHOU Hongjie*
Pu-erh Tea College, Yunnan Agricultural University, Kunming 650201, China
Yunnan Pu-erh tea was used as experimental material. Aspergillus flavus strains YM31882 were inoculated into Pu-erh tea, and the Pu-erh tea un-inoculated by strains was taken as the control. The storage conditions were (1) temperature 30℃, humidity 90%. (2) temperature 30℃, humidity 90% and (3) room temperature. The tea samples were storage for 7, 14, 21and 28 days respectively and then collected for yellow aspergillus toxin detection by LC-MS / MS. The results showed that none of the aflatoxin B1, B2, G1, G2 was detected in tested samples. indicating that storage process could avoid Aspergillus flavus contamination in Pu-erh tea, In summary, Pu-erh tea is safe to drink in this field.
Pu-erh tea, Aspergillus flavus, aflatoxin, safety
TS272.5+4;Q949.32
A
1000-369X(2017)05-513-10
2017-03-18
2017-05-23
国家自然科学基金项目(31460215)、云岭产业技术领军人才(发改委[2014]1782)
李亚莉,女,博士,副教授,硕士生导师,主要从事普洱茶加工和综合利用研究。*通讯作者:1051195348@qq.com
