高通量测序研究霉变黑毛茶的真菌多样性
2017-10-19胥伟姜依何吴丹赵仁亮朱旗
胥伟,姜依何,吴丹,赵仁亮,朱旗
1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128
高通量测序研究霉变黑毛茶的真菌多样性
胥伟,姜依何,吴丹,赵仁亮,朱旗*
1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2. 国家植物功能成分利用工程技术研究中心,湖南 长沙 410128
为了解高湿条件下霉变黑毛茶的微生物情况,通过人工促霉培养和Illumina Miseq高通量测序技术研究了黑毛茶霉变过程的真菌多样性,并探讨了不同OTU(Operational Taxonomic Unit)阈值划分对真菌多样性生物信息学分析的影响。结果表明,高湿条件下霉变黑毛茶的真菌分类学地位集中于 2门(Ascomycot, Basidiomycota)6属(Aspergillus, Galactomyces, Ogataea, Debaryomyces, Pichia和Cryptococcus),其中曲霉属(Aspergillus)真菌相对丰度值最大,达 98%以上。不同 OTU阈值划分水平导致了同一样本的分类学地位、多样性指数及群落结构组成的分析结果存在差异。相似性0.97水平下的OTU聚类真菌群落Shannon多样性指数为 0.15~0.43,0.99水平下 Shannon多样性指数为 0.28~0.58。曲霉属(Aspergillus)真菌为高湿条件下导致仓储黑毛茶霉变的优势真菌种群。
黑毛茶;霉变;真菌多样性
茶树鲜叶经杀青、揉捻、渥堆、干燥等 工序制得黑毛茶[1],渥堆是其品质形成的关键工序[2],渥堆过程中,受湿热和微生物[3-8]的共同作用,茶叶内含物质发生一系列转化,形成黑毛茶独有的品质特征。由黑毛茶精制而成的黑茶产品因其良好的减肥降脂及促消化功效[9-11]而深受消费者青睐,其年产量不断增加而成为我国第二大茶类[12]。由于黑毛茶采摘较粗老,加工成的黑毛茶需在存放1~2年才进行精制,通过精制和拼配加工成各种黑茶成品。同时,销售后的成品黑茶,民间也有通过存放以改善其粗涩口感的习俗。但在黑毛茶仓储或成品黑茶存放过程中,由于环境条件的变化,特别是在南方的梅雨季节,茶叶表面极易滋生霉菌,轻者有风霉味,重者失去饮用价值,甚至产生饮用安全问题。生产实践中,在高湿条件下,黑毛茶极易因其多孔径特点而吸湿回潮,导致微生物迅速繁殖而引起霉变[13-14]。为了解黑茶霉变的发生规律,在黑毛茶等温吸湿模型建立的基础上[15],人工设定温、湿度环境促进霉菌在黑毛茶上的生长,通过对高湿条件下霉变黑毛茶真菌多样性的研究,为仓储中的黑毛茶安全评估提供依据。
1 材料与方法
1.1 试验材料
湖南内销黑毛茶(2016年 5月产于湖南省桃源县,水分含量:(10.05±0.20)%;DNA抽提试剂盒(OMEGA-soil DNA Kit, Omega Bio-Tek, USA);2% agarose gels(biowest agArose, biowest, Espana);FastPfu Polymerase(FastPfu Polymerase, TransGen, China);AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Axygen, USA);Illumina MiSeq platform(TruSeq™ DNA Sample Prep Kit, Illumina, USA)。
1.2 仪器与设备
GZ-150-HSII恒温恒湿箱,韶关市广智科技设备有限公司;KL300 LED体式显微镜,LEICA; Eppendorf N13462C 移 液 器 , Eppendorf;ABSON MiFly-6小型离心机,合肥艾本森科学仪器有限公司;Eppendorf 5430 R小型离心机,Eppendorf;Eppendorf 5424R高 速 台 式 冷 冻 离 心 机 , Eppendorf;NanoDrop2000超微量分光光度计,Thermo Fisher Scientific;DYY-6C电泳仪,北京市六一仪器厂;ABI GeneAmp® 9700型PCR仪,ABI;Illumina Miseq测序仪,Illumina;Illumina hiseq测序仪,Illumina;BioTek ELx800酶标仪 , Biotek; TBS380 微 型 荧 光 计 ,TurnerBioSystems; Covaris M220, Gene Company Limited;QL-901旋涡混合器,海门其林贝尔仪器制造有限公司;TL-48R粉碎研磨仪,上海万柏生物科技有限公司。
1.3 促霉处理及保存
称取黑毛茶盛于培养皿(培养皿开口,每份培养皿15 g茶样),分5层,每层15份放置于恒温恒湿箱,温度 25℃,相对湿度 RH 90%。人工培养经体式显微镜镜检观察到有霉菌菌丝存在时开始取样,隔48 h取1次样品,共获得培养至第 3、5、7、9、11、13、15 d的样品,分层取样并迅速置于无菌袋中混合均匀密封保存(样品编号分别为:1、2、3、4、5、6、7),-20℃冻存。
1.4 基因组DNA提取
参考葛英亮[16]的方法采用 E.Z.N.A. Soil DNA基因组提取试剂盒进行基因组 DNA的提取,-20℃冻存。电泳检测参数:琼脂糖凝胶1%,电场强度:5 V·cm-1,时间30 min。
1.5 18 S rDNA PCR扩增
参考Wei Zhang[17]的方法进行18 S r DNA PCR扩增,参数调整如下。
反 应 体 系 : 引 物 : SSU0817F: 5'-TTAGCATGGAATAATRRAATAGGA-3', 1196R: 5'-TCTGGACCTGGTGAGTTTCC-3';5×FastPfu Buffer,4 μL;2.5 mmol·L-1dNTPs,2 μL;Forward Primer (5 mmol·L-1),0.8 μL; Reverse Primer (5 μmol·L-1),0.8 μL;FastPfu Polymerase,0.4 μL;BSA,0.2 μL;Template DNA,10 ng;ddH2O补至20 μL。反应参数:95℃变性3 min;以95℃ 30 s,55℃,30 s,72℃,45 s扩增35个循环;72~10℃,10 min。
1.6 Miseq高通量测序
Illumina MiSeq高通量基因测序委托上海美吉生物医药科技有限公司完成。
1.7 测序数据优化与统计
Illumina高通量测序平台测序得到的序列数据,首先根据PE reads之间的overlap关系,将成对的reads拼接(merge)成1条序列,同时对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向。数据去杂方法和参数:过滤read尾部质量值20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于 20,从窗口开始截去后端碱基,过滤质控后50 bp以下的read;根据PE reads之间的overlap关系,将成对reads拼接(merge)成 1条序列,最小 overlap长度为10 bp;拼接序列的overlap区允许的最大错配比率为 0.2,筛选不符合序列;根据序列首尾两端的barcode和引物区分样品,并调整序列方向,barcode允许的错配数为 0,最大引物错配数为2。软件平台:Trimmomatic、FLASH。该工作委托上海美吉生物医药科技有限公司完成。
1.8 物种注释
采用RDP classifier贝叶斯算法[18]分别对97%和99%相似水平的OTU代表序列进行分类学分析[19],并在各个分类学水平统计每个样品的群落组成。软件平台:Qiime[20]。生物信息学分析工作委托上海美吉生物医药科技有限公司完成。
1.9 多样性指数计算
霉变黑毛茶真菌多样性指标:采用 Chao指数和 Ace指数计算菌群丰富度;采用Shannon指数和 Simpson指数计算菌群多样性;采用 Coverage指数计算测序深度。软件平台:mothur version v.1.30.1[21]。
2 结果与分析
2.1 人工促霉培养黑毛茶茶样镜检结果
采用恒温恒湿培养的方法模拟高湿条件下的黑毛茶仓储进行促霉培养,每隔24 h进行1次体式显微观察,培养至72 h时,黑毛茶表面在体式显微镜下可观察到霉菌菌丝,表明高湿条件下霉菌菌丝开始在黑毛茶表面生长。体式显微镜可观察到霉菌菌丝在茶叶表面交织生长,随着培养时间的延长,霉菌菌丝开始特异化形成孢囊梗并产生产孢结构(图1)。
2.2 不同样品优化序列及OTU统计信息
采用Illumina Miseq高通量测序技术检测了黑毛茶霉变过程的真菌种群,通过对真菌18 S区进行测序,设置不同相似度水平值(0.97,0.99)进行归类操作。去除嵌合体和没有重复的单序列,0.97相似水平下7个样品共获得257 471条tags,被归类于7个OTUs(图2)。样品tags数随霉变时间的变化见图3,平均 tags数为 36 782±3 858。0.99相似水平下 7个样品共获得 234 122条 tags,被归类于25个OTUs(图2),样品tags数随霉变时间的变化见图 3,平均 tags数为 33 446 ±3 844。优化后测序数据序列碱基长度401~420 bp的序列达262 107条,约占总序列的99.91%。
2.3 霉变黑毛茶的OTU及分类学地位统计
将通过Illumina Miseq高通量测序所得的序列优化后比对至OTU代表序列,生成OTU表格,优选 OTU 序列检索数据库https://unite.ut.ee/index.php进行分类学地位统计,分类学地位对比情况见表1。

图1 高湿条件下不同培养时间的黑毛茶体式显微镜检图Fig. 1 The Stereomicroscope examination of raw dark tea under high humidity during different culture times
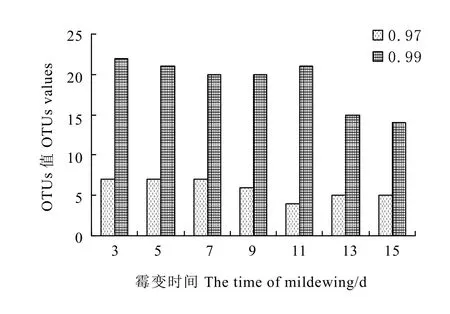
图2 不同相似水平下不同霉变时间的OTUs值Fig. 2 The OTUs of different mildew time under different similarity levels

图3 不同霉变时间样品的Tags值Fig. 3 The tags of different mildew times
基于不同相似水平(0.97, 0.99)进行归类操作形成的OTU单元存在较大差别,相似水平提高后获得的总OTU值减少,但OTU种类数增加至3倍左右,有利于真菌种群的分析及多样性计算。Illumina Miseq高通量测序技术基于 18 S rDNA测序数据检索数据库得出分类学地位及多样性指数,目前普遍认为该方法在 0.97的相似水平下得出的属水平分类学地位较可靠[16,22-24]。从霉变过程取得的7个黑毛茶样品真菌种群变化不大,基于 0.97相似水平得出的属水平分类学地位有:曲霉属(Aspergillus)、地霉属(Galactomyces)、毕赤酵母属(Pichia)、隐球菌属(Cryptococcus)、德巴利酵母属(Debaryomyces);基于0.99相似水平得出的属水平分类学地位有:曲霉属(Aspergillus)、甲醇诱导型酵母属(Ogataea)、毕赤酵母属(Pichia)、地霉属(Galactomyces)、隐球菌属(Cryptococcus)、德巴利酵母属(Debaryomyces)。对比可发现提高相似水平值后新增加了甲醇诱导型酵母属(Ogataea)真菌。原因在于此属物种序列与 0.97水平下注释出的真菌种群中某个属的序列水平相似度很高,不能被区分。黑毛茶的霉变过程真菌种群变化不大,并表现出越往后期种群数量越单一的规律,这可能与本研究设置的霉变条件有较大关系,该霉变条件下某类真菌较优的适应了该环境而得到生长繁殖,在与其他物种竞争过程中取得了优势。

表1 霉变黑毛茶的真菌多样性分类学地位统计Table 1 Taxonomic status of the fungi diversity in mildew dark tea
2.4 霉变黑毛茶的Alpha多样性指数
通过Alpha多样性指数可以反映各样品之间微生物群落的丰度和多样性指数的差异。Alpha 多样性指数的计算要求测序深度能够覆盖整个微生物群落。物种观测稀释性曲线[25]表明,观测到OTU数量随着随机抽取的测序数量的增加而逐渐呈现水平趋势(图4),表明测序数据量合理,其数据可以反映样本真实多样性情况。基于不同相似水平(0.97, 0.99)形成的归类操作单元进行多样性指数计算统计数据见表2。
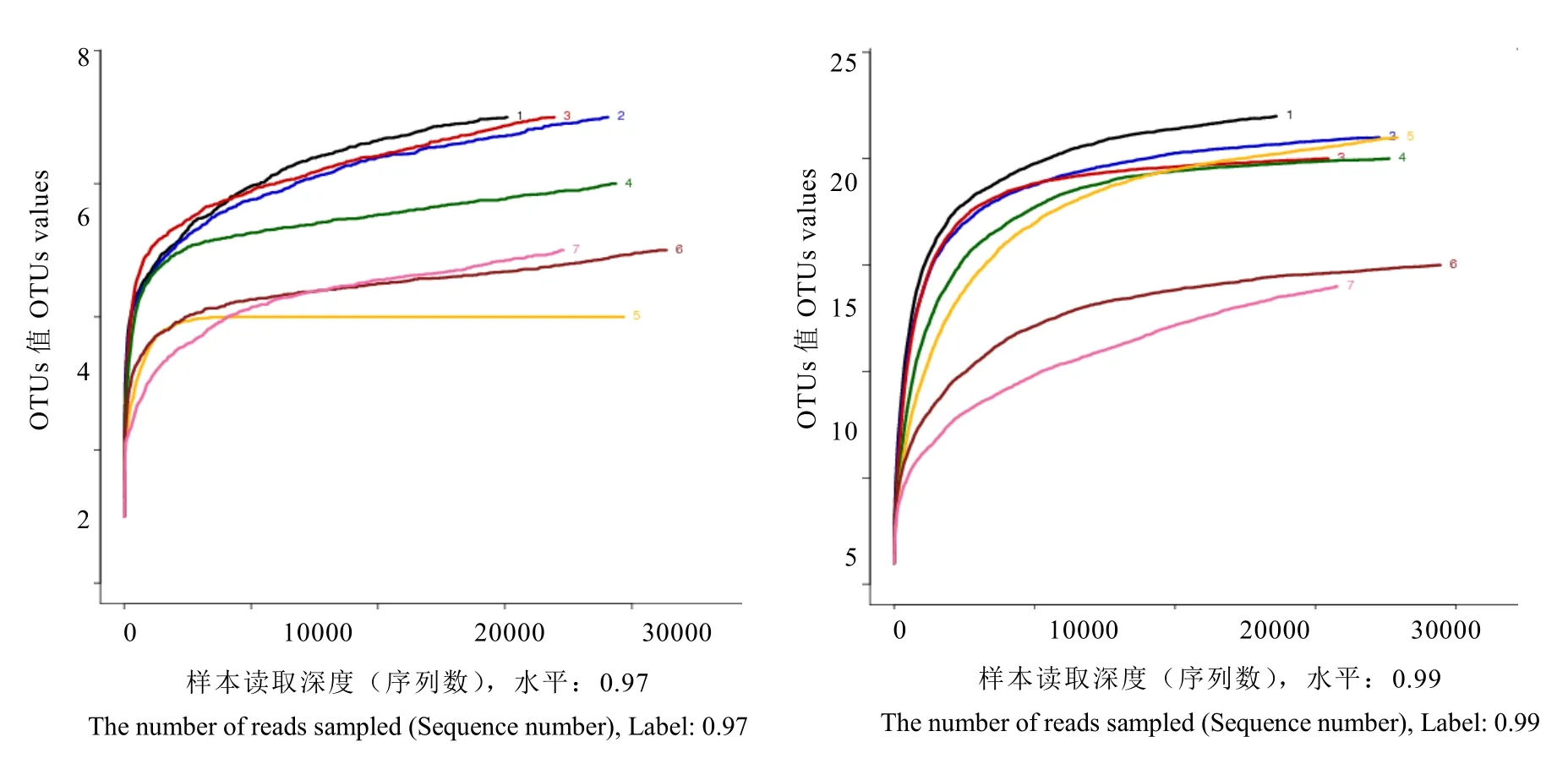
图4 不同相似水平下观测指数稀释性曲线Fig. 4 The morphology microscopic observations of raw dark tea under different similarity levels

表2 霉变黑毛茶真菌群落Alpha多样性指数Table 2 Alpha community diversity index of gungus in mildew dark tea
Alpha多样性分析检验用来估计样品微生物群落的物种丰富度和多样性,包括 Ace、Chao、Coverage、Shannon、Simpson等统计学分析指数。Coverage值均高达0.999以上,表明本次测序对样品中真菌的覆盖率很高,证明选择测序深度适合,可以满足样品中真菌多样性分析的需要;Ace指数和Chao指数反应出霉变过程真菌群落丰富度较低,Shannon指数和 Simpson指数则表明黑毛茶霉变过程真菌多样性程度较低;同时提高相似水平值后的Ace指数和Chao指数均有所提高,Shannon指数有所提高,Simpson指数有所降低。相似水平提高后进行归类操作形成的 OTU统计分析得出的Alpha值与理论值相吻合。多样性指数的统计结果与分类学地位的统计数据相匹配,表明黑毛茶在高湿条件下的霉变过程中真菌种群丰度和多样性指数都有所降低,可为黑茶的霉变防范、预测及安全评价提供相关依据。
2.5 霉变黑毛茶的真菌群落组成分析
基于不同相似水平(0.97,0.99)形成的归类操作单元进行群落组成分析、真菌群落相关性分析及样本间相关性分析,具体统计见群落组成图(图5)、群落Heatmap图(图6),真菌群落组成分析统计数据见表3(可注释分类学地位)及表4(未注释出分类学地位)。

图5 基于属水平霉变黑毛茶不同相似水平真菌群落结构Fig. 5 Genus-level community structure of fungus in mildew raw dark tea based on different similar levels

图6 基于属水平霉变黑毛茶不同相似水平真菌群落Heatmap图Fig. 6 Genus-level community heatmap of fungus in mildew raw dark tea based on different similar levels
不同相似度水平下的注释结果均表明霉变过程的黑毛茶样品真菌种群主要为曲霉属(Aspergillus)真菌,占比达98%以上,其次为德巴利酵母属(Debaryomyces)真菌(表3)。0.99相似度水平的物种注释结果较 0.97水平下丰富(表3),新增甲醇诱导型酵母属(Ogataea)(表3)真菌注释结果及未能清晰注释的 Ascomycota unclassified、Eurotiales unclassified和Trichocomaceae unclassified(表4)等3个属的真菌。从研究材料考虑,黑毛茶霉变过程以占绝对优势的曲霉属(Aspergillus)真菌所表征,清晰阐述该属真菌的具体种类及生物学特性是黑茶仓储及安全评价亟待解决的问题。从研究方法考虑,基于0.97的相似度水平对于真菌18 S条带的物种注释存在一定的局限性,18 S r DNA为高度保守序列,在进化过程中变异程度低,较难区分注释亲缘关系较近的真菌种群分类学地位。

表3 霉变黑毛茶的真菌群落组成(可注释)Table 3 The fungal community composition in mildew dark tea (can be noted)

表4 霉变黑毛茶的真菌群落组成(未能注释)Table 4 The fungal community composition in mildew dark tea (can not be noted)
黑毛茶霉变过程真菌多样性及丰度变化见Heatmap图(图6),横轴样品为不同霉变时间的黑毛茶样品,纵轴显示各属真菌种类,不同颜色表示各属真菌在样品中的丰度,图上方进化树表明样品间的相似程度:0.99相似度水平下的进化树聚类分析结果更能还原实际样本情况,1号样品为一类,2、3、4、5、6、7号样品为一类,表明相似度水平越高,样本间聚类分析结果更科学。该进化树聚类分析表明黑毛茶霉变初期(1~3 d)真菌种群变化迅速,第5天开始种群多样性变化速度减缓,多样性呈逐渐下降趋势,至第15天时最低,这与Alpha多样性指数结果相一致。该结果表明随着霉变时间的延长,适宜室温高湿条件下的曲霉属(Aspergillus)真菌得到生长繁殖,其他类真菌种群生长受到相对抑制。图左侧进化树将曲霉属(Aspergillus)真菌聚为一类,并与其他类真菌有较远的遗传距离,在霉变进程中属于绝对优势真菌种群。在所检样品中,许多丰度极低的酵母属真菌种群亦被检出,表明高通量测序技术能检测出样本中含量极微的真菌种群信息,对分析种群多样性有着传统分析方法无法比拟的优越性。
3 讨论
黑茶微生物学的研究多基于微生物与其品质形成机理的相互关系开展微生物的种群鉴定及功能注释等方面的研究[3-7],但鲜见黑茶生霉劣变过程中的真菌种群多样性分析及物种注释。采用高通量测序技术直接从样本中提取微生物基因组总DNA,并对18 S条带进行特异性扩增,解决了不可培养及低丰度真菌在传统方法中无法检出的局限。如形态学鉴定法对贮藏期的黑茶样本进行研究仅发现黑曲霉(Aspergillus niger)、灰绿曲霉(Aspergillus glaucus)、 产 黄 青 霉 ( Penicillium chrysogenum)、根霉属(Rhizopus spp.)、木霉属(Trichoderma spp.)、酵母(分类学地位未知)等真菌种群[26-28]。本方法基于Miseq平台测序技术,研究了高湿条件下黑茶霉变的主要真菌种群结构和多样性特性,不仅了解了黑毛茶霉变过程中主要真菌种群为曲霉属(Aspergillus),而且解析出其丰度值高达98%以上,同时低丰度的甲醇诱导型酵母属(Ogataea)、毕赤酵母属(Pichia)、地霉属(Galactomyces)、隐球菌属(Cryptococcus)、德巴利酵母属(Debaryomyces)等真菌亦有检出,这与Abe M等[3]和Xu A等[5]采用DGGE技术鉴定贮藏期茯砖茶和普洱茶的结果较一致,但更加全面地揭示出低丰度地霉属(Galactomyces)、甲醇诱导型酵母属(Ogataea)、隐球菌属(Cryptococcus)等真菌种群,表明该研究方法具有传统鉴定法无法比拟的优势,这与陈庆金等[29]的观点一致。
基于0.97的相似度水平下多样性 Shannon指数为 0.15~0.43,Simpson 指数 0.7449~0.9492;基于 0.99的相似度水平下多样性Shannon指数为0.28~0.58,Simpson指数0.7007~0.9032,该结果表明曲霉属(Aspergillus)真菌是黑毛茶霉变过程中霉菌的优势菌群。陈建玲等[30]曾报道了普洱茶在高湿条件下的真菌毒素含量,从食品安全的角度而言,我们需要防范高湿条件下曲霉属真菌可能产生的真菌毒素给消费者带来的安全隐患。高湿条件下,曲霉属真菌代谢繁殖,使之成为黑毛茶霉变过程的绝对优势真菌种群,并随着霉变程度的增加使之在真菌菌群多样性结构中的丰度进一步加大。而黑毛茶霉变过程中霉菌的具体种名及丰度动态变化需要进一步研究。
需要留意的是,从我们已进行的感官审评和传统形态分类学方面的鉴定工作来看,人工促霉的黑茶样本和存放环境不当所导致的黑毛茶自然霉变样本真菌种群存在差异,考虑霉变真菌种群受到样本所处环境中的微生物菌群、环境基质及外界条件等共同影响,该部分内容将在以后的工作中进行系统研究。
基于高通量测序结果的物种注释在 OTU阈值划分时需要留意,不同的OTU阈值划分对物种的分类学结果及多样性指数会带来一定的影响,特别是对丰度低的物种和样本间聚类分析进行研究时建议提高相似度水平,有利于同源性高的物种和丰度低的物种注释出分类学结果,也有利于样本间相似度分析时的结果更科学。
[1]齐桂年, 田鸿, 刘爱玲, 等. 四川黑茶品质化学成分的研究[J]. 茶叶科学, 2004, 24(4): 266-269.
[2]安徽农学院. 制茶学[M]. 北京: 中国农业出版社, 1999: 227-230.
[3]Abe M, Takaoka N, Idemoto Y, et al. Characteristic fungi observed in the fermentation process for Puer tea [J]. International Journal of Food Microbiology, 2008, 124(2): 199-203.
[4]Lyu C, Chen C, Ge F, et al. A preliminary metagenomic study of puer tea during pile fermentation [J]. Journal of the Science of Food and Agriculture, 2013, 93(13): 3165-3174.
[5]Xu A, Wang Y, Wen J, et al. Fungal community associated with fermentation and storage of Fuzhuan brick-tea [J]. International Journal of Food Microbiology, 2011, 146(1): 14-22.
[6]Zhao M, Xiao W, Ma Y, et al. Structure and dynamics of the bacterial communities in fermentation of the traditional Chinese post-fermented pu-erh tea revealed by 16S rRNA gene clone library [J]. World Journal of Microbiology & Biotechnology, 2013, 29(10): 1877-1884.
[7]Zhao M, Zhang DL, Su XQ, et al. An integrated metagenomics/metaproteomics investigation of the microbial communities and enzymes in solid-state fermentation of Pu-erh tea [J]. Scientific Reports, 2015(5): 1-10.
[8]陈栋, 李晶晶, 方祥, 等. 广东陈香茶后发酵过程中主要微生物种群和酶类活性变化的研究[J]. 茶叶科学, 2010, 30(6): 429-434.
[9]吴香兰, 刘仲华, 曹丹, 等. 茯砖茶对小鼠肠道免疫功能调节作用的研究[J]. 茶叶科学, 2013, 33(2): 125-130.
[10]任洪涛, 周斌, 秦太峰, 等. 普洱茶挥发性成分抗氧化活性研究[J]. 茶叶科学, 2014, 34(3): 213-220.
[11]滕翠琴, 刘仲华, 龚受基, 等. 六堡茶对胰岛素抵抗3T3-L1脂肪细胞糖脂代谢的影响[J]. 茶叶科学, 2014, 34(3): 230-238.
[12]梅宇, 王智超, 林璇. 2015年中国茶叶产销形势分析[J]. 茶世界, 2015(4): 21-30.
[13]HAAS D, PFEIFER B, Reiterich C, et al. Identification and quantification of fungi and mycotoxins from Pu-erh tea [J]. International Journal of Food Microbiology, 2013, 166(2): 316-322.
[14]MO HZ, ZHANG H, WU QH, et al. Inhibitory effects of tea extract on aflatoxin production by Aspergillus flavus [J]. Letters in Applied Microbiology, 2013, 56(6): 462-466.
[15]胥伟, 赵仁亮, 姜依何, 等. 湖南黑毛茶等温吸湿模型建立及霉变安全性研究[J/OL]. 食品科学. http://www.cnki.net/ kcms/detail/11. 2206. TS.20170303. 1431.086.html.
[16]葛英亮, 于水利, 时文歆, 等. 应用Illumina MiSeq高通量测序技术解析O3-BAC饮用水处理过程细菌多样性变化[J].食品科学, 2016, 37(16): 223-228.
[17]Wei Zhang, Ruijuan Yang, Wenjun Fang, et al. Characterization of thermophilic fungal community associated with pile fermentation of Pu-erh tea [J]. International Journal of Food Microbiology, 2016, 227: 29-33.
[18]WANG Q, GARRITY G M, TIEDJE J M, et al. Naive bayesian classifier for rapid assignment of rrna sequences into the new bacterial taxonomy [J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267.
[19]Urmas Kõ ljalg, R Henrik Nilsson, Kessy Abarenkov, et al. Towards a unified paradigm for sequence-based identification of fungi [J]. Molecular Ecology, 2013, 22: 5271-5277.
[20]Caporaso JG, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data [J]. Nature Methods, 2010, 7(5): 335-336.
[21]Schloss PD, Gevers D, Westcott SL. Reducing the effects of PCR amplification and sequencing artifacts on 16S rRNA-based studies [J]. PLoS ONE, 2011, 6(12): e27310.
[22]谢萍, 徐明生, 尹仲平, 等. Miseq测序研究散装酱卤鸭肉贮藏期间微生物群落多样性[J]. 现代食品科技, 2015, 31(11): 120-126, 106.
[23]徐帅, 林奕岑, 周梦佳, 等. 基于高通量测定肉鸡回肠微生物多样性及PICRUSt基因预测分析[J]. 动物营养学报, 2016, 28(8): 2581-2588.
[24]曹碧璇, 胡滨, 刘爱平. 利用16S rRNA基因克隆文库分析东北自然发酵酸菜中细菌多样性[J]. 食品与发酵工业, 2015, 41(11): 76-80.
[25]Katherine R Amato, Carl J Yeoman, Angela Kent, et al. Habitat degradation impacts black howler monkey (Alouatta pigra) gastrointestinal microbiomes [J]. The ISME Journal, 2013, 7(7): 1344-1353.
[26]彭喜春, 于淼. 一款 10年陈熟普洱茶中可培养微生物的分离鉴定[J]. 食品科学, 2011, 32(15): 196-199.
[27]方祥, 陈栋, 李晶晶, 等. 普洱茶不同贮藏时期微生物种群的鉴定[J]. 现代食品科技, 2008, 24(2): 105-108, 160.
[28]钟涛, 齐桂年, 胥伟, 等. 藏茶贮存过程中真菌种群的鉴定[J]. 贵州农业科学, 2010, 38(10): 101-103, 106.
[29]陈庆金, 黄丽, 滕建文, 等. 基于 Miseq测序分析六堡茶陈化初期真菌多样性[J]. 食品科技, 2015, 40(8): 67-71.
[30]陈建玲, 李文学, 杨光宇, 等. 广州某茶叶市场普洱茶中多种生物毒素污染现状调查[J]. 癌变畸变突变, 2011, 23(1): 68-71.
RNA Sequencing Analysis of Fungi Community Diversity in Mildew Raw Dark Tea
XU Wei, JIANG Yihe, WU Dan, ZHAO Renliang, ZHU Qi*
1. Key Laboratory of Tea Science of Ministry of Education, Hunan Agriculture University, Changsha 410128, China; 2. National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China
In order to understand the feature of microbe in the mildew dark tea under high humidity conditions, Illumina Miseq high-throughput sequencing was performed to study fungi diversity by artificial culture of certain fungi. The influence of the OTU (Operational Taxonomic Unit) threshold on the bioinformatic analysis results of fungal diversity was also discussed. The results showed that the mildew dark tea fungus under high humidity conditions were mainly classified into 2 phylum (Ascomycota, Basidiomycota) and 6 genera (Aspergillus, Galactomyces, Ogataea, Debaryomyces, Pichia and Cryptococcus), with the highest abundance value of Aspergillus (>98%). The different OTU thresholds resulted in the difference in the taxonomic status, diversity index and community structure in the same sample. The Shannon diversity index of OTU under the 0.97 was 0.15-0.43, and the Shannon diversity index under 0.99 was 0.28-0.58. Under high moisture conditions aspergillus was the major fungi causing dark tea mildew in storage.
raw dark tea, mildew, fungi community diversity
TS272.5+4;Q949.32
A
1000-369X(2017)05-483-10
2017-02-28
2017-05-04
国家自然科学基金(31571802)、湖南省教育厅重点项目(14A066)、湖南省研究生科研创新项目(CX2016B283)
胥伟,男,博士研究生,主要从事茶叶加工及功能成分化学研究。*通讯作者:1965994459@qq.com
