茶树磷转运蛋白基因CsPT4的克隆、亚细胞定位及表达分析
2017-10-19辛华洪王伟东王明乐马青平甘玉迪黎星辉
辛华洪,王伟东,王明乐,马青平,甘玉迪,黎星辉
南京农业大学茶叶科学研究所,江苏 南京 210095
茶树磷转运蛋白基因CsPT4的克隆、亚细胞定位及表达分析
辛华洪,王伟东,王明乐,马青平,甘玉迪,黎星辉*
南京农业大学茶叶科学研究所,江苏 南京 210095
茶园中磷肥的利用效率取决于茶树体内与磷元素吸收、转运及生理利用等相关蛋白的协同调控,而磷转运蛋白(Phosphate transporter proteins,Phts)在此过程中起着关键的调控作用。本研究以茶树品种龙井长叶(Camellia sinensis cv. Longjing-changye)为试验材料,采用同源克隆的方法首次克隆获得茶树磷转运蛋白编码基因CsPht1:4(CsPT4)的全长cDNA。该基因全长1 642 bp,开放阅读框(ORF)1 620 bp(GenBank登录号:KY132100),编码539个氨基酸。生物信息学分析显示,CsPT4基因编码蛋白分子量为59.12 kD,理论等电点(pI)为8.51;具有典型的 Pht1家族特性:“6-亲水-6”跨膜结构。亚细胞定位结果显示,该蛋白分布于质膜上,与Softberry软件预测结果一致。荧光定量PCR表明:CsPT4在正常生长的茶树根、茎、嫩叶、老叶中均有表达,在老叶中的表达量较高,在根部表达量最低。低磷处理,根和叶中 CsPT4上调表达水平均先上升后下降;根部CsPT4表达量48 h内各个时间点均高于叶部。缺磷处理,根和叶中CsPT4上调表达水平均升高;根部和叶部分别在72 h和48 h达最大值。本研究为茶树响应低磷的分子机制提供了参考。
茶树;磷转运蛋白;基因克隆;亚细胞定位;表达分析
磷是植物生长发育所必需的元素之一,是ATP、磷脂和核酸等许多代谢物和大分子的重要组分,同时又参与植物体内多种生物化学途径,如基因表达、信号转导等[1-2]。然而磷在土壤中极易被吸附和固定,使得土壤中有效磷的浓度很低而难以满足植物的吸收利用,因而土壤中有效磷缺乏成为限制作物产量的重要因素[3-4]。研究表明,植物对磷吸收、转运是一个逆浓度梯度的主动运输过程,这一过程主要依靠磷转运蛋白来实现[3,5]。植物磷转运蛋白根据其功能特征分为Pht1、Pht2、Pht3、Pho1和Pho2五大家族,其中Pht1家族主要成员在植物根系细胞膜中负责磷酸根的吸收、转运,其表达受磷调控[6-8],因此Pht1家族成为研究的热点,也是研究得最为深入的植物磷转运蛋白家族。近年利用 Pht1家族的保守性,分别从烟草[9-10]、拟南芥[11-12]、水稻[13-14]、大麦[3]、玉米[4]、油菜[15]、大豆[16]、菊花[17]、油茶[18-19]等植物中克隆到多个属于 Pht1家族的磷转运蛋白基因。
茶树[Camellia sinensis (L.) O. Kuntze]主要种植于湿润、半湿润的热带、亚热带和温带的酸性土壤中,茶园缺磷的现象普遍存在,为了提高茶叶产量和质量,每年不得不施入大量的磷肥[20-21]。缺磷导致茶叶水浸出物、茶多酚、类黄酮、总游离氨基酸、茶氨酸等内含成分含量下降,从而降低了茶叶品质[22]。目前茶树磷的研究比较广泛,但关于茶树应答低磷胁迫的研究比较少。迄今关于茶树磷吸收、转运的研究尚未见报道。研究茶树Pht1基因对探索茶树磷胁迫分子响应机制及提高磷利用效率具有重要意义。本研究以龙井长叶两年生水培苗为试材,通过对茶树磷酸转运蛋白 Pht1家族基因 CsPht1:4(以下简称CsPT4)的分离克隆、亚细胞定位和该基因在根系中表达情况进行分析,为探索茶树磷胁迫分子响应机制、磷高效种质资源筛选,以及分子育种提供参考资料。
1 材料与方法
1.1 植物材料、菌种与试剂
2015年9 月至2016年3月,以茶树品种龙井长叶(Camellia sinensis cv. Longjing changye)为试验材料。于2015年9月15日取正常生长的茶树的根、茎、老叶、嫩叶、芽。低磷、缺磷处理前选取长势一致的茶苗于光照培养箱中(昼夜温度25℃/22℃,光周期12 h昼/12 h夜,光照强度 240 μmol·m-2·s-1,相对湿度 75%~80%)进行预培养至长出新根,完全营养液的配方组分参考 Wan等[23],包括大量元素 NH4+-N 0.75 mmol·L-1、NO3-N 0.25 mmol·L-1、K 0.35 mmol·L-1、P 0.05 mmol·L-1、Ca 0.395 mmol·L-1、Mg 0.21 mmol·L-1、Al 0.25 mmol·L-1和微量元素Mo 0.17 μmol·L-1、B 3.33 μmol·L-1、Fe 2.10 μmol·L-1、Mn 0.5 μmol·L-1、Cu 0.13 μmol·L-1、Zn 0.51 μmol·L-1。根据前期预实验和模拟土壤有效磷浓度 1~2 μmol·L-1[24-25]在2016年1月10日对水培茶苗进行正常磷(50 μmol·L-1)、低磷(1 μmol·L-1)、缺磷处理,并分别于0、6、12、24、48、72 h取新长出的根、老根和当年生第一成熟叶片。所采样品立即投入液氮,-80℃保存备用。取处理3个月后的根(新根、老根)、茎、叶用于测定总磷浓度。
亚细胞定位载体pJIT166-GFP和大肠杆菌(Escherichia coli)菌株DH5α由本实验室保存;rTaq聚合酶、pMD®-T5 Zero Cloning Vector、pMD®19-T Vector、dNTPs、DL2000 M arker、HindⅢ酶、XbaⅠ酶、荧光定量染料SYBR®GreenⅠ、T4 DNA连接酶、TdT、dCTP、RNA酶抑制剂、Reverse Transcriptase M-MLV(RNase H-)等均购自TaKaRa公司;pMD®-T5 Zero Cloning Vector、Blunt simple Vector、Trans-T1感受态细胞购于南京百斯凯科技有限公司;多糖多酚RNA提取试剂盒购自北京华越洋生物,E. Z. N. A.TM Gel Extraction Kit D2500-02、Plasm id M ini Kit II购自OMEGA。所有引物委托南京金斯瑞生物科技有限公司合成。其编号及序列见表1。

表1 基因克隆和定量PCR引物Table 1 Primers used for cloning and RT-PCR of CsPT4
1.2 磷浓度测定
样品于75℃烘干至恒重,磷含量测定参照电感耦合等离子体原子发射光谱(ICP-AES)[26]。试验数据采用SPSS 17.0进行统计处理,利用Duncan’s新复极差法做显著性分析(P<0.05)。
1.3 总RNA的提取和cDNA的合成
取保存实验材料,用多糖多酚RNA提取试剂盒提取总RNA,利用1.0%琼脂糖凝胶电泳检测总 RNA的完整性后,用 Agilent 2100 Bioanalyzer(Agilent, USA)检测总RNA的质量,用NanoD rop ND-1000 spectrophotometer(NanoDrop, Wilm ington, DE)检测总RNA的浓度。根据Reverse Transcriptase M-MLV(RNase H-)试剂盒反转录成cDNA。
1.4 茶树CsPT4基因克隆
根据已在NCBI公布的油茶(GenBank: AHL44892.1);大豆(GenBank: AEA 76640.1)、菊花(GenBank:AGK29560.1)、胡萝卜( GenBank:XP_017224754.1)、 拟 南 芥(GenBank:NM_001203533.1)、毛果杨(GenBank:XM_002312553.2)、 玉 米(GenBank: NM_001111799.1)磷转运蛋白氨基酸序列中的保守区,利用Primer Prem ier 5.0软件设计简并引物PT4-Degenerate primer-F和PT4-Degenerate primer-R。以cDNA为模板扩增出的产物连接到 pMD®-T5 Zero Cloning Vector上并转化入大肠杆菌DH5α中,进行菌落 PCR筛选,挑选阳性克隆进行测序,普通PCR扩增程序参照赵真等[27]。在获得的片段序列上设计3'RACE和5'RACE的巢式扩增引物,参照SMARTTMRACE cDNA Amplification Kit(Clontech,美国)改进步骤进行 5'RACE和3'RACE。根据RACE得到的序列信息,拼接后设计引物扩增全长cDNA序列,cDNA全长采用高保真酶 PrimeSTAR®GXL DNA Polymerase进行PCR扩增。回收全长 cDNA扩增片段,与Blunt simple Vector连接,转化大肠杆菌Trans-T1感受态细胞,LB/Amp平板培养,挑选单菌落震荡培养14 h,取1 µL菌液为模板,用载体通用引物M13F和M13R进行PCR鉴定,将鉴定的阳性克隆样品测序。
1.5 CsPT4基因生物信息学分析
利用NCBI BLAST对测序结果进行检索比对,DNAMAN6.0软件分析酸碱氨基酸统计分析。运用ProtParam tool(http://web.expasy. org/protparam)计算蛋白质的相对分子质量和理论等电点;ProtScale Sever(http://web.expasy. org/protscale)采用 Hphob/Doolittle的方法对CsPT4蛋白的亲水/疏水性进行分析;使用MHMM(www.cbs.dtu.dk/services/TMHMM-2.0)预测跨膜结构域;采用 NetPhos Sever 3.0(http://www.cbs.dtu.dk/services/NetPhos)程序对蛋白序列中的主要氨基酸残基可能的磷酸化位点进行预测。利用在线软件 Softberry(http://www.softberry.com/berry.phtml)[28]进行亚细胞定位预测。
1.6 CsPT4基因的亚细胞定位
以测序 CsPT4全长正确的菌液,提取质粒作为模板,以vector primer-HindⅢ、vector primer-XbaⅠ为F、R引物进行RT-PCR,将正确的亮带进行胶回收,与平末端载体pEASY-Blunt Simple Cloning Vector连接,转化到大肠杆菌,挑单克隆进行验证。验证正确的菌液提取质粒与pJIT166-GFP分别经XbaⅠ和HindⅢ双酶切,回收目的片段并用T4DNA连接酶连接,构建pJIT166-GFP/CsPT4融合表达载体,转入DH5α,经PCR、酶切筛选阳性克隆,并对阳性克隆进行测序验证。金粉子弹的制备和轰击洋葱表皮细胞参照王明乐等[29]和Wang等[30]的方法。
1.7 实时荧光定量PCR
使用 PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒反转录后按照 SYBR®Premix Ex TaqTMII(Tli RnaseH Plus)使用说明进行荧光定量 PCR。为了研究基因 CsPT4在茶树正常生长情况下芽、叶(老叶和嫩叶)、根、茎中的表达情况,提取了芽、嫩叶、老叶、茎、根的总 RNA,将提取的 RNA反转录成cDNA,以茶树 β-actin基因(Accession No. HQ420251)[31]作为内参基因,使用 IQ5 multicolor real time PCR detection system(Bio-Rad, USA)进行实时荧光定量PCR反应,采用 2–ΔΔCT算法[32]分析结果。为了研究基因 CsPT4在低磷和缺磷处理下根部和叶部的表达情况,将在完全营养液下水培好的新根苗进行低磷处理(1 μmol·L-1)、缺磷处理。CsPT4基因在茶树中的表达受低磷、缺磷诱导,为了研究该基因在不同诱导时间的表达情况,分别提取了经过低磷、缺磷处理 0、6、12、24、48、72 h等不同时间的根部和叶部的 RNA,经过反转录和荧光定量PCR检测分析。
试验数据采用SPSS 17.0进行统计处理,利用 Duncan's新复极差法做显著性分析(P<0.05)。
2 结果与分析
2.1 不同磷水平对茶树磷浓度的影响
茶树在水培液正常生长3个月后,进行低磷(1 μmol·L-1)、缺磷处理3个月,结果表明,低磷、缺磷处理显著降低了茶树根、茎、叶中的磷浓度,新根的总磷含量高于老根(图1)。

图1 低缺磷处理对茶树磷浓度的影响(平均值±标准差,P<0.05)Fig. 1 Effects of different P treatments on P concentrations in tea plants (Mean±SD, P<0.05)
2.2 CsPT4基因克隆与序列分析
在 NCBI中下载并比较不同植物同一家族的磷转运蛋白基因序列,根据保守区域设计简并引物,获得592 bp的片段(图2-A)。利用 5′RACE和 3′RACE得到的序列进行拼接后设计全长引物进行cDNA编码区全长的特异扩增,克隆后测序结果表明,该条带长度1 642 bp(图2-D)。该基因编码539个氨基酸,长度与其他物种同家族的磷转运蛋白基因相近。
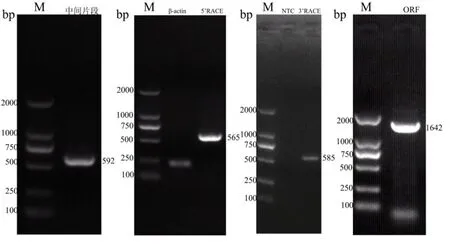
图2 基因克隆电泳图Fig. 2 Electrophoresis results of CsPT4 cloning
2.3 CsPT4生物信息学分析
2.3.1 CsPT4的进化分析
ORF分析表明,CsPT4基因含有1 617 bp的开放阅读框,编码 539个氨基酸(图 3),其中酸性氨基酸65个,碱性氨基酸50个,中性氨基酸424个。同源比对发现,其氨基酸序列 与 油 茶 ( AHL44892.1)、 芝 麻(XP_011073523.1)、菊花(AGK29560.1)、胡 萝 卜 ( XP_017224754.1)、 可 可(XP_007035103.2)的同源性大多在 70%以上;其中与油茶和芝麻的一致性达到 92%和83%。利用 ProtParam tool分析发现,CsPT4蛋白理论等电点(pI)为:8.51,分子式为C2737H4166N672O731S29,分子量为59.12 kDa。

图3 CsPT4与其他植物的Pht1磷转运蛋白氨基酸多序列比对Fig. 3 Alignment of amino acid sequence of CsPT4 with some selected Pht1 proteins in plants
2.3.2 CsPT4蛋白跨膜结构分析以及磷酸化修饰预测
ProtScale Sever在线分析整个蛋白质基本上表现出疏水性。HMMTOP对CsPT4进行的跨膜结构预测结果(图4-A)显示:CsPT4具有12个跨膜域,预测结果与报道的其他物种Pht1跨膜区结构一致[2]。磷酸化修饰预测发现整个蛋白质多肽链中分值大于 0.5的氨基酸位点共有19个,且非均匀分布在整个多肽链中,其中10个丝氨酸残基(Ser)可能发生磷酸化,分别位于肽链的第99、122、153、163、193、206、282、439、510、515个位点;4个苏氨酸残基(Thr)可能发生磷酸化,分别位于肽链的第58、229、239、398个位点;5个络氨酸残基(Tyr)可能发生磷酸化,分别位于肽链的第37、155、194、199、231个位点(图4-B)。
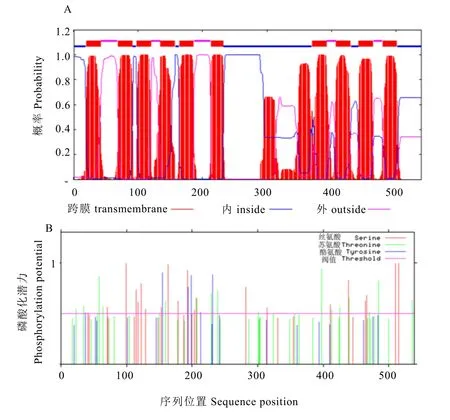
图4 CsPT4的跨膜结构预测(A)和磷酸化预测(B)Fig. 4 The prediction of CsPT4 transmembrane domains (A) and phosphorylation (B)
2.4 CsPT4蛋白的亚细胞定位
基因枪轰击洋葱表皮后25℃暗培养18 h,利用激光共聚焦显微镜(Zeiss LSM780)对绿色荧光蛋白信号进行观察,结果发现,转pJIT166-GFP空载体的洋葱表皮细胞内布满了绿色荧光(图 5-A),而转pJIT166-GFP/CsPT4载体的洋葱细胞内只有细胞质膜上有绿色荧光信号(图 5-B),说明CsPT4蛋白定位于质膜。

图5 GFP蛋白(A)和CsPT4蛋白(B)在洋葱表皮中的定位Fig. 5 Subcellular localization of GFP protein (A) and CsPT4 protein (B) in onion epidermal cells
2.5 CsPT4基因的组织特异性表达分析
荧光定量PCR发现CsPT4在茶树的芽、嫩叶、老叶、茎、根中均有表达;表达量由高到低依次为:老叶、嫩叶、芽、茎、根,在老叶中表达量最高,在根中表达量最低;随着叶龄增加,表达量呈上升趋势(图6)。

图6 CsPT4基因在茶树不同组织的表达情况(平均值±标准差,P<0.05)Fig. 6 Relative transcription level of CsPT4 gene in different tissues (Mean±SD, P<0.05)
2.6 CsPT4基因在不同磷水平条件下的差异表达分析
低磷(1 μmol·L-1)处理茶树后(设未处理的表达量为 1,下同),与对照相比,根部和叶部 CsPT4表达水平均先上升后下降,根部在12 h达到最大值(图7-A);叶部6 h即达到最大值(图7-B);根部CsPT4表达量48 h内各个时间点均高于叶部。缺磷处理,与对照相比,根和叶 CsPT4表达水平基本呈上升趋势。根部在72 h达最大值(图7-C),叶部至48 h达最大值(图7-D)。
3 讨论
植物磷转运蛋白中 Pht1家族主要成员在植物根系细胞膜中负责磷酸根的吸收、转运,其表达受磷调控[33-34],因此 Pht1成为研究的热点也是研究得最为深入的植物磷转运蛋白家族。本研究利用该家族的保守性并结合cDNA末端快速扩增技术(RACE),首次从茶树中克隆到磷转运蛋白基因 CsPT4。发现 CsPT4编码的氨基酸序列与油茶、芝麻等高亲和磷转运蛋白相似性高达80%以上,并含有Pht1家族蛋白的主要特点:位于质膜上,蛋白大小约59 kDa,含539个氨基酸残基;预测保守结构为“6-亲水-6”结构,即包括6个N端的跨膜区和6个 C端的跨膜区,中部由 1个亲水环分隔开;家族保守序列GGDYPLSATIMSE位于第 4个跨膜域。同时,在系统进化树中,CsPT4所在的亚家族Ⅰ磷转运蛋白大部分已通过酵母突变体互补实验,证明为高亲和力磷转运蛋白,如 AtPht1:4[11]、CmPT1[16]等。因此,可以推测 CsPT4为茶树的高亲和磷转运蛋白基因。
Pht1家族基因表达受磷浓度调控[33]。现有报道在模式植物中 Pht1家族基因主要在根部接收低磷信号上调表达[34],而通过荧光定量实验发现 CsPT4在茶树正常生长的芽、嫩叶、老叶、茎、根中均有表达,在老叶中表达量最高,在根中表达量最低;这与拟南芥[11]、水稻[13]等物种的主要表达于根部不同。可能因为磷是可移动的营养元素,又因为茶树是多年生木本植物,推测正常生长情况下茶树老叶中的磷转移到幼嫩叶部而出现低磷状态,从而高表达了CsPT4基因。在低磷和缺磷处理下,不管是茶树根部还是叶部 CsPT4都上调表达了,说明了 CsPT4是受低磷胁迫响应的正调控诱导型基因,具有Pht1家族基因表达特点,这与转 AtPht1:4基因拟南芥的结果一致[11]。在低磷处理下,根部上调表达高于叶部,说明CsPT4主要在根部表达,这与其他物种的Pht1基因表达一致[34];上调表达出现先上升后下降可能是由于CsPT4转录的mRNA的累积效应。本研究虽然从茶树中克隆到CsPT4基因,但是茶树 Pht1基因家族成员的数量及功能仍然有待验证。

图7 CsPT4在不同磷水平条件下的表达分析(平均值±标准差,P<0.05)Fig. 7 Expression analysis of CsPT4 under different P treatments (Mean±SD, P<0.05)
[1]Liu J, Yang L, Luan M, et al. A vacuolar phosphate transporter essential for phosphate homeostasis in Arabidopsis [J]. Proceedings of the National Academy of Sciences, 2015, 112(47): E6571-E6578.
[2]Rausch C, Bucher M. Molecular mechanisms of phosphate transport in plants [J]. Planta, 2002, 216(1): 23-37.
[3]Rae A L, Cybinski D H, Jarmey J M, et al. Characterization of two phosphate transporters from barley, evidence for diverse function and kinetic properties among members of the Pht1 family [J]. Plant Mol Biol, 2003, 53(1/2): 27-36.
[4]苏顺宗, 吴锋锴, 刘丹, 等. 一个玉米 Pht1家族磷转运蛋白基因克隆和功能分析[J]. 核农学报, 2013, 27(7): 885-894.
[5] Liu J, Versaw W K, Pumplin N, et al. Closely related members of the medicago truncatula PHT1 phosphate transporter gene family encode phosphate transporters with distinct biochemical activities [J]. Journal of Biological Chemistry, 2008, 283(36): 24673-24681.
[6]Catarecha P, Segura M D, Franco-zorrilla J M, et al. A mutant of the arabidopsis phosphate transporter PHT1:1 displays enhanced arsenic accumulation [J]. The Plant Cell Online, 2007, 19(3): 1123-1133.
[7]Miao J, Sun J, Liu D, et al. Characterization of the promoter of phosphate transporter TaPHT1.2, differentially expressed in wheat varieties [J]. Journal of Genetics and Genomics, 2009, 36(8): 455-466.
[8] Preuss C P, Huang C Y, Gilliham M, et al. Channel-like characteristics of the low-affinity barley phosphate transporter PHT1:6 when expressed in xenopus oocytes [J]. Plant Physiology, 2010, 152(3): 1431-1441.
[9]Park M R, Baek S, Los Reyes B G, et al. Overexpression of a high-affinity phosphate transporter gene from tobacco (NtPT1) enhances phosphate uptake and accumulation in transgenic rice plants [J]. Plant and Soil, 2007, 292(1/2): 259-269.
[10]Tan Z, Hu Y, Lin Z. Expression of NtPT5 is correlated with the degree of colonization in tobacco roots inoculated with glomus etunicatum [J]. Plant Molecular Biology Reporter, 2012, 30(4): 885-893.
[11]Shin H, Shin H, Dewbre G R, et al. Phosphate transport in Arabidopsis: Pht1:1 and Pht1:4 play a major role in phosphate acquisition from both low- and high-phosphate environments [J]. The Plant Journal, 2004, 39(4): 629-642.
[12]Misson J, Thibaud M C, Bechtold N, et al. Transcriptional regulation and functional properties of Arabidopsis, Pht1;4, a high affinity transporter contributing greatly to phosphate uptake in phosphate deprived plants [J]. Plant Molecular Biology, 2004, 55(5): 727.
[13]高佳, 刘雄伦, 刘玲, 等. 水稻磷酸盐转运蛋白 Pht1家族研究进展[J]. 中国农学通报, 2009, 25(15): 31-34.
[14]Ye Y, Yuan J, Chang X, et al. The phosphate transporter gene OsPht1:4 is involved in phosphate homeostasis in rice [J]. Plos One, 2015, 10(5): e126186.
[15]Ren F, Zhao C, Liu C, et al. A brassica napus PHT1 phosphate transporter, BnPht1:4, promotes phosphate uptake and affects roots architecture of transgenic arabidopsis [J]. Plant Molecular Biology, 2014, 86(6): 595-607.
[16]Song H, Yin Z, Chao M, et al. Functional properties and expression quantitative trait loci for phosphate transporter GmPT1 in soybean [J]. Plant, Cell & Environment, 2014, 37(2): 462-472.
[17]Peng L, Chen S, Song A, et al. A putative high affinity phosphate transporter, CmPT1, enhances tolerance to Pi deficiency of chrysanthemum [J]. Bmc Plant Biology, 2014, 14(1): 1-9.
[18]周俊琴, 谭晓风, 袁军, 等. 油茶 Pht1;2的克隆及生物信息学分析[J]. 生物技术, 2013(1): 37-42.
[19]周俊琴, 谭晓风, 袁军, 等. 油茶 Phtl;1基因克隆及其表达分析[J]. 植物遗传资源学报, 2013, 14(3): 512-517.
[20]Akn Z, Loganathan P, Hedley M J. Phosphorus utilisation efficiency and depletion of phosphate fractions in the rhizosphere of three tea (Camellia sinensis L.) clones [J]. Nutrient Cycling in Agroecosystems, 1999, 53(2): 189-201.
[21]Salehi S Y, Hajiboland R. A high internal phosphorus use efficiency in tea (Camellia sinensis L.) plants [J]. Asian Journal of Plant Sciences, 2008, 7(1): 30-36.
[22]Lin Z, Qi Y, Chen R, et al. Effects of phosphorus supply on the quality of green tea [J]. Food Chemistry, 2012, 130(4): 908-914.
[23]Wan Q, Xu RK, Li XH. Proton release by tea plant (Camellia sinensis L.) roots as affected by nutrient solution concentration and pH [J]. Plant Soil Environ, 2012, 58(9): 429-434
[24]Raghothama K G. Phosphate acquisition [J]. Annual Review of Plant Biology, 1999, 50(1): 665-693.
[25]Schachtman D P, Reid R J, Ayling S M. Phosphorus uptake by plants: from soil to cell [J]. Plant Physiology, 1998, 116(2): 447-453.
[26]何飞顶, 李华昌, 冯先进. 电感耦合等离子体原子发射光谱法(ICP-AES)测定红土镍矿中的Cd、Co、Cu、Mg、Mn、Ni、Pb、Zn、Ca 9种元素[J]. 中国无机分析化学, 2011, 1(2): 39-41.
[27]赵真, 陈暄, 王明乐, 等. 茶树磷酸烯醇式丙酮酸转运子基因 CsPPT的克隆与表达分析[J]. 茶叶科学, 2015, 35(5): 491-500.
[28]杨亦扬, 胡雲飞, 万青, 等. 茶树硝态氮转运蛋白 NRT1.1基因的克隆及表达分析[J]. 茶叶科学, 2016, 36(5): 505-512.
[29]王明乐, 王伟东, 赵真, 等. 茶树NADPH氧化酶基因的克隆、亚细胞定位与表达分析[J]. 园艺学报, 2015, 42(1): 95-103.
[30]Wang W, Wang Y, Du Y, et al. Overexpression of Camellia sinensis H1 histone gene confers abiotic stress tolerance in transgenic tobacco [J]. Plant Cell Reports, 2014, 33(11): 1829-1841.
[31]孙美莲, 王云生, 杨冬青, 等. 茶树实时荧光定量 PCR分析中内参基因的选择[J]. 植物学报, 2010, 45(5): 579-587.
[32]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2–ΔΔCTmethod [J]. Methods, 2001, 25(4): 402-408.
[33]李慧, 丛郁, 常有宏, 等. 豆梨磷转运蛋白质基因(PcPht1)的克隆、表达及启动子分析[J]. 江苏农业学报, 2013, 29(4): 842-850.
[34]杨存义, 刘灵, 沈宏, 等. 植物 Pht1家族磷转运子的分子生物学研究进展[J]. 分子植物育种, 2006, 4(2): 153-159.
Molecular Cloning, Subcellular Localization and Expression Analysis of CsPT4 Gene in Tea Plant (Camellia sinensis)
XIN Huahong, WANG Weidong, WANG Mingle, MA Qingping, GAN Yudi, LI Xinghui*
Tea Research Institute,Nanjing Agricultural University,Nanjing 210095, China
Phosphate transporter proteins (Phts) play important roles in plant phosphorus (P) absorption and transportation. Furthermore, Phts affect usage efficiency of the tea garden fertilizer. A full-length phosphate transporter complementary DNA (cDNA) CsPht1:4 (also named CsPT4) was cloned from tea plant (Camellia sinensis cv. Longjingchangye) by rapid amplification of cDNA ends (RACE) techniques. CsPT4 had an open reading frame of 1 620 bp (GenBank accession No. KY132100) and encoded a 539 amino acid polypeptide. Bioinformatic analyses showed that CsPT4 had a molecular weight of 59.12 kD and a theoretical isoelectric point of 8.51. The protein secondary structure was a “6+Hydrophilic+6” configuration,which was consistent with the typical structure of Phts. Subcellular localization assay showed that the CsPT4 protein localized in plasma membrane, which was consistent with the predicted results of Softberry. The expression pattern of CsPT4 gene was tissue-specific. Its transcript abundance in old leaves was much higher than that in tender leaves, stems and roots. The lowest expressionof CsPT4 gene was identified in roots. Quantitative real-time PCR showed that the gene expression trends in root and leaves were different under low-P and P-deficiency treatments. Under low-P treatment, its induced level was first increased and then decreased, with higher expression in roots than leaves. While under P-deficiency treatment, the induced expression of CsPT4 gene kept stable, with its peak in roots and leaves at 72 h and 48 h, respectively. The results of this study provided a reference for the study of the molecular mechanism of tea adaptation to low P.
tea plant (Camellia sinensis), phosphate transporter protein, gene cloning, subcellular localization, expression analysis
S571.1;Q51
A
1000-369X(2017)05-493-10
2017-04-05
2017-05-02
现代农业产业技术体系建设专项资金(CARS-23)、江苏高校优势学科建设工程资助项目、国家自然科学基金(31570691)、江苏省科技支撑计划(BE2009313-1)
辛华洪,男,硕士研究生,主要从事茶树遗传育种和茶叶生化研究。*通讯作者:lxh@njau.edu.cn
