TRPC1沉默对脑缺血大鼠神经干细胞迁移的影响
2017-10-17张广慧冯金洲郭振委何明利吴方荣
张广慧, 冯金洲, 郭振委, 耿 闪, 何明利, 吴方荣
TRPC1沉默对脑缺血大鼠神经干细胞迁移的影响
张广慧1, 冯金洲2, 郭振委1, 耿 闪1, 何明利1, 吴方荣1
目的探讨瞬时受体电位通道1(TRPC1)沉默对脑缺血大鼠内源性神经干细胞增殖、迁移和分化的影响。方法SD大鼠分为假手术组、脑缺血组、TRPC1沉默组(脑缺血+TRPC1沉默)和阴性对照组,以脑室内注射siRNA沉默TRPC1,以线栓法制作大鼠大脑中动脉脑缺血(MCAO)模型,脑缺血模型制作成功后,腹腔内注射Brdu标记内源性神经干细胞,分别于48 h、4 w后处死大鼠,行Brdu免疫组化染色、免疫荧光双标染色(Brdu/GFAP、Brdu/Neun)观察NSC的增殖、迁移和分化情况。结果脑缺血后48 h,脑缺血组和TRPC1沉默组SVZ区Brdu阳性表达均较假手术组明显增多(P<0.01),但TRPC1沉默组Brdu阳性细胞数较缺血组低(P<0.01)。脑缺血4 w后,缺血组与假手术组相比,皮质区具有更多的Brdu阳性细胞(P<0.01),同样TRPC1沉默组Brdu阳性细胞数多于假手术组,但明显低于脑缺血组(P<0.01);免疫荧光双标染色发现,脑缺血各组Brdu/GFAP、Brdu/Neun双阳性细胞的数量均比假手术组明显增高,但TRPC沉默组双阳性细胞显著少于脑缺血组和阴性对照组(P<0.01)。结论TRPC1沉默显著影响脑缺血大鼠SVZ区NSC的增殖、向脑缺血区迁移及向成熟细胞的分化。
脑缺血; 瞬时受体电位通道1; 神经干细胞; 增殖; 迁移
Abstract:ObjectiveTo investigate the effects of transient receptor potential canonical 1(TRPC1) silencing on proliferation,migration and differentiation of endogenous neural stem cells(NSCs) after cerebral ischemia.MethodsSD rats were divided into sham group,cerebral ischemia group,TRPC1 silent group (cerebral ischemia + TRPC1 silence) and negative control group. siRNA was injected to intraventricular to silence TRPC1.Middle cerebral artery occlusion models were produced using the method of intraluminal monofilament. After cerebral ischemia models were made,endogenous neural stem cells were marked by intraperitoneal injection of Brdu. The rats were sacrificed after 48 hours and 4 weeks,then Brdu immunohistochemistry and immunofluorescence double staining (Brdu/GFAP,Brdu/Neun) were performed to observe the proliferation,migration and differentiation of NSCs.ResultsAt 48hours after cerebral ischemia,the Brdu expression in SVZ region of cerebral ischemia group and TRPC1 silent group increased significantly compared with the sham group (P<0.01),but the number of Brdu positive cells in TRPC1 silencing group were lower than the ischemic group (P<0.01 ). However,the number of Brdu positive cells were lower in TRPC1 blocking group than ischemia group (P<0.01). Four weeks after cerebral ischemia,there were more Brdu positive cells in the cortex in ischemia group and TRPC1 blocking group than sham group (P<0.01),but the number was significantly lower in TRPC1 blocking group than cerebral ischemia group (P<0.01). Double immunofluorescence staining found that,the numbers of Brdu/GFAP,Brdu/Neun double positive cells in all cerebral ischemia groups were significantly higher than the sham group. The numbers in TRPC1 silent group were significantly less than the cerebral ischemia group and negative control group (P<0.01).ConclusionTRPC1 silencing significantly affected the proliferation in SVZ,migration to cortex and differentiation into mature cells of NSCs after cerebral ischemia.
Keywords: Cerebral ischemia; Neural stem cells; Proliferation; Migration
研究表明,成年哺乳动物脑内某些区域存在持续的神经发生,在生理条件下,此处的神经干细胞(neural stem cell,NSC)可分化为神经元和胶质细胞,承担一定的生理功能[1]。脑缺血后脑室下(SVZ)区NSC增殖活跃,并向缺血区定向迁移,参与缺血后的神经修复[2,3],这为脑缺血后缺损神经元的修复带来了新的曙光。然而,对于内源性NSC的研究已持续了数十年,目前NSC对脑缺血后的修复作用研究仍未获得突破,其中一个重要原因在于脑缺血后NSC向病灶区迁移的数量有限,难以填补大量神经元缺血坏死所致的空缺,可见,提高NSC定向迁移的数量是内源性NSC治疗脑缺血的关键,而目前内源性NSC定向迁移的机制尚不清楚,了解相关机制成为促进NSC定向迁移和神经修复的首要解决的问题。
最近发现,瞬时受体电位通道1(transient receptor potential canonical 1,TRPC1)在多种肿瘤细胞的增殖和转移过程中发挥十分重要的作用[4],但其诱导细胞迁移的机制及其在脑缺血后NSC的增殖和迁移过程中的作用未见报道;本研究拟通过沉默TRPC1的方法探讨TRPC1在脑缺血后NSC增殖、定向迁移和分化中的作用,为探讨内源性NSC治疗脑梗死提供理论依据。
1 材料和方法
1.1 实验动物 健康成年雌性Sprague-Dawley(SD)大鼠,体重250~280 g,购于徐州医学院动物实验中心。大鼠接受自然昼夜规律光照,饲养周围环境温度为25 ℃左右,大鼠自由饮水和摄食(所有大鼠于手术前12 h禁止进食,以防术中意外)。
1.2 动物分组 取SD大鼠80只,随机分为假手术组、脑缺血组、TRPC1沉默组和阴性对照组,以脑室内注射siRNA沉默TRPC1,以线栓法制作大鼠大脑中动脉脑缺血(MCAO)模型,脑缺血模型制作成功后,腹腔内注射Brdu标记内源性神经干细胞,其中40只大鼠48 h后处死,行Brdu免疫组化染色观察NSC增殖情况;余下的40只大鼠4 w后处死行Brdu免疫组化染色、免疫荧光双标染色(Brdu/GFAP、Brdu/Neun)观察NSC的增殖、迁移和分化情况。
1.3 siRNA沉默大鼠脑内TRPC1基因 针对大鼠TRPC1 mRNA设计2条靶序列:5′GATCCCC GCATTCCAGG TTTCGTCTTGA TTCAAGAGA TCAAGA CGAAA CCTGGAATGCTTTTT3′,5′AGCTT AAAAA GCATTCC AGGTTT CGTCTTGA TCTCTTGAA TCAAGACGAAACCTGGAATGCGGG3′。siRNA模板由上海生工生物工程公司合成,根据Ambion公司体外转录试剂盒(SilencerTM siRNA Construction Kit)说明书操作。大鼠在脑缺血前1 w,以水合氯醛麻醉,俯卧位固定大鼠头部,局部消毒,于前囟后约10 mm,中线旁15 mm为中心,钻磨钻孔,以微量注射器自脑表面垂直进针35 mm,向脑室内缓慢注射TRPC1 siRNA或阴性对照液20 μl。
1.4 大鼠大脑中动脉模型的建立 参照Xu等的方法,以线栓法制作大鼠右侧大脑中动脉缺血(middle cerebral artery occlusion,MCAO)模型[5]。操作步骤如下:以3.5%的水合氯醛腹腔注射麻醉大鼠,取颈部正中切口,先后分离迷走神经、右侧颈总动脉、颈外动脉和颈内动脉,结扎颈外动脉远端,并切断之;在颈外动脉末端,插入4-0单股外科尼龙丝线,插入深度距离动脉分叉处约18 mm。用丝线扎紧线栓,缝合切口。假手术组仅分离出颈内动脉,不插入栓子。
1.5 BrdU标记及动物处理 (1)观察内源性NSC的增殖:大鼠于脑缺血后48 h处死,处死前1 d腹腔注射Brdu 50 mg/kg,共注射3次,每次间隔4 h。以4%的多聚甲醛灌注后取脑,然后放于4%多聚甲醛中进行后固定,石蜡包埋后制作石蜡切片,在前囟点正中前0.1~0.3 mm处收集10张10 μm厚切片。(2)观察NSC迁移及分化情况:脑缺血后腹腔注射Brdu 50 mg/kg,2/d次,连续2 d。4 w后灌注取脑,放入4%多聚甲醛中固定,制作石蜡切片,在前囟点正中前0.1~0.3 mm处收集10张10 μm厚切片。
1.6 BrdU免疫组化染色 切片分别以2 mol/L HCl 37 ℃孵育30 min,0.1 mol/L的硼酸缓冲液(pH 8.0)室温10 min,0.1%的胰酶37 ℃孵育20 min,然后0.3% Triton X-100室温20 min,3% H2O2室温15 min,正常羊血清室温下孵育20 min,甩干后鼠抗BrdU单克隆抗体(Chemicon,1∶100) 4 ℃过夜,再依次加入生物素化二抗工作液(北京中衫),室温30 min;过氧化物酶标记的链霉卵白素工作液,室温30 min,DAB显色,常规脱水、透明、封片。
1.7 免疫荧光双标染色 切片经HCl、胰酶等变性、抗原修复及血清封闭后,加入鼠抗BrdU 抗体(1∶100)和兔抗NeuN(博奥森公司,1∶50)或兔抗GFAP(博士德公司,1∶50)抗体,4 ℃过夜,加入TRITC标记的羊抗鼠IgG(博士德公司,1∶50)与FITC标记的羊抗兔IgG(博士德公司,1∶50)混合抗体,室温孵育2 h,50%的缓冲甘油封片,荧光显微镜下观察照相(Olympus)。
1.8 免疫组化染色结果分析 免疫组化染色:以Olympus显微镜观察并摄片,并在放大倍数(10×40)下,随机选择5个非重叠视野,以缺血侧SVZ区、皮质为观察部位,每组10只动物,每只动物的每个部位随机选取5张非连续切片,数出每个视野的阳性细胞数后计算每只大鼠所要分析部位的平均阳性细胞数。
免疫荧光双标染色:每只大鼠随机抽取5张不同的脑片,在200倍荧光显微镜下,每张随机选5个视野计数皮质Brdu/NeuN、Brdu/GFAP阳性细胞数。
2 结 果
2.1 TRPC1沉默对SVZ区NSC增殖的影响 BrdU阳性细胞为胞核染色,圆形、卵圆形,沿侧脑室壁呈线样排列(见图1)。假手术组SVZ区可见少量的BrdU阳性细胞,排列较为稀疏,染色较浅;脑缺血组和阴性对照组SVZ区则见大量Brdu阳性细胞堆积,染色较深,与假手术组比较均有显著性差异,(P<0.01)。TRPC1沉默组SVZ区Brdu阳性细胞数在脑缺血后也明显升高(P<0.01),但显著少于脑缺血组(P<0.01)(见表1,图1)。
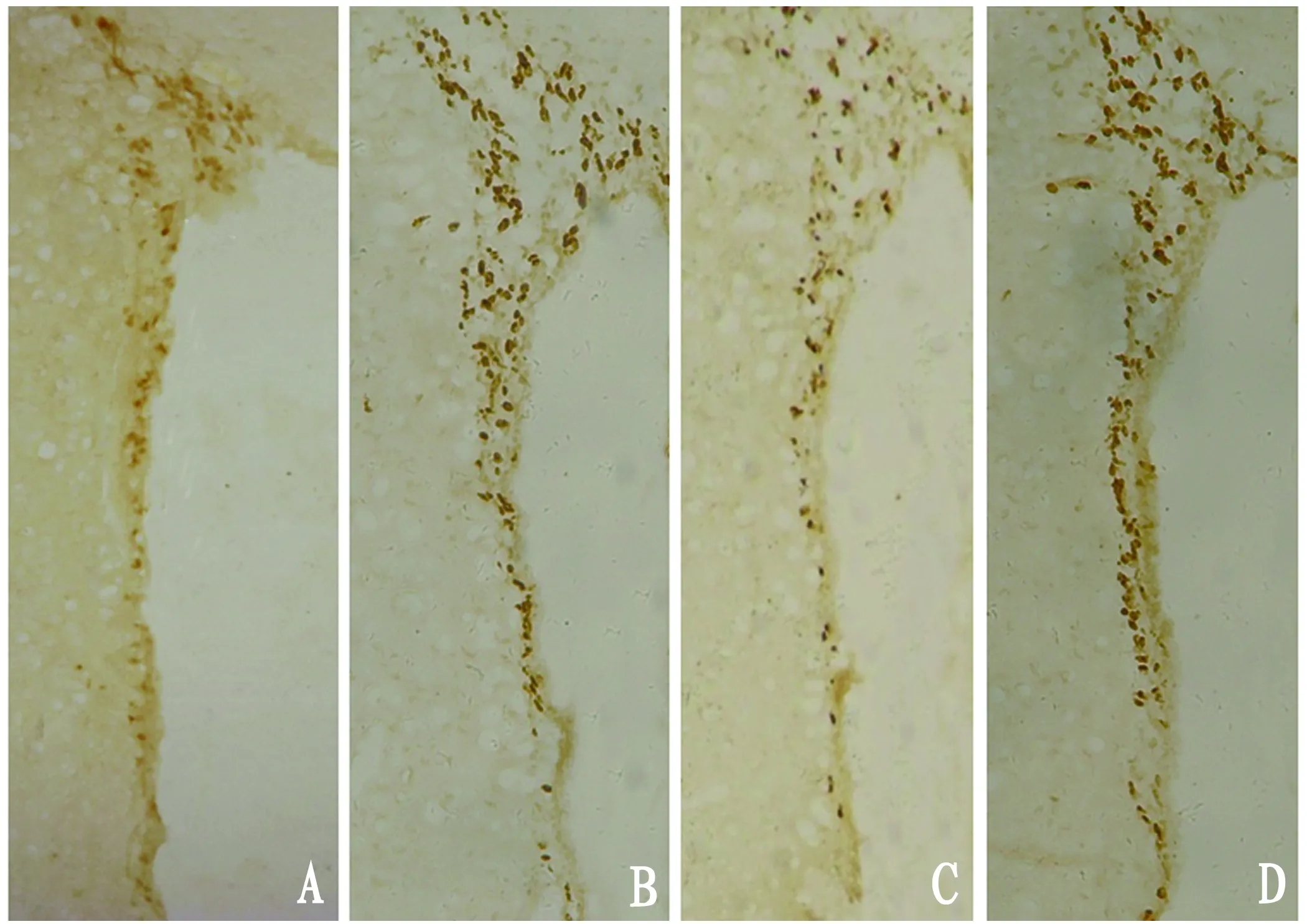
2.2 TRPC1沉默对NSC迁移的影响 脑缺血后4 w,假手术组大鼠右侧皮质区只有少数Brdu阳性细胞,而脑缺血组、阴性对照组可见大量Brdu阳性细胞,与假手术组比较具有显著性差异(P<0.01),TRPC1沉默组右侧皮质区Brdu阳性细胞数较假手术组多(P<0.01),但明显少于脑缺血组和阴性对照组(P<0.01)(见表1,图2)。
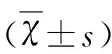
表1 各组大鼠SVZ和皮质区BrdU阳性细胞数
与假手术组比较#P<0.01;与脑缺血组和阴性对照组比较*P<0.01
A:假手术组;B:脑缺血组;C:TRPC1沉默组;D:阴性对照组
图1 大鼠SVZ区Brdu阳性细胞的表达(免疫组化×100)
A:假手术组;B:脑缺血组;C:TRPC1沉默组;D:阴性对照组
图2 大鼠缺血侧皮质区Brdu阳性细胞的表达(免疫组化×100)
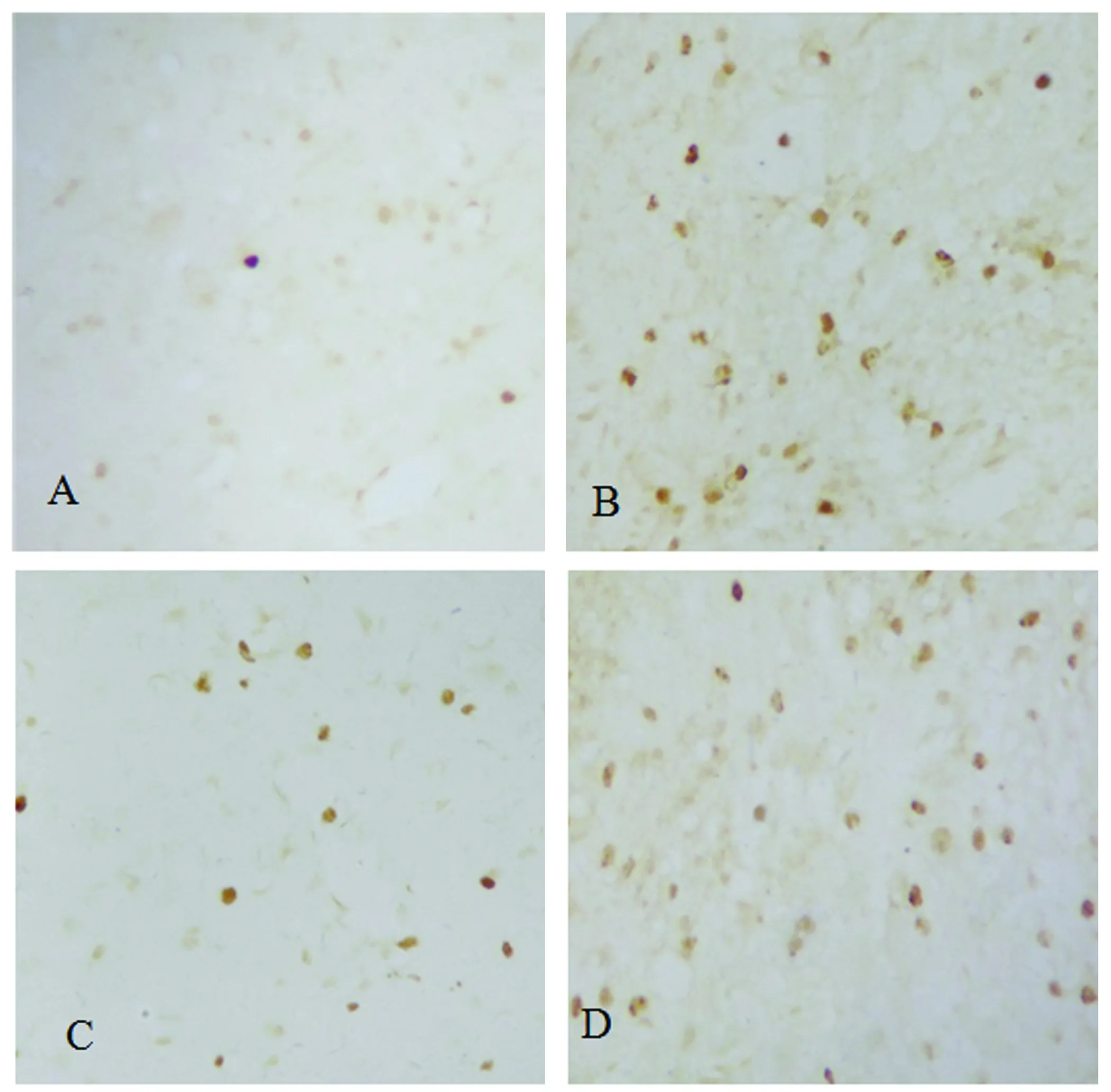
2.3 TRPC1沉默对NSC分化的影响 免疫荧光双标染色显示,Brdu阳性细胞表现为红色荧光,GFAP和Neun阳性细胞为绿色荧光;在假手术组,皮质区只有少数的Brdu/Neun、Brdu/GFAP双阳性细胞,脑缺血组和阴性对照组双阳性细胞数明显增多,与假手术组比较均有显著性差异(P<0.01),TRPC1沉默组双阳性细胞较脑缺血组和阴性对照组明显减少,差异有显著性意义(P<0.01)(见表2,图3)。
Brdu阳性细胞为红色荧光,GFAP/Neun阳性细胞为绿色荧光。A、C:脑缺血组,分别为brdu/GFAP荧光双标,brdu/Neun双标;B、D:TRPC1沉默组,分别为brdu/GFAP荧光双标,brdu/Neun双标
图3 NSC在缺血皮质内的分化情况(免疫荧光双标染色×200)
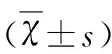

组别Brdu/Neun阳性细胞Brdu/GFAP阳性细胞假手术组脑缺血组TRPC沉默组阴性对照组3.7±1.5616.6±4.01#9.7±3.30#*15.5±4.67#14.1±3.1851.6±9.96#37.8±7.33#*51.3±8.02#
与假手术组比较#P<0.01;与脑缺血组和阴性对照组比较*P<0.01
3 讨 论
瞬时受体电位通道1(transient receptor potential canonical 1,TRPC1)是非电压依赖的介导钙离子内流的跨膜蛋白,可被G蛋白偶联受体介导的磷脂酶C(Phospholipase C,PLC)信号通路激活。
TRPC1在细胞的增殖及分化过程中起重要作用[6]。TRPC1基因敲除显著降低血管内皮祖细胞内钙库操控的钙离子的内流,使内皮祖细胞停滞在G1期,从而抑制内皮祖细胞的增殖[7]。siRNA介导的TRPC1沉默使非小细胞肺癌细胞停滞在G(0)/G(1)期,严重影响细胞的生长和增殖[8]。TRPC通道阻断剂2-APB和SKF-96365可显著抑制卵巢肿瘤细胞的增殖,而通过胰蛋白酶提高TRPC1通道的活性则明显促进卵巢肿瘤细胞增殖,促进肿瘤细胞集落的生长[9]。由此可见,TRPC1对细胞增殖具有重要意义。本研究发现沉默TRPC1后脑缺血大鼠SVZ区的NSC数量较单纯脑缺血组明显减少,提示TRPC1是脑缺血后NSC增殖活跃的一个重要因素。
另外,TRPC1在细胞定向迁移中也发挥重要作用。Rao等将TRPC1基因转染至肠上皮细胞,发现肠上皮细胞迁移能力显著提高,反之,通过RNA干扰技术抑制TRPC1的表达则显著削弱肠上皮细胞的迁移能力,严重阻碍受损的肠上皮的修复;而且,TRPC1沉默可抑制受损的肠上皮细胞STIM1/TRPC1复合物的形成,减少钙库操控的钙通道介导的钙离子的内流,从而抑制肠上皮细胞的迁移[10]。TRPC1还与多种肿瘤细胞的迁移和浸润有关;通过RNA干扰技术发现,沉默鼻咽癌(25TNPC25T)25T细胞25T株25TCNE225T的TRPC1基因,能显著降低细胞的粘附和侵袭能力,提示TRPC1可调控鼻咽癌细胞的转移[11];Maroto等也发现TRPC1与前列腺癌的转移有关,抑制TRPC1的转录则使前列腺癌的转移能力显著减弱[12]。本研究发现,脑缺血后4 w,脑缺血组缺血区Brdu阳性细胞明显增多,这些细胞可能参与了损伤后的神经修复作用;而TRPC1沉默组的脑缺血区Brdu阳性细胞较缺血组显著减少,说明TRPC1沉默抑制了神经干细胞向脑缺血区的迁移,从而阻止缺血后的神经修复。
总之,本研究发现,TRPC1沉默能够显著抑制脑缺血后内源性神经干细胞的增殖,并可能阻止新生的神经干细胞向脑缺血区迁移,影响新生细胞的分化,从而阻碍了脑缺血大鼠的神经恢复。
[1]Capilla-Gonzalez V,Lavell E,Quiones-Hinojosa A,et al. Regulation of subventricular zone-derived cells migration in the adult brain[J]. Adv Exp Med Biol,2015,853:1-21.
[2]Tang Y,Wang J,Lin X,et al. Neural stem cell protects aged rat brain from ischemia-reperfusion injury through neurogenesis and angiogenesis[J]. J Cereb Blood Flow Metab,2014,34(7):1138-1147.
[3]Villeda SA,Luo J,Mosher KI,et al. The ageing systemic milieu negatively regulates neurogenesis and cognitive function[J]. Nature,2011,477(7362):90-94.
[4]Zanou N,Schakman O,Louis P,et al. Trpc1 ion channel modulates phosphatidylinositol 3-kinase/Akt pathway during myoblast differentiation and muscle regeneration[J]. Biol Chem,2012,287(18):14524-14534.
[5]Xu Z,Ford BD. Upregulation of erbB receptors in rat brain after middle cerebral arterial occlusion[J]. Neurosci Lett,2005,375(3):181-186.
[6]Zanou N,Schakman O,Louis P,et al. Trpc1 ion channel modulates phosphatidylinositol 3-kinase/Akt pathway during myoblast differentiation and muscle regeneration[J]. Biol Chem,2012,287(18):14524-14534.
[7]Kuang CY,Yu Y,Wang K,et al. Knockdown of transient receptor potential canonical-1 reduces the proliferation and migration of endothelial progenitor cells[J]. Stem Cells Dev,2012,21(3):487-496.
[8]Tajeddine N,Gailly P. TRPC1 protein channel is major regulator of epidermal growth factor receptor signaling[J]. J Biol Chem,2012,287(20):16146-16157.
[9]Zeng B,Yuan C,Yang X,et al. TRPC channels and their splice variants are essential for promoting human ovarian cancer cell proliferation and tumorigenesis[J]. Curr Cancer Drug Targets,2013,13(1):103-116.
[10]Rao JN,Rathor N,Zou T,et al. STIM1 translocation to the plasma membrane enhances intestinal epithelial restitution by inducing TRPC1-mediated Ca2+ signaling after wounding[J]. Am J Physiol Cell Physiol,2010,299(3):579-588.
[11]He B,Liu F,Ruan J,et al. Silencing TRPC1 expression inhibits invasion of CNE2 nasopharyngeal tumor cells[J]. Oncol Rep,2012,27(5):1548-1554.
[12]Maroto R,Kurosky A,Hamill OP. Mechanosensitive Ca2+permeant cation channels in human prostate tumor cells[J]. Channels (Austin),2012,6(4):290-307.
TheeffectsofTRPC1silencingonneurogenesisaftercerebralischemiaofrats
ZHANGGuanghui,FENGJinzhou,GUOZhenwei,etal.
(DepartmentofNeurology,theFirstPeople’sHospitalofLianyungang,Lianyungang222002,China)
1003-2754(2017)09-0782-04
2017-07-15;
2017-08-18
中国博士后科学基金(No. 2016M601759);连云港市第一人民医院博士科研启动基金
(1.连云港市第一人民医院神经内科,江苏 连云港 222002;2.重庆医科大学附属第一医院神经内科,重庆 400016)
吴方荣,E-mail:smart-123@163.com
R743
A
